山羊化脓隐秘杆菌重庆分离株CbpA肝素结合结构域鉴定
2018-01-26沈克飞许国洋胡瑞思徐登峰付利芝张素辉
沈克飞,许国洋,胡瑞思,徐登峰,杨 睿,付利芝,张素辉*
(1.重庆市畜牧科学院,重庆 402460; 2.西北农林科技大学动物医学院,杨凌 712100)
化脓隐秘杆菌是革兰阳性菌,主要寄生在动物上呼吸道、消化道、生殖道等黏膜,是和化脓性感染相关联的机会性病原体[1-3]。化脓隐秘杆菌是山羊呼吸道疾病和体表淋巴结炎的重要病原之一,病羊表现渐进性消瘦、流产等症状,病理组织学变化为化脓性炎症[4-5]。
细菌定植于宿主组织是感染发生的关键一步。在感染过程中,许多病原菌产生蛋白质以促进细菌黏附。微生物表面识别黏附基质分子成分(microbial surface components recognizing adhesive matrix molecules,MSCRAMM)是一类与宿主细胞外基质成分相互作用的蛋白质家族,导致细菌黏附宿主[6]。MSCRAMM属于一类具有类似结构的细胞壁锚定蛋白质,N端由信号序列、配体结合结构域和一个或多套重复多肽组成,C端有细胞壁锚定结构域。化脓隐秘杆菌的胶原结合蛋白(collagen-binding protein,Cbp)CbpA是MSCRAMM中一员,具有MSCRAMM基本序列特征,能黏附多型胶原和多种细胞,在细菌黏附中发挥重要作用[7]。病原体常以真核细胞表面的氨基葡聚糖(glycosaminoglycan)(如肝素、硫酸乙酰肝素、硫酸软骨素等多糖)作为黏附受体[8-11]。
山羊化脓隐秘杆菌重庆分离株2012CQ-ZSH(GenBank登录号CP012649)已完成基因组测序[12]。序列比对显示,其CbpA(CbpA-CQ)基因与已公布化脓隐秘杆菌的CbpA基因在5′端无明显相似性。为了揭示其分子特性,本研究对CbpA-CQ进行序列分析,并鉴定了其中2个潜在的肝素结合结构域。
1 材料与方法
1.1 材料
人宫颈癌HeLa细胞株、山羊化脓隐秘杆菌重庆分离株2012CQ-ZSH由重庆市畜牧科学院兽医研究所保存和提供;新生胎牛血清、Roswell Park Memoria Institute-1640(RPMI-1640)培养基、胰蛋白酶均购自Hyclone公司;细菌DNA提取试剂盒、DNA凝胶回收试剂盒购自OMEGA公司;肝素、还原性谷胱甘肽购自GE Healthcare公司;GST小鼠单克隆抗体(GST2)、碱性磷酸酶标记的山羊抗小鼠IgG(完整分子)抗体购自Sigma公司,Gluthathione-Sepharose 4B购自Pharmacia公司;BCTP/NBT购自上海生工生物工程有限公司。
1.2 方法
1.2.1 序列分析 将CbpA-CQ基因在NCBI上作BLAST搜索以进行同源性分析,使用在线软件(http://web.expasy.org/translate/)翻译基因,查找蛋白质序列中的碱性氨基酸,预测CbpA-CQ的跨膜结构域和信号肽(http://phobius.sbc.su.se),进行保守结构域分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)。采用MEGA 4软件中的邻接法(neighbor-joining method, NJ)构建CbpA-CQ进化树。
1.2.2 基因克隆 为了分析功能,设计了2对引物分别扩增CbpA-CQ的N端富含碱性氨基酸区域NRB和胶原结合蛋白结构域B1(图1)的编码序列。引物序列分别为CbpAF1:5′-GGATCCGTGAGCCCTGGGAAAAGTTA-3′,CbpAR1:5′-CTCGAGAGGCAATAGTTTACCCGAGA-3′;CbpAF2: 5′-GGATC-CGTTACCGTATCTGTTGAGAAGATG-3′,CbpAR2: 5′-CTCGAGGTAAGTGTTGACCACCGTAAA-3′。引物序列中斜体分别为BamHⅠ和XhoⅠ酶切位点。使用细菌 DNA 试剂盒提取化脓隐秘杆菌基因组DNA。PCR反应体系:10×PCR Buffer (含15 mmol·L-1Mg2+)2.5 μL,2.5 mmol·L-1dNTPs 0.5 μL,5 U·μL-1rTaq 0.10 μL,10 μmol·L-1上、下游引物各0.5 μL,cDNA 0.5 μL,用去离子水补足25 μL。PCR反应参数:94 ℃预变性2 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸25 s,共进行30循环;72 ℃ 延伸5 min。目的片段经DNA凝胶回收试剂盒回收后克隆到pMD18-T载体,转化入DH5α。经序列测定的重组质粒使用BamHⅠ和XhoⅠ双酶切,将酶切下的目的基因与经同样双酶切pGEX-4T-1连接构建表达载体pGEX-NRB和pGEX-B1,转化入DH5α,筛选阳性克隆提取重组质粒,将其转化入DE3用于诱导表达。预测GST融合蛋白GST-NRB和GST-B1的相对分子质量为44 和33 ku。
1.2.3 诱导表达 37 ℃下振摇培养至菌体浓度达OD600 nm约为1时,加入终浓度0.1 mmol·L-1IPTG,37 ℃下诱导表达3 h。培养物4 ℃下5 000 r·min-1离心30 min,沉淀用PBS洗涤3次。每100 mL培养液加20 mL PBS以悬浮菌体沉淀,冰水浴中超声裂解菌悬液(超声功率为300 W,工作4 s间歇5 s,超声裂解15 min)。裂解物12 000 r·min-1离心10 min,采用免疫印迹(GST小鼠单克隆抗体)检测上清中的GST融合蛋白。
1.2.4 蛋白质纯化 纯化上清中的可溶性重组蛋白质。向裂解物中加入终浓度1% Trition X-100,4 ℃振摇孵育30 min,5 000 r·min-1离心30 min,收集上清。每20 mL上清加入300 μL Gluthathione-Sepharose 4B,4 ℃搅动孵育1 h。PBS洗涤3次后用10 mmol·L-1还原性谷胱甘肽洗脱,采用透析法去除其中的还原性谷胱甘肽。利用SDS-PAGE分析纯化效果。
1.2.5 细菌黏附抑制试验 在6孔培养板内放入细胞爬片进行细胞培养,倒置显微镜下观察爬片上细胞生长至60%时停止培养,用RPMI-1640洗贴壁细胞3次。加入RPMI-1640洗涤的新鲜化脓隐秘杆菌(109·mL-1),10 μL·孔-1;加入肝素溶液(RPMI-1640溶液配制),使用RPMI-1640溶液将每孔溶液补足至1 mL,肝素终质量浓度依次为13.8、3.6、1.2、0.4、0.13、0 mg·mL-1。37 ℃放置1 h。弃去悬浮液,加入RPMI-1640溶液振摇洗3次。甲醛固定10 min,PBS洗2次。取出爬片,在爬片上滴一滴结晶紫溶液染色1 min,用蒸馏水冲洗干净,待爬片干燥后观察。
1.2.6 融合蛋白黏附试验 用胰酶(0.05%胰酶,0.02% EDTA)消化长满单层的HeLa细胞,用RPMI-1640洗3次,将细胞制备成1010·mL-1备用。将蛋白质(GST、GST-NRB或GST-B1)的质量浓度调整为1 mg·mL-1。按表1加入各组分,每组按蛋白质质量浓度分为4个浓度梯度,依次为0、0.05、0.15和0.75 mg·mL-1。颠倒混匀各组分,4 ℃下缓慢摇动孵育1 h。4 ℃下800 r·min-1离心10 min,沉淀用1 mL 预冷PBS洗3次。样本经SDS-PAGE后转印至硝酸纤维素膜上,用5%脱脂奶粉封闭2 h,TBST洗3次后与GST单克隆抗体(1∶5 000)孵育,TBST洗3次后与碱性磷酸酶标记的山羊抗小鼠IgG(1∶5 000)孵育,最后置BCTP/NBT中显色。
1.2.7 融合蛋白黏附抑制试验 按上述方法制备细胞和肝素溶液。按表2加入各组分,每组按肝素浓度分为4个质量浓度梯度,依次为0、13.29、39.69、118.80 mg·mL-1。混匀,4 ℃下缓慢摇动孵育1 h,其间注意翻转离心管以使细胞不沉降。4 ℃下800 r·min-1离心10 min保留沉淀。按上述方法进行免疫印迹分析。
表1融合蛋白细胞黏附分析

Table 1 Cell adhesion assay of fusion proteins μL
表2肝素抑制融合蛋白黏附细胞分析
Table2Heparininhibitstheadhesionoffusionproteinstocells
μL
2 结 果
2.1 序列分析
CbpA-CQ基因全长3 456 bp,编码1 151个氨基酸残基的蛋白质。BLAST结果显示,CbpA-CQ在胶原结合蛋白重复B结构域部分与化脓隐秘杆菌、链球菌属等细菌有同源性,覆盖率为55%,其编码基因也仅在这部分与上述细菌有同源性。
在CbpA-CQ中,共有38 R、97 K和17 H,碱性氨基酸含量为13.2%(152/1151)(图1)。保守结构域分析结果显示,CbpA-CQ含有7个胶原结合蛋白B重复结构域。跨膜结构域和信号肽预测结果显示,在CbpA-CQ的N端有信号肽,羧基端有跨膜结构域(图1)。分子系统进化分析显示,CbpA-CQ与化脓隐秘杆菌的CbpA在进化树中聚集成一个进化支(图2)。
2.2 融合蛋白质的可溶性表达分析
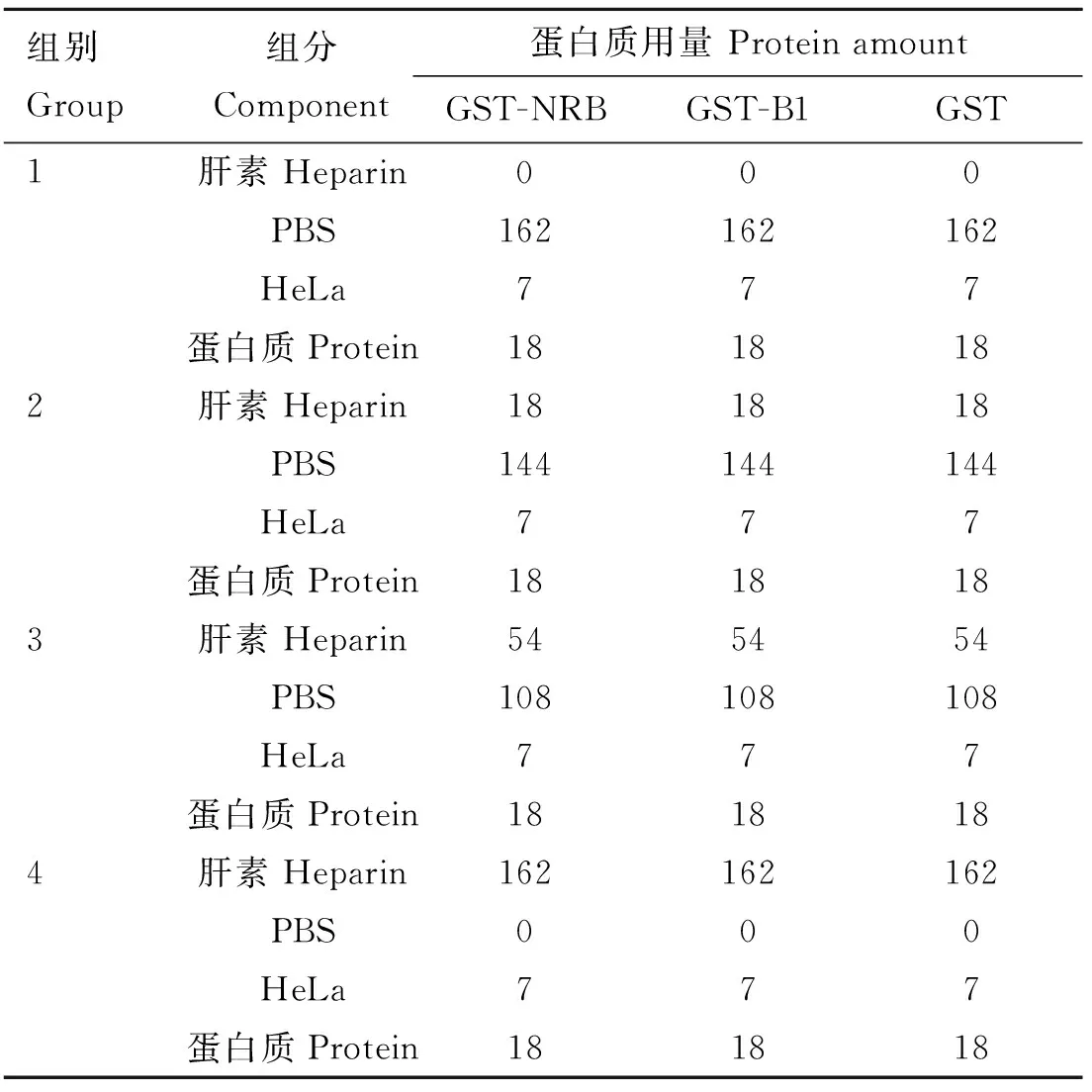
免疫印迹分析显示,重组菌经IPTG诱导后,在裂解物上清中可见相对分子质量分别约44和33 ku的目的条带,大小与预期相符,表明融合蛋白GST-NRB和GST-B1有可溶性表达(图3)。

信号肽切割位点以箭头标注。用于表达的氨基酸序列为斜体和加粗字体,7个重复B结构域用下划线标注,跨膜结构域被加框The predicted signal peptide cleavage site is denoted by the vertical arrow. The amino acid sequence expressed is in italic and bold, seven repeat B domains are underlined, and the intervening membrane-spanning domain is boxed图1 CbpA-CQ的序列分析Fig.1 Sequence analysis of CbpA-CQ

●. CbpA-CQ图2 CbpA-CQ及其相似蛋白质进化树Fig.2 Phylogenetic tree of CbpA-CQ and similar proteins
M. 蛋白质相对分子质量标准;1. GST-NRB;2.GST-B1;3.GST-NRBM. Protein marker; 1. GST-NRB; 2.GST-B1; 3.GST-NRB图3 菌体裂解物上清的融合蛋白质Western blot鉴定(GST单克隆抗体)Fig.3 Detection of fusion proteins by Western blot (GST mAb) in the supernatant of the induced bacteria lysate
2.3 融合蛋白质纯化
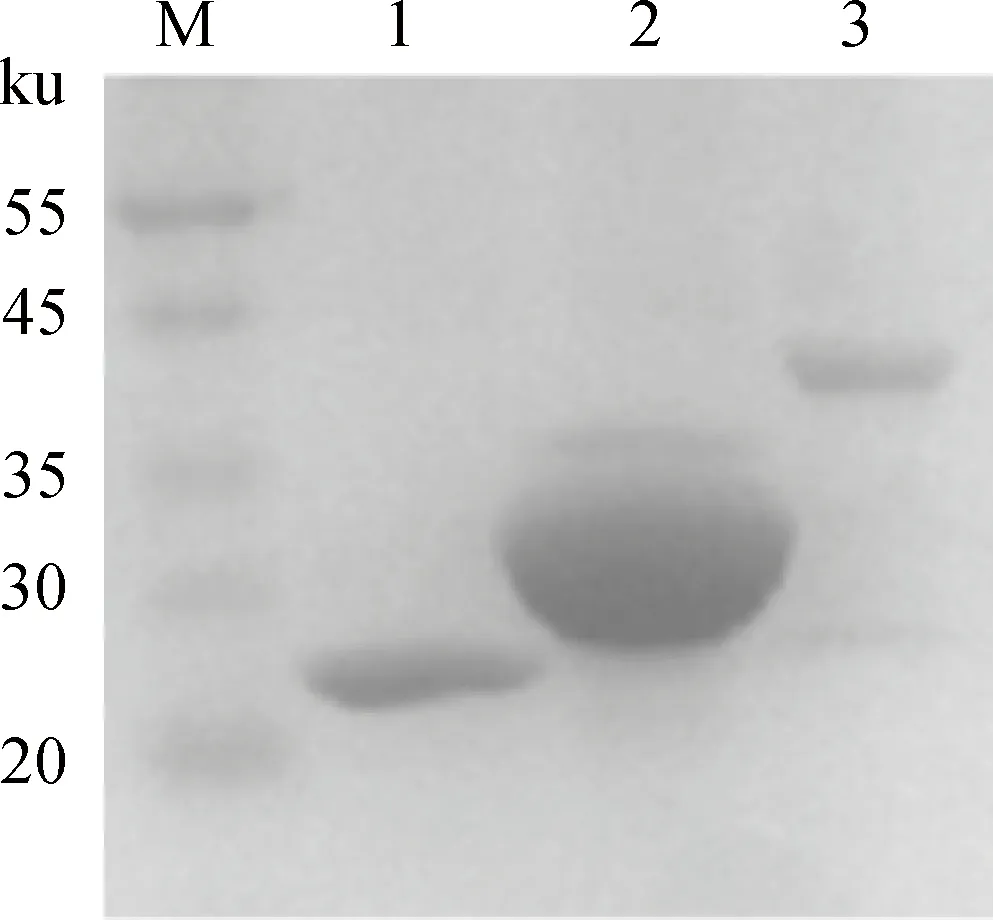
SDS-PAGE分析显示,采用Gluthathione-Sepharose 4B从裂解物上清中纯化得到融合蛋白质GST-NRB和GST-B1(图4)。
2.4 肝素抑制化脓隐秘杆菌黏附细胞
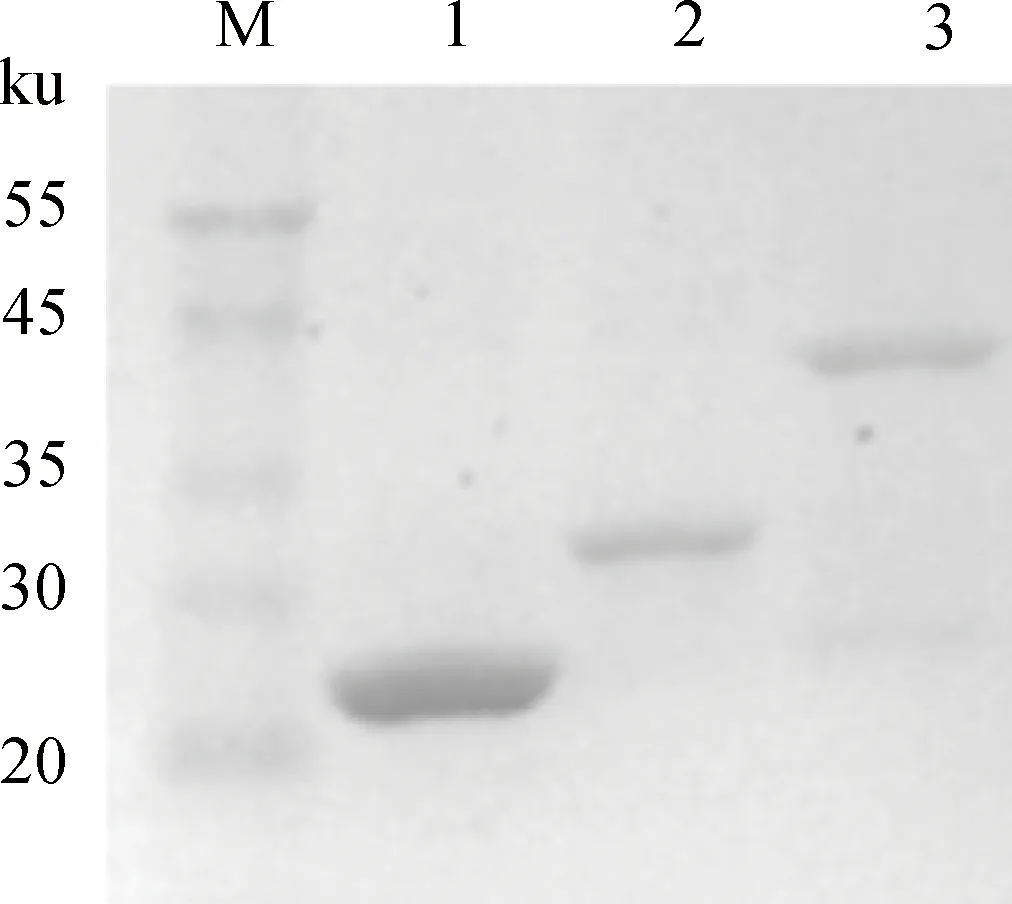
结晶紫染色观察显示,共同孵育后,山羊化脓隐秘杆菌重庆株黏附到HeLa细胞表面;肝素、化脓隐秘杆菌、细胞共同孵育后,在肝素质量浓度为0.13~13.8 mg·mL-1间,HeLa细胞表面的化脓隐秘杆菌数量随肝素剂量递增而递减(图5)。
M. 蛋白质相对分子质量标准;1. GST;2. GST-B1;3. GST-NRB M. Protein marker; 1. GST; 2. GST-B1; 3. GST-NRB图4 融合蛋白质的纯化Fig.4 Purification of fusion proteins
2.5 融合蛋白质黏附细胞及肝素抑制黏附
免疫印迹显示,GST未与HeLa细胞发生黏附,GST-NRB、GST-B1与HeLa细胞孵育后,出现特异条带,且条带亮度随GST-NRB、GST-B1剂量的增加而增加,表现出良好的剂量依赖关系(图6),
肝素剂量:13.8(A)、3.6(B)、1.2(C)、0.4(D)、0.13(E)、0(F)mg·mL-1Heparin dose: 13.8 (A), 3.6 (B), 1.2 (C), 0.4 (D), 0.13 (E) and 0 (F) mg·mL-1图5 肝素抑制山羊化脓隐秘杆菌重庆株黏附HeLa细胞Fig.5 Heparin inhibits the adhesion of T. pyogenes Chongqing isolate from goat to HeLa cells
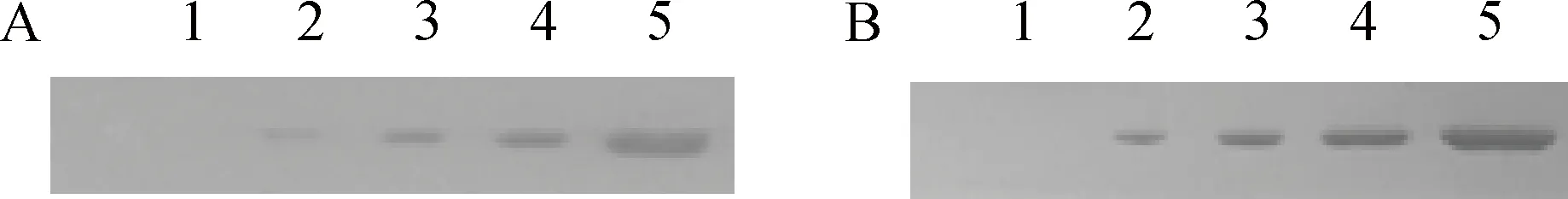
A. GST-NRB;B. GST-B1。1. GST;2~5. 0、0.05、0.15和0.75 mg·mL-1蛋白质A. GST-NRB; B. GST-B1. 1. GST; 2-5. Protein concentration: 0, 0.05, 0.15 and 0.75 mg·mL-1, respectively图6 GST-NRB和GST-B1黏附HeLa细胞分析Fig.6 Adhesion assay of GST-NRB and GST-B1 to HeLa cells
表明GST-NRB、GST-B1与HeLa细胞发生特异性黏附,且黏附与标签GST无关。肝素与HeLa细胞、GST-NRB或GST-B1孵育后,免疫印迹中的特异条带亮度随肝素质量浓度降低而升高,表现出剂量依赖关系(图7),表明肝素对GST-NRB、GST-B1黏附细胞的抑制作用是特异的。

A. GST-NRB;B. GST-B1。1~4. 0、13.29、39.69和118.80 mg·mL-1肝素A. GST-NRB; B. GST-B1. 1-4. Heparin concentration: 0, 13.29, 39.69 and 118.80 mg·mL-1, respectively图7 肝素抑制GST-NRB 和GST-B1黏附HeLa细胞分析Fig.7 Heparin inhibits the adhesion of GST-NRB and GST-B1 to HeLa cells
3 讨 论
序列分析结果显示,CbpA-CQ基因及其编码的蛋白质尽管在前半部分有超过40%的序列与已知菌株无同源性,但Cbp-CQ具有MSCRAMM 家族典型的分子特征,即N端含有信号序列、配体结合结构域、C端有细胞壁锚定结构域等[6],与化脓隐秘杆菌的同源性最高,在进化树中与化脓隐秘杆菌构成一个独立进化分支。研究指出化脓隐秘杆菌的CbpA可黏附多种细胞,在黏附宿主细胞上发挥重要作用[7]。我们的结果证实CbpA-CQ的NRB和B1结构域可黏附HeLa细胞,提示其在功能上可能与化脓隐秘杆菌其他菌株的CbpA一样在黏附宿主细胞上发挥作用。
黏附宿主细胞是感染发生的关键阶段。在过去的研究中,人们发现细菌、病毒、寄生虫等病原体特异黏附真核细胞表面的氨基葡聚糖分子,是黏膜感染的主要机制之一[8-11]。本研究观察到肝素可竞争性抑制山羊化脓隐秘杆菌重庆株黏附HeLa细胞,表明肝素分子介导细菌黏附HeLa细胞,提示化脓隐秘杆菌也利用这一一般策略以实现感染动物。
氨基葡聚糖结合蛋白在细菌生长和培养过程中表达,微生物利用氨基葡聚糖结合蛋白黏附、入侵宿主[13]。蛋白质与肝素类似物黏附的分子基础,是配体蛋白分子上带正电荷的氨基酸簇与肝素类似物的负电荷形成离子键,带正电荷的氨基酸簇与疏水性氨基酸相靠近[14],疏水性氨基酸侧链和肝素类似物的非极性基团间的相互作用稳定了蛋白质和聚糖的作用[15]。暴露在结构域表面的富含赖氨酸基序在配体分子与肝素或硫酸乙酰肝素结合上起主要作用,而其他区域或结构域对结合有稳定或促进作用[15-17]。这样,尽管肝素结合蛋白的功能、空间构象可能不同,但它们都具有肝素结合基序(motif)暴露在结构域表面。因此,在蛋白质序列中带正电荷的区域尤其是含有赖氨酸簇区域是肝素分子的潜在结合位点。CbpA是碱性氨基酸含量高的蛋白质,可能是肝素结合蛋白。为了鉴定肝素结合域,本研究选择了CbpA-CQ中富含碱性氨基酸的NRB和B1区域,通过黏附试验和黏附抑制试验证实NRB和B1是肝素结合结构域,其与HeLa细胞的黏附受肝素介导。
4 结 论
运用生物信息学软件分析山羊化脓隐秘杆菌重庆分离株的胶原结合蛋白(CbpA-CQ)基因及其编码产物。发现重庆株CbpA有7个胶原结合蛋白B结构域,约占全长的55%,此结构域与化脓隐秘杆菌、链球菌属等细菌有同源性,具有已知化脓隐秘杆菌CbpA的共同序列特征;CbpA-CQ的NRB和B1结构域可黏附HeLa细胞,其NRB和B1区域为肝素结合结构域。
[1] RIBEIRO M G, RISSETI R M, BOLAOS C A, et al.Trueperellapyogenesmultispecies infections in domestic animals: a retrospective study of 144 cases (2002 to 2012)[J].VetQ, 2015, 35(2): 82-87.
[2] ISHIYAMA D, MIZOMOTO T, UEDA C, et al. Factors affecting the incidence and outcome ofTrueperellapyogenesmastitis in cows[J].JVetMedSci, 2017, 79(3): 626-631.
[3] AFEMA J A, BECKMEN K B, ARTHUR S M, et al. Disease complexity in a declining Alaskan muskox (Ovibosmoschatus) population[J].JWildlDis, 2017, 53(2): 311-329.
[4] 张素辉, 付利芝, 朱买勋, 等. 山羊源化脓隐秘杆菌的分离与鉴定及自然感染病例的病理学观察[J]. 畜牧兽医学报, 2015, 46(12): 2251-2257.
ZHANG S H, FU L Z, ZHU M X, et al. Isolation and identification ofArcanobacteriumpyogenesfrom goats and pathological observation of naturally infected case[J].ActaVeterinariaetZootechnicaSinica, 2015, 46(12): 2251-2257. (in Chinese)
[5] 许国洋, 付利芝, 杨金龙, 等. 山羊淋巴结炎病原菌的分离鉴定及多重PCR检测方法的建立[J]. 畜牧兽医学报, 2017, 48(2): 324-330.
XU G Y, FU L Z, YANG J L, et al. Isolation and identification of pathogenic bacteria of lymphadenitis in goat and establishment of multiplex PCR detection method[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(2): 324-330. (in Chinese)
[6] ROSS C L, LIANG X W, LIU Q, et al. Targeted protein engineering provides insights into binding mechanism and affinities of bacterial collagen adhesins[J].JBiolChem, 2012, 287(41): 34856-34865.
[7] ESMAY P A, BILLINGTON S J, LINK M A, et al. TheArcanobacteriumpyogenescollagen-binding protein, CbpA, promotes adhesion to host cells[J].InfectImmun, 2003, 71(8): 4368-4374.
[8] FULLER A O. Microbes and the proteoglycan connection[J].JClinInvest, 1994, 93(2): 460.
[9] WADSTRÖM T, LJUNGH Å. Glycosaminoglycan-binding microbial proteins in tissue adhesion and invasion: key events in microbial pathogenicity[J].JMedMicrobiol, 1999, 48(3): 223-233.
[10] MENOZZI F D, PETHE K, BIFANI P, et al. Enhanced bacterial virulence through exploitation of host glycosaminoglycans[J].MolMicrobiol, 2002, 43(6): 1379-1386.
[11] 尹 鑫,张 颖,刘澜澜, 等. 3种受体抑制剂对鸡传染性支气管炎病毒感染鸡胚肾细胞的影响[J]. 畜牧兽医学报, 2011, 42(5): 704-710.
YIN X, ZHANG Y, LIU L L, et al. The impact of three different receptor inhibitors in the progress of infectious bronchitis virus infection in chicken embryo kidney cells[J].ActaVeterinariaetZootechnicaSinica, 2011, 42(5): 704-710. (in Chinese)
[12] ZHANG S H, QIU J J, YANG R, et al. Complete genome sequence ofTrueperellapyogenes, isolated from infected farmland goats[J].GenomeAnnounc, 2016, 4(6): e01421-16, doi: 10.1128/genomeA.01421-16.
[13] CHHATWAL G S. Anchorless adhesins and invasins of Gram-positive bacteria: a new class of virulence factors[J].TrendsMicrobiol, 2002, 10(5): 205-208.
[14] SINNIS P, CLAVIJO P, FENYÖ D, et al. Structural and functional properties of region II-plus of the malaria circumsporozoite protein[J].JExpMed, 1994, 180(1): 297-306.
[15] VERMERSCH P S, LEMON D D, TESMER J J, et al. Sugar-binding and crystallographic studies of an arabinose-binding protein mutant (Met108Leu) that exhibits enhanced affinity and altered specificity[J].Biochemistry, 1991, 30(28): 6861-6866.
[16] YUAN Z Z, YAN X J, ZHANG A D, et al. Molecular mechanism by which surface antigen HP0197 mediates host cell attachment in the pathogenic bacteriaStreptococcussuis[J].JBiolChem, 2013, 288(2): 956-963.
[17] ZHAO J H, BHANOT P, HU J J, et al. A comprehensive analysis ofPlasmodiumcircumsporozoite protein binding to hepatocytes[J].PLoSOne, 2016, 11(8): e0161607.
