绵羊季节性繁殖的神经内分泌研究进展
2018-01-26贺小云胡文萍王翔宇刘秋月储明星
贺小云,狄 冉,胡文萍,王翔宇,刘秋月,储明星
(中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193)
季节性繁殖是指成年哺乳动物随着季节的变化而呈现可逆的繁殖和不繁殖的现象,被认为是动物适应环境变化而形成的“自然避孕”措施[1]。当环境条件有利于其泌乳和后代生存时,它们就会打开生殖开关进行繁殖。虽然同一区域内的大多数哺乳动物在一年中的繁殖运转基本一致,但对其神经内分泌规律的研究主要集中在绵羊、叙利亚仓鼠和西伯利亚仓鼠3个物种中[2-5]。绵羊由于具有个体大、静脉血液易采集、脑部等器官组织易辨认的特点,是研究生殖激素的实时变化和下丘脑神经元回路潜在变化的理想动物。
绵羊在一年中表现出不同的繁殖模式:对于母羊,有卵巢活动和排卵的时期称为繁殖季节,卵巢静止和无排卵交替则称乏情,卵巢生殖活动的季节性变化主要来源于脑部下丘脑功能的控制,尤其是对GnRH释放的调控[6]。一方面,乏情期下丘脑GnRH对雌激素的负反馈响应迅速增加,随着繁殖季节的到来而逐渐降低;另一方面,科学家利用双侧卵巢摘除模型发现了类固醇激素对GnRH的释放具有非依赖性抑制作用[3,7-8]。目前,由于雌激素的负反馈引起动物季节性繁殖的说法被广泛接受。本文通过总结外界环境改变导致绵羊季节性繁殖的传入系统、GnRH分泌对雌激素负反馈的敏感度变化的神经回路、绵羊与仓鼠神经内分泌控制季节性繁殖的差异和相似点,以揭示绵羊季节性繁殖的功能系统和该系统中特异的神经递质和神经肽。
1 光照周期与绵羊季节性繁殖
在哺乳动物中,光周期或者日照长短是影响动物繁殖季节性转变的关键因素。在秋季和冬季,母羊的生殖内分泌轴受短日照的刺激,从而进入排卵周期和繁殖状态;相反,在春季和夏季,长日照阻断了生殖内分泌轴的活动,从而进入休情状态[9-10]。光周期信息通过这样一个神经-激素通路将信息传递给生殖内分泌系统:光经视网膜投射到视交叉上核,然后通过一个多功能突触回路,最终将信号传递到松果体,松果体分泌的褪黑激素作为一个重要媒介将光周期信号传递到下丘脑及其它脑室,褪黑激素通常在晚上由松果体合成和分泌,而在白天褪黑激素的含量几乎降为零[3,11-12]。因此,褪黑激素成为研究动物季节性发情的主要切入点。在绵羊中,外界日照时间缩短,褪黑激素升高持续时间延长,绵羊进入发情周期;外界日照时间延长,褪黑激素升高持续时间缩短,绵羊不发情[13](图1)。
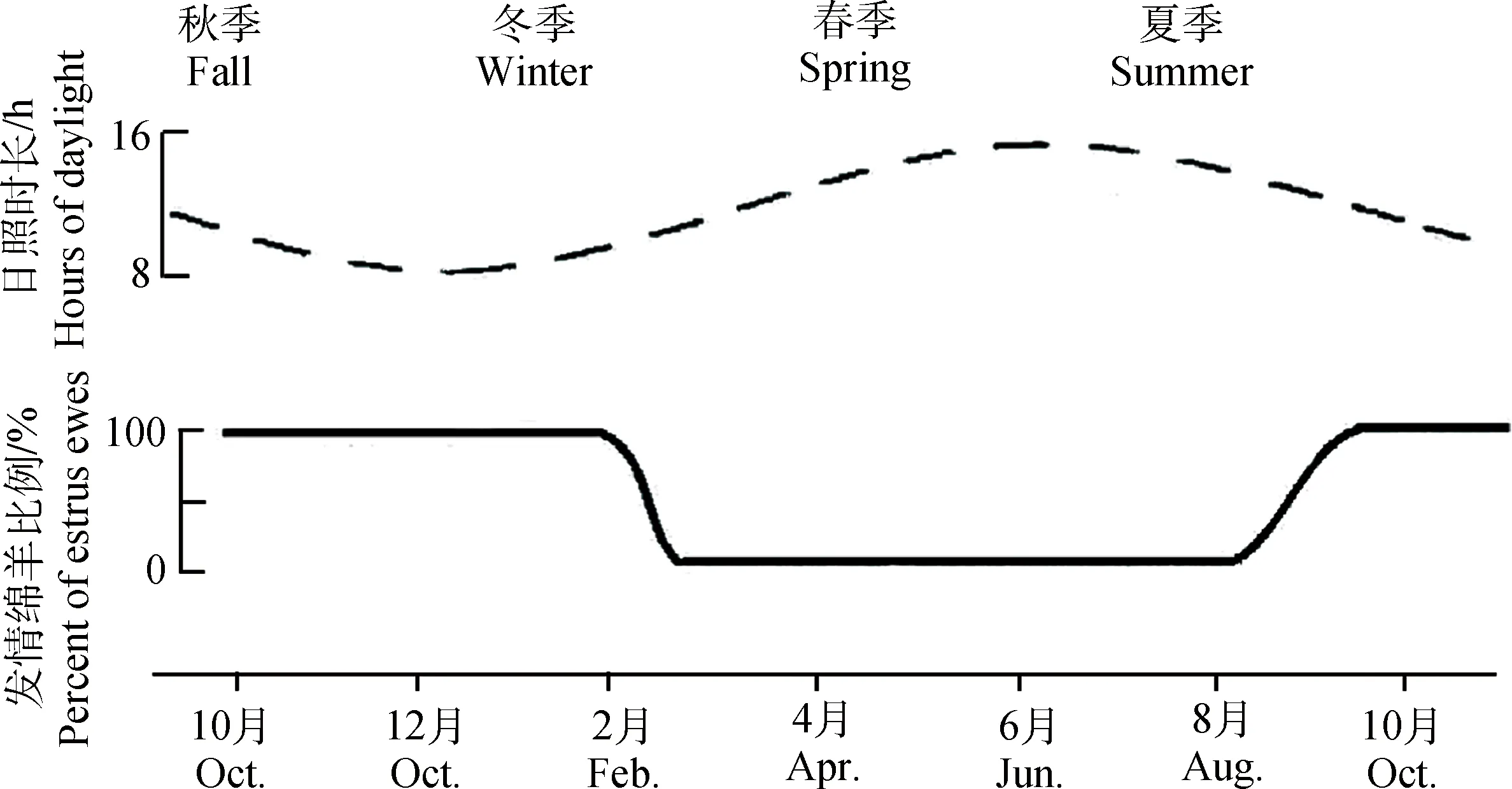
图1 绵羊繁殖状态在一年中随日照长短变化Fig.1 Changes in fertility with the variations of daylight throughout the year
科学家利用摘除松果体的绵羊研究发现,褪黑激素和内源的周期节律同步作用引起动物季节性繁殖[14-16]。目前,褪黑激素的生理作用已广为人知,但其具体作用靶点还存在争议。早期科学家通过体外植入褪黑激素的方法,发现褪黑激素的特异性靶点在下丘脑的乳头体前部(Premammillary region, PMR)[10,15];而近期的研究发现,绵羊褪黑激素受体在垂体结节部(Pars tuberalis, PT)浓度最高[9],暗示垂体结节部可能是褪黑激素作用的一个重要靶点,至少对绵羊由发情周期转向乏情十分关键。
绵羊由发情周期转变为乏情最早的研究主要集中在甲状腺激素(T3和T4),二者是绵羊从发情周期进入乏情期必不可少的一部分,摘除甲状腺的绵羊可以一直处于发情周期[16]。长日照对脑部T4转变成T3十分重要,且这种转变主要是PT的褪黑激素活动引起的[17-18]。针对这一发现科学家进行了详细描述:长日照条件下,褪黑激素导致PT的视力缺失转录因子(Eyes absent 3, Eya3)表达,Eya3是一个生物钟基因,其表达在褪黑激素释放12 h后达到峰值;如果褪黑激素的浓度降低,则Eya3表达下降,刺激促甲状腺激素(Thyroid stimulating hormone, TSH)的合成,接着TSH分泌到存在其受体的临近神经组织,刺激二型脱碘酶(Type 2 deiodinase, DIO2)分泌,促使T4转变成T3,T3可以诱导神经系统改变,GnRH脉冲式分泌关闭[17,19-20];长日照对三型脱碘酶(Type 3 deiodinase, DIO3)的分泌有着相反的作用,可使其浓度降低,但其降低的原因并不是由TSH分泌变化造成的[18]。综上表明,T3在其中发挥着重要作用,但其具体作用位置和作用方式仍然有待于进一步研究。由于T3在神经元可塑性和神经发育中扮演一个重要角色,科学家推断,它可能改变了神经回路中神经元的形态特征,增加了绵羊在乏情期对雌激素负反馈的灵敏度,然后才将信号传输给GnRH神经元[21]。
2 绵羊季节性繁殖的神经内分泌研究
大量的研究集中在雌二醇(E2)对乏情期绵羊下丘脑回路的负反馈作用。乏情期下丘脑对E2的敏感性增加,即使低浓度的E2也能强烈抑制GnRH活动,防止LH浓度升高[22-23]。虽然乏情期由于E2的负反馈作用导致排卵停止,但脉冲机制依然存在,科学家通过研究发现外源E2发挥正反馈作用,诱导GnRH/LH峰[24]。因此,E2负反馈调节对下丘脑GnRH神经元的影响是研究绵羊季节性繁殖神经内分泌调控机制的主要方向。
雌激素α受体(Estrogen receptor alpha, ERα)是研究E2对GnRH负反馈调节的关键受体,但由于GnRH神经元表面缺乏该受体,所以对E2发挥负反馈调节的传入通路进行鉴定至关重要。早期研究发现,在乏情期绵羊中多巴胺(Dopamine, DA)D2受体拮抗剂受体,但由于GnRH神经元表面缺乏该受体,所以对E2发挥负反馈调节的传入通路进行研究以阻止E2发挥抑制作用,并且在视交叉后区(Retrochiasmatic area, RCh)发现了许多关键性的多巴胺能神经元,被称为A15群,这些多巴胺能神经元目前已被公认在季节性繁殖调控中扮演着关键角色[25-27]。首先,在乏情期,研究者发现母羊A15神经元受损阻止了E2负反馈,而无论在什么季节,直接刺激A15神经元都能阻止GnRH/LH脉冲;其次,在GnRH/LH脉冲释放之前,A15群的多神经元活动降低,反之,当E2负反馈作用存在时,A15群的多神经元活动升高[28-29]。但和GnRH神经元一样,A15多巴胺神经元也不表达ERα,E2通过间接作用调节A15多巴胺细胞,意味着雌激素应答细胞是E2负反馈传入回路中的关键一步。科学家通过局部给药试验鉴定了两个主要的E2应答细胞区域在E2负反馈过程中被激活,这两个区域是腹内侧核视前区(Ventromedial preoptic area, vmPOA)和RCh,ERα阳性神经元在这两个区域将输入信号传递给A15神经元[21]。
那么,A15神经元是如何调控GnRH释放的呢?在绵羊下丘脑视前区(Preoptic area, POA)有大量GnRH神经元,少量位于下丘脑前部(Anterior hypothalamic area, AHA)及下丘脑内侧基底部(Mediobasal hypothalamus, MBH)。科学家通过神经通路研究发现,A15神经元的主要投射区在MBH[22]。在繁殖季节,绵羊正中隆起(Median eminence, ME)的多巴胺能神经元末梢通过轴-树突触与GnRH末端连接,A15神经元释放多巴胺可能作用于ME的GnRH神经元轴突直接抑制其脉冲释放,但它们在GnRH轴突和末端的传递和具体作用方式还不清楚[30-31]。最近研究发现,A15可能通过另一个可选的多突触通路在弓状核(Arcuate nucleus, ARC)介导GnRH分泌调控,ARC上的神经亚群kiss神经元可以表达kisspeptin,与A15细胞分泌的多巴胺作用相反,kisspeptin也可以刺激GnRH分泌,相关研究已经证明在绵羊及其它物种季节性发情中发挥重要作用[32-34]。ARC中kisspeptin细胞还表达神经激肽B(Neurokinin B)和强啡肽(Dynorphin)两种作用肽。因此,科学家将分泌这3种物质(Kisspeptin、Neurokinin B和Dynorphin)的细胞群命名为KNDy细胞群,目前该细胞群是研究动物繁殖神经内分泌调控的重点[35-37]。
随着研究的深入,大量研究表明,ARC中KNDy细胞在绵羊季节性繁殖调控中发挥重要作用。J.T.Smith等[27]发现,由于E2的负反馈抑制,乏情期绵羊下丘脑ARC细胞中Kiss1 mRNA含量及kisspeptin神经肽较低;同时,由下丘脑MBH细胞分泌作用于GnRH神经元的kisspeptin含量也明显较低。研究者还发现:KNDy细胞分泌的强啡肽和D2受体共表达时,对GnRH的脉冲释放有季节性抑制作用,共表达机制随季节改变而发生变化,通过脑部注射kisspeptin拮抗剂可以完全阻断D2受体拮抗剂的作用,使绵羊在非繁殖季节出现GnRH脉冲频率[26]。由此推断,A15多巴胺神经元主要通过ARC影响乏情期的绵羊GnRH释放。因此,E2负反馈影响乏情期母羊的神经内分泌回路,如图2所示:在乏情期,E2作用于POA和RCh表达的ERα,进而刺激A15,被激活的A15神经细胞末梢投射到下丘脑MBH,然后释放DA,DA通过两种方式作用于GnRH神经元。1)直接作用:在正中隆起通过轴-树突触连接作用于GnRH神经元;2)间接作用:在下丘脑ARC通过下调kisspeptin的表达抑制GnRH的脉冲释放。
虽然大量研究表明,ARC中KNDy细胞在雌性绵羊季节性繁殖调控中发挥重要作用,但是仍有部分问题尚待解决。绵羊乏情期下丘脑ARC中KNDy细胞群kisspeptin含量降低可能由于A15末端多巴胺释放增加,也有可能是由于多巴胺受体增加,或者其它输入信号的改变,目前还不清楚。虽然图2展示了E2在乏情期发挥负反馈调节的神经内分泌回路,但仍然不能解释乏情期下丘脑对E2的敏感性增加的原因,科学家推断其可能与下丘脑神经元的季节性重塑有关[25,38-39]。

图2 雌二醇负反馈对下丘脑中神经回路的季节性调控Fig.2 Seasonal regulation of hypothalamus Neural circuitry by E2 negative feedback
3 绵羊与仓鼠季节性繁殖机制比较
除了绵羊,科学家对仓鼠季节性繁殖的神经内分泌机制也进行了大量的研究[3, 40-43],二者在多个方面作用机制相似:1)光周期都是它们季节性繁殖的环境信号;2)松果体分泌的褪黑激素对于连接外部光周期变化和性腺轴活动至关重要,且光周期调控松果体褪黑激素释放的神经通路基本一致;3)类固醇激素对促性腺激素释放存在正负两种反馈作用。虽然它们之间存在诸多相似之处,但随着研究的深入,一些细微的差异逐渐被发现:如褪黑激素在下丘脑的作用位点不同,绵羊是乳头体前区(Premammillary region, PMR)[10],叙利亚仓鼠和西伯利亚仓鼠分别在下视丘背内侧核(Dorsomedial hypothalamus, DMH)[44]和视交叉上核(Suprachiasmatic nucleus, SCN)[45];绵羊DIO2和DIO3含量都受日照长短的影响[46],对于叙利亚仓鼠,长日照可以使其DIO2含量增加,而DIO3的表达无论是在什么日照条件下几乎都是不可见的[41, 47],但DIO3的表达变化与西伯利亚仓鼠的季节性繁殖密切相关[48]。此外,仓鼠和绵羊在季节性繁殖活动中存在许多差异,如仓鼠是长日照发情动物,而绵羊是短日照发情动物;仓鼠的妊娠期仅有几周,而绵羊却长达5个月。研究者认为,充分了解绵羊与仓鼠之间季节性繁殖的差异对于促进绵羊繁殖性状研究意义重大。
通过绵羊和仓鼠的比较,季节性繁殖神经机制差异可能主要来源于A15多巴胺神经元的作用。如前文所述,A15多巴胺神经元在绵羊的季节性发情中发挥重要作用,而在仓鼠季节性繁殖中的作用目前还未见报道,但Kiss1神经元作为重要的中间环节被广泛关注。然而,当检测kisspeptin的含量时,西伯利亚仓鼠和叙利亚仓鼠之间也有明显的差别,后者的作用机制更像绵羊[49]。kisspeptin在下丘脑ARC和POA都有表达,但与绵羊不同的是,仓鼠下丘脑前腹部室旁核(Anteroventral periventricular nucleus, AVPV)同样也表达kisspeptin[34]。在叙利亚仓鼠中,发情期ARC和AVPV的kisspeptin表达都会上升,但由于ARC中kisspeptin的表达受褪黑激素控制,其更可能是季节性繁殖调控的主要区域;相反,体外对雄鼠进行睾酮处理发现,下丘脑AVPV区域kisspeptin的表达受外源睾酮的影响发生显著变化[50],表明其繁殖季节下丘脑AVPV中kisspeptin表达上升可能是下丘脑-垂体-性腺轴被激活的表现而不是诱因。在西比利亚仓鼠中,kisspeptin的表达模式与叙利亚仓鼠有所不同:长日照条件下,ARC中kisspeptin表达降低,而AVPV中kisspeptin表达升高[51-52]。在短日照条件下,外源注射kisspeptin不能恢复西伯利亚仓鼠的繁殖能力,这种现象可能反映出在西伯利亚仓鼠中kisspeptin不是调节季节性变化的关键因子。
最近研究发现,长日照条件下仓鼠下丘脑DMH处RFRP-3的表达不管是mRNA水平还是蛋白水平都有显著升高,这种变化可能是由褪黑激素引起的[49,53]。短日照条件下外源性RFRP-3在两种仓鼠中都能刺激LH释放;而在长日照条件下,外源性RFRP-3在叙利亚仓鼠中对LH起抑制作用,在西伯利亚仓鼠中起刺激作用[54]。由此可以推断长日照刺激了RFRP-3的释放,从而影响了雄性仓鼠下丘脑-垂体-性腺轴的活动。科学家还意外发现,短日照刺激增加了西伯利亚仓鼠ARC中kisspeptin阳性神经元的数量,暗示着RFRP-3可能通过kisspeptin神经元发挥作用[55]。
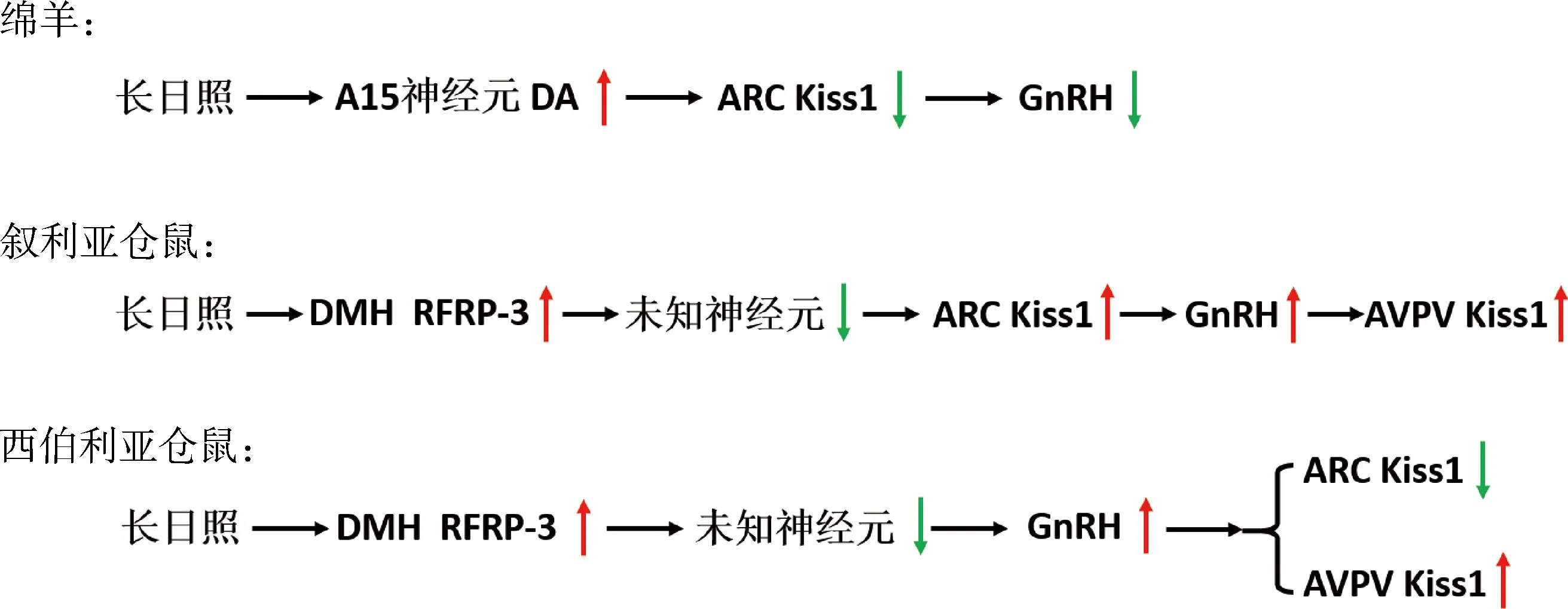
图3 长日照对绵羊、叙利亚仓鼠、西伯利亚仓鼠神经调控GnRH释放的影响Fig.3 The effects of long days on GnRH secretion in sheep, Syrian and Siberian hamsters
综上所述,不论是绵羊还是仓鼠,其下丘脑ARC在光照调控GnRH分泌中都发挥着重要作用,并且长光照在两物种中具有相反的作用效果。如图3所示:在母羊中,长日照激活DA神经元释放DA,DA能够降低ARC kisspeptin神经元活性,从而抑制GnRH和LH释放以及繁殖活动;在叙利亚仓鼠中,长日照刺激下丘脑DMH处神经元释放RFRP-3,RFRP-3通过某未知神经元发挥抑制作用,间接促使下丘脑ARC kisspeptin神经元的活性增强,高表达的kisspeptin促使GnRH释放,诱导性腺功能恢复,从而引起下丘脑AVPV kisspeptin表达升高;在西伯利亚仓鼠中,长光照首先也是刺激下丘脑DMH处神经元释放RFRP-3,再通过某未知神经元发挥抑制作用,不同的是,未知神经元的作用先引起了GnRH的分泌发生变化,而不是kisspeptin神经元的活动。
4 小 结
虽然国内外对绵羊季节性繁殖机制已进行了多年探索,但由于对神经回路中褪黑激素活动如何介导E2的负反馈调节了解较少,致使光周期调节绵羊季节性发情神经机制的研究还存在许多盲点。科学家通过外源激素植入和人工控制光照等措施对季节性发情调控中的相关通路和基因变化进行了大量研究[56],然而这些研究结果都没有很好地把神经调节与绵羊繁殖活动进行关联。主要原因:1)绵羊的季节性繁殖是一个复杂的生殖生理过程,涉及环境、遗传、内分泌等多个方面,其机制很难在短期内明晰;2)绵羊繁殖的季节性与光周期的变化关系巨大,并且还受气候、海拔、营养等因素的影响;3)绵羊季节性繁殖神经通路中多种神经元的功能还未完全阐述清楚,需要进一步探究。虽然有许多问题等待研究,但随着分子遗传学和表观遗传学的发展以及基因组学的兴起,对绵羊季节性繁殖的分子机理以及内分泌机制的研究会逐渐深入。目前,关于绵羊季节性繁殖的研究已经有了成功的动物模型,褪黑激素的功能和母羊季节性繁殖的大致神经回路也已有了很多了解,这些技术和研究成果可以为进一步阐明绵羊季节性繁殖的分子机制提供技术支持和理论基础。
[1] LINCOLN G A, SHORT R V. Seasonal breeding: nature’s contraceptive[J].RecentProgHormRes, 1980, 36: 1-52.
[2] ALFONZO J. Estrogen receptors involved in the differential regulation of hypothalamic kisspeptin expression[D]. Corvallis: University of Oregon State, 2016.
[3] KARSCH F J, BITTMAN E L, FOSTER D L, et al. Neuroendocrine basis of seasonal reproduction[J].RecentProgHormRes, 1984, 40: 185-232.
[4] LYNCH E W J, COYLE C S, STEVENSON T J. Photoperiodic and ovarian steroid regulation of histone deacetylase 1, 2, and 3 in Siberian hamster (Phodopussungorus) reproductive tissues[J].GenCompEndocrinol, 2017, 246: 194-199.
[5] HENNINGSEN J B, ANCEL C, MIKKELSEN J D, et al. Roles of RFRP-3 in the daily and seasonal regulation of reproductive activity in female Syrian hamsters[J].Endocrinology, 2017, 158(3): 652-663.
[6] KARSCH F J, GOODMAN R L, LEGAN S J. Feedback basis of seasonal breeding: test of an hypothesis[J].JReprodFertil, 1980, 58(2): 521-535.
[7] BITTMAN E L, KARSCH F J, HOPKINS J W. Role of the pineal gland in ovine photoperiodism: regulation of seasonal breeding and negative feedback effects of estradiol upon luteinizing hormone secretion[J].Endocrinology, 1983, 113(1): 329-336.
[8] WOODFILL C J I, WAYNE N L, MOENTER S M, et al. Photoperiodic synchronization of a circannual reproductive rhythm in sheep: identification of season-specific time cues[J].BiolReprod, 1994, 50(4): 965-976.
[9] THIERY J C, MALPAUX B. Seasonal regulation of reproductive activity in sheep: modulation of access of sex steroids to the brain[J].AnnNYAcadSci, 2003, 1007: 169-175.
[10] WEAVER D R, RIVKEES S A, REPPERT S M. Localization and characterization of melatonin receptors in rodent brain byinvitroautoradiography[J].JNeurosci, 1989, 9(7): 2581-2590.
[11] BITTMAN E L, DEMPSEY R J, KARSCH F J. Pineal melatonin secretion drives the reproductive response to daylength in the ewe[J].Endocrinology, 2013, 113(6): 2276-2283.
[12] JOHNSTON J D, SKENE D J. 60 years of neuroendocrinology: regulation of mammalian neuroendocrine physiology and rhythms by melatonin[J].JEndocrinol, 2015, 226(2): T187-T198.
[13] WEEMS P W, GOODMAN R L, LEHMAN M N. Neural mechanisms controlling seasonal reproduction: principles derived from the sheep model and its comparison with hamsters[J].FrontNeuroendocrinol, 2015, 37: 43-51.
[14] MALPAUX B, MIGAUD M, TRICOIRE H, et al. Biology of mammalian photoperiodism and the critical role of the pineal gland and melatonin[J].JBiolRhythms, 2001, 16(4): 336-347.
[15] MALPAUX B, DAVEAU A, MAURICE-MANDON F, et al. Evidence that melatonin acts in the premammillary hypothalamic area to control reproduction in the ewe: presence of binding sites and stimulation of luteinizing hormone secretion byinsitumicroimplant delivery[J].Endocrinology, 1998, 139(4): 1508-1516.
[16] DAHL G E, EVANS N P, MOENTER S M, et al. The thyroid gland is required for reproductive neuroendocrine responses to photoperiod in the ewe[J].Endocrinology, 1994, 135(1): 10-15.
[17] HANON E A, LINCOLN G A, FUSTIN J M, et al. Ancestral TSH mechanism signals summer in a photoperiodic mammal[J].CurrBiol, 2008, 18(15): 1147-1152.
[18] EHRENKRANZ J, BACH P R, SNOW G L, et al. Circadian and circannual rhythms in thyroid hormones: determining the TSH and free T4 reference intervals based upon time of day, age, and sex[J].Thyroid, 2015, 25(8): 954-961.
[19] DARDENTE H, WYSE C A, BIRNIE M J, et al. A molecular switch for photoperiod responsiveness in mammals[J].CurrBiol, 2010, 20(24): 2193-2198.
[20] DUPRÉ S M, MIEDZINSKA K, DUVAL C V, et al. Identification ofEya3 andTAC1 as long-day signals in the sheep pituitary[J].CurrBiol, 2010, 20(9): 829-835.
[21] LEHMAN M N, COOLEN L M, GOODMAN R L. Minireview: kisspeptin/neurokinin B/dynorphin (KNDy) cells of the arcuate nucleus: a central node in the control of gonadotropin-releasing hormone secretion[J].Endocrinology, 2010, 151(8): 3479-3489.
[22] GOODMAN R L, JANSEN H T, BILLINGS H J, et al. Neural systems mediating seasonal breeding in the ewe[J].JNeuroendocrinol, 2010, 22(7): 674-681.
[23] DARDENTE H, LOMET D, ROBERT V, et al. Seasonal breeding in mammals: from basic science to applications and back[J].Theriogenology, 2016, 86(1): 324-332.
[24] WINTERMANTEL T M, CAMPBELL R E, PORTEOUS R, et al. Definition of estrogen receptor pathway critical for estrogen positive feedback to gonadotropin-releasing hormone neurons and fertility[J].Neuron, 2006, 52(2): 271-280.
[25] SINGH S R, HILEMAN S M, CONNORS J M, et al. Estradiol negative feedback regulation by glutamatergic afferents to A15 dopaminergic neurons: variation with season[J].Endocrinology, 2009, 150(10): 4663-4671.
[26] GOODMAN R L, MALTBY M J, MILLAR R P, et al. Evidence that dopamine acts via kisspeptin to hold GnRH pulse frequency in check in anestrous ewes[J].Endocrinology, 2012, 153(12): 5918-5927.
[27] SMITH J T, COOLEN L M, KRIEGSFELD L J, et al. Variation in kisspeptin and RFamide-related peptide (RFRP) expression and terminal connections to gonadotropin-releasing hormone neurons in the brain: a novel medium for seasonal breeding in the sheep[J].Endocrinology, 2008, 149(11): 5770-5782.
[28] GOODMAN R L, SINGH S R, VALENT M, et al. Glutamate input to A15 neurons may mediate estradiol negative feedback in anestrous ewes[J].FrontNeuroendocrinol, 2006, 27(1): 65.
[29] GOODMAN R L, THIERY J C, DELALEU B, et al. Estradiol increases multiunit electrical activity in the A15 area of ewes exposed to inhibitory photoperiods[J].BiolReprod, 2000, 63(5): 1352-1357.
[30] FORADORI C D, AMSTALDEN M, GOODMAN R L, et al. Colocalisation of dynorphin A and neurokinin B immunoreactivity in the arcuate nucleus and median eminence of the sheep[J].JNeuroendocrinol, 2006, 18(7): 534-541.
[31] RIZZOTI K, LOVELL-BADGE R. Pivotal role of median eminence tanycytes for hypothalamic function and neurogenesis[J].MolCellEndocrinol, 2016, 445: 7-13.
[32] UENOYAMA Y, PHENG V, TSUKAMURA H, et al. The roles of kisspeptin revisited: inside and outside the hypothalamus[J].JReprodDev, 2016, 62(6): 537-545.
[33] PINILLA L, AGUILAR E, DIEGUEZ C, et al. Kisspeptins and reproduction: physiological roles and regulatory mechanisms[J].PhysiolRev, 2012, 92(3): 1235-1316.
[34] OAKLEY A E, CLIFTON D K, STEINER R A. Kisspeptin signaling in the brain[J].EndocrRev, 2009, 30(6): 713-743.
[35] WEEMS P, SMITH J, CLARKE I J, et al. Effects of season and estradiol on KNDy neuron peptides, colocalization with D2 dopamine receptors, and dopaminergic inputs, in the ewe[J].Endocrinology, 2017, 158(4): 831-841.
[36] MERKLEY C M, COOLEN L M, GOODMAN R L, et al. Evidence for changes in numbers of synaptic inputs onto KNDy and GnRH neurones during the preovulatory LH surge in the ewe[J].JNeuroendocrinol, 2015, 27(7): 624-635.
[37] MERKLEY C M, PORTER K L, COOLEN L M, et al. KNDy (kisspeptin/neurokinin B/dynorphin) neurons are activated during both pulsatile and surge secretion of LH in the ewe[J].Endocrinology, 2012, 153(11): 5406-5414.
[38] LEHMAN M N, LADHA Z, COOLEN L M, et al. Neuronal plasticity and seasonal reproduction in sheep[J].EurJNeurosci, 2010, 32(12): 2152-2164.
[39] KLOSEN P, SÉBERT M E, RASRI K, et al. TSH restores a summer phenotype in photoinhibited mammals via the RF-amides RFRP3 and kisspeptin[J].FASEBJ, 2013, 27(7): 2677-2686.
[40] SHINOMIYA A, SHIMMURA T, NISHIWAKI-OHKAWA T, et al. Regulation of seasonal reproduction by hypothalamic activation of thyroid hormone[J].FrontEndocrinol(Lausanne), 2014, 5: 12.
[41] REVEL F G, MASSON-PÉVET M, PÉVET P, et al. Melatonin controls seasonal breeding by a network of hypothalamic targets[J].Neuroendocrinology, 2009, 90(1): 1-14.
[42] STEVENSON T J, BALL G F. Information theory and the neuropeptidergic regulation of seasonal reproduction in mammals and birds[J].ProcRoySciB, 2011, 278(1717): 2477-2485.
[43] NG L, LIU H, ST GERMAIN D L, et al. Deletion of the thyroid hormone-activating type 2 deiodinase rescues cone photoreceptor degeneration but not deafness in mice lacking type 3 deiodinase[J].Endocrinology, 2017, 158(6): 1999-2010.
[44] MAYWOOD E S, BITTMAN E L, HASTINGS M H. Lesions of the melatonin- and androgen-responsive tissue of the dorsomedial nucleus of the hypothalamus block the gonadal response of male Syrian hamsters to programmed infusions of melatonin[J].BiolReprod, 1996, 54(2): 470-477.
[45] SONG C K, BARTNESS T J. The effects of anterior hypothalamic lesions on short-day responses in Siberian hamsters given timed melatonin infusions[J].JBiolRhythms, 1996, 11(1): 14-26.
[47] YASUO S, YOSHIMURA T, EBIHARA S, et al. Photoperiodic control ofTSH-βexpression in the mammalian pars tuberalis has different impacts on the induction and suppression of the hypothalamo-hypopysial gonadal axis[J].JNeuroendocrinol, 2010, 22(1): 43-50.
[48] KAMPF-LASSIN A, PRENDERGAST B J. Acute downregulation of type II and type III iodothyronine deiodinases by photoperiod in peripubertal male and female Siberian hamsters[J].GenCompEndocrinol, 2013, 193: 72-78.
[49] SIMONNEAUX V, ANCEL C, POIREL V J, et al. Kisspeptins and RFRP-3 act in concert to synchronize rodent reproduction with seasons[J].FrontNeurosci, 2013, 7: 22.
[50] ANSEL L, BOLBOREA M, BENTSEN A H, et al. Differential regulation ofKiss1 expression by melatonin and gonadal hormones in male and female Syrian hamsters[J].JBiolRhythms, 2010, 25(2): 81-91.
[51] GREIVES T J, LONG K L, BURNS C M B, et al. Response to exogenous kisspeptin varies according to sex and reproductive condition in Siberian hamsters (Phodopussungorus)[J].GenCompEndocrinol, 2011, 170(1): 172-179.
[52] GREIVES T J, KRIEGSFELD L, DEMAS G E. Exogenous kisspeptin does not alter photoperiod-induced gonadal regression in Siberian hamsters (Phodopussungorus)[J].GenCompEndocrinol, 2008, 156(3): 552-558.
[53] UBUKA T, INOUE K, FUKUDA Y, et al. Identification, expression, and physiological functions of Siberian hamster gonadotropin-inhibitory hormone[J].Endocrinology, 2012, 153(1): 373-385.
[54] PERAGINE D E, POKAROWSKI M, MENDOZA V L, et al. RFamide-related peptide-3 (RFRP-3) suppresses sexual maturation in a eusocial mammal[J].ProcNatlAcadSciUSA, 2017, 114(5): 1207-1212.
[55] ANCEL C, BENTSEN A H, SÉBERT M E, et al. Stimulatory effect of RFRP-3 on the gonadotrophic axis in the male Syrian hamster: the exception proves the rule[J].Endocrinology, 2012, 153(3): 1352-1363.
[56] BAILEY A M, LEGAN S J, DEMAS G E. Exogenous kisspeptin enhances seasonal reproductive function in male Siberian hamsters[J].FunctEcol, 2017, 31(6): 1220-1230. doi: 10.1111/1365-2435.12846.
