旋毛虫plancitoxin-1-like基因的序列分析与编码蛋白结构预测
2018-01-26廖成水王晓利田文静杨亚东张梦珂王安琪张春杰刘明远BoireauPascal程相朝
廖成水,王晓利,田文静,杨亚东,张梦珂,王安琪,张春杰,刘明远,Boireau Pascal,5,程相朝,3*
(1. 河南科技大学,动物科技学院/洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471023;2. 河南科技大学 医学院,洛阳 471023;3. 洛阳职业技术学院,洛阳 471003;4. 吉林大学 人兽共患病研究所/人兽共患病研究教育部重点实验室,长春 130062;5. 法国国家食品、环境及劳动卫生署动物卫生实验室, 迈松阿尔福 94706)
脱氧核糖核酸酶(deoxyribonuclease, DNase)具有DNase I(EC 3.1.21.1)和DNase II(EC 3.1.22.1)两大类[1]。1988年首次报道人类DNase II基因后[2],DNase II在脊椎动物、无脊椎动物和单细胞原虫中被陆续报道[3]。旋毛虫是一种寄生于骨骼肌细胞的重要人兽共患胞内寄生虫,主要分布于中国、阿根廷和部分东欧国家等[4]。旋毛虫基因组显示旋毛虫具有多达125个DNase II蛋白家族基因[5]。在这之前含有最多DNase II的物种是秀丽杆线虫(仅10种)[6],旋毛虫如此庞大的蛋白家族在其他物种中实属罕见,而关于旋毛虫DNase II的研究仍未见有明显进展。经典DNase II的氨基酸序列在N端和C端都具有高度保守区域,即HKD基序[7]。在线软件分析显示旋毛虫125个基因中仅仅plancitoxin-1(1 095 bp, GenBank accession No. XM_003370715.1)含有一个HKD基序,且位于C端。因此,本研究克隆得到旋毛虫plancitoxin-1基因,并分析其序列特征,以期为庞大的DNase II蛋白家族在旋毛虫发育和感染中的作用研究提供科学资料。
1 材料与方法
1.1 主要材料
Wistar大鼠(200.0 g±20.0 g)购自吉林大学白求恩医学院动物实验中心;中国河南猪旋毛虫分离株Trichinellaspiralis(genotype T1),国际标准虫种编号为ISS534,由本实验室小鼠传代保种;pMD18-T购自宝生物工程(大连)有限公司;大肠杆菌DH5α购自德国Novagen公司,由本实验室常规冻存;胰蛋白胨和酵母浸出物购自英国OXOID公司;胃蛋白酶购自中国医药集团总公司;RPMI-1640培养液购自Hyclone公司;青霉素、硫酸链霉素均购自美国Sigma-Aldrich公司;TaqDNA聚合酶、dNTPs、DNA Marker、BamHⅠ、HindⅢ和RNA PCR Kit (AMV) Ver.3.0均购自宝生物工程(大连)有限公司;其他化学试剂均为国产分析纯。
1.2 Plancitoxin-1基因的克隆
根据GenBank上的旋毛虫plancitoxin-1基因序列(GenBank No.: XM_003370715.1)设计引物(上游引物:5′-GGATCCATGGACGCACGTCGGCCGGTAT-3′,BamHⅠ;下游引物:5′-AAGCTT TCAATATGGTGGAATAGGACAAAGT-3′,HindⅢ)。常规方法收集旋毛虫肌幼虫、新生幼虫和成虫虫体,根据Trizol试剂盒的方法得到三个时期总RNA。根据RNA PCR Kit (AMV) Ver.3.0试剂盒的方法得到cDNA。以旋毛虫cDNA为模板,常规PCR扩增获得plancitoxin-1基因。
1.3 同源性分析
利用CLASTALX 2.1进行二十余种物种DNase II蛋白多重序列分析。采用PHYLIP 3.695-NEIGHBOR重复1 000次的bootstrap法进行氨基酸序列的遗传进化树分析。
1.4 理化性质分析
在线网站ProtParam(http://web.expasy.org/protparam/)分析蛋白质相对分子质量大小、理论等电点和氨基酸组成。在线网站http://people.mbi.ucla.edu/sumchan/caltor.html和http://biotech.ou.edu/分别用于分析氨基酸的稀有密码子和重组蛋白质的可溶性。在线网站ProtScale(http://web.expasy.org/protscale/)分析蛋白质的亲水性与疏水性。
1.5 结构分析
在线网站http://www.cbs.dtu.dk/services/的NetNGlyc、NetOGlyc和NetPhos分别分析N-糖基化位点、O-糖基化位点和磷酸化位点。在线网站http://www.embl-heidelberg.de/ predictprotein/predictprotein.html分析二硫键数量。http://tools.immuneepitope.org/bcell/和NetCTL (http://www.cbs.dtu.dk/services/)预测蛋白可能存在的线性B细胞抗原表位和T细胞结合位点。在线软件https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/ npsa_server.html预测二级结构。SWISS-MODEL Workspace分析三级结构。
2 结 果
2.1 Plancitoxin-1-like基因的克隆
从旋毛虫中扩增得到一条885 bp的序列(图1),与plancitoxin-1(Tsp_09974, GenBank No. XM_003370715.1)相比,核苷酸序列少210 bp,缺少部分位于184—393位,将其命名为plancitoxin-1-like。从肌幼虫、成虫和新生幼虫扩增得到的plancitoxin-1-like序列均一致,而从基因组扩增的序列与NCBI公布的1 471 bp一致。Plancitoxin-1-like编码294个氨基酸,比plancitoxin-1少70个氨基酸,缺少部分位于62—131位。保守区域预测显示plancitoxin-1只有一个HKD基序,且位于C端,但plancitoxin-1-like在N端和C端均具有HKD基序。
2.2 同源性分析

M. DNA相对分子质量标准 (DL2000);1. 水对照;2. 肌幼虫;3. 新生幼虫;4. 成虫;5. 基因组M. DNA marker ladder (DL2000); 1. ddH2O control; 2. ML; 3. NBL; 4. Ad; 5. T. spiralis genome图1 旋毛虫plancitoxin-1-like基因的PCR扩增Fig.1 Amplification of T. spiralis plancitoxin-1-like gene by PCR
Plancitoxin-1-like的核苷酸序列与其他物种的DNase II的相似性较低,最高的是广杆属线虫CBR-CRN-6基因(10.07%),与人类、牛、马、猪、小鼠、大鼠、鸡、斑马鱼、非洲蟾蜍、果蝇、海星、河豚、类鼻疽杆菌、盘基网柄菌、鸡痘病毒、金丝雀痘病毒、冈比亚按蚊、广杆属线虫和秀丽杆线虫等DNase II成员的相似性集中在34%~38%,与海星plancitoxin-1具有40.18%的相似性,遗传进化关系上被分在一个进化支(图2),但保守区域基本相同。Plancitoxin-1-like与低等生物具有较近的亲缘关系,且更靠近于DNase IIβ。
2.3 Plancitoxin-1-like的理化性质分析
Plancitoxin-1-like的理论相对分子质量为33.19 ku,理论等电点为9.17。分子式为C1507H2333N399O425S1。不稳定系数为39.25,属于稳定存在蛋白质。氨基酸由20种氨基酸组成,不含Sec和Pyl,其中频次较高的氨基酸残基有Leu、Ser和Lys;频次较低的氨基酸残基有Met、Cys和His。正电荷残基数(R+K)为33个,负电荷残基数(D+E)为24个。含有26个稀有密码子,其中有两处连续出现稀有密码子,在大肠杆菌中呈可溶性表达的可能性为8.8%。在287位亲水性分值最高(1.967),有最强的疏水性;在175位分值最低(-2.811),有最强的亲水性。
2.4 序列结构分析
在N19GS、N49NT、N209CS和N262RS共有4个N-糖基化位点。在L22、L26和A108共有3个O-糖基化位点。存在31个磷酸化位点,分别为14个Ser、9个Thr和8个Tyr,潜力值均大于0.5。有17个B细胞线性结合位点和9个T细胞结合位点。蛋白质二级结构主要由42个α-螺旋(14.29%)、83个延伸链(28.23%)和162个无规卷曲(55.10%)构成。存在3个二硫键,分别位于59和101位、210和269位、250和289位(图3)。Plancitoxin-1-like三维结构同源模型见图4,三级结构预测发现,蛋白质序列与PDB数据库中5i3e.1.A模板序列相似性为31.79%。
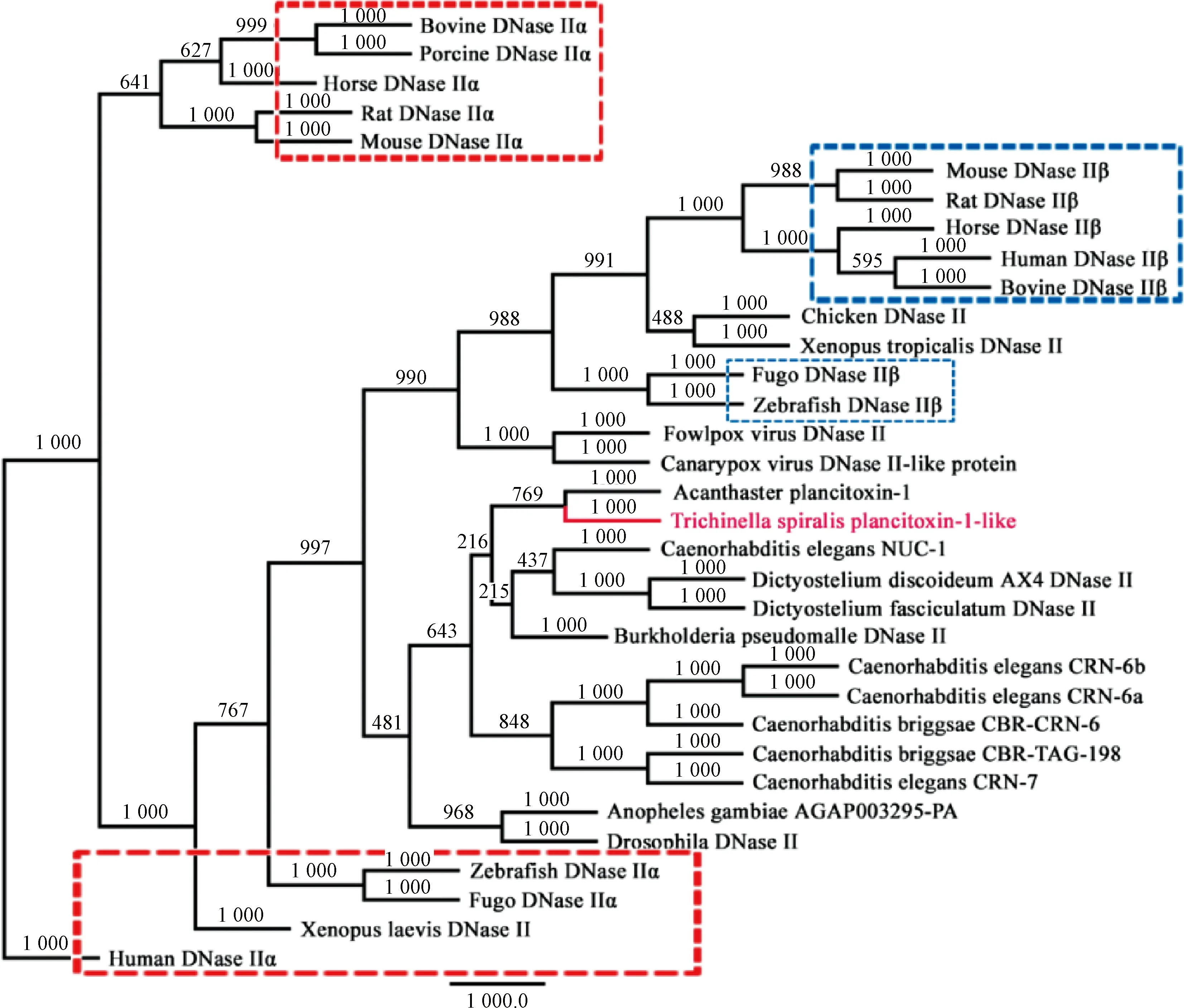
图2 Plancitoxin-1-like与其他物种DNase II家族蛋白的遗传进化树分析Fig.2 Phylogenetic analysis of plancitoxin-1-like and other previously reported DNase II family proteins
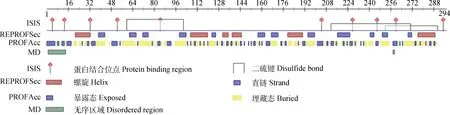
图3 Plancitoxin-1-like蛋白二级结构分析Fig.3 Predicted secondary structure of plancitoxin-1-like protein
3 讨 论

图4 Plancitoxin-1-like三维结构同源模型Fig.4 Three-dimensinal model of plancitoxin-1-like
1999年,C. H. Mak等首次发现旋毛虫排泄分泌产物具有降解DNA的活性[8]。来源于排泄分泌产物的43 ku蛋白质与哺乳动物DNase II序列具有一定的同源性[9],但由于缺乏DNase II保守的活性位点,该43 ku蛋白质是否具有DNase II活性仍然存在争议。2011年公布的旋毛虫基因组显示,旋毛虫可能存在一个高达125种DNase II蛋白家族。人类、牛、马、猪、小鼠、大鼠、鸡、斑马鱼、非洲蟾蜍、果蝇、海星、河豚、类鼻疽杆菌、盘基网柄菌、鸡痘病毒、金丝雀痘病毒、冈比亚按蚊、广杆属线虫和秀丽隐杆线虫等物种只有一种或几种DNase II[10],而秀丽隐杆线虫具有最多DNase II。但旋毛虫拥有如此多的DNase II家族成员有何作用仍不清楚。43 ku蛋白具有一个螺旋环螺旋基序分子结构,具有调节肌细胞分化的功能[11],因此与旋毛虫包囊形成有关[12]。125种旋毛虫DNase II蛋白50%以上的基因编码排泄分泌产物,DNase II蛋白被认为是控制和预防旋毛虫病的理想疫苗候选蛋白质。
DNase II在N端和C端包含有两个保守的HKD基序(H-x-K-x(4)-D)[7]。旋毛虫p43、SS1和AAK85403三个蛋白与人类DNase II具有一定的相似性,但缺乏DNase II经典的HKD基序[13]。但除了plancitoxin-1具有一个DNase II保守活性位点,其他124种DNase II蛋白都不具有DNase II保守活性位点。在本研究中,plancitoxin-1-like具有两个HKD基序,分别位于序列的N端和C端。由于小鼠、大鼠、河豚和斑马鱼DNase IIβ的C端保守区域为DHSK,因此,根据DNase IIα和DNase IIβ在C端的HKD保守基序分别为DHSK和DHAK的说法很难把plancitoxin-1-like归为DNase IIα还是DNase IIβ。但遗传进化树分析显示,plancitoxin-1-like的亲缘关系更靠近于DNase IIβ(图2)。
4 结 论
以旋毛虫总RNA为模板进行RT-PCR,获得旋毛虫plancitoxin-1-like基因,得到的核苷酸序列为885 bp,编码294个氨基酸,由20种氨基酸组成。其氨基酸序列在N端和C端都具有HKD基序。蛋白质理论相对分子质量为33.19 ku,等电点为9.17,是稳定存在的亲水性蛋白。plancitoxin-1-like的氨基酸序列与其他物种DNase II的相似性为35%左右。
[1] CUNNINGHAM L, LASKOWSKI M. Presence of two different desoxyribonucleode- polymerases in veal kidney[J].BiochimBiophysActa, 1953, 11(4): 590-591.
[2] YASUDA T, TAKESHITA H, IIDA R, et al. Molecular cloning of the cDNA encoding human deoxyribonuclease II[J].JBiolChem, 1998, 273(5): 2610-2616.
[3] HOU N, PIAO X, CAI P, et al. A novel Schistosoma japonicum endonuclease homologous to DNase II[J].BMCGenomics, 2015, 16: 126.
[4] SHIMONI Z, FROOM P. Uncertainties in diagnosis, treatment and prevention of trichinellosis[J].ExpertRevAntiInfectTher, 2015, 13(10): 1279-1288.
[5] MITREVA M, JASMER D P, ZARLENGA D S, et al. The draft genome of the parasitic nematodeTrichinellaspiralis[J].NatGenet, 2011, 43(3): 228-235.
[6] YU H, LAI H J, LIN T W, et al. Autonomous and non-autonomous roles of DNase II during cell death inC.elegansembryos[J].BiosciRep,2015,35(3).pii:e00203.
[8] MAK C H, KO R C. Characterization of endonuclease activity from excretory/secretory products of a parasitic nematode,Trichinellaspiralis[J].EurJBiochem, 1999, 260(2): 477-481.
[10] VARELA-RAMIREZ A, ABENDROTH J, MEJIA A A, et al. Structure of acid deoxyribonuclease[J].NucleicAcidsRes, 2017, 45(10): 6217-6227.
[11] JASMER D P, KWAK D. Fusion and differentiation of murine C2C12 skeletal muscle cells that expressTrichinellaspiralisp43 protein[J].ExpParasitol, 2006, 112(2): 67-75.
[12] VASSILATIS D K, DESPOMMIER D, MISEK D E, et al. Analysis of a 43-kDa glycoprotein from the intracellular parasitic nematodeTrichinellaspiralis[J].JBiolChem, 1992, 267(26): 18459-18465.
[13] MACLEA K S, KRIESER R J, EASTMAN A. A family history of deoxyribonuclease II: surprises fromTrichinellaspiralisandBurkholderiapseudomallei[J].Gene, 2003, 305(1): 1-12.
