抗病毒蛋白Viperin抑制猪瘟病毒在PK-15细胞上的复制
2018-01-26李文良邓加武李基棕杨蕾蕾张纹纹江杰元
李文良,毛 立,邓加武,郝 飞,李基棕,杨蕾蕾,张纹纹,江杰元
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,南京 210014)
Ⅰ型干扰素与特异受体结合后诱导产生的干扰素刺激基因(interferon stimulate genes, ISGs)是先天免疫系统的重要组成成分和效应分子,在机体抵抗感染过程中发挥重要作用。Viperin(virus inhibitory protein,endoplasmic reticulum-associated,interferon-inducible)是一种ISG编码的抗病毒蛋白,最早于2001年由K. C. Chin等鉴定并报道[1]。Viperin在正常细胞中的基础表达水平很低,但可以被Ⅰ型干扰素、脂多糖(LPS)、poly(I:C)以及多种病毒诱导产生,且Viperin的表达可以通过干扰素依赖和非依赖的两种途径实现[2-3]。研究证明它对不同病毒科的多种病毒具有抗病毒活性,如单纯疱疹病毒[4]、H1N1流感病毒[5]、乙型肝炎病毒[6]、狂犬病病毒[7]、人副流感病毒3型[8]等,近年有报道证明马源Viperin对马传贫病毒[9]、猴源和猪源Viperin对猪繁殖与呼吸综合征病毒(PRRSV)[10-11]具有抑制作用。
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的高度接触性传染病,CSFV属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),基因组为单股正链RNA,长约12.3 kb。该病是危害养猪业发展的重要病毒性疾病,是OIE规定的必须报告的疫病,我国目前依靠高强度的疫苗免疫等综合防控策略控制该病[12]。深入研究CSFV与宿主细胞的相互作用具有重要意义。已有研究发现猪Mx1蛋白、鸟苷酸结合蛋白1(GBP1)能够显著降低CSFV在细胞和猪体内的增殖水平[13-14]。
为了探讨猪源Viperin对CSFV复制的作用,本研究在稳定表达Viperin的PK-15细胞系上研究Viperin对CSFV复制的抑制作用,并研究其发挥作用的机制,丰富了Viperin抗病毒谱,为猪瘟与Viperin相互作用研究奠定了基础。
1 材料与方法
1.1 试剂与材料
RNA提取试剂TransZol UP、一步法荧光定量RT-PCR检测试剂盒、Taq酶、预染蛋白质Marker、HRP标记羊抗小鼠/兔IgG(H+L)、DH5α感受态细胞购自北京全式金生物技术有限公司;质粒提取试剂盒和琼脂糖凝胶回收试剂盒购自Axygen公司;转染试剂Lipofectamine 2000购自Invitrogen公司;ECL化学发光显色试剂盒购自南京诺维赞生物科技有限公司;WH303抗体购自AHVLA;FITC/Cy3标记的羊抗小鼠IgG购自武汉博士德生物技术公司;flag/HA标签单抗、兔抗flag/HA标签多抗、Alexa Fluor 555标记的驴抗小鼠IgG、Alexa Fluor 488标记的羊抗兔IgG、DAPI、Western及IP细胞裂解液、Protein G Agarose、免疫染色固定液及封闭液购自碧云天生物技术研究所。
猪瘟病毒石门株购自中国兽医药品监察所。
PK-15、293T细胞由本实验室保存。稳定表达Viperin的细胞系PK-Vi及对照细胞系PK-C1由本实验室构建[15]。
1.2 过表达Viperin对CSFV复制的影响
将PK-Vi及对照细胞系PK-C1铺于24孔细胞培养板,待细胞达到80%融合度时接种猪瘟石门株病毒(MOI=0.05),在12、24、48、72 h后分别收获全细胞培养物、培养上清和细胞裂解物。通过荧光定量RT-PCR和TCID50检测不同样品中的病毒含量。
1.3 干扰Viperin表达对CSFV复制的影响
设计并合成针对Viperin的siRNA(siVi,5′-GGAAGAAGAUAUGACAGAATT-3′)及阴性对照siRNA(siNC,5′-UUCUCCGAACGUGUCACGUTT-3′)。使用Lipofectamine 2000,按照说明书将siVi和siNC(50 nmol·L-1)分别转染PK-Vi细胞。12 h后收获细胞通过荧光定量RT-PCR和Western blot 检测Viperin表达的变化。同时接种CSFV,于48 h后收获细胞样品检测病毒含量变化。
1.4 荧光定量RT-PCR
使用Transzol UP试剂按照说明书提取样品中总RNA。采用相对定量RT-PCR检测样品中Viperin或CSFV基因表达水平,按照TransScript Green one-step qRT-PCR supermix说明书操作:总反应体系为20 μL,包含10 μL 2×Supermix、20 pmol·L-1的引物(表1,CSFV:qE2F和qE2R;Viperin:qViF和qViR;β-actin:actin qF和actin qR)、0.5 μL E-Mix、0.4 μL passive reference Dye、4 μL RNA。在ABI Step One荧光定量PCR仪上进行扩增反应:45 ℃反转录5 min;94 ℃变性30 s,然后按94 ℃5 s、60 ℃30 s进行40个循环。以β-actin为内参计算各处理组目的基因相对于阴性对照组的转录量变化并以-ΔΔCt表示。
表1PCR及荧光定量RT-PCR引物
Table1PrimersusedinPCRandqRT-PCR

引物名Primername序列SequenceVF25'-ATAAAGCTTCGCCACCATGTGGACACTGGTAC-3'VR25'-ATTCTCGAGTCAAGCGTAATCTGGAACATCGTATGGGTACCAGTCCAGCTTCA-3'qE2F5'-GCTCCCTGGGTGGTCTAAGTC-3'qE2R5'-GGCTTCTGCTCACGTCGAA-3'qViF5'-AAGCAGAGCAGTTTGTTATCAGC-3'qViR5'-TTCCGCCCGTTTCTACAGT-3'actinqF5'-TCTGGCACCACACCTTCT-3'actinqR5'-TGATCTGGGTCATCTTCTCAC-3'
1.5 病毒滴度测定
将PK-15细胞接种96孔板,待长成单层后,用维持液将病毒样品做10倍倍比稀释后,接种细胞单层,每孔100 μL,做4个重复,37 ℃培养3 d。弃去细胞培养基,加入免疫染色固定液固定细胞15 min,然后加入封闭液孵育1 h。加入1∶200稀释的WH303抗体,37 ℃孵育1 h,洗涤后加入1∶200稀释的FITC标记的羊抗小鼠IgG,37 ℃孵育30 min。洗涤后置荧光显微镜下观察每个稀释度出现荧光信号的阳性孔数。按Reed-Muench方法计算病毒TCID50。
1.6 激光共聚焦检测
试验1:将PK-Vi细胞接种于24孔板中的盖玻片培养24 h,待细胞达到80%融合度时接种CSFV,48 h后弃去细胞培养基,加入免疫染色固定液固定细胞15 min,然后加入封闭液孵育1 h。加入1∶200稀释WH303(针对E2蛋白)抗体,37 ℃孵育1 h,洗涤后加入1∶200稀释的Cy3标记的羊抗小鼠IgG,最后加入DAPI染色5 min,置于激光共聚焦显微镜(PE, Ultra View VOX)下观察,检测Viperin与感染病毒E2蛋白的定位情况。
试验2:合成CSFV的E2基因序列并在3′端引入flag标签,克隆入的真核表达质粒pCMV 中获得重组质粒pCMV-E2。通过PCR扩增(引物VF2、VR2,表1)在Viperin基因3′端引入HA标签,并克隆入pcDNA3.1中获得重组质粒pcDNA-Vi。质粒经酶切、测序验证,提取质粒并测定浓度。将293T细胞接种于24孔板中的盖玻片培养24 h,待细胞长满单层后进行质粒转染,24 h后弃去细胞培养基,加入免疫染色固定液固定细胞15 min,然后加入封闭液孵育1 h。加入1∶1 000稀释的flag抗体37 ℃孵育1 h,洗涤后加入1∶500稀释的Alexa Fluor 555标记的驴抗小鼠IgG,37 ℃孵育30 min;之后加入1∶1 000稀释的HA抗体37 ℃孵育1 h,洗涤后加入1∶500稀释的Alexa Fluor 488标记的羊抗兔IgG,37 ℃孵育30 min。最后加入DAPI染色5 min,置于激光共聚焦显微镜(PE, Ultra View VOX)下观察,检测Viperin与E2蛋白的定位情况。
1.7 免疫共沉淀
将293T细胞接种于6孔细胞培养板中,待细胞长满单层后进行pCMV-E2和pcDNA-Vi质粒转染。48 h后弃去细胞培养基,用预冷的PBS洗涤细胞2次,加入细胞裂解液裂解细胞,细胞样品经10 000 r·min-1离心10 min后加入1 μg HA抗体4 ℃孵育过夜,之后加入30 μL Protein G Agarose,4 ℃缓慢摇动孵育3 h。离心弃去上清,使用细胞裂解液洗涤3次,加入PBS重悬沉淀并加入加样缓冲液煮沸10 min后进行SDS-PAGE,转印后分别使用flag和HA抗体进行Western blot检测。
1.8 统计分析
荧光定量RT-PCR及病毒滴度测定试验均进行三次重复,各组数据经SPSS v.16软件分析其差异性(*.P<0.05;**.P<0.01)。
2 结 果
2.1 Viperin过表达对猪瘟病毒复制的影响
在PK-Vi和PK-C1细胞上分别接种CSFV后,收获全细胞裂解物通过荧光定量RT-PCR检测病毒含量。如图1所示,与PK-C1组相比,除12 h外,PK-Vi组的病毒基因组相对含量在24、48、72 h时均显著(P<0.05或P<0.01)下降,分别降低68.75%、83.61%和77.27%(图1A)。病毒滴度检测也显示相似的结果,在24、48、72 h时分别降低68.75%、87.5%和80.39%(图1B)。

*.P<0.05;**.P<0.01图1 过表达Viperin抑制CSFV的复制Fig.1 Over-expression of Viperin inhibits CSFV replication in PK-Vi cell line
2.2 RNA干扰Viperin表达对病毒复制的影响
为进一步证实Viperin作用的特异性,通过RNAi技术将siRNA转染PK-Vi及PK-C1细胞,进而检测CSFV含量的差异。如图2所示,特异的siVi转染后Viperin mRNA和蛋白质表达水平均显著(P<0.05)下降,而siNC转染细胞Viperin表达水平与未转染细胞一致;siVi与siNC转染的PK-C1细胞中Viperin含量均无显著变化(图2A、B)。接种病毒48 h后检测发现siVi转染的PK-Vi中病毒基因组含量和病毒滴度均显著(P<0.05)升高,虽然仍低于对照细胞。而转染前后的PK-C1细胞中病毒含量均无显著差异(图2C、D)。
2.3 Viperin表达对CSFV释放的影响
如图3所示,通过检测CSFV感染后24、48、72 h细胞培养上清和细胞沉淀中的病毒含量,发现其均同等程度地受到抑制,降低的比例之间没有显著差异,说明Viperin的过表达对病毒的释放没有影响。
2.4 Viperin与E2蛋白相互作用
将CSFV感染的PK-Vi细胞固定后加入针对E2蛋白的单抗WH303及荧光二抗孵育后进行共聚焦检测,发现二者存在共定位(图4A,黑白图中未能显示颜色)。进而通过构建E2与Viperin的真核表达质粒共转染293T细胞,固定后进行共聚焦检测,E2蛋白的红色荧光能够与Viperin的绿色荧光重合显示橙黄色,说明两种蛋白存在共定位(图4B,黑白图中未能显示本来颜色)。免疫共沉淀试验显示E2蛋白能够与Viperin相互作用(图5)。

A.qRT-PCR检测Viperin mRNA水平的变化;B. Western blot检测Viperin蛋白水平的变化;C. 病毒基因含量的检测;D. 病毒滴度(TCID50)的检测;*. P<0.05A.Viperin mRNA expression levels detected by real-time qRT-PCR; B. Viperin protein expression levels; C. CSFV genome copy numbers detected by qRT-PCR; D. Viral load (TCID50) detected by virus titration; *. P<0.05图2 抑制Viperin表达对CSFV复制的影响Fig.2 Knockdown ofViperin in PK-Vi cells impaired its antiviral activity

*.P<0.05;**.P<0.01图3 Viperin表达对CSFV释放的影响Fig.3 The effect of Viperin over-expression on the release of CSFV in PK-15 cells
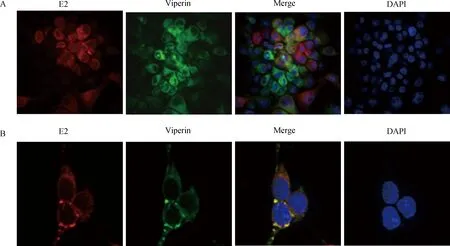
A.Viperin在CSFV感染PK-15细胞中与E2蛋白共定位(100×);B. Viperin在转染的293T细胞中与E2蛋白共定位(400×)A.Viperin co-localized with E2 in CSFV infected PK-15 cells (100×); B. Viperin co-localized with E2 protein in transfected 293T cells (400×)图4 共聚焦检测Viperin蛋白与CSFV E2蛋白的共定位情况Fig.4 Confocal microscopy examination of Viperin with CSFV E2 protein

图5 免疫共沉淀试验检测Viperin蛋白与E2蛋白之间的相互作用Fig.5 The interaction between Viperin and E2 protein in transfected 293T cells by co-IP assay
3 讨 论
CSFV感染能够引起免疫抑制和细胞凋亡,并且形成了独特的干扰宿主免疫反应的机制。研究证实其Npro蛋白能够与IRF3相互作用,诱导IRF3经蛋白酶体途径降解,从而发挥抑制靶细胞IFN-α和IFN-β产生的作用[16]。另有报道糖蛋白Erns对IFN-β启动子具有抑制作用,同时对NDV诱导的IFN-β产生具有抑制作用[17]。深入研究CSFV与宿主先天免疫反应的相互作用对于CSFV致病机制及防控技术研究具有重要意义。已有报道证明人源MxA、猪源Mx1蛋白能够显著降低CSFV在细胞和猪体内的增殖水平[13-14,18]。Viperin作为一种抗病毒蛋白,对多种病毒具有抑制作用,尤其是黄病毒科黄病毒属的成员,如日本脑炎病毒[19]、西尼罗病毒(WNV)[20]、登革病毒(DENV)[20-21]、蜱传脑炎病毒[22]以及寨卡病毒[23]。
本研究利用前期试验构建的稳定表达Viperin的PK-15细胞系,研究Viperin对CSFV复制的抑制作用。通过检测接种病毒后不同时间病毒基因水平与滴度的差异证实Viperin的抗CSFV作用,在感染48 h抑制作用最强。在该细胞系上进一步转染特异的siRNA干扰Viperin的表达,CSFV的复制水平得到显著恢复,虽然与对照组相比仍有一定差异。这可能是由于siRNA的转染效率偏低导致Viperin的表达没有被完全抑制所致(从图2A、B中可以看出)。但是,这仍能够证明Viperin可以特异性抑制CSFV复制的结论。
与其他ISG不同的是,Viperin抗病毒没有统一的机制,对于不同病毒其发挥作用的机制不尽相同。Viperin包含N端双亲α螺旋结构区、SAM区和C端三个功能区,N端结构域是Viperin细胞定位的关键,对流感病毒[24]的抑制发挥关键作用;SAM区具有radical SAM酶活性[25],在蜱传脑炎病毒[16]起作用;C端是Viperin最为保守的区域,在对DENV 2型[21]、HCV[26]作用中发挥关键作用。Viperin对HCMV可能是通过影响病毒复制晚期的成熟和组装发挥作用[1]。Viperin对流感病毒的抑制是通过影响脂筏结构,抑制病毒的出芽释放发挥作用的[24]。Viperin对呼吸道合胞病毒的抑制作用是发生在病毒复制的后期[27]。本研究在证明Viperin在基因组水平及病毒滴度水平抑制CSFV复制后,参考流感病毒的研究方法,通过检测细胞培养上清和细胞内病毒含量,发现其均同等程度地受到抑制,从而证明Viperin不影响病毒的组装释放。此外,通过激光共聚焦和免疫共沉淀检测发现Viperin与病毒E2蛋白存在共定位,两种蛋白质间存在相互作用,E2蛋白是病毒重要的结构蛋白,是囊膜的组成成分,推测Viperin有可能通过与E2蛋白(但不排除还有其他病毒蛋白,如非结构蛋白中的NS3、NS5B、NS5A等)相互作用影响蛋白质的加工、转运或病毒的组装来发挥抑制病毒的作用。
4 结 论
本研究证实Viperin具有抗CSFV作用,该作用可能是通过与病毒E2蛋白相互作用实现。本研究丰富了Viperin的抗病毒谱,为猪瘟与Viperin及其与宿主免疫反应相互作用的研究提供了理论基础。
[1] CHIN K C, CRESSWELL P. Viperin (cig5), an IFN-inducible antiviral protein directly induced by human cytomegalovirus[J].ProcNatlAcadSciUSA, 2001, 98(26): 15125-15130.
[2] MATTIJSSEN S, PRUIJN G J M. Viperin, a key player in the antiviral response[J].MicrobesInfect, 2012, 14(5): 419-426.
[3] SEO J Y, YANEVA R, CRESSWELL P, et al. Viperin: a multifunctional, interferon-inducible protein that regulates virus replication[J].CellHostMicrobe, 2011, 10(6): 534-539.
[4] SHEN G H, WANG K Z, WANG S, et al. Herpes simplex virus 1 counteracts viperin via its virion host shutoff protein UL41[J].JVirol, 2014, 88(20): 12163-12166.
[5] TAN K S, OLFAT F, PHOON M C, et al.Invivoandinvitrostudies on the antiviral activities of viperin against influenza H1N1 virus infection[J].JGenVirol, 2012, 93(Pt 6): 1269-1277.
[6] BAI X X, YANG H Y, WAN L X, et al. Involvement of viperin in prevention of intrauterine transmission of hepatitis B virus[J].APMIS, 2017, 125(2): 170-175.
[7] TANG H B, LU Z L, WEI X K, et al. Viperin inhibits rabies virus replication via reduced cholesterol and sphingomyelin and is regulated upstream by TLR4[J].SciRep, 2016, 6: 30529.
[8] RABBANI M A G, RIBAUDO M, GUO J T, et al. Identification of interferon-stimulated gene proteins that inhibit human parainfluenza virus type 3[J].JVirol, 2016, 90(24): 11145-11156.
[9] TANG Y D, NA L, ZHU C H, et al. Equine viperin restricts equine infectious anemia virus replication by inhibiting the production and/or release of viral Gag, Env, and receptor via distortion of the endoplasmic reticulum[J].JVirol, 2014, 88(21): 12296-12310.
[10] FANG J Y, WANG H Y, BAI J, et al. Monkey viperin restricts porcine reproductive and respiratory syndrome virus replication[J].PLoSOne, 2016, 11(5): e0156513.
[11] 方剑玉, 白 娟, 郭小参, 等. 猪源Viperin蛋白抑制猪繁殖与呼吸综合征病毒感染MARC-145细胞[J]. 病毒学报, 2017, 33(2): 216-223.
FANG J Y, BAI J, GUO X C, et al. Swine Viperin restricts replication of the porcine reproductive and respiratory syndrome virus[J].ChineseJournalofVirology, 2017, 33(2): 216-223. (in Chinese)
[12] LUO Y Z, LI S, SUN Y, et al. Classical swine fever in China: a minireview[J].VetMicrobiol, 2014, 172(1-2): 1-6.
[13] ZHANG X M, JING J, LI W L, et al. Porcine Mx1 fused to HIV Tat protein transduction domain (PTD) inhibits classical swine fever virus infectioninvitroandinvivo[J].BMCVetRes, 2015, 11: 264.
[14] LI L F, YU J H, LI Y F, et al. Guanylate-binding protein 1, an interferon-induced GTPase, exerts an antiviral activity against classical swine fever virus depending on its GTPase activity[J].JVirol, 2016, 90(9): 4412-4426.
[15] 李文良, 毛 立, 杨蕾蕾, 等. 稳定表达猪Viperin的PK-15细胞系的构建与鉴定[J]. 江苏农业学报, 2016, 32(1): 128-132.
LI W L, MAO L, YANG L L, et al. Construction and identification of PK-15 cell line stably expressing porcine Viperin[J].JiangsuJournalofAgriculturalScience, 2016, 32(1): 128-132. (in Chinese)
[16] BAUHOFER O, SUMMERFIELD A, SAKODA Y, et al. Classical swine fever virus Nprointeracts with interferon regulatory factor 3 and induces its proteasomal degradation[J].JVirol, 2007, 81(7): 3087-3096.
[17] XIAY H, CHEN L, PAN Z S, et al. A novel role of classical swine fever virus Ernsglycoprotein in counteracting the Newcastle disease virus (NDV)-mediated IFN-β induction[J].JBiochemMolBiol, 2007, 40(5): 611-616.
[18] ZHAO Y C, PANG D X, WANG T D, et al. Human MxA protein inhibits the replication of classical swine fever virus[J].VirusRes, 2011, 156(1-2): 151-155.
[19] CHAN Y L, CHANG T H, LIAO C L, et al. The cellular antiviral protein viperin is attenuated by proteasome-mediated protein degradation in Japanese encephalitis virus-infected cells[J].JVirol, 2008, 82(21): 10455-10464.
[20] JIANG D, WEIDNER J M, QING M, et al. Identification of five interferon-induced cellular proteins that inhibit west nile virus and dengue virus infections[J].JVirol, 2010, 84(16): 8332-8341.
[21] HELBIGK J, CARR J M, CALVERT J K, et al. Viperin is induced following dengue virus type-2 (DENV-2) infection and has anti-viral actions requiring the C-terminal end of Viperin[J].PLoSNeglTropDis, 2013, 7(4): e2178.
[22] UPADHYAY A S, VONDERSTEIN K, PICHLMAIR A, et al. Viperin is an iron-sulfur protein that inhibits genome synthesis of tick-borne encephalitis virus via radical SAM domain activity[J].CellMicrobiol, 2014, 16(6): 834-848.
[23] VAN DER HOEK K H, EYRE N S, SHUE B, et al. Viperin is an important host restriction factor in control of Zika virus infection[J].SciRep, 2017, 7: 4475.
[24] WANG X Y, HINSON E R, CRESSWELL P. The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts[J].CellHostMicrobe, 2007, 2(2): 96-105.
[25] FENWICK M K, LI Y, CRESSWELL P, et al. Structural studies of viperin, an antiviral radical SAM enzyme[J].ProcNatlAcadSciUSA, 2017, 114(26): 6806-6811.
[26] HELBIG K J, EYRE N S, YIP E, et al. The antiviral protein viperin inhibits hepatitis C virus replication via interaction with nonstructural protein 5A[J].Hepatology, 2011, 54(5): 1506-1517.
[27] JUMAT M R, HUONG T N, RAVI L I, et al. Viperin protein expression inhibits the late stage of respiratory syncytial virus morphogenesis[J].AntiviralRes, 2015, 114: 11-20.
