铁蛋白Ferritin原核表达和纯化及纳米颗粒胞外自组装
2018-01-26李志鹏刘福航崔奎青石德顺刘庆友
李志鹏,刘福航,崔奎青,石德顺,刘庆友
(广西大学,亚热带农业生物资源保护利用国家重点实验室,南宁 530004)
铁蛋白于1937 年由V.Laufberger[1]分离纯化于马的脾中,是生命活动所必需的蛋白之一。铁蛋白是一个古老而庞大的蛋白家族,广泛存在于动物、植物和微生物体内[2]。铁蛋白本身在生命活动中的功能已经得到广泛研究,如调节铁元素的代谢平衡、抗氧化胁迫以及消除某些重金属和有毒分子毒害等功能[3-6]。近年来,随着纳米技术的广泛应用和对铁蛋白结构的进一步认识, 铁蛋白纳米载体正成为肿瘤造影和药物呈递等生物医药领域的研究热点[7-8]。天然合成的铁蛋白主要由一个矿物质内核和一个蛋白外壳组成。蛋白外壳是一个由24个铁蛋白亚基组成的球形空心纳米笼状结构,其中每3个亚基组成一个三聚体亚单位,8个三聚体亚单位再组装成外径12 nm,内径8 nm的蛋白外壳[9]。1991年,英国巴斯大学F. C. Meldrum[10-11]实验室首次在马脾铁蛋白的空腔内合成了磁性铁核,这项工作开辟了纳米颗粒仿生合成的新领域。2006年M.Uchida[12]实验室利用原核表达系统重组表达人H-铁蛋白,并在获得的铁蛋白外壳内仿生合成了磁性铁蛋白。该方法简化了铁蛋白的仿生合成步骤,极大地推动了铁蛋白在生物医学领域的应用。铁蛋白天然结构的物理性质稳定,能够耐受高温和多种变性剂[13-14],但是对pH敏感。铁蛋白外壳在pH 2.0 的酸性条件下解体,但在pH 恢复到生理条件(pH 7.0)时,又能重新组装成天然结构的铁蛋白[15-16],利用这种特性人们可以对铁蛋白纳米结构的外表面、内表面或铁内核进行选择性的修饰。铁蛋白外壳不仅可以通过化学方法进行修改,而且还可以进行基因工程修饰。2006年,美国新世纪医药公司(New Century Pharmaceuticals)在铁蛋白L 亚基的N 端融合表达HIV 病毒的Tat 肽段,表达所得的蛋白具有铁蛋白纳米结构,并可以诱导产生高效的免疫应答[17]。2013年,NIH 过敏与传染病研究所的疫苗研究中心又通过将流感病毒血凝素HA与幽门螺杆菌铁蛋白亚基N端融合,用这种铁蛋白免疫雪貂成功产生中和抗体。同时还发现,这种铁蛋白疫苗显著的增加了疫苗的广谱性,且对动物内源铁蛋白不产生免疫反应[18]。此后,铁蛋白纳米结构在抗原呈递等医药相关研究中迅速升温。韩国纳米生物科学与化工学院利用铁蛋白作为基于树突状细胞疫苗的抗原呈递平台[19]。Y.C.Chiu等[20]研究发现,铁蛋白纳米载体在抗原呈递过程中可以通过改变抗原与免疫细胞的相互作用而增强免疫效果。
原核表达系统是目前研究最为成熟的表达系统,在外源蛋白表达领域得到了广泛的应用[21]。本研究参考M.Kanekiyo等[18]使用的HelicobacterPylorinonheme iron-containing Ferritin 蛋白序列,并按照大肠杆菌密码子偏好性进行密码子优化,通过原核表达系统表达并纯化得到重组Ferritin蛋白,为其作为纳米载体在药物与抗原呈递中的研究和应用奠定基础。
1 材料与方法
1.1 试剂与材料
本试验所用内切酶购自New England Biolabs (NEB),配制缓冲液的试剂除特殊说明均为国产分析纯。试验所用克隆感受态细胞Trans 5α和表达感受态细胞BL21(DE3)均购自北京全式金生物技术(TransGen Biotech)有限公司。试验所涉及到的引物合成及DNA测序均由上海生工生物工程有限公司完成。超螺旋DNA marker (Supercoiled DNA marker)购买自TaKaRa,DNA marker Ⅲ 购买自北京天根生化科技有限公司。
1.2 pET-32a-Ferritin原核表达载体构建
按大肠杆菌密码子偏好性优化过的HelicobacterPylorinonheme iron-containing Ferritin 蛋白序列(WP_000949190.1)于上海生工生物工程有限公司合成并克隆于pMD-18T载体上。Ferritin全长502 bp,按照fast-fusion克隆试剂盒(FFPC-C020,GeneCopoeia)说明书在目的基因两端设计同源臂,并在同源臂和目的基因之间添加酶切位点(表1,斜体下划线处)。将Ferritin基因定向插入至pET-32a(+)载体多克隆位点区XhoI 和BamH I酶切位点之间,得到pET-32a-Ferritin原核表达载体(图1)。提取菌液PCR阳性菌株的质粒(天根生化科技有限公司,北京),用XhoI 和BamH I内切酶进行双酶切鉴定,并送上海生工生物工程有限公司进行测序鉴定。
表1pET32a-Ferritin载体克隆引物
Table1PrimersofpET32a-Ferritinvectorforfast-fusion

名称Name序列(5'→3')Sequence退火温度/℃Tm扩增长度/bpProductlengthpET32a-FerritinFRTGGCTGATATCGGATCCATGCTGTCTAAAGACATCGTGGTGGTGGTGCTCGAGTTAAGATTTACGAGATT60502
图1 Ferritin原核表达载体构建Fig.1 Prokaryotic expression vector construction of Ferritin
1.3 Ferritin蛋白诱导表达
将鉴定后的阳性菌液按1∶50比例接种于10 mL LB 液体培养基中,37 ℃震荡培养4 h,然后加入IPTG至终浓度0.5 mmol·L-1(保留1管菌液不加诱导剂以作阴性对照),继续诱导培养5 h。分别取1 mL菌液,4 ℃ 12 000 r·min-1离心2 min收集菌体,加入75 μL RIPA裂解液和25 μL 4×上样缓冲液,混匀沸水煮10 min后,冰浴10 min。然后4 ℃ 12 000 r·min-1离心10 min,取上清,使用Bio-Rad Stain-Free试剂盒进行10% SDS-PAGE电泳。
1.4 Ferritin蛋白表达形式鉴定
收集100 mL阳性菌液,12 000 r·min-1离心5 min,用PBS洗涤2次后在沉淀中加入预冷的细菌裂解缓冲液(50 mmol·L-1Tris-HCl, 500 mmol·L-1NaCl, 0.1 mmol·L-1PMSF, 5 mmol·L-1EDTA, 1 mg·mL-1溶菌酶),重悬菌体,冰上消化30 min。之后于冰浴中超声波破碎菌体(400 W,2 s,2 s,30 min),至菌液不再黏稠时即可停止。取50 μL菌液作为混合液样品,另外取出1 mL菌液4 ℃ 12 000 r·min-1离心15 min。分别收取50 μL上清及沉淀制作可溶蛋白及包涵体样品。分别取混合液,上清及沉淀使用Bio-Rad Stain-Free 试剂盒进行10% SDS-PAGE电泳。电泳结束后使用ChemiDoc®MP-Bio-Rad 凝胶成像系统进行拍照分析。然后用半干转印法将蛋白转移至硝酸纤维素膜。然后将硝酸纤维素膜用5% 脱脂牛奶(TBS-T配制)封闭2 h,之后用TBS-T洗涤3次,并用TBS清洗1次。然后加入His标签一抗(1∶10 000,武汉三鹰)于4 ℃孵育过夜。次日再用TBS-T洗涤3次,TBS洗涤1次,然后用HRP标记的二抗于室温孵育1 h。最后再用TBS-T洗涤3次,并用TBS清洗1次,用增强型ECL(15049A2,Millipore)显色液进行显色拍照。
1.5 His-Ferritin融合蛋白的亲和层析
取pET-Ferritin阳性菌液300 mL,按照上述方法制作包涵体样品,加入预冷的包涵体洗涤缓冲液,进行超声洗涤(400 W,2 s,3 s,10 min)2次,之后4 ℃ 8 000 r·min-1离心10 min,收集包涵体,加入结合缓冲液冰上溶解。溶解后的包涵体经离心,过滤之后使用His-Trap HP层析柱及AKTA avant仪器进行亲和层析,咪唑线性浓度梯度进行洗脱(咪唑浓度从20 mmol·L-1线性上升至500 mmol·L-1),收集各段洗脱液进行SDS-PAGE电泳,分析融合蛋白His-Ferritin的纯度。
1.6 蛋白的复性和组装
由于将变性蛋白直接透析至不含尿素的缓冲液时,蛋白质很容易析出沉淀,而透析至含有2 mol·L-1脲的相同缓冲液中无沉淀产生[22]。因此将纯化后的His-Ferritin 蛋白使用Hiprep 26/10(GE healthcare)脱盐柱梯度置换至2 mol·L-1脲的复性缓冲液(2 mol·L-1尿素,50 mmol·L-1PBS,pH 8.0),并于4 ℃放置过夜。然后将蛋白置换至50 mmol·L-1PBS,pH 8.0 缓冲液,4 ℃存放。复性后的蛋白用superdex 75 分子筛检测蛋白复性效果。
1.7 His-Ferritin融合蛋白纳米结构电镜观察
取10 μL复性后的蛋白质滴加到干净塑料纸上制作微滴,将150 目铜网支持膜贴在液滴上吸附3~5 min,用滤纸吸去多余的样品,然后滴加蒸馏水清洗铜网表面并用滤纸吸去多余液体。最后将铜网放置在2%磷钨酸液滴中进行染色2 min,用滤纸吸去多余染色液后晾干铜网,使用日立HT7700 透射电子显微镜观察。
2 结 果
2.1 pET-32a-Ferritin原核表达载体构建
通过同源重组连接得到大小为6 402 bp的pET-32a-Ferritin重组表达载体,对重组原核表达质粒进行双酶切(BamH I+XhoI)鉴定,可见约502 bp的Ferritin片段及5 900 bp的载体片段(图2),大小均与理论值相同。
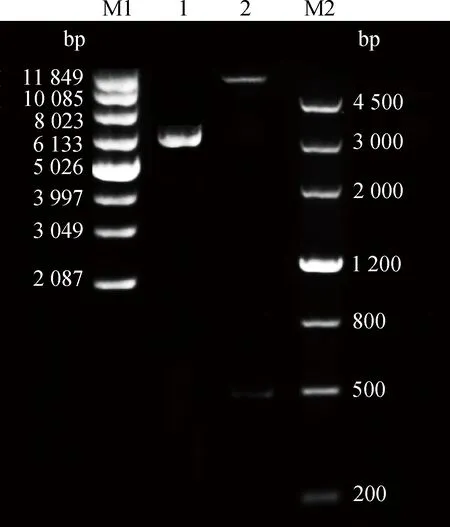
M1. 超螺旋 DNA相对分子质量标准; 1. pET-32a-Ferritin 质粒;2. pET-32a-Ferritin酶切后片段;M2. DNA相对分子质量标准M1. Supercoiled DNA marker; 1. pET-32a-Ferritin plasmid;2. pET-32a-Ferritin enzymatic digestion fragment;M2. DNA marker Ⅲ图2 重组质粒pET-32a-Ferritin的双酶切鉴定Fig.2 Identification of pET-32a-Ferritin by double enzyme digestion
2.2 His-Ferritin融合蛋白诱导表达及表达形式
重组原核表达质粒pET-32a-His-Ferritin 共编码332个氨基酸(包括His标签等表达元件在内),理论大小约为36.9 ku。10% SDS-PAGE电泳及Western-blot分析显示,IPTG诱导后有一个约为37 ku蛋白出现过表达(图3A)。使用His标签抗体进行Western-blot 试验,结果显示,约在37 ku处有一条特异性条带,表明诱导出的蛋白确为His-Ferritin融合蛋白(图3B)。同时,可溶性分析结果显示,His-Ferritin融合蛋白主要以包涵体形式表达。
2.3 His-Ferritin融合蛋白的亲和层析纯化及SDS-PAGE分析
选用His-Trap HP 层析柱对变性蛋白质进行亲和层析纯化,使用96孔深孔板对梯度洗脱过程中的洗脱产物进行完全收集,并选择有代表性的样品进行SDS-PAGE电泳分析。A1-E4对应96孔收集板不同的收集孔,分别对应不同浓度咪唑洗脱样品(96孔板竖排标记A~E,横排标记1~12)。结果显示,咪唑线性梯度洗脱可以特异性的获得目标蛋白,融合蛋白在咪唑浓度为190 mmol·L-1时出现单一洗脱峰(图4A)。用SDS-PAGE 对穿透峰及不同浓度咪唑的洗脱产物进行SDS-PAGE分析,结果显示,目的蛋白主要存在于洗脱峰处的洗脱液中,纯度达96%(图4B)。在洗脱峰处可见约37 和105 ku的2条蛋白条带,说明在纯化过程中有少量目标蛋白复性自组装为三聚体结构。

A. SDS-PAGE胶验证重组蛋白表达;B. Western-blot 验证重组蛋白表达。M. 蛋白质相对分子质量标准;1. 未诱导的大肠杆菌总蛋白;2. IPTG诱导大肠杆菌总蛋白;3. IPTG诱导表达大肠杆菌总蛋白可溶组分;4. IPTG诱导表达大肠杆菌包涵体组分A. SDS-PAGE verifying the expression of His-Ferritin;B. Western-blot verifying the expression of His-Ferritin. M. Protein marker;1. Total protein of E.coli without induction;2. Total protein of E.coli after IPTG induction;3. Soluble protein of E.coli after IPTG induction;4. Inclusion body of E.coli after IPTG induction图3 His-Ferritin融合蛋白诱导表达及表达形式分析Fig.3 Expression of His-Ferritin fusion protein and soluble analysis
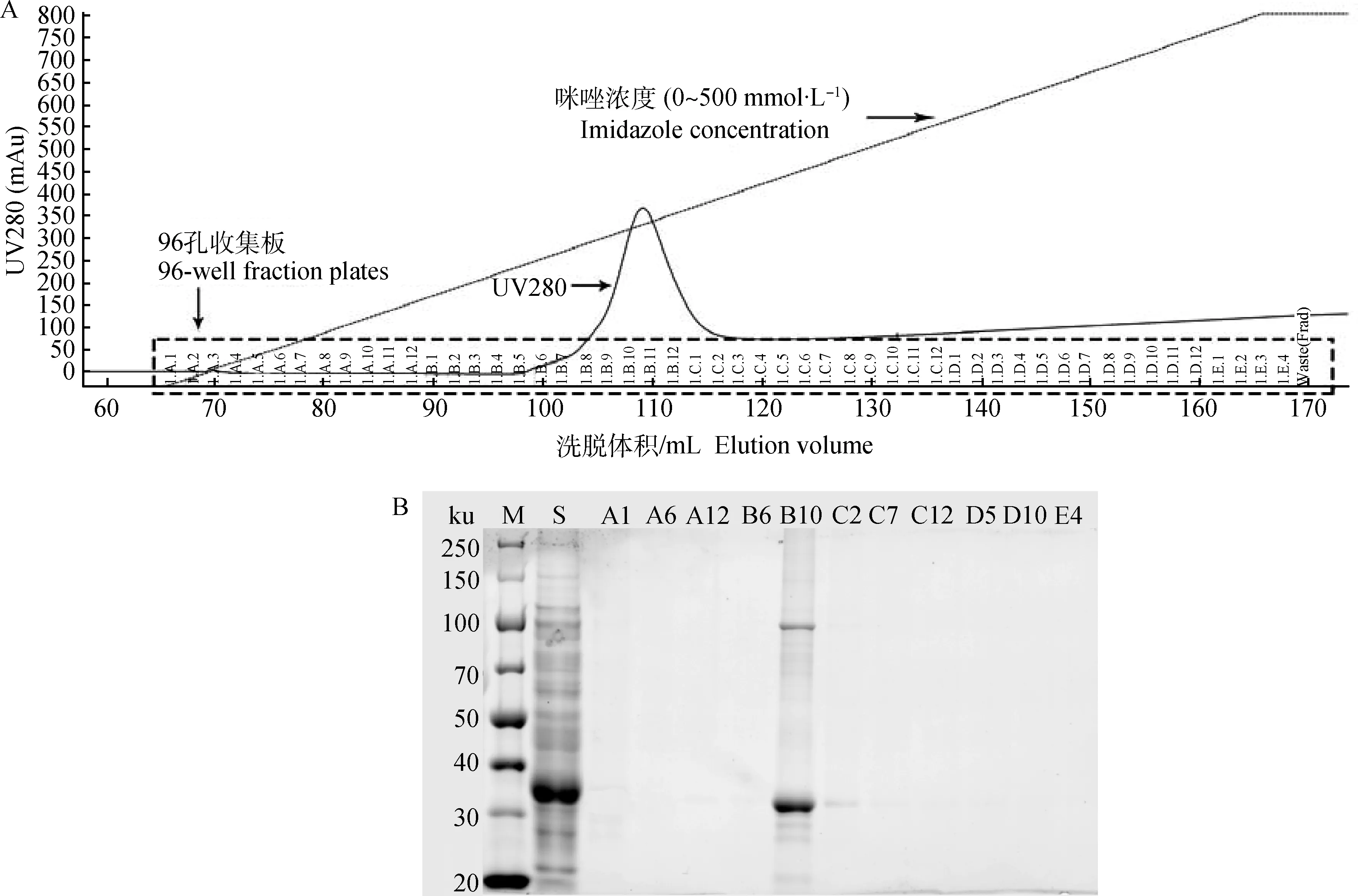
M. 蛋白质相对分子质量标准; S. 重组蛋白样品;A1~E4. 不同浓度咪唑洗脱样品M. Protein marker;S. Recombinant protein sample;A1-E4. Imidazole elution samples with different concentrations图4 His-Ferritin融合蛋白的亲和层析纯化(A)及SDS-PAGE分析(B)Fig.4 Affinity chromatography purification(A) and SDS-PAGE analysis (B) of fusion protein His-Ferritin
2.4 重组蛋白复性及胞外自组装
为使纯化得到的蛋白进行充分的复性及自组装,将纯化后的His-Ferritin 蛋白梯度置换至2 mol·L-1尿素的复性缓冲液放置于4 ℃ 过夜,Superdex75 检测发现融合蛋白在外水体积出峰,说明大多数蛋白呈现为大分子量复合体,即在体外完成复性及自组装(图5A)。采用透射电子显微镜观察复性后的蛋白质样品,发现蛋白质呈现为均匀的纳米级颗粒,粒径约为12~20 nm(图5B)。

A. 重组蛋白分子量和纯度分析;B. 透射电镜分析重组蛋白纳米结构A. Molecular weight and purity analysis of recombinant protein;B. Transmission electron microscope analysis of nano-structure of recombinant protein图5 重组蛋白复性与胞外自组装Fig.5 Refolding and self-assembling in vitro of recombinant protein
3 讨 论
生物纳米技术的众多优势使其在生物医药领域得到了广泛的关注。高小龙等[23]利用原核表达系统等筛选得到了新城疫病毒F蛋白纳米抗体。铁蛋白广泛存在于生物体内,具有良好的生物安全性,其独特的理化性质使其成为理想的纳米载体,目前已广泛用于肿瘤检测与靶向治疗以及多种癌症预后指标[24-26]。T.R.Daniels等[25]研究发现,人铁蛋白重链受体(TfR1)在肿瘤细胞中的表达量提高了100 倍,因此铁蛋白纳米颗粒可以作为肿瘤标志分子,并通过修饰携带药物以TfR1为靶标,从而达到靶向治疗的效果。许婉芳等[27]利用原核表达系统得到了重组人铁蛋白,为其在生物医学的应用提供基础。此外,由于铁蛋白内核Fe3O4具有超顺磁性,使其可以发展为MRI 显影剂。有学者甚至研究通过使体内的肿瘤细胞过表达H-铁蛋白,并直接应用核磁共振实现体内肿瘤成像和淋巴结肿瘤转移的检测[7,28]。然而, 人们对于铁蛋白与肿瘤关系的认识, 目前多是源于发现有铁蛋白在肿瘤细胞中出现异常表达,其在肿瘤形成过程中的具体功能和机制还有待进一步研究。同时,由于铁蛋白在免疫调控和炎症发生等多方面均有着重要的作用,目前还无法确定体内直接过表达铁蛋白的安全性。而且由于铁蛋白在各组织器官中广泛表达,过表达的铁蛋白信号容易受到内源性铁蛋白背景信号的干扰,从而不易于获得明确的检测信号。因此,使用外源铁蛋白作为疾病诊断和治疗的研究近年来成为一种趋势。M.Kanekiyo等[18]研究表明,使用幽门螺杆菌铁蛋白与流感病毒血凝素HA融合表达免疫动物后不会引起机体内源性蛋白的免疫反应。本研究通过原核表达获得了与人类铁蛋白H链同源性为46%的幽门螺杆菌的铁蛋白,纯化及复性过程中采用将Ferritin蛋白先变性纯化,然后透析至2 mol·L-1脲复性,再透析至PBS的方案,降低目标蛋白形成不规则多聚体的几率,使目标蛋白可以正确折叠为纳米粒子,由于该蛋白为外源蛋白,作为纳米载体应用于体内时理论上不会引起免疫系统针对自身铁蛋白的免疫反应,更加有利于铁蛋白纳米粒子在医学上的应用。
对蛋白类药物而言,相对于化学修饰,采用基因工程方法将目标蛋白与铁蛋白亚基融合表达的方法解决了在化学标记时标记蛋白方向的随机性降低检测灵敏度的问题。而通过将标记蛋白与铁蛋白亚基融合表达,使融合蛋白有序的展示在铁蛋白壳的外表面,提高抗体或药物等目标蛋白的载量和效率。中国科学院生物物理研究所开发的携带阿霉素的H-铁蛋白,通过单次注射即可特异性结合并杀死癌细胞[29]。在铁蛋白L 亚基的N 端融合表达HIV 病毒的Tat 肽段,并用自组装纳米疫苗口服免疫小鼠引起高效的免疫应答[17]。韩国蔚山国家科学技术研究所研究发现,铁蛋白可以将OT-1和OT-2肽段成功的呈递于树突状细胞,并在体内和体外都可以诱导T细胞抗原特异性因子CD4和CD8的增殖[19]。本研究所使用的铁蛋白包涵体分离纯化及胞外复性自组装方法使铁蛋白可以在体外自组装为具有纳米结构的铁蛋白纳米粒子,该方法同样适用于其他蛋白与铁蛋白进行融合表达的纯化与胞外自组装。
4 结 论
本研究通过原核表达系统成功表达并纯化得到了具有天然纳米结构的铁蛋白,该铁蛋白粒径均一,结构稳定,可以通过化学修饰用于药物呈递载体,也可以通过与蛋白类药物或抗原等融合表达,直接用于新型药物或疫苗的研发,为铁蛋白纳米粒子在生物医药领域的研究与应用提供参考。
[1] LAUFBERGER V. Sur la cristallisation de la ferritine[J].BullSocChimBiol, 1937, 19: 1575-1582.
[2] THEIL E C, BEHERA R K, TOSHA T. Ferritins for chemistry and for life[J].CoordChemRev, 2013, 257(2): 579-586.
[3] THEIL E C. Ferritin protein nanocages-the story[J].NanotechnolPercept, 2012, 8(1): 7-16.
[4] HARRISON P M, AROSIO P. The ferritins: molecular properties, iron storage function and cellular regulation[J].BiochimBiophysActa, 1996, 1275(3): 161-203.
[5] COZZI A, CORSI B, LEVI S, et al. Overexpression of wild type and mutated human ferritin H-chain in HeLa cells:invivorole of ferritin ferroxidase activity[J].JBiolChem, 2000, 275(33): 25122-25129.
[6] ANDREWS N C. Forging a field: the golden age of iron biology[J].Blood, 2008, 112(2): 219-230.
[7] COHEN B, ZIV K, PLAKS V, et al. Ferritin nanoparticles as magnetic resonance reporter gene[J].WileyInterdiscipRevNanomedNanobiotechnol, 2009, 1(2): 181-188.
[8] 李志鹏, 刘庆友, 石德顺. 铁蛋白纳米颗粒应用于生物医疗领域的研究进展[J]. 生物技术通报, 2015, 31(10): 38-47.
LI Z P, LIU Q Y, SHI D S. Research progress on application of ferritin nanoparticles in the field of biomedicine[J].BiotechnologyBulletin, 2015, 31(10): 38-47. (in Chinese)
[9] TOWE K M. Structural distinction between ferritin and iron-dextran (imferon). An electron diffraction comparison[J].JBiolChem, 1981, 256(18): 9377-9378.
[10] MELDRUM F C, WADE V J, NIMMO D L, et al. Synthesis of inorganic nanophase materials in supramolecular protein cages[J].Nature, 1991, 349(6311): 684-687.
[11] MANN S, ARCHIBALD D D, DIDYMUS J M, et al. Crystallization at inorganic-organic interfaces: biominerals and biomimetic synthesis[J].Science, 1993, 261(5126): 1286-1292.
[12] UCHIDA M, FLENNIKEN M L, ALLEN M, et al. Targeting of cancer cells with ferrimagnetic ferritin cage nanoparticles[J].JAmChemSoc, 2006, 128(51): 16626-16633.
[13] SANTAMBROGIO P, PINTO P, LEVI S, et al. Effects of modifications near the 2-, 3- and 4-fold symmetry axes on human ferritin renaturation[J].BiochemJ, 1997, 322(Pt 2): 461-468.
[14] STEFANINI S, CAVALLO S, WANG C Q, et al. Thermal stability of horse spleen apoferritin and human recombinant H apoferritin[J].ArchBiochemBiophys, 1996, 325(1): 58-64.
[15] KANG S, OLTROGGE L M, BROOMELL C C, et al. Controlled assembly of bifunctional chimeric protein cages and composition analysis using noncovalent mass spectrometry[J].JAmChemSoc, 2008, 130(49): 16527-16529.
[16] UCHIDA M, KANG S, REICHHARDT C, et al. The ferritin superfamily: supramolecular templates for materials synthesis[J].BiochimBiophysActa, 2010, 1800(8): 834-845.
[17] LI C Q, SOISTMAN E, CARTER D C. Ferritin nanoparticle technology... A new platform for antigen presentation and vaccine development[J].IndBiotechnol, 2006, 2(2): 143-147.
[18] KANEKIYO M, WEI C J, YASSINE H M, et al. Self-assembling influenza nanoparticle vaccines elicit broadly neutralizing H1N1 antibodies[J].Nature, 2013, 499(7456): 102-106.
[19] HAN J A, KANG Y J, SHIN C, et al. Ferritin protein cage nanoparticles as versatile antigen delivery nanoplatforms for dendritic cell (DC)-based vaccine development[J].NanomedNanotechnolBiolMed, 2014, 10(3): 561-569.
[20] CHIU Y C, GAMMON J M, ANDORKO J I, et al. Assembly and immunological processing of polyelectrolyte multilayers composed of antigens and adjuvants[J].ACSApplMaterInterface, 2016, 8(29): 18722-18731.
[21] 薛茂云, 董 飚, 张 营, 等. 鸭脂联素基因全长cDNA的克隆和原核表达的研究[J]. 畜牧兽医学报, 2010, 41(10): 1232-1239.
XUE M Y, DONG B, ZHANG Y, et al. Identification and prokaryotic expression of duckAdiponectingene[J].ActaVeterinariaetZootechnicaSinica, 2010, 41(10): 1232-1239. (in Chinese)
[22] 薛 玲, 刘江宁, 张 耀, 等. EV71多表位抗原亲和纯化及类病毒颗粒胞外自组装[J]. 中国生物工程杂志, 2016, 36(7): 34-40.
XUE L, LIU J N, ZHANG Y, et al. Affinity purification of enterovirus 71 fused multi-epitope protein antigen and assembling it as virus-like particlesinvitro[J].ChinaBiotechnology, 2016, 36(7): 34-40. (in Chinese)
[23] 高小龙, 胡湘云, 付向晶, 等. 新城疫病毒F蛋白纳米抗体的筛选及活性鉴定[J]. 畜牧兽医学报, 2016, 47(8): 1645-1651.
GAO X L, HU X Y, FU X J, et al. Screening and characterization of VHH against newcastle disease virus fusion protein[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(8): 1645-1651. (in Chinese)
[24] 黄培森, 沈 阳, 王焦清, 等. 铁蛋白纳米粒子的修饰及细胞内化特性的研究[J]. 化学试剂, 2015, 37(1): 8-12.
HUANG P S, SHEN Y, WANG J Q, et al. Modified ferritin-based nanoparticles and internalizationin cells[J].ChemicalReagents, 2015, 37(1): 8-12. (in Chinese)
[25] DANIELS T R, DELGADO T, HELGUERA G, et al. The transferrin receptor part II: targeted delivery of therapeutic agents into cancer cells[J].ClinImmunol, 2006, 121(2): 159-176.
[26] REISSMANN K R, DIETRICH M R. On the presence of ferritin in the peripheral blood of patients with hepatocellular disease[J].JClinInvest, 1956, 35(6): 588-595.
[27] 许婉芳, 陈 曦, 陈巧君. 人铁蛋白基因的克隆与原核表达[J]. 泉州师范学院学报, 2011, 29(4): 45-49.
XU W F, CHEN X, CHEN Q J. Cloning and expression of theFerritingene inHomosapiens[J].JournalofQuanzhouNormalUniversity, 2011, 29(4): 45-49. (in Chinese)
[28] GILAD A A, WINNARD P T JR, VAN ZIJL P C M, et al. Developing MR reporter genes: promises and pitfalls[J].NMRBiomed, 2007, 20(3): 275-290.
[29] LIANG M M, FAN K L, ZHOU M, et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection[J].ProcNatlAcadSciUSA, 2014, 111(41): 14900-14905.
