补益宗气方对慢性阻塞性肺疾病大鼠血清前白蛋白及TNF-α水平影响的实验研究*
2018-01-26宋文龙陈章生陈豫生龚莉兰智慧
★ 宋文龙 陈章生 陈豫生 龚莉 兰智慧**
(1.江西中医药大学附属医院 南昌 330006;2.江西中医药大学2014级硕士研究生 南昌 330004;3.南昌大学第四附属医院 南昌 330003)
慢性阻塞性肺疾病( COPD) 不仅是一种气道和肺部的疾病,也是由多种危险因素共同参与、多种生物机制同时介导的全身多系统性慢性炎症反应性疾病C0PD病变主要损害患者肺部,患者临床主要表现为慢性的咳嗽,以清晨明显,有少许黏液性痰及呼吸困难等,同时也会引起患者产生全身效应,其中合并营养不良较为常见[1]。近年来,有研究表明肿瘤坏死因子、血清前白蛋白与COPD发展及预后关系密切[2-9]。COPD属中医学“咳嗽”“肺胀”“喘证”等范畴,国医大师洪广祥教授认为其病机为本虚标实,虚实夹杂,其中宗气虚弱为本,痰瘀实邪为标,在临床应用补益宗气方积累了丰富的经验,本实验研究拟通过观察补益宗气方对COPD大鼠气道结构,体重、血清前白蛋白(Prealbumin)及肿瘤坏死因子(TNF-α)的影响,探讨补益宗气方改善COPD大鼠营养状态的可能作用机制。
1 材料与方法
1.1 实验动物 健康纯系雄性SD大鼠30只(湖南斯莱克景达实验动物有限公司提供,合格证号:NO.43004700009069)。
1.2 实验材料 中药饮片由附属医院小包装药房提供;补益宗气方组成及剂量:西党参30g、生黄芪30g、炒白术15g、当归10g、升麻10g、北柴胡10g、锁阳15g、山萸肉15g、陈皮10g、炙甘草10g。
上述饮片拆封后按赵瑞华[10]文献内所述方法,用冷水浸泡0.5h后用煎药砂锅进行煎煮,共两遍,后将所得水剂密封后低温保存,按需取用。灌胃前室温下放置1h。
1.2.2 主要试剂 血清前白蛋白及TNF-α酶联免疫吸附试验盒:湖北武汉优尔生科技股份有限公司提供,规格及批号:96TL141212626、96T L141122631。脂多糖(LPS)固体 每支含10mg,美国Sigma公司生产,货号:Sigma-L2880。
1.3 实验步骤 每10只大鼠为一个单元饲养,随机分为空白组、模型组、观察组。采用气管内注射脂多糖溶液加香烟烟雾烟熏及冷风刺激方法[11]:COPD模型组及观察组第1、14d在气管内注入脂多糖(LPS)溶液后,2~13d及15~28d则持续熏烟30min,香烟量约20支/d,香烟烟雾熏烟后,立刻移至室外冷风刺激1h(室内外温差约5℃)。29~42d,观察组则给予补益宗气汤灌胃进行干预,第43d,将各组大鼠称重,在乙醚麻醉后经腹主动脉抽血[12]致死,并立即取右肺下叶组织,经10%甲醛固定。
1.4 肺组织病理切片的制备 取出固定好的肺组织,常规石蜡包埋,4μm 切片。切片用二甲苯脱蜡,经各级乙醇至水洗;苏木素染色后自来水冲洗;盐酸乙醇分化;自来水浸泡15 min;置伊红液2 min;常规脱水,透明,中性树胶封片。
1.5 酶联免疫吸附法检测肿瘤坏死因子及血清前白蛋白水平 使用离心机提取血清并用相关酶联免疫吸附试验(ELISA)盒测定肿瘤坏死因子、血清前白蛋白水平。将酶标板除第1孔(对照孔)外的空白微孔按顺序,分别加入100μL的标准品溶液,再加入100μL的血清;将100μL pH为7.0~7.2的PBS 液加入到空白对照孔。将50μL的酶标记溶液加入到除对照孔外各孔中后。 将微孔板轻轻摇动后密封,放置37℃孵育箱中,1h后,将微孔板取出,去掉反应物,使用洗涤液清洗酶标板,将显色剂A 50μL、B 50μL次序加入各孔中后,在37℃下,避光反应,15min后,将终止液50μL,加入各孔中。最后使用450nm光,测定各孔的吸光度OD值后,输入横、纵坐标,横坐标为标注品的6个浓度值,纵坐标为标准品的OD值,画出曲线,应用软件分析得出计算的公式,将血清样本所测得的OD值,使用分析得出公式算出各血清样本中各相关指标浓度。
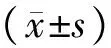
2 结果
2.1 各组大鼠在实验过程中的表现 在造模期间,观察组和模型组大鼠均出现烦躁不安,并且先后出现咳嗽、气促、少动,迟缓,蜷缩一团、精神萎靡,饮食减少、毛发枯槁,体重增长缓慢,个别大鼠体重减轻,从造模开始后第6d起有大鼠出现喷嚏、流涕,此后陆续有大鼠出现喷嚏及呼吸加快症状,模型组有一部分大鼠持续至第43d,观察组通过服用中药症状逐渐减轻,至第43d处死时基本恢复;空白组表现正常。
2.2 对模型组大鼠肺组织病理的初步观察 对大鼠进行解剖后发现模型组大鼠肺体积明显增大,外观苍白、粗糙不平。固定切片后在光镜下可以观察到支气管纤毛柱状上皮增厚,气管黏膜下腺体增生肥大,杯状细胞增生明显,淋巴细胞浸润,黏膜下及外膜胶原纤维增生,支气管平滑肌明显增厚,终末细支气管炎症浸润明显,同时肺泡、肺泡囊扩大以及排列结构紊乱。
2.3 光镜下对大鼠肺组织切片的病理形态观察 在奥林巴斯光学显微镜下观察三组大鼠的支气管肺组织病理改变,以下分别为HE染色图片、马松染色图片(见图1、图2)。
空白组上皮细胞结构完整,排列整齐,小气道及肺泡未见炎症细胞浸润;模型组上皮细胞坏死,脱落,可见巨噬细胞、淋巴细胞等炎症细胞,小气道可见弹力纤维、胶原纤维,肺泡壁变薄,甚至断裂;观察组上皮细胞坏死较模型组减轻,炎性浸润亦减轻,仍可见少许弹力纤维。
空白组小气道周围仅少量蓝色胶原纤维沉积;模型组小气道周围大量蓝色胶原纤维沉积,气道壁增厚;观察组小气道周围蓝色胶原纤维较模型组减少。

图1 三组大鼠支气管肺组织HE染色所显示的病理改变(×200)
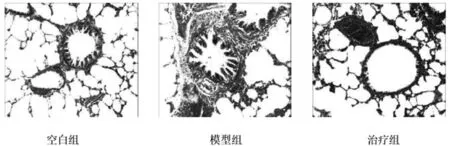
图2 三组大鼠支气管肺组织Masson染色显示的病理改变(×400)
光镜下观察肺组织切片发现,模型组大鼠肺组织细支气管纤毛上皮结构不完整,部分缺失,杯状上皮细胞增生明显,气管粘膜下层可见大量炎性细胞浸润(主要为淋巴细胞),观察组气道及肺组织炎症浸润程度较模型组轻,而空白组肺组织中未见明显炎症细胞浸润,提示COPD大鼠模型建立成功。
2.4 大鼠的体重 造模前三组大鼠体重无明显差异,造模后模型组及观察组大鼠间体重增长无明显差异,但显著低于空白组,而以补益宗气方对观察组进行干预后,该组大鼠体重增长值显著高于模型组,低于空白对照组。各组大鼠体重增长,情况见表1。
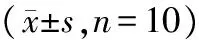
表1 三组大鼠体重
注:与空白组比较,*P<0. 05;与模型组比较,#P<0. 05;与治疗前比较,△P<0. 05 。
2.5 血清前白蛋白的比较 造模后模型组及观察组大鼠血清前白蛋白水平显著低于空白组,模型组及观察组间血清前白蛋白水平差异则无显著性,而以补益宗气方对观察组进行干预后,其血清前白蛋白水平显著高于模型组,仍低于空白组,具体见表2。
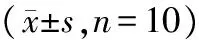

组别治疗前前白蛋白(ug/mL)治疗后前白蛋白(ug/mL)空白组234.82±7.87237.7±6.58模型组 98.94±5.41∗ 101.60±4.27∗观察组 99.05±5.68∗ 182.78±7.34∗#△
注:与空白组比较,*P<0. 05;与模型组比较,#P<0. 05;与治疗前比较,△P<0. 05。
2.6 血清肿瘤坏死因子的比较 造模后模型组及观察组大鼠血清TNF-α水平显著高于空白组,模型组及观察组间血清TNF-α水平差异则无显著性,以补益宗气方对观察组进行干预后,其血清TNF-α水平显著低于治疗前,治疗后的模型组大鼠,仍高于空白组,具体见表3。
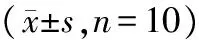

组别治疗前TNF-α(ng/L)治疗后TNF-α(ng/L)空白组131.05±6.59133.17±5.69模型组 199.41±70.32∗ 208.73±91.0∗观察组 181.05±6.59∗ 150.92±14.35∗#△
注:与空白组比较,*P<0. 05;与模型组比较,#P<0. 05;与治疗前比较,△P<0. 05。
3 讨论
COPD属中医学“喘证”“咳嗽”“肺胀”范畴,主要表现为长期反复的咳嗽、咳痰,逐渐出现喘促、胸膺膨满、憋闷如塞,重者可有唇甲青紫,心悸,肢肿等症,发展成肺心病。目前,多数医家认为本虚标实,虚实夹杂是慢性阻塞性肺疾病证候的基本特点。国医大师洪广祥教授根据临床上COPD合并营养不良患者存在咳嗽喘促,少气不足以息,语言低微,身倦乏力等特征,认为慢阻肺病人普遍存在营养障碍的情况,是缘于宗气虚衰,元气不能得到充养,肺脾气弱,不能正常运化水谷精微,输布障碍,供给不足,脏腑及肌肤失养,故肺气胀满,又呼吸过度,耗气伤津过甚,形体逐渐消瘦,日趋羸弱[13]。《灵枢》曰:“大气入于脏腑者,不病而卒死矣”。说明了宗气虚衰,导致患者死亡的病理过程。
目前对肺胀的治疗,多数医家认为急则治其标,缓则治其本。洪教授则指出慢阻肺在急性发作期与稳定期均可出现虚中夹实,提出宗气虚弱是慢性阻塞性肺疾病发生发展的重要内因,在疾病全程皆可治以补益宗气[14-18]。
COPD 患者最显著的特征就是体质量下降、血液营养指标下降及免疫力下降加重感染。目前认为机体的过度能量消耗、高代谢以及患者本身摄入不足是COPD 合并营养不良的主要原因,有研究表明肿瘤坏死因子等炎症因子引起的代谢紊乱可能是患者营养状况下降的重要原因[19]。本实验以上述几种指标为切入点,通过观察COPD模型大鼠肺部组织形态的变化以及对血清前白蛋白、肿瘤坏死因子的定量检测,观察补益宗气汤对COPD模型大鼠体内血清前白蛋白、肿瘤坏死因子含量水平及体重的影响。经统计学分析比较,证明补益宗气汤可以有效的降低肿瘤坏死因子含量,增加血清前白蛋白含量,以达到改善COPD大鼠营养状态的作用。
3.1 体重变化 在试验中,造模前三组大鼠间体重无明显差异。造模后模型组、大鼠体重较空白组增长更慢,体重较空白组轻。经补益宗气方干预后观察组高于治疗前及治疗后的模型组,仍低于空白组,由此,我们发现,通过补益宗气方可促进大鼠摄食,有效增加COPD大鼠体重,从而改善COPD大鼠营养状况。
3.2 血清前白蛋白 血清前白蛋白(prealbumin,PA)是存在于血浆中的一种急性相反应蛋白,主要存在于血液和脑脊液中,其水平与蛋白质的代谢有关,可灵敏反映机体的营养状态及肝脏合成功能,与机体内炎症反应有关。
造模后,模型组大鼠前白蛋白含量较空白组显著降低;观察组治疗后大鼠血清前白蛋白较治疗前显著升高,较模型组治疗后升高明显。说明通过补益宗气方,可提升COPD大鼠血清前白蛋白水平,营养状态得到相应改善。
3.3 肿瘤坏死因子 肿瘤坏死因子-α(TNF-α)是由活化的单核细胞、巨噬细胞和T淋巴细胞产生的,能诱导肿瘤组织出血坏死的物质,除抗肿瘤作用外,还参与炎症、发热以及机体脂肪、蛋白质的分解代谢等病理生理过程[20]。通过抑制脂肪细胞对脂肪酸的摄入,降低脂生成关键酶如乙酰辅酶A羧化酶、脂肪酸合成酶的表达,促进脂肪分解,抑制脂肪细胞分化,并诱导脂肪细胞及前脂肪细胞凋亡,参与了众多慢性消耗性疾病恶病质的发生。Schols等[21]研究认为TNF-α与COPD的高代谢有关,TNF-α可能通过增加能量消耗导致COPD患者的营养不良。本研究结果也证实该观点,且大鼠血清TNF-α水平与前白蛋白水平呈负相关,提示TNF-α生物学效应的发挥对血清前白蛋白有影响。
本研究结果显示,造模后,COPD模型及观察组大鼠血清TNF-α浓度明显高于对照组,且血清TNF-α浓度与体质量呈显著负相关;观察组治疗后大鼠血清TNF-α较治疗前显著降低,较模型组治疗后降低。结合治疗前后各组大鼠血清前白蛋白水平的变化,提示TNF-α参与了COPD营养不良的发生,证实通过补益宗气方,可降低COPD大鼠血清TNF-α水平, 抑制炎症反应,改善COPD大鼠营养状态。其中,模型组中有个别大鼠治疗前后TNF-α水平远高于该组平均值,考虑可能为造模刺激后诱发肿瘤导致。
综上所述,营养不良是COPD 的常见肺外表现,也是COPD 预后不良的独立危险因素,可加重COPD 疾病的进展,本研究提示:补益宗气方能改善COPD营养不良大鼠的营养状况,其作用机制在于能降低大鼠血清肿瘤坏死因子水平,提高血清前白蛋白水平。结合目前国内外对COPD合并营养不良倾向于在常规治疗的基础上配合营养支持及适当锻炼的观点,我们认为,在临床治疗中,对COPD 患者进行营养风险筛查及营养评价,制订不同的长期分级营养支持治疗方案,合理、均衡地搭配肠内和(或)肠外营养,并辅以具有代谢支持作用的物质,结合运动训练,配合辨证服用补益宗气汤,可改善临床预后。我们将在下一步工作中继续深入研究,为补益宗气方的临床运用提供实验依据。
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志, 2013, 36(4):484-491.
[2]童桂兰, 杨沛华, 刘春文,等. 血清前白蛋白的临床应用价值[J].中国中西医结合消化杂志, 2012, 20(5):232-234.
[3]于美玲, 张中和. 慢性阻塞性肺疾病研究进展[J].中国临床研究, 2013, 26(1):82-85.
[4]Mohan A, Arora S, Uniyal A, et al. Evaluation of plasma leptin, tumor necrosis factor-α, and prealbumin as prognostic biomarkers during clinical recovery from acute exacerbations of chronic obstructive pulmonary disease[J].Lung India Official Organ of Indian Chest Society, 2017, 34(1):3-8.
[5]贺丽雅, 杨爱民, 刘豹,等. IL-8、IL-1β、TNF-α水平在COPD发病中意义的探讨[J].放射免疫学杂志, 2007, 20(5):392-394.
[6]宋华. COPD患者治疗前后血清IL-10、IL-18和TNF-α检测的临床意义[J].放射免疫学杂志, 2009, 22(4):338-340.
[7]孙圣华. TNF-α对COPD营养不良动物模型骨骼肌蛋白质分解代谢的影响及可能的机制[D].长沙:中南大学, 2006.
[8]沈景昊. COPD患者不同时期血清CRP、IL-8、TNF-α水平变化及临床意义[D].苏州大学, 2014.
[9]Brug J, Schols A, Mesters I. Dietary change, nutrition education and chronic obstructive pulmonary disease[J].Patient Education & Counseling, 2004, 52(3):249-57.
[10]杨艳环, 赵瑞华. 中药煎服方法研究进展[J].辽宁中医药大学学报, 2011,13(1):30-32.
[11]李进华, 邓敏华, 陈平,等. 慢性阻塞性肺疾病动物模型的研究进展[J].中华结核和呼吸杂志, 2014, 37(8):606-609.
[12]邹洪, 闫洪涛, 李军,等. 大鼠实验研究中三种采血方法的应用[J].西南军医, 2011, 13(5):787-788.
[13]洪广祥. 论宗气与慢性阻塞性肺疾病[J].中医药通报, 2006, 5(1):5-8.
[14]温武兵, 张珍玉. 论宗气的生理功能[J].山东中医药大学学报, 2000, 24(4):247-250.
[15]余建玮, 薛汉荣, 张元兵,等. 国医大师洪广祥教授诊疗肺系疾病学术思想荟萃[J].中华中医药杂志, 2015,30(11):3 824-3 829.
[16]洪广祥. 中医药治疗慢性阻塞性肺疾病的几点思考[J].中华中医药杂志, 2005, 20(1):16-19.
[17]佘靖. 中国现代百名中医临床家丛书. 洪广祥[M].中国中医药出版社, 2007.
[18]王丽华, 张元兵, 兰智慧. 洪广祥补益宗气理论在慢性阻塞性肺疾病中的应用[J].中华中医药杂志, 2011,26(2):302-304.
[19]王丽华, 张元兵, 兰智慧. 洪广祥虚实并治慢性阻塞性肺疾病[J].中华中医药杂志, 2010,25(3):386-388.
[20]陆梅, 李泽庚, 朱洁,等. COPD合并营养不良状况的相关研究进展[J].光明中医,2016, 31(2):296-298.
[21]Foley R J, Zuwallack R. The impact of nutritional depletion in chronic obstructive pulmonary disease[J].Journal of Cardiopulmonary Rehabilitation, 2001, 21(5):288.
