小檗碱、巴马汀和药根碱在“三明治”培养大鼠原代肝细胞中的胆汁外排特征
2018-01-24梁瑞峰宋献美葛文静李更生
梁瑞峰,宋献美,葛文静,张 峰,代 震,李 宁,田 萍,李更生
(1. 河南省中医药研究院中药研究所,河南 郑州 450004;2. 河南医学高等专科学校微生物与免疫学教研室,河南 郑州 451191)
经肠道吸收的药物由肠系膜静脉汇总至肝门静脉后,经肝细胞的血窦侧膜进入肝细胞内,在肝细胞内的I相和II相代谢酶作用下,经氧化、还原、水解、结合等代谢反应后,其最终产物经肝细胞的胆管侧膜排进胆汁,进入肠道。在这一过程中,除被动扩散外,肝细胞血窦侧的摄取转运体可将药物摄取转运至肝细胞内,胆管侧的外排转运体可将底物排进胆汁[1-2]。肝脏转运体直接关系着药物的分布、代谢、肝脏清除等体内过程,不仅能影响药效,而且有可能诱发药物的不良反应。因此,了解药物的肝脏转运特征对于研究药物的体内过程和不良反应具有重要的意义。
小檗碱、巴马汀和药根碱是中药黄连的主要成分,具有相似的理化性质及化学结构。本课题组前期研究表明,小檗碱、巴马汀和药根碱进入肝细胞均以主动转运为主,Oatp1a1、Oatp1a4、Oatp1b2、Oct1可能介导了小檗碱和巴马汀的肝脏摄取,Oatp1b2和Oct1参与了药根碱的主动转运[3]。然而,小檗碱、巴马汀和药根碱的胆汁外排特征尚不明确。本研究通过“三明治”培养大鼠原代肝细胞(sandwich cultured rat hepatocytes, SCRH)模型,评价小檗碱、巴马汀、药根碱在大鼠肝细胞中的外排转运特征,为研究相关药物的体内过程提供依据。
1 材料与方法
1.1动物SPF级SD大鼠,♂,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。
1.2药品与试剂盐酸小檗碱(批号110713-201613)、盐酸药根碱(批号110733-201609)、盐酸巴马汀(批号110732-201611)、盐酸维拉帕米(verapamil,Ver,批号100223-200102)、丙磺舒(probenecid,PBC,批号101113-201101)、环孢素A(ciclosporinA,CsA,批号130495-201303),均购自中国食品药品检定研究院;DMEM 培养基、胎牛血清购自Hyclone公司;兔抗P-gp、Mrp2多克隆抗体购自北京博奥森生物技术有限公司;羊抗兔IgG 抗体、GAPDH抗体购自武汉三鹰生物技术有限公司;对乙酰氨基酚、鼠尾胶原、MK571购自Sigma公司;Matrigel基质胶购自BD公司;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
1.3仪器Xevo TQS型三重四级杆串联质谱仪,配有Waters Acquity 型超高效液相色谱仪(美国Waters公司);2K15型高速离心机(德国Sigma公司);Synergy NEO型全功能酶标仪(Bio-Tek公司);XSJ-D型倒置相差显微镜(重庆光学仪器厂);3164型细胞培养箱(Forma Scientific公司)。
1.4SCRH模型的建立参照文献采用两步灌流法分离大鼠原代肝细胞[4]:大鼠腹腔注射戊巴比妥钠(100 mg·kg-1)麻醉,注射肝素(250 IU·kg-1)以抗凝,75%乙醇浸泡消毒,无菌条件下打开腹腔,门静脉插管,以D-Hanks液灌流,灌注10 s后,结扎下腔静脉通往肾静脉远端,在下腔静脉腹腔段插管同时结扎胸腔段静脉。继续灌注至肝脏变为土黄色,灌注37℃ 0.05% Ⅳ型胶原酶液300 mL,流速20 mL·min-1,然后分离软化的肝脏,撕开肝脏包膜,将肝细胞收集到4℃ DMEM培养液中,100目细胞筛过滤,细胞悬液低速离心(4℃,600 r·min-1,1 min)3次,按细胞数4×108·L-1铺于经过鼠尾胶原处理过的24孔板,每孔体积0.5 mL;用含10%胎牛血清的完全培养液在37℃、5% CO2培养箱中预培养4 h,贴壁后改换含有0.25 g·L-1Matrigel胶的无血清完全培养液培养形成“三明治”构型,每24 h换液1次,直至d 4胆管形成[5]。
1.5SCRH模型P-gp和Mrp2的表达将“三明治”培养1、2、3、4 d的大鼠肝细胞及大鼠肝组织匀浆,冰上裂解后,离心,取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。煮沸5 min,SDS-PAGE分离后,将蛋白转印到PVDF膜上,奶粉封闭,漂洗后分别加入P-gp(1 ∶800)、Mrp2(1 ∶600)一抗,4℃孵育过夜,漂洗后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,漂洗后ECL曝光成像。用Image-Pro Plus 6.0 软件分析,以目的蛋白的积分光密度(integral optical density,IOD)/内参GAPDH的IOD的比值作为蛋白的表达量。
1.6累积摄取和胆管外排实验在“三明治”培养的d 4,将肝细胞与含Ca2+或无Ca2+的Hanks液预孵育15 min,分别加入10 μmol·L-1小檗碱、药根碱、巴马汀孵育2、5、10、20 min,在相应时间点吸去培养液,并用4℃ Hanks液清洗3次,随后加入细胞裂解液150 μL裂解细胞。取100 μL细胞裂解液加入50 μL内标(5 μmol·L-1对乙酰氨基酚),涡旋混匀,用10%冰醋酸溶液100 μL 酸化,混匀后用3 mL乙醚提取,吸取有机相2.5 mL,氮气吹干,用100 μL流动相复溶后离心,上清液5 μL进样分析,UPLC-MS/MS 分别测定小檗碱、药根碱、巴马汀在含Ca2+或无Ca2+条件下的细胞蓄积量。
当SCRH在含Ca2+的缓冲液中培养时,紧密连接完整,摄取进入肝细胞的药物可在转运体作用下外排至胆管,此时测得的药物蓄积量为肝细胞和胆管中的蓄积量;当细胞在无Ca2+的缓冲液中孵育时,紧密连接遭到破坏,胆管管腔内药物释放进入培养液中,此时测得的药物蓄积量仅为肝细胞的蓄积量。通过两种不同条件下药物细胞蓄积量的差值,可计算排入胆管的药量。
1.7P-gp和Mrp2抑制剂对外排的影响培养4 d的SCRH,分为对照组和低、中、高浓度P-gp、Mrp2抑制剂组,换成含Ca2+或无Ca2+的Hanks液预孵育15 min,在抑制剂组的不同孔内分别加入浓度为25、50、100 μmol·L-1的P-gp抑制剂维拉帕米、Mrp2抑制剂丙磺舒孵育20 min,对照组加入空白溶剂,随后分别加入终浓度为10 μmol·L-1小檗碱、药根碱、巴马汀共孵育10 min,孵育结束后吸去上清液,并用4℃ Hanks液清洗3次,随后加入150 μL裂解液裂解细胞,按“1.6”项下方法处理,UPLC-MS/MS分别测定小檗碱、药根碱、巴马汀在含Ca2+或无Ca2+条件下的细胞蓄积量。
1.8色谱和质谱条件色谱条件:色谱柱:ACQUITY UPLCTM BEH C18柱(2.1 mm×50 mm,1.7 μm);柱温:30 ℃;流动相乙腈-水(含0.1%甲酸)=15 ∶85,流速:0.25 mL·min-1;进样量5 μL。
质谱条件:离子源为电喷雾离子源(ESI),正离子多离子反应监测(MRM),毛细管电压3.2 kV,去溶剂气温度500℃,去溶剂气流速700 L·h-1,锥孔气流速:150 L·h-1。小檗碱、药根碱、巴马汀和内标对乙酰氨基酚的离子通道分别为m/z 336.1→320.2、m/z 338.2→322.3、m/z 352.2→308.1、m/z 152.2→110.1。
1.9数据分析通过下列公式(1)、(2)计算药物的胆管外排指数(biliary excretion index, BEI)和胆汁清除率(CLbile)[6],公式(1)中Acells+bile是含Ca2+条件下药物在肝细胞和胆管中的蓄积量,Acells是无Ca2+条件下药物在肝细胞的蓄积量。SCRH在含Ca2+培养液中胆小管保持完整,Acells+bile反映了肝细胞摄取转运体摄取底物的能力; 在无Ca2+条件下,SCRH胆小管的紧密连接被破坏,胆小管中的药物释放到上清液中,Acells反映了肝细胞摄取和外排的净效应,两者的差值反映肝细胞外排转运体外排底物的量。公式(2)中AUCmedium是底物初始浓度和孵育时间的乘积,用200 mg蛋白/克肝脏、40 g肝/kg大鼠体重的参数计算体外的内在胆汁清除率(CLbile)。
公式(1)
公式(2)

2 结果
2.1SCRH模型P-gp和Mrp2的表达不同培养时间的SCRH细胞中的P-pg、Mrp2转运体的表达情况见Fig 1,SCRH细胞有P-pg、Mrp2表达,且随着培养时间的增加,P-pg、Mrp2表达也增加,培养4 d的SCRH细胞表达的P-pg、Mrp2与肝组织无明显差异。表明SCRH模型可用于评价经P-pg、Mrp2介导的药物转运研究。
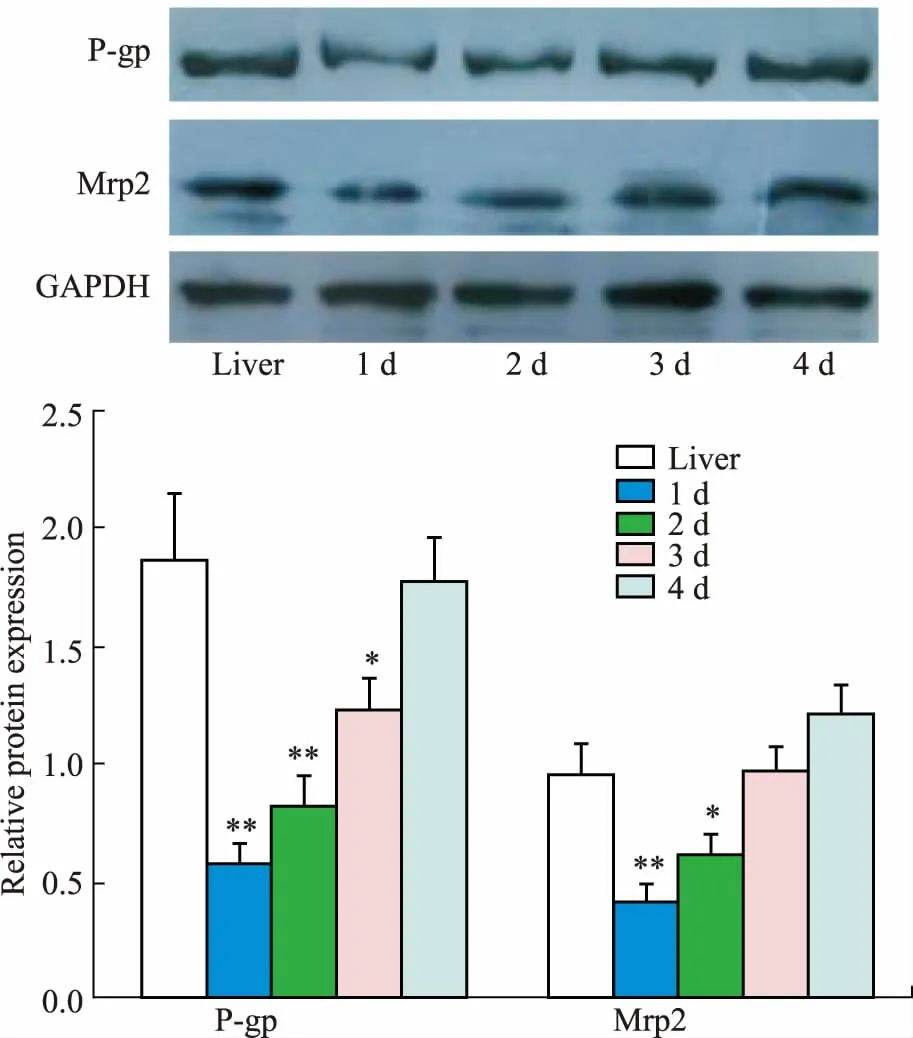
Fig 1 Expression of P-gp and Mrp2
*P<0.05,**P<0.01vsliver
2.2UPLC-MS/MS分析方法的确证分别取空白细胞裂解液、对照品溶液及实验的细胞样品溶液,按“1.6”项下操作,进行UPLC-MS /MS分析,获得空白细胞样品色谱图(Fig 2A)、空白细胞裂解液加入对照品溶液色谱图(Fig 2B)、外排实验的细胞样品色谱图 (Fig 2C)。结果表明,组织中的内源性物质不干扰小檗碱、药根碱、巴马汀及内标的测定。
配制系列浓度的标准样品溶液进样分析,以样品与内标的峰面积比为纵坐标,药物浓度为横坐标进行线性回归,得相应的回归方程。Tab 1结果表明,所测成分在各自的线性范围内线性关系良好。
吸取空白细胞裂解液,分别加入对照品溶液和内标溶液,配制Tab 1中2、4、6 三个浓度的的质量控制(QC)样品各5份,进行基质效应、提取回收率、精密度、稳定性考察。小檗碱的基质效应在91.85%~98.13%之间,提取回收率为82.26%~88.87%,日内精密度RSD为1.21%~5.34%,日间精密度RSD为1.55%~5.76%;巴马汀的基质效应在95.21%~102.30%之间,提取回收率为79.37%~85.05%,日内精密度RSD为2.09%~6.62%,日间精密度RSD为1.86%~6.14%;药根碱的基质效应在89.92%~95.62%之间,提取回收率为80.33%~86.70%,日内精密度RSD为1.86%~6.38%,日间精密度RSD为1.71%~5.96%;稳定性实验表明3种生物碱样品室温下放置24 h、经3次冻融循环以及-70 ℃存放30 d条件下,供试品稳定性良好,RSD均小于15%。
2.3小檗碱、巴马汀、药根碱在SCRH的累积摄取和胆管外排将小檗碱、巴马汀、药根碱分别在有Ca2+或无Ca2+的条件下孵育不同时间,测定细胞蓄积量,计算胆管外排量,考察小檗碱、巴马汀、药根碱在有Ca2+或无Ca2+条件下细胞累积摄取随时间的变化。Fig 3结果表明,随着孵育时间的延长,3种生物碱的细胞蓄积量增加,且在7.5、15、20 min,含Ca2+条件的蓄积量与无Ca2+相比具有明显差异(P<0.05,P<0.01),说明3种生物碱均经过胆汁外排。小檗碱、巴马汀、药根碱孵育10 min的BEI 值分别为(67.54±7.12)%、(33.51±4.27)% 、(43.67±5.51)%,CLbile分别为(24.28±3.04)mL·min-1·kg-1、(4.97±0.59)mL·min-1·kg-1、(4.20±0.52)mL·min-1·kg-1。
2.4转运体抑制剂对小檗碱、巴马汀、药根碱外排的影响不同浓度的P-gp抑制剂CsA、Ver和Mrp2抑制剂MK571、PBC对小檗碱、巴马汀、药根碱外排的影响见Fig 4。结果显示,P-gp抑制剂CsA、Ver均能降低小檗碱、巴马汀、药根碱的BEI,且呈浓度依赖性,100 μmol·L-1的CsA分别将小檗碱、巴马汀、药根碱的BEI降低至对照组的31.01%、26.97%、36.44%,100 μmol·L-1的Ver分别将小檗碱、巴马汀、药根碱的BEI降低至对照组的34.73%、31.50%、41.96%。不同浓度的Mrp2抑制剂MK571、PBC对小檗碱、巴马汀、药根碱的BEI均无明显影响。表明P-gp 可能介导了小檗碱、巴马汀、药根碱的胆汁外排,Mrp2未参与小檗碱、巴马汀、药根碱的转运。
Tab 1 Liner relationships of three components(±s, n=5)
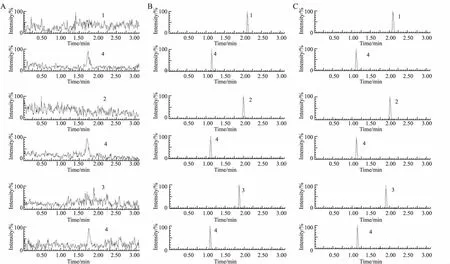
Fig 2 Typical UPLC-MS /MS chromatograms
A: Blank cell suspension; B: Blank cell suspension spiked with standards and IS; C: SCRH cell sample; 1: Berberine; 2: Palmatine; 3: Jateorhizine ; 4: Paracetamol (IS)
3 讨论
有些药物进入肝脏后,以原形或代谢产物的形式,通过胆小管膜上外排转运体外排进胆汁,然后排至肠道,外排转运体对药物在肝脏的清除至关重要。外排转运体分布在肝脏胆小管侧,主要有P-gp、MRP2、乳腺癌耐药相关蛋白、胆盐输出泵等,介导多种内源性物质及外源性药物的胆汁排泄过程[7],在这些转运体中研究较多的是P-gp和MRP2。
P-gp由多药耐药性基因MDR1编码,为典型的外排转运体,在体内分布广泛, 不仅在肝脏的胆小管面上,在小肠、胎盘以及大脑毛细血管上皮细胞的腔膜侧均有不同水平的表达。P-gp的底物范围广泛,能将在结构和化学性质上相差很远的多种化合物阻挡在细胞之外。尽管P-gp 在体内不同组织均有分布,不管是通过阻碍吸收还是加速排泄,它的作用均表现为降低底物药物在体内的暴露量[8]。因此,当体内P-gp 的功能被抑制时,药物在组织的分布浓度将提高,相反,当P-gp 的表达被诱导时,药物在组织的分布浓度将降低。典型的P-gp抑制剂包括维拉帕米、环孢素A、红霉素、酮康唑等。MRP2是ABCC 外排转运体家族中的一员,在不同组织中MRP2 均表达于细胞的腔膜侧,将底物从组织向外转运。MRP2 有较宽的内源性和外源性的底物谱,如胆红素的葡糖醛酸结合物、类固醇激素的葡糖醛酸或硫酸结合物、药物的II 相代谢物等[9]。抗肿瘤药物如甲氨蝶呤、长春新碱以及顺铂也能被MRP2 转运。MRP2的抑制剂包括MK571、丙磺舒、吲哚美辛等。因此,本研究选择维拉帕米、环孢素A作为P-gp的特异性抑制剂,选择MK571、丙磺舒作为MRP2的特异性抑制剂,评价小檗碱、巴马汀、药根碱是否经P-gp、MRP2外排进入胆汁。
原代肝细胞来源于肝组织,可表达肝脏药物代谢酶和转运体,被应用于药代动力学的体外研究,如评价经肝药物转运、代谢、毒性及药物相互作用等。虽然原代肝细胞可模拟肝脏的基本功能,然而,不同方式培养的细胞功能和应用却不尽相同。单层贴壁培养的原代肝细胞保持了正常肝细胞的生物学特性,却丧失了细胞原有的极性,且随着培养时间的延长,代谢酶和转运体的表达迅速减少,常用于药效和毒性实验[10]。悬浮培养的肝细胞完整地表达转运体和代谢酶的功能活性,且药物与细胞的接触面积充足,常用于药物的摄取研究[11]。贴壁或悬浮培养的肝细胞会迅速丧失极性,不能形成胆管,难以模拟体内肝脏的胆汁外排功能。
Fig 3 Accumulation and BEI of berberine, palmatine and jateorhizine in SCRH (±s, n=6)
*P<0.05,**P<0.01vscell+bile at the same time
三明治培养是将肝细胞培养于两层胶原之间,底层的鼠尾胶原使肝细胞易于贴壁,上层的Matrigel基质胶使其形成肝板样结构,并维持肝细胞极化状态(包括血管侧膜和胆管侧膜),使肝细胞的生长接近体内生理状况,培养后肝细胞可形成完整的胆小管网络并保持紧密连接,常用于药物的肝胆排泄研究[12]。SCRH与目前常用的Caco-2、MDCK等细胞模型相比,能更好地模拟体内环境,可考察肝脏转运体与肝脏药物代谢酶的作用[13],尤其是用于预测药物的胆汁排泄,具有独特的优势。
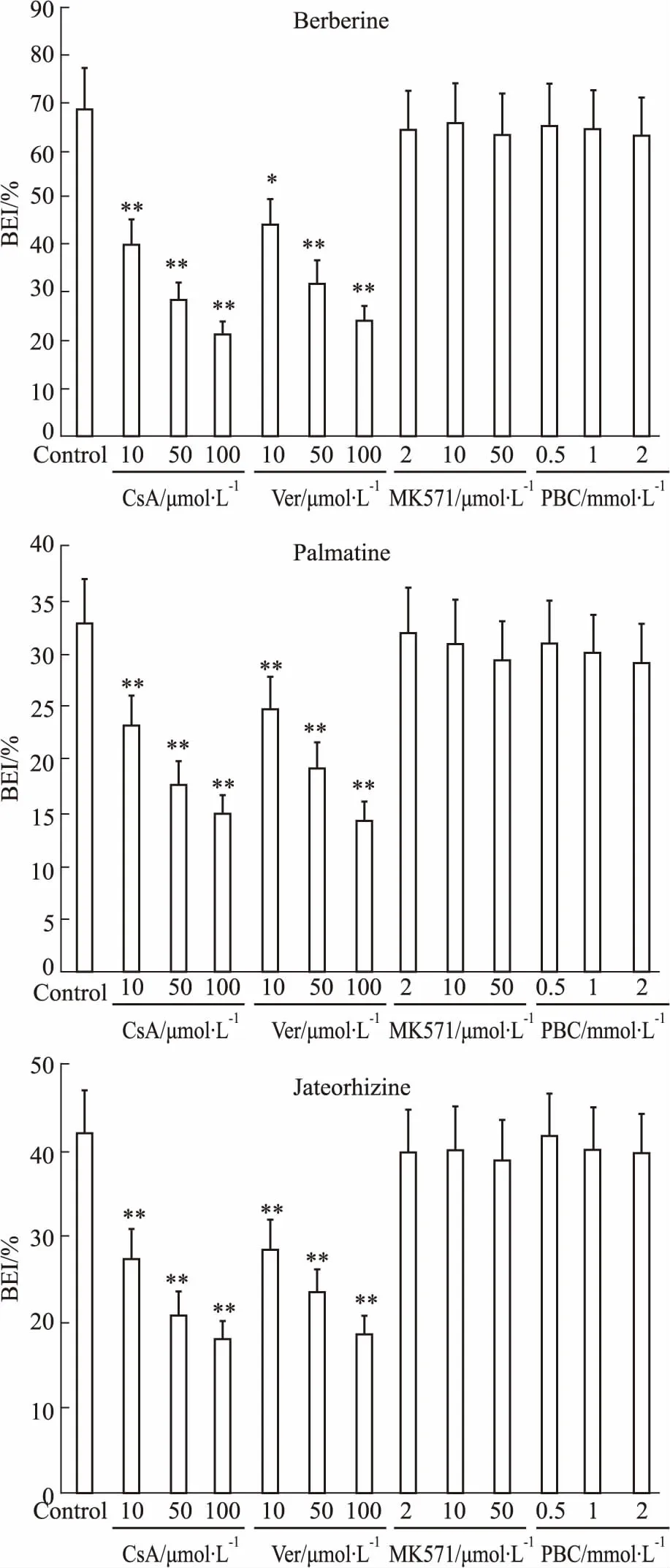
Fig 4 Effect of P-gp and Mrp2 inhibitors on BEI of berberine, palmatine and jateorhizine(±s, n=6)
*P<0.05,**P<0.01vscontrol group
本实验在确证培养至d 4,SCRH细胞模型表达P-gp和Mrp2转运体的基础上,考察含Ca2+或无Ca2+条件下小檗碱、巴马汀、药根碱的药物蓄积量,计算BEI和CLbile。结果表明,肝细胞中的小檗碱、巴马汀、药根碱均经过胆汁排泄;进一步观察P-gp和Mrp2抑制剂对小檗碱、巴马汀和药根碱外排的影响发现,不同浓度的P-gp抑制剂CsA、Ver均能降低小檗碱、巴马汀、药根碱的BEI,且呈浓度依赖性,而Mrp2抑制剂MK571、PBC对小檗碱、巴马汀、药根碱的胆汁排泄均无明显影响,说明P-gp 可能介导了小檗碱、巴马汀、药根碱的胆汁外排,Mrp2未参与小檗碱、巴马汀、药根碱向胆汁的排泄。本实验为研究相关药物的在肝脏的排泄奠定了基础,为进一步分析药物在体内的处置提供了依据。
(致谢: 本实验在河南省中医药研究院中药研究所药理实验室完成,非常感谢实验室各位老师和同学在实验技术上的无私帮助。)
[1] Köck K,Brouwer K L. A perspective on efflux transport proteins in the liver[J].ClinPharmacolTher,2012,92(5):599-612.
[2] 高纯颖,陈 笑,钟大放. 转运体在药物经肝脏清除过程中的作用[J]. 药学学报,2012,47(5):565-72.
[2] Gao C Y, Chen X, Zhong D F. Role of transporters in hepatic drug disposition[J].ActaPharmSin,2012,47(5):565-72.
[3] 梁瑞峰,石 科,刘 雪,等.小檗碱、巴马汀和药根碱在大鼠原代肝细胞中的摄取转运特征[J]. 中国药学杂志,2017,52(14):1251-6.
[3] Liang R F, Shi K, Liu X, et al. Uptake characterizations of berberine, palmatine and jateorhizine in rat primary hepatocytes[J].ChinPharmJ,2017,52(14):1251-6.
[4] Seglen P O. Preparation of isolated rat liver cells[J].MethodsCellBiol,1976,13:29-83.
[5] Mohamed L A,Kaddoumi A.Tacrine sinusoidal uptake and biliary excretion in sandwich-cultured primary rat hepatocytes[J].JPharmPharmSci,2014,17(3):427-38.
[6] Lee J K,Paine M F,Brouwer K L.Sulindac and its metabolites inhibit multiple transport proteins in rat and human hepatocytes[J].JPharmacolExpTher,2010,334(2):410-8.
[7] Giacomini K M, Huang S M, Tweedie D J, et al. Membrane transporters in drug development[J].NatRevDrugDiscov, 2010,9(3):215-36.
[8] 聂 昊,王 晖.P糖蛋白在不同组织中的分布与功能研究进展[J]. 广东药学院学报, 2012,28(4):456-60.
[8] Nie H,Wang H.Advances in the expression and function of p-glycoprotein in different human tissues[J].JGuangdongPharmUniv,2012,28(4):456-60
[9] 牛 璐,金 晶,陈 攀,等.黄芩素对胆汁外排转运体MRP2和BSEP的影响[J]. 中国药理学通报,2015,31(1):147-8.
[9] Niu L,Jin J,Chen P,et al. Effect of baicalein on expression of MRP2 and BSEP in HepG2 cells[J].ChinPharmacolBull, 2015,31(1):147-8.
[10] Shimizu K,Sano T,Kubota R,et al.Effects of the amino acid constituents of microcystin variants on cytotoxicity to primary cultured rat hepatocytes[J].Toxins(Basel), 2013,6(1):168-79.
[11] Shin D H,Park S H,Jeong S W,et al. Hepatic uptake of epirubicin by isolated rat hepatocytes and its biliary excretion after intravenous infusion in rats[J].ArchPharmRes, 2014,37(12):1599-606.
[12] Zeigerer A,Wuttke A,Marsico G,et al. Functional properties of hepatocytesinvitroare correlated with cell polarity maintenance[J].ExpCellRes, 2017,350(1):242-52.
[13] Matsunaga N,Nunoya K,Okada M,et al. Evaluation of hepatic disposition of paroxetine using sandwich-cultured rat and human hepatocytes[J].DrugMetabDispos, 2013,41(4):735-43.
