肝X受体激活对全脑缺血/再灌注小鼠海马神经干细胞增殖及认知功能的影响
2018-01-24陈莉莉杨雪梅谌贝贝承欧梅
陈莉莉,杨雪梅,谌贝贝,承欧梅
(重庆医科大学 1. 附属第一医院神经内科、2. 药理学院,重庆 400016)
全脑缺血引发海马CA1区锥体神经元的大量死亡,常导致认知和记忆功能缺损。成年哺乳动物海马齿状回(dentate gyrus,DG)中的神经干细胞(neural stem cell, NSC)可以产生新生的神经元,并整合到神经网络中,从而改善全脑缺血后小鼠的认知功能[1]。然而,内源性神经发生的NSC数量远远不足,且其存活率也不高,就需要扩大内源性的神经发生。肝X受体(liver X receptor, LXR)是核受体家族成员中重要的一员,有α和β两种亚型。LXRα主要在脂类代谢有关的器官高表达,LXRβ几乎在所有的组织和器官内表达,尤其在脑。研究表明,TO901317能够非选择性地激活LXRα和LXRβ,其激活后能够使LXR的目标基因ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)表达增加。激活后的LXR具有调节脂质代谢、抑制炎症、促进神经保护、促进神经发生的作用[2-3]。神经发生包括NSC的增殖、迁移、分化、存活等诸多复杂的环节,并受到一些分子机制的调控。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)能够促进细胞的增殖、分化、存活等,在神经系统发生、发育过程中有重要的作用,同时在神经系统损伤的情况下具有神经保护与修复的作用[4],且BDNF能够促进内源性NSC的神经发生[5]。而BDNF基因转录的启动是由于细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase, ERK)的磷酸化,从而激活环磷酸腺苷反应原件结合蛋白(cyclic AMP response element binding protein, CREB)而发生。因此,本课题探讨LXR激活对全脑缺血/再灌注(ischemia/reperfusion,I/R)小鼠海马齿状回NSC的增殖与认知功能的影响,其机制是否与激活ERK1/2-CREB-BDNF信号通路有关,从而促进I/R小鼠海马DG区内源性神经发生。
1 材料
1.1试剂TO901317(纯度99%)、5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU,纯度99%)均购自Sigma公司;兔抗BrdU单克隆抗体、兔抗双皮质素(doublecortin,DCX)单克隆抗体、兔抗p-CREB多克隆抗体、兔抗LXRα多克隆抗体、兔抗LXRβ多克隆抗体,均购自美国Abcam公司;兔抗p-ERK1/2、t-ERK1/2、t-CREB多克隆抗体(万类生物公司);兔抗BDNF多克隆抗体(武汉三鹰公司) ;兔抗ABCA1多克隆抗体(美国Immunoway公司);鼠抗β-actin多克隆抗体 (北京博奥森公司)。
1.2仪器Morris水迷宫系统(淮北正华生物仪器设备有限公司);凝胶成像系统(Bio-Rad,美国);全自动酶标仪(Spectra Max M2,美国);光学显微镜(Nikon,日本);激光共聚焦显微镜(Nikon A1+R,日本)。
2 方法
2.1实验动物与分组成年♂ C57BL/6小鼠( SPF级),购自重庆医科大学实验动物中心。75只♂ C57小鼠,体质量(24±2) g,随机分为假手术组(Sham组)、全脑缺血/再灌注组(I/R组)、全脑缺血/再灌注+TO901317组(I/R+TO90组) ,每组25只。其中Morris水迷宫实验各组6只,HE染色各组5只,免疫组化各组5只,免疫荧光各组5只,Western blot检测各组4只。
2.2小鼠双侧颈总动脉夹闭(bilateralcommoncarotidarteryocclusion,BCCAO)模型的制备[6]3.5%水合氯醛进行腹腔注射麻醉后,分离左、右颈总动脉,用动脉夹夹闭双侧颈总动脉20 min,然后取下动脉夹,进行缝合。Sham组不用动脉夹夹闭,只需要对其进行分离。
2.3实验动物的给药将TO901317溶解于二甲基亚砜(dimethyl sulfoxide, DMSO)中,I/R+TO90组造模后24 h采用TO901317腹腔注射,剂量30 mg·kg-1,每天1次,连续14 d。Sham组和I/R组在相同时候给予同体积的DMSO腹腔注射。造模后9~12 d各组小鼠腹腔注射BrdU(50 mg·kg-1),每天1次,持续4 d。
2.4行为学测试[1]各组选择6只小鼠在再灌注后d 28进行Morris水迷宫实验。小鼠在水迷宫的4个象限中游泳,Morris水迷宫直径120 cm、高45 cm,里面有直径10 cm的平台1个,位于水面下1 cm。各象限为小鼠进行Morris水迷宫实验时的入水点,用电脑记录实验数据。训练d 1让小鼠在平台上适应60 s,然后将小鼠放入水中,让其游至平台,60 s内没有找到隐藏平台者,由实验者将该小鼠引导至隐藏平台停留30 s,然后终止该小鼠实验。d 2~5小鼠分别由4个象限沿水池壁入水训练,记录其找到隐藏平台的时间,如果超过60 s则按照60 s计算。d 6移去隐藏在水下的平台,将小鼠放入水中,记录60 s内各小鼠在原平台所在象限内的跨台次数。
2.5HE染色观察组织病理学形态再灌注后7 d,各组选择5只小鼠进行HE染色,染色后,在显微镜下观察各组小鼠海马CA1区神经元的形态结构变化,在400倍显微镜下随机取非重叠视野5个,并对CA1区正常神经元进行计数,计算出每只小鼠海马CA1区400倍视野下正常神经元的个数。
2.6免疫组织化学检测DCX阳性细胞数目各组选择5只小鼠。用免疫组化方法检测海马DG区DCX阳性细胞的表达(DCX标记新生的神经元),按试剂盒说明书逐项操作。DCX阳性细胞呈棕黄色,切片的选择及细胞计数的方法同HE染色,计算每只小鼠海马DG区每个高倍镜视野下的平均DCX阳性细胞数。
2.7BrdU免疫荧光各组选5只小鼠。I/R后14 d,水合氯醛麻醉小鼠后心脏灌注,脑组织用蔗糖溶液进行梯度脱水,后冠状切片厚10 μm。50%甲酰胺65℃修复后加盐酸、硼酸等处理30 min。山羊血清封闭,加BrdU一抗( 1 ∶200,PBS阴性对照),4℃过夜。加二抗37℃ 1 h,DAPI染色5 min,甘油封片。观察海马DG区BrdU阳性细胞。应用Image-pro plus6.0进行图像分析。
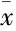
Tab 1 The escape latency and number of crossings in each group (±s, n=6)
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsI/R
2.8Westernblot检测各组选择4只小鼠。I/R后14 d,3.5%水合氯醛麻醉小鼠后断头取脑,在冰上迅速用弯镊分离出小鼠的双侧海马,立刻放在液氮里。经过电泳、电转、封闭等步骤后,加一抗p-ERK1/2(1 ∶300)、t-ERK1/2(1 ∶500)、p-CREB(1 ∶800)、t-CREB(1 ∶1 000)、BDNF(1 ∶1 000)、LXRα(1 ∶300)、LXRβ(1 ∶500)、ABCA1(1 ∶1 000)、β-actin(1 ∶1 000), 4℃孵育过夜。加二抗(1 ∶3 000),显影。用Fusion软件分析。

3 结果
3.1LXR激活对全脑I/R小鼠空间学习记忆能力的影响在d 1~5的定位航行实验中,各组小鼠找到水下平台的时间随着天数的增加均逐渐减少。与Sham组比较,I/R组小鼠找到隐藏平台的时间明显延长(P<0.05,P<0.01);与I/R组比较,I/R+TO90组小鼠找到隐藏平台的时间明显缩短(P<0.01)。在空间探索实验中,Sham组和I/R+TO90组小鼠穿越原平台所在象限的次数均明显高于I/R组(P<0.01)。表明在全脑缺血后,激活LXR能够改善小鼠受损的学习记忆等认知功能,见Tab 1、Fig 1。
Fig 1 Typical trajectories of place navigation test
3.2全脑I/R小鼠海马CA1区病理学变化Fig 2 HE染色可见,Sham组小鼠海马CA1区锥体神经元结构清晰,排列紧密,核圆形,染色清晰,呈深蓝色;而I/R组和I/R+TO90组神经元结构不规则,出现明显核固缩,排列松散,神经细胞数目明显减少(P<0.01)。说明所造模型成功可靠,并且稳定。
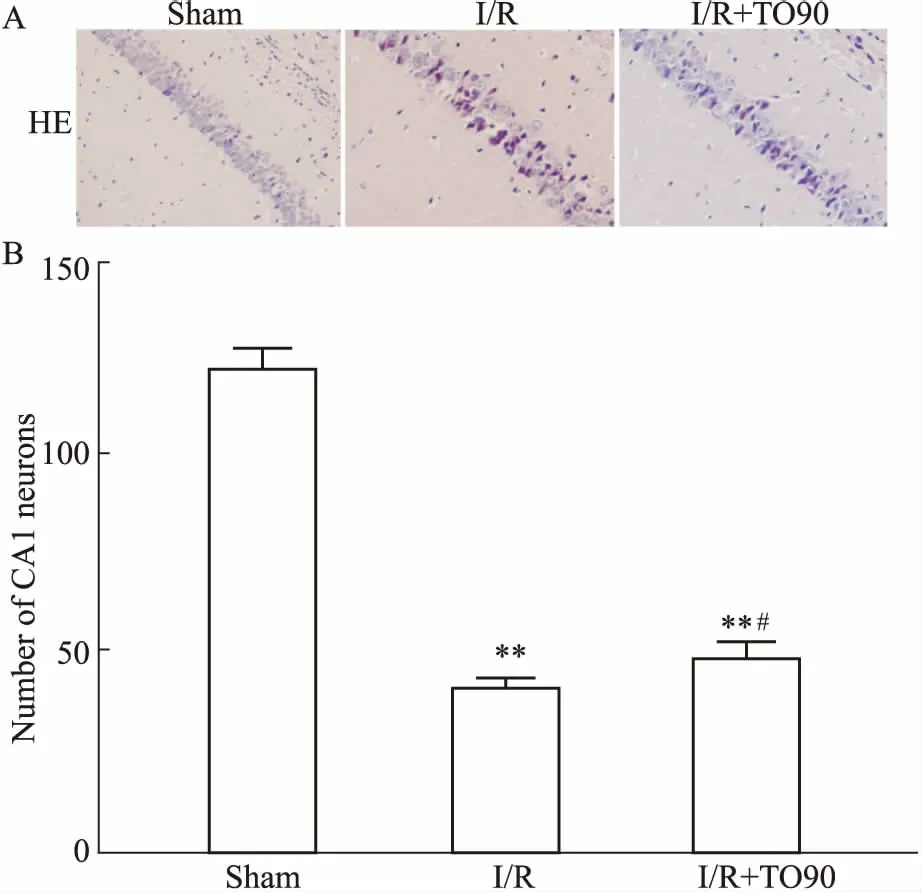
Fig 2 Pathology of hippocampal CA1 region in mice afterI/R 7 days observed by HE staining (× 400)
A: Microphotographs showed the histological changes of CA1 region in hippocampal; B: Histograms showed the numbers of CA1 neurons in hippocampal.**P<0.01vssham group;#P< 0.05vsI/R group
3.3LXR激活对全脑缺血小鼠海马DCX阳性细胞的影响免疫组化检测小鼠海马DCX阳性细胞的表达,如Fig 3A、3B所示,Sham组和I/R组小鼠海马DG区可见少量的DCX阳性细胞;而I/R阳性TO90组小鼠DCX阳性细胞沿海马DG区分布,且较Sham组和I/R组的DCX阳性细胞明显增多(P<0.01)。
3.4LXR激活对全脑缺血小鼠海马BrdU阳性细胞的影响免疫荧光检测小鼠海马BrdU阳性细胞的表达,如Fig 3C、3D所示,Sham组小鼠海马DG区仅见少量的BrdU阳性细胞; I/R组海马DG区较Sham组出现较多BrdU阳性细胞(P<0.01);给予I/R小鼠LXR激动剂TO901317处理后,海马DG区BrdU阳性细胞数明显增多(P<0.01)。
3.5LXR激活对LXRα、LXRβ、ABCA1蛋白表达的影响如Fig 4所示,3组小鼠海马内均有LXRα、LXRβ、ABCA1蛋白的表达,LXRα与LXRβ在3组间没有太大变化,而ABCA1在I/R+TO90组中的表达呈明显上升趋势(P<0.05,P<0.01)。说明非选择性LXR激动剂TO901317引起了LXRα和LXRβ在脑内的激活,使下游基因ABCA1的表达明显增加。
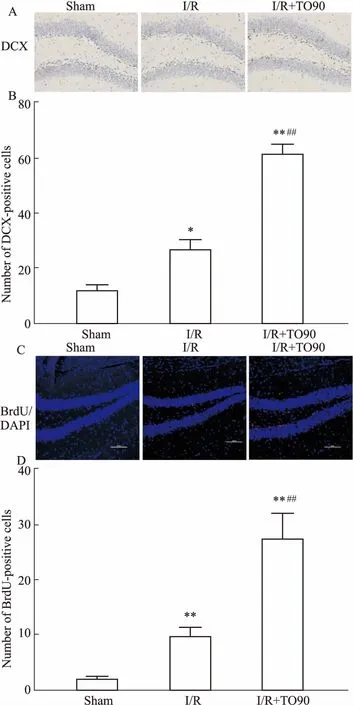
Fig 3 Effect of LXR activation on BrdU+ and DCX+ cellsin hippocampus of mice with global cerebral ischemia (±s, n=5)
A, B: Effect of LXR activation on hippocampal DCX+ cells in mice with global cerebral ischemia (immunohistochemistry, ×400); C,D: Effect of LXR activation on hippocampal BrdU+ cells in global cerebral ischemia mice (immunofluorescence, ×200).*P<0.05,**P<0.01vssham group;##P<0.01vsI/R group
3.6LXR激活对全脑缺血小鼠海马p-ERK1/2、t-ERK1/2、p-CREB、t-CREB、BDNF蛋白表达的影响如Fig 5所示,3组小鼠海马内均有t-ERK1/2和t-CREB蛋白的表达,但各组间无统计学意义。Sham组小鼠海马p-ERK1/2和p-CREB蛋白表达较低,与Sham组相比,I/R组小鼠海马p-ERK1/2和p-CREB蛋白表达水平增加(P<0.05)。与I/R组相比,使用LXR激动剂TO901317干预后,I/R+TO90组p-ERK1/2和p-CREB蛋白表达明显上升(P<0.01)。Sham组小鼠表达少量BDNF蛋白;与Sham组相比,I/R组小鼠海马BDNF蛋白表达水平增加(P<0.01),而I/R+TO90组BDNF蛋白的表达水平较I/R组又进一步增加(P<0.01)。
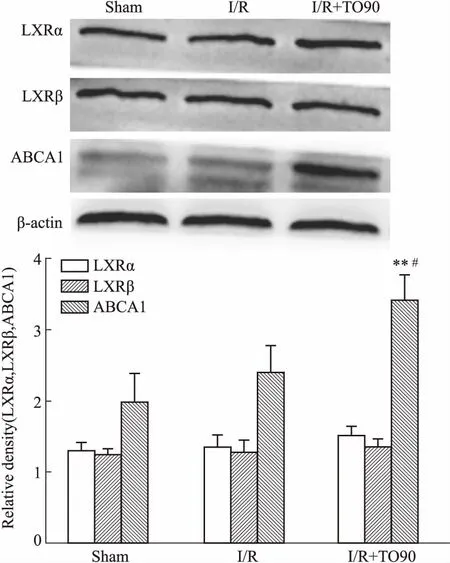
Fig 4 Expression of LXRα, LXRβ and ABCA1 proteinin hippocampus of mice by Western blot (±s, n=4)
**P<0.01vssham group;#P<0.05vsI/R group
4 讨论
全脑I/R模型模拟的是临床上心脏骤停、休克、窒息等疾病发生、发展的病理生理过程。小鼠在经受I/R后,受损的主要是对缺血比较敏感的海马,I/R使海马CA1区锥体神经元大量死亡及海马的功能受损,从而损害了学习记忆能力[7]。神经发生是指NSC在一定条件下增殖、分化、迁移,并且参与神经功能恢复的过程。大量研究证实,成年哺乳动物的神经发生存在于海马DG 和侧脑室室管膜下区( subventricularzone,SVZ)两个区域,从而使认知功能在一定程度上得到改善[8-9]。全脑缺血、睡眠剥夺、运动等能诱导体内NSC增殖分化为神经元,从而整合到已有的神经网络中发挥其生理功能[10-11]。
我们前期研究发现,全脑缺血后即刻腹腔注射LXR激动剂可减少炎症因子的表达,发挥脑保护作用。另有研究发现,LXR配体在斑马鱼体内可以促进神经发育。值得注意的是,每个配体选择性地调节不同的中脑神经元种群的发育[3]。同时,用氧甾醇激活LXR配体,增加了小鼠胚胎干细胞多巴胺(dopamine,DA)神经元的数量,LXR敲除后,胚胎鼠DA神经元的数量明显减少,说明LXR可促进胚胎鼠中脑神经再生[12]。但LXR激活能否促进全脑缺血小鼠DG区NSC增殖,从而改善认知功能,目前未见报道。

Fig 5 Expression of p-ERK1/2, t-ERK1/2, p-CREB, t-CREB, BDNF protein in hippocampus of mice by Western blot (±s, n=4)
*P<0.05,**P<0.01vssham group;##P<0.01vsI/R group
本研究结果表明,在缺血24 h,LXR激活能够促进全脑缺血小鼠海马NSC的增殖,能够使全脑缺血导致的小鼠学习、记忆等认知功能缺损得到改善,上调全脑缺血小鼠海马p-ERK1/2、p-CREB、BDNF等蛋白的表达。
成年海马的神经发生受到一系列机制的调控,其中ERK1/2对细胞的增殖分化有重要作用。ERK1/2磷酸化后的p-ERK对下游转录因子CREB进行调控,而CREB在活化后形成p-CREB,p-CREB能够特异性结合下游的BDNF编码基因的启动子,从而促进BDNF的转录[13-14]。BDNF是一类对神经细胞的增殖、营养、分化等具有重要作用的蛋白质。这种营养因子能协调生物功能,除了它的醛脱氢酶可塑性过程外,还可以通过异源传递的长期作用,促进神经元前体细胞的蛋白质分化、突触形成和神经元生存[15]。本实验结果显示,LXR激活可能通过激活ERK1/2-CREB-BDNF信号通路,上调全脑I/R后小鼠海马BDNF蛋白的表达,促进小鼠海马NSC的增殖。
综上,LXR激活可能通过激活ERK1/2-CREB-BDNF信号通路,使BDNF表达升高,进而促进小鼠齿状回区海马NSC的增殖,使全脑I/R后小鼠的认知功能障碍得到改善。
(致谢:本实验在重庆医科大学附属第一医院实验研究中心完成,感谢实验研究中心各位老师的指导和帮助。)
[1] Tian L, Nie H, Zhang Y, et al. Recombinant human thioredoxin-1 promotes neurogenesis and facilitates cognitive recovery following cerebral ischemia in mice [J].Neuropharmacology, 2014,77(2):453-64.
[2] Wu C H, Chen C C, Lai C Y, et al. Treatment with TO901317, a synthetic liver X receptor agonist, reduces brain damage and attenuates neuroinflammation in experimental intracerebral hemorrhage [J].JNeuroinflammation, 2016,13(1):1-17.
[3] Theofilopoulos S, Wang Y, Kitambi S S, et al. Brain endogenous liver X receptor ligands selectively promote midbrain neurogenesis [J].NatChemBiol, 2013,9(2):126.
[4] 刘 莎, 吴 明, 施兵奇,等. 脐带间充质干细胞通过上调神经营养因子表达改善Aβ损伤大鼠的学习记忆能力[J]. 中国药理学通报, 2016,32(7):980-5.
[4] Liu S, Wu M, Shi B Q, et al. Human umbilical cord mesenchymal stem cells protects against Aβ-induced impairment partly through up-regulation of expression of neurotrophins [J].ChinPharmacolBull, 2016,32(7):980-5.
[5] 严 灿, 刘银伟, 吴丽丽,等. 加味四逆散调控抑郁症大鼠海马BDNF、NR1表达及促进海马DG区神经再生的研究[J]. 中国药理学通报, 2016,32(4):569-74.
[5] Yan C, Liu Y W, Wu L L, et al. Regulatory of Jiaweisinisan on expression of hippocampal BDNF,NR1 and dental gyrus neurogenesis in rats with chronic stressed-depression [J].ChinPharmacolBull, 2016,32(4):569-74.
[6] Tulsulkar J, Shah Z A. Ginkgo biloba prevents transient global ischemia-induced delayed hippocampal neuronal death through antioxidant and anti-inflammatory mechanism [J].NeurochemInt, 2013,62(2):189-97.
[7] Zhang Q, Gao T, Luo Y, et al. Transient focal cerebral ischemia/reperfusion induces early and chronic axonal changes in rats: its importance for the risk of Alzheimer’s disease [J].PLoSOne, 2012,7(3):e33722.
[8] Kee N J,Preston E,Wojtowicz J M. Enhanced neurogenesis after transient global ischemia in the dentate gyrus of the rat [J].ExpBrainRes, 2001,136(3) : 313-20.
[9] Zhang K, Zhou Y, Zhao T, et al. Reduced cerebral oxygen content in the DG and SVZinsitupromotes neurogenesis in the adult rat braininvivo[J].PLoSOne, 2015,10(10):e0140035.
[10] Yoo D Y, Lee K Y, Park J H, et al. Glucose metabolism and neurogenesis in the gerbil hippocampus after transient forebrain ischemia [J].NeuralRegenRes, 2016,11(8):1254-9.
[11] Cheng O, Li R, Zhao L, et al. Short-term sleep deprivation stimulates hippocampal neurogenesis in rats following global cerebral ischemia/reperfusion [J].PLoSOne, 2014,10(6):e0125877.
[12] Sacchetti P, Sousa K M, Hall A C, et al. Liver X receptors and oxysterols promote ventral midbrain neurogenesisinvivoand in human embryonic stem cells [J].CellStemCell, 2009,5(4):409.
[13] Hu J F, Niu F, Ning N, et al. Activation of ERK1/2-CREB pathway during potentiating synaptic transmission of (-) clausenamide in rat dentate gyrus [J].JAsianNatProdRes, 2012,14(3):256-62.
[14] Alhaider I A, Aleisa A M, Tran T T, et al. Sleep deprivation prevents stimulation-induced increases of levels of p-CREB and BDNF: protection by caffeine [J].MolCellNeurosci, 2011,46(4):742-51.
[15] Leal G, Afonso P M, Salazar I L, et al. Regulation of hippocampal synaptic plasticity by BDNF [J].BrainRes, 2015,16(21):82.
