孕期咖啡因暴露所致雌性子代胎鼠肾脏宫内发育迟缓及其发生机制
2018-01-24孙朝霞胡霜霜
万 阳,敖 英,3,李 斌,熊 颖,孙朝霞,胡霜霜,汪 晖,3
(武汉大学 1. 基础医学院药理学系、2. 中南医院骨科、3. 发育源性疾病湖北省重点实验室,湖北 武汉 430071)
流行病学资料显示,多种肾脏疾病(如高血压、慢性肾病等)均存在着宫内发育起源,不良宫内环境可致子代成年后相关疾病的易感性增加[1]。大量的动物实验和临床研究也证实,宫内发育迟缓(intrauterine growth retardation, IUGR)可致胚胎肾脏发育不良,肾单位数量低于正常,出生后肾小球代偿性肥大和超滤过,并进一步导致肾小球硬化,出现高血压和肾损害的临床表现[2]。可见,胎肾发育不良是多种胎源性肾病的共同病理生理学基础。
IUGR的发生除了先天遗传因素外,很大程度上是因为孕中、晚期宫内环境欠佳所致,其中,孕期母体摄入咖啡因是确切的诱因之一。咖啡因存在于多种软饮料(如咖啡、可乐)中,并倍受人们喜爱,我国咖啡因的消耗量也在逐年增加。流行病学研究表明,孕妇每天咖啡因摄入量大于150 mg(2.5 mg·kg-1)就会导致IUGR,且摄入咖啡因的孕妇,其流产率可提高1倍多[3]。本课题组前期研究也证实,孕期咖啡因暴露(prenatal caffeine exposure, PCE)可导致胎鼠IUGR发生[4]。然而,PCE所致宫内胎肾发育不良的机制尚不明确。本研究首先在本室前期稳定建立的PCE所致大鼠IUGR模型上证实PCE胎鼠存在肾脏发育不良,进一步在细胞水平通过观察皮质酮(corticosterone, CORT)对后肾间充质细胞发育的影响以探究其发生机制,以期为证实孕期不良环境所致IUGR子代肾脏疾病易感性增加提供实验依据。
1 材料与方法
1.1试剂与仪器咖啡因(分析纯级别)购自美国 Sigma公司;乙醚购自上海恒远生物科技有限公司;大鼠CORT的酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒购于美国R&D公司;A型胶原酶由瑞士Roche公司生产;DMEM/F12培养基、胎牛血清、胰酶均由美国Gibco公司生产;引物由上海生工生物工程技术有限公司合成;逆转录和实时荧光定量PCR试剂盒由大连TaKaRa公司提供。ND2000C紫外分光光度计和低温高速离心机均购于美国Thermo公司;显微镜购于日本Nikon公司;实时定量PCR仪购于美国Applied Biosystems公司。
1.2实验动物及细胞处理SPF级健康♂[体质量(280±20)g]及♀[体质量(200±20)g]Wistar大鼠,由湖北省疾病预防控制中心提供,许可证号:SCXK(鄂)2009-2011。适应性喂养1周后,每晚6时按♀ ∶♂=2 ∶1合笼,次晨观察雌鼠阴栓或阴道涂片镜检,查到阴栓或精子之日为受孕0 d(gestation day, GD0)。每日上午9时检查孕鼠生仔情况,若生仔记为生后d 0(PD0)。GD9-GD20每天经口灌胃给予不同剂量咖啡因(30、120 mg·kg-1),对照组灌胃给予等容量蒸馏水,直至自然生产。在GD20,采用乙醚吸入的方式全身麻醉部分孕鼠,待翻正反射消失后迅速处死。将子代胎崽数为8~14个且♂♀比接近1的孕鼠纳入最终研究,收集它们各自的♀胎鼠。IUGR诊断依据为胎鼠体质量低于对照组胎鼠体质量平均值的2个标准差,IUGR率的计算是依据每窝IUGR胎鼠数比上该窝的总胎崽数。随机选择每一窝的♀胎鼠进行后续实验研究,收集大动脉血液,在4°C高速离心机下17 205×g离心15 min,留取上清液储存于-80 ℃冰箱,以测血CORT浓度,随机选取部分左侧胎肾固定于体积分数为0.04的中性甲醛固定液,待做形态学分析。右侧胎肾迅速用液氮冷冻,并储存于-80℃冰箱待进一步实验分析。
细胞实验:参照文献分离GD13.5原代后肾间充质细胞[5],选择SPF级健康的孕13 d ♀ Wistar大鼠,由湖北省疾病预防控制中心提供,许可证号:SCXK(鄂)2015-0018。乙醚麻醉处死孕鼠,并经过体积分数为0.75的乙醇溶液进行灭菌,用无菌手术器械取出胚胎,并进入超净工作台中取出胎肾,置入加有PBS的培养皿中进行多次漂洗,用眼科剪剪碎胎肾,用0.2%的A型胶原酶消化约15 min得到原代后肾间充质细胞的悬液,经过细胞筛过滤后,离心机1 000×g离心5 min,洗涤细胞并去掉上清,得到原代后肾间充质细胞,按1×108·L-1的浓度接种在6孔板中,待细胞贴壁生长后,给予含10%胎牛血清的DMEM/F12培养基培养,并给予不同浓度CORT(250、500、1 000 μg·L-1)处理,24 h后收取细胞,运用实时定量PCR技术检测相关基因的表达变化。
1.3血清CORT浓度的测定按照ELISA试剂盒说明书检测血清CORT浓度,其中试剂盒可检测到的最低CORT浓度为0.39 μg·L-1,其批间和批内变异系数分别为5.0%和7.2%。
1.4病理学检查胎鼠实验中,每组随机选取3只胎鼠,取左侧肾脏,沿长轴纵向剖开,体积分数为0.04的中性甲醛固定液固定,石蜡包埋,4 μm厚连续切片,苏木精-伊红(hematoxylin and eosin, HE)染色,在光学显微镜下观察肾脏形态学改变。对于每张切片,选取肾门正对区域,400倍光镜下拍照。
1.5实时定量PCR检测按照 RNA-Solv Reagent使用说明书提取胎肾和细胞总RNA。测定A260和A280,计算RNA的浓度及纯度,调整RNA浓度至1 g·L-1。cDNA合成和PCR扩增均按试剂盒说明进行。检测胎肾和细胞肾素血管紧张素系统(renin-angiotensin system, RAS)组分中血管紧张素转换酶(angiotensin converting enzyme,ACE)、血管紧张素Ⅱ1型受体(angiotensin Ⅱ receptor type 1, AT1R)、血管紧张素Ⅱ2型受体(angiotensin Ⅱ receptor type 2, AT2R)、胶质源性神经营养因子(glial-cell-line-derived neurotrophic factor, GDNF)/c-Ret 受体酪氨酸激酶(c-Ret tyrosine kinase receptor,c-Ret)通路、配对盒基因(paired box gene 2,Pax2)、Spry1以及内参基因GAPDH的mRNA表达。各指标引物及扩增条件见Tab 1。扩增产物回收按试剂盒说明进行。将回收产物以10倍梯度稀释成一系列浓度,根据预实验结果,选取至少5个梯度浓度为标准品,与样品一起在实时定量PCR仪(RG-3000 Rotor-Gene)上进行PCR扩增;以标准品的相对浓度为横坐标,测得各自的Ct值为纵坐标作图,即得标准曲线。根据样品Ct值在各自标准曲线上得到样品的相对浓度,以GAPDH作为内对照,计算各指标与GAPDH浓度比作为其mRNA表达的相对水平。每个样品针对GAPDH mRNA含量进行标准化。


Tab 1 Oligonucleotide primers and PCR conditions of rat in quantitative real-time PCR
2 结果
2.1PCE对胎鼠肾脏形态与功能发育的影响首先,我们观察了宫内时期GD20 ♀胎鼠的肾脏发育。如Fig 1A所示,HE染色400倍光镜下可见,对照组胎肾生肾区肾小球结构正常,而PCE(120 mg·kg-1)组胎肾肾小球球囊空虚,鲍曼囊腔变大,肾小球毛细血管网发育不良。Fig 1B-1E的qPCR结果显示,与对照组相比,PCE(30、120 mg·kg-1)组胎肾发育基因Pax2、GDNF、c-Ret、PI3K的mRNA表达均呈剂量依赖性降低(P<0.05,P<0.01)。提示PCE可导致胎肾发育不良,与胎肾GDNF/c-Ret 信号通路低表达有关。
2.2PCE对胎鼠血CORT浓度和肾脏局部RAS组分的影响为了探讨血CORT和肾脏组织RAS是否参与PCE所致的胎肾发育不良,我们检测了胎血CORT浓度、胎肾局部RAS组分(ACE、AT1R、AT2R)的表达。如Fig 2A所示,与对照组相比,PCE(30 mg·kg-1)组的胎血CORT浓度无明显变化,而PCE(120 mg·kg-1)组升高(P<0.05)。Fig 2B~2D的qPCR结果显示,与对照组相比,PCE(30、120 mg·kg-1)组胎肾ACE、AT1R、AT2R的mRNA表达均呈剂量依赖性降低(P<0.05,P<0.01)。提示PCE可升高胎血CORT含量,并使胎肾AT1R、AT2R的表达抑制。
2.3皮质酮对原代后肾间充质细胞GDNF/c-Ret信号通路的影响为了探究PCE所致胎肾发育不良的具体机制,我们在细胞水平观察了CORT对原代后肾间充质细胞相关基因的表达影响。基于Fig 2A中的血清CORT浓度,我们细胞实验中选择的浓度分别为250、500、1 000 μg·L-1。如Fig 3所示,与对照组相比, CORT(250、500、1 000 μg·L-1)处理细胞24 h,GDNF/c-Ret信号通路Pax2、GDNF、c-Ret表达呈不同程度的降低 (P<0.05,P<0.01)。而与对照组相比,CORT(250、500、1 000 μg·L-1)处理细胞24 h,GDNF/c-Ret信号通路抑制基因Spry1的表达呈不同程度的升高(P<0.01)。提示CORT可使原代后肾间充质细胞的GDNF/c-Ret信号通路的表达抑制。
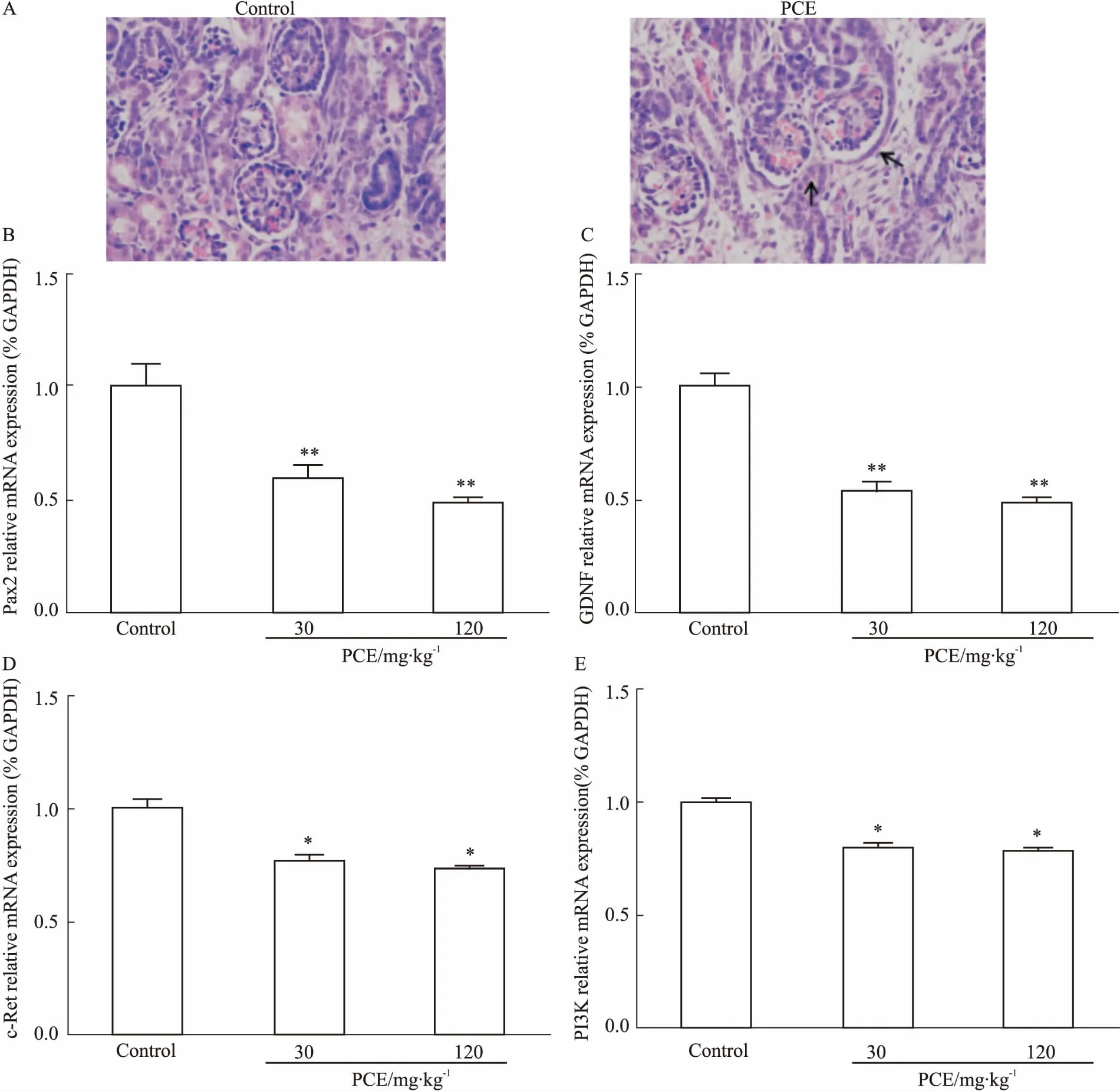
Fig 1 Effects of prenatal caffeine exposure (PCE) onfetal kidney development and GDNF/c-Ret pathway-related genes in female fetal rats(±s, n=5~7)
A: Kidney sections were stained with HE (×400); B: Pax2 mRNA expression; C: GDNF mRNA expression; D: c-Ret mRNA expression; E: PI3K mRNA expression.*P<0.05,**P<0.01vscontrol.
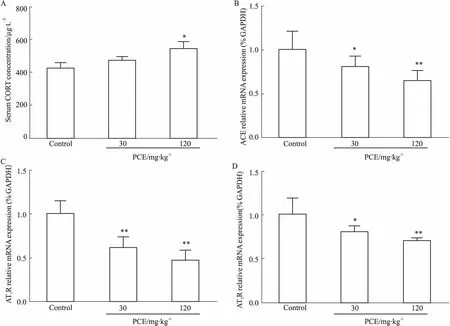
Fig 2 Effects of PCE on serum corticosterone (CORT) concentration andrenal renin-angiotensin system-related genes in female fetal rats(±s, n=5~8)
A: Serum CORT concentration; B: ACE mRNA expression; C: AT1R mRNA expression; D: AT2R mRNA expression.*P<0.05,**P<0.01vscontrol.
2.4皮质酮对原代后肾间充质细胞RAS组分的影响我们进一步检测CORT对原代后肾间充质细胞RAS组分的影响。如Fig 4所示,与对照组相比,CORT(250、500、1 000 μg·L-1)处理细胞24 h后,RAS组分(ACE、AT1R、AT2R)表达呈不同程度的降低 (P<0.05,P<0.01)。提示CORT可使原代后肾间充质细胞的AT1R、AT2R的表达抑制。
3 讨论
本室前期研究发现,孕期尼古丁暴露可导致IUGR胎鼠肾脏发育不良,且成年后肾小球硬化的易感性增加[6]。因此,为了研究PCE所致IUGR仔鼠胎肾发育不良的机制,我们首先观察了胎肾发育的变化。病理学检查发现,PCE(120 mg·kg-1)组胎肾肾小球囊腔间隙加大,肾小球毛细血管网发育不良。提示PCE可导致胎肾发育不良,这可能是成年后肾小球硬化的宫内发育起源。
已知GDNF/c-Ret信号通路是后肾发育的主要诱导者。后肾间充质细胞分泌GDNF,该因子与肾导管上皮细胞中表达的c-Ret酪氨酸激酶受体和GFRα1受体结合,激活PI3K/Akt、MAPK、PLCγ等下游信号通路,诱导输尿管芽的分支[7]。同时,GDNF/ c-Ret信号通路还受到多种上游信号分子的调节,其中,Spry1能抑制该信号通路的活性,而Pax2能激活GDNF信号通路[8]。本研究中,PCE(30、120 mg·kg-1)组胎肾Pax2、GDNF、c-Ret、PI3K的mRNA表达水平均降低,提示PCE可抑制Pax2/GDNF/c-Ret/PI3K信号通路,可能是其抑制胎肾发育的机制之一。文献证实,肾单位的减少与肾内RAS组分表达的改变有关[9]。在胎儿发育过程中,RAS 的主要活性物质Ang Ⅱ能在肾脏局部表达[10]。其生理作用的发挥主要是通过其受体实现的,Ang II与AT1R结合后,可活化EGF、RTK、c-Ret 等RTK蛋白,继而激活GDNF/c-Ret通路下游PI3K通路;而与AT2R的结合可促进GDNF/c-Ret通路上游基因Pax2的表达,从而激活GDNF/c-Ret通路[11]。可见,AT1R和AT2R对胎肾发育均有促进作用,但作用环节不同。在本研究中,我们发现PCE(30、120 mg·kg-1)组♀胎肾AT1R和AT2R的mRNA表达水平降低。这些结果提示,PCE可能通过抑制♀胎鼠肾脏局部ATRs及GDNF/c-Ret信号通路相关基因的表达,从而抑制肾单位的发育,造成胎肾发育不良。
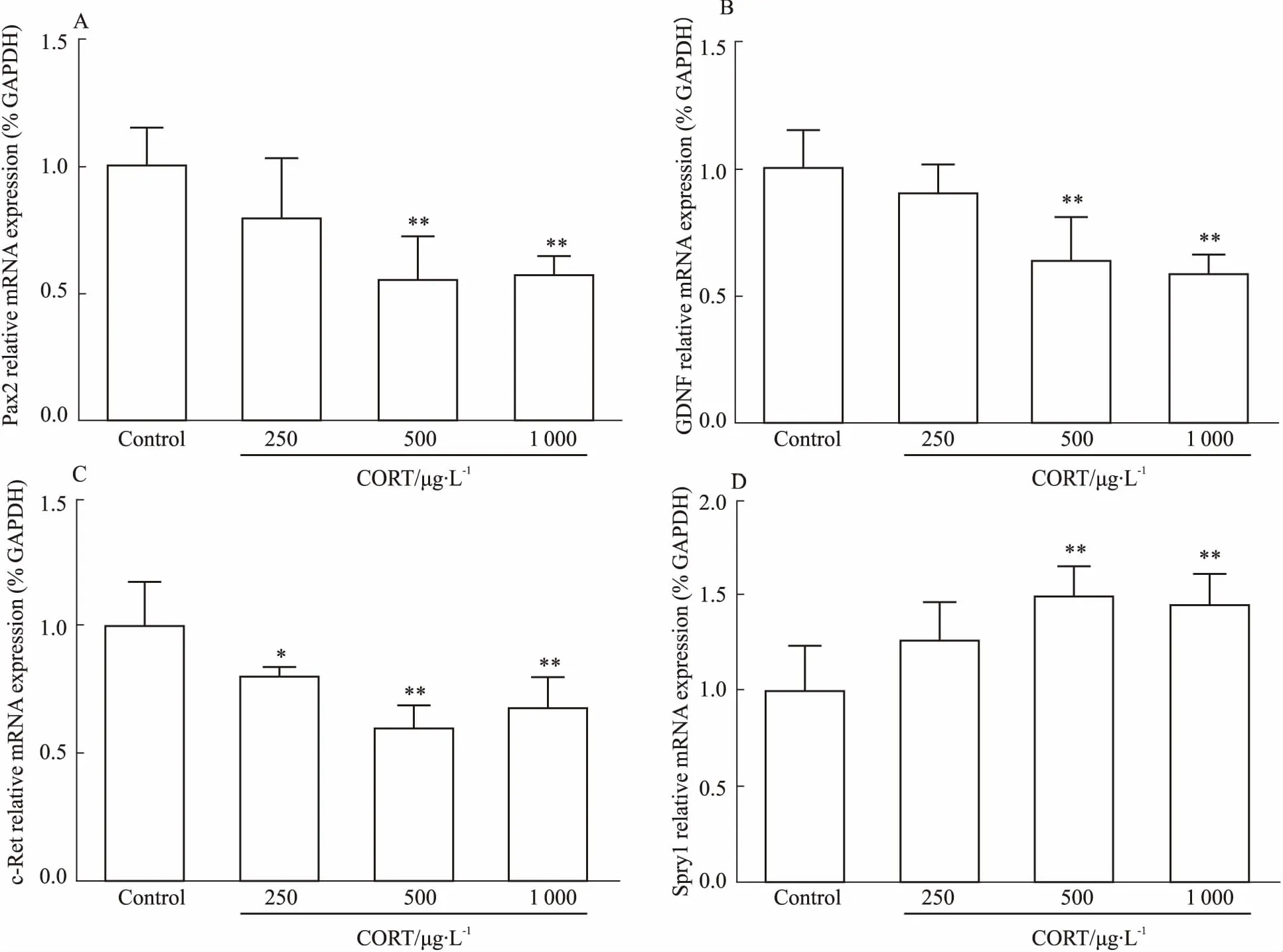
Fig 3 Effects of CORT on GDNF/c-Ret pathway-related genes in metanephric mesenchyme stem cells(±s, n=5)
A: Pax2 mRNA expression; B: GDNF mRNA expression; C: c-Ret mRNA expression; D: Spry1 mRNA expression.*P<0.05,**P<0.01vscontrol.
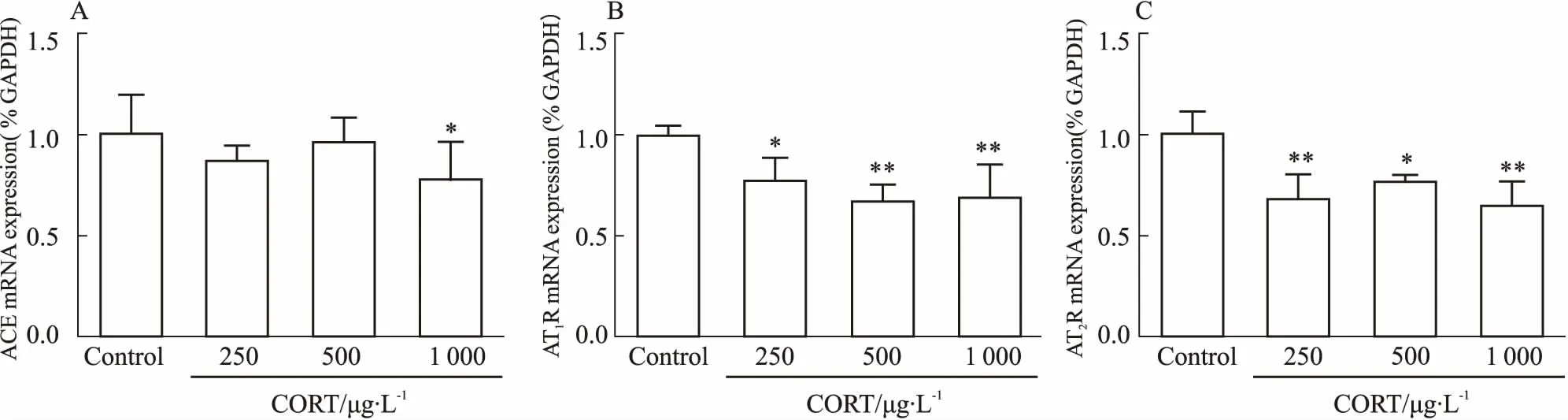
Fig 4 Effects of CORT on renin-angiotensin system-related genes in metanephric mesenchyme stem cells(±s, n=5)
A: ACE mRNA expression; B: AT1R mRNA expression; C: AT2R mRNA expression.*P<0.05,**P<0.01vscontrol.
本实验室前期研究发现,PCE可引起子代IUGR及多脏器发育不良,其发生与PCE所致胎盘糖皮质激素(glucocorticoid, GC)屏障开放,导致母源性GC过暴露有关[12]。文献报道,宫内时期高GC水平是胎儿疾病编程的主要始动因素,高GC通过调控胎儿一系列神经内分泌代谢过程,引起胚胎组织结构和功能的持续性改变[13-14]。本研究中,PCE(120 mg·kg-1)组♀胎鼠血CORT浓度也明显升高;另有研究则认为,GC过暴露可以负向调节胎儿肾内RAS组分的表达[15]。提示PCE胎鼠肾脏局部ATR的低表达可能与宫内高CORT有关。因此,为了探究其具体机制,我们进一步使用外源性CORT处理原代后肾间充质细胞。结果发现,不同浓度外源性CORT处理可使后肾间充质细胞AT1R、AT2R、Pax2、GDNF、c-Ret的mRNA表达水平均降低,而Spry1表达则有不同程度升高。综合上述,我们证实,高CORT可通过抑制肾脏组织中AT1R/AT2R及GDNF/c-Ret信号通路的表达,进而导致胎肾发育不良。
综上,我们在证实PCE所致胎肾发育不良的基础上,提出了高血CORT可能介导PCE所致♀子代胎肾发育不良的机制。我们认为,PCE所致高血CORT可抑制胎肾AT1R/AT2R及GDNF/c-Ret信号通路的表达,导致胎肾发育不良。本研究结果为了解PCE的肾脏发育毒性并阐明其毒性机制,提供了实验和理论依据。
(致谢:本实验主要在武汉大学基础医学院药理学系汪晖实验室完成,感谢李宁、钟卫华饲养动物。)
[1] Boubred F, Saint-Faust M, Buffat C, et al. Developmental origins of chronic renal disease: an integrative hypothesis[J].IntJNephrol, 2013,2013: 346067.
[2] Brenner B M, Garcia D L, Anderson S. Glomeruli and blood pressure. Less of one, more the other[J]?AmJHyperten, 1988,1(4 Pt 1): 335-47.
[3] Fernandes O, Sabharwal M, Smiley T, et al. Moderate to heavy caffeine consumption during pregnancy and relationship to spontaneous abortion and abnormal fetal growth: a meta-analysis[J].ReprodToxicol, 1998,12(4): 435-44.
[4] Xu D, Wu Y, Liu F, et al. A hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic programmed alteration in offspring rats of IUGR induced by prenatal caffeine ingestion[J].ToxicolApplPharmacol, 2012,264(3): 395-403.
[5] Tanigawa S, Sharma N, Hall M D, et al. Preferential propagation of competent SIX2+ nephronic progenitors by LIF/ROCKi treatment of the metanephric mesenchyme[J].StemCellRep, 2015,5(3): 435-47.
[6] Sun Z X, Hu S S, Zuo N, et al. Prenatal nicotine exposure induced GDNF/c-Ret pathway repression-related fetal renal dysplasia and adult glomerulosclerosis in male offspring[J].ToxicolRes, 2015,4:1045-58.
[7] Song R, Spera M, Garrett C, et al. Angiotensin II-induced activation of c-Ret signaling is critical in ureteric bud branching morphogenesis[J].MechDev, 2010,127(1): 21-7.
[8] Clarke J C, Patel S R, Raymond R M Jr, et al. Regulation of c-Ret in the developing kidney is responsive to Pax2 gene dosage[J].HumMolGenet, 2006,15(23): 3420-8.
[9] Gilbert J S, Nijland M J. Sex differences in the developmental origins of hypertension and cardiorenal disease[J].AmJPhysiolRegulIntegrCompPhysiol, 2008,295(6): R1941-52.
[10] 高 峰, 张 涛, 王晓梅,等. 血管紧张素Ⅱ对足细胞Notch通路及Nephrin表达的影响[J]. 中国药理学通报, 2015,31(2):247-50.
[10] Gao F, Zhang T, Wang X M, et al. Effect of angiotensin Ⅱ on expression of Notch pathway and Nephrin in podocyte [J].ChinPharmacolBull, 2015,31(2): 247-50.
[11] Yosypiv I V. Renin-angiotensin system in ureteric bud branching morphogenesis: implications for kidney disease[J].PediatrNephrol, 2014,29(4): 609-20.
[12] Xu D, Zhang B, Liang G, et al. Caffeine-induced activated glucocorticoid metabolism in the hippocampus causes hypothalamic-pituitary-adrenal axis inhibition in fetal rats[J].PLoSOne, 2012,7(9): e44497.
[13] Moisiadis V G, Matthews S G. Glucocorticoids and fetal programming part 1: outcomes[J].NatRevEndocrinol, 2014,10(7): 391-402.
[14] Moisiadis V G, Matthews S G. Glucocorticoids and fetal programming part 2: mechanisms[J].NatRevEndocrinol, 2014,10(7): 403-11.
[15] Zandi-Nejad K, Luyckx V A, Brenner B M. Adult hypertension and kidney disease: the role of fetal programming[J].Hypertension, 2006,47(3): 502-8.