靶向DNA损伤反应途径:PARP抑制剂抗肿瘤治疗研究进展
2018-01-24郑宇静左彤彤封宇飞
郑宇静,左彤彤,封宇飞
(1. 北京医院药学部,国家老年医学中心,北京 100730;2. 上海交通大学医学院附属新华医院小儿神经外科,上海 200092)
在生命过程中,机体细胞中的DNA每天都会受到多种体内因素和体外环境的影响,导致DNA损伤。正常情况下,这些损伤可以通过细胞内的多种DNA修复途径来完成,从而维护正常细胞的增殖和凋亡。细胞内DNA损伤反应 (DNA damage response, DDR) 通路是复杂的蛋白网络系统,是维护基因组完整性的重要途径。细胞内DDR缺陷可引起多种疾病,如肿瘤、神经退行性疾病、免疫缺陷等[1-3]。肿瘤细胞一个重要的特征就是基因组不稳定性,主要表现为染色体数目和(或)结构的改变,以及微卫星不稳定性(microsatellite instability, MIN),因此,DDR已经成为肿瘤药物开发的一个重要途径。目前,针对DDR及其相关的信号通路而开发的药物主要有聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase, PARP)抑制剂、共济失调毛细血管扩张突变/共济失调性毛细血管扩张症与Rad3相关蛋白(ataxia-telangiectasia mutated/ataxia telangiectasia and Rad3 related protein, ATM/ATR)激酶抑制剂、DNA-依赖蛋白激酶(DNA-dependent protein kinase catalytic subunit, DNA-PKcs)抑制剂、检查点激酶(Chk1/2)抑制剂、细胞周期素依赖激酶(cyclin-dependent kinase, CDK)抑制剂以及DNA甲基转移酶(O6-methylguanine DNA methyltransferase, MGMT)抑制剂等[4-5],见Tab 1。这些靶向抑制剂一般作用于蛋白激酶或者利用协同致死现象选择性地杀伤肿瘤细胞[6]。在DDR通路抑制剂中,PARP抑制剂是目前研究最广泛的DDR抑制剂。迄今为止,FDA已经批准奥拉帕尼(olaparib)、瑞卡帕尼(rucaparib)和尼拉帕尼(niraparib)用于卵巢癌和(或)乳腺癌的晚期临床治疗。本文主要对PPAR抑制剂进行综述。
1 PARP抑制剂作用机制
1.1DNA损伤修复和协同致死基因组DNA在受到内、外环境因素影响时,可能导致DNA损伤。DNA损伤的类型大致可以分为碱基损伤、DNA交联、单链断裂(single-strand breaks, SSBs)、双链断裂(double-strand breaks, DSBs)、碱基错配等。为了维护基因组的稳定性,在长期的进化过程中,细胞内已经形成了复杂的DNA损伤修复机制。参与DNA修复的途径主要有单链损伤修复 (single-strand break repair, SSBR)和双链损伤修复(double-strand break repair, DSBR)。这些修复的机制主要有同源重组(homologous recombination, HR)、非同源末端连接(non-homologous end joining, NHEJ)、碱基切除修复(base excision repair, BER)、核苷酸切除修复(nucleotide excision repair, NER)、错配修复(mismatch repair, MMR)和跨损伤合成[7]。HR和NHEJ途径一般参与DSB损伤修复,而BER和MMR一般参与SSB修复。HR损伤修复途径是高度保守的无错修复,因此,是修复DSB损伤的最佳途径。NHEJ修复途径是易错修复,有可能导致基因组不稳定性。BER是DNA 单链损伤修复的主要途径,通过PARP酶可以感知DNA损伤,招募其他修复因子到DNA损伤处[8]。
协同致死现象最初是在研究果蝇和秀丽隐杆线虫经典的基因的过程中发现的,协同致死是指当两个非致死性突变基因单独发生时不会导致细胞死亡,而同时发生时可引起细胞凋亡的现象。PARP抑制剂治疗具有乳腺癌易感基因(breast cancer susceptibility gene, BRCA)突变的恶性肿瘤,就是成功利用协同致死概念而开发的新型靶向药物。临床前研究发现,具有BRCA1和BRCA2突变的双链DNA修复异常的细胞,会增强PARP抑制剂诱导的单链DNA修复缺陷现象。在HR缺陷的细胞中,使用PARP抑制剂诱导BER通路受损,导致细胞死亡。这种PARP抑制剂的细胞毒性可能有两种机制:一种机制是抑制PARP酶的活性结构域,阻止聚腺苷二磷酸核糖基化;另一种机制是在DNA损伤处捕获PARP。PARP1或PARP2在DNA上捕获被认为是导致细胞凋亡及与传统的细胞毒性药物(如拓扑异构酶抑制剂、DNA烷化剂)及交联剂(如铂类)产生协同作用的药理机制。

Tab 1 Selective small-molecule inhibitors targeting DNA damage response pathway
1.2PARP的生物学功能在哺乳动物细胞内,PARP酶家族至少包括17个成员,然而,只有 PARP1、 PARP2和PARP3参与DNA损伤修复活动。其中,PARP1酶参与细胞内85%以上的PARP酶活动,PARP3与PARP1形成异构二聚体参与DDR反应。PARP1和(或)PARP2参与DNA单链损伤修复,PARP1也参与DNA双链损伤修复[9]。PARP1和PARP2功能有部分重叠,但对底物选择性有差异。PARP3在DNA双链损伤修复中起招募修复蛋白和DSB末端连接复合物的支架作用。PARP 是DDR通路的重要DNA断裂分子感受器,在DNA损伤后被激活,PARP可以感受DNA单链损伤缺口,并结合到DNA断裂部位,结合PARP酶后的催化活性增强500倍以上。PARP通过自身的糖基化来催化烟酰胺腺嘌呤二核苷酸(NAD+)分解为烟酰胺和ADP核糖,再以ADP核糖为底物,使受体蛋白以及PARP1自身发生“PAR化”,形成PARP-ADP核糖支链[poly(ADP-ribose) polymer, pADPr]。这样一方面可以阻止损伤部位周围的DNA分子与损伤的DNA进行重组,同时吸引DNA修复蛋白、组蛋白H1和一系列转录因子结合在DNA损伤处;另一方面,可以降低PARP1与DNA的亲和性,使PARP1从DNA断裂处解离,然后DNA修复蛋白与DNA缺口结合,对损伤部位进行修复。而PARP1的“PAR化”会被其他酶清除,使得PARP1恢复活性[10]。
1.3BRCA1/2与DNA修复BRCA1/2是肿瘤抑制基因,BRCA1定位于人类17号染色体q21,以常染色体显性遗传方式遗传,BRCA2基因定位于13号染色体q12。BRCA1和BRCA2蛋白与HR、DNA损伤修复、胚胎生长、转录调控等均有关,尤以两者在DNA损伤修复、同源重组和转录调控中的功能最为明显和重要,其基因突变表型具有诱发乳腺癌和卵巢癌的倾向。BRCA1/2突变携带者一生中发生乳腺癌和卵巢癌的概率分别为50%~80% 和30%~50%。BRCA1/2在维持细胞基因组完整性中起着重要作用,BRCA1蛋白连接DNA损伤感受器和效应器蛋白,其与肿瘤抑制蛋白、DNA修复蛋白和细胞周期调节蛋白相互作用,参与DNA损伤修复和检查点调节。BRCA1具有多种功能,直接参与HR介导的DSB修复,BRCA1与abaxas和RAP80形成复合物,感知DNA损伤,与MRN (MRE11-RAD50-NBS1)复合物一起感知和切除DSB,与PALB2和BRCA2形成复合物介导RAD51依赖的同源重组。BRCA2主要功能是参与DNA损伤修复。BRCA2可招募重组酶RAD51、BRCA2蛋白与Rad51蛋白的相互结合,在双链DNA的损伤修复中起着重要作用,其共同定位于双链DNA断裂处,BRCA2缺陷的细胞不能招募RAD51到DNA损伤处,因此,不能通过HR修复损伤的DNA。BRCA2蛋白8个连续的BRC模序是其与RAD51蛋白因子相互结合的位点。BRCA2蛋白的DNA结合域可以结合单链DNA和双链DNA。另外,BRCA2还能保护修复过程中的DNA复制叉,防止复制叉崩塌。BRCA1/2突变的细胞存在DNA损伤修复缺陷,当细胞PARP活性受到抑制时,细胞不能通过HR修复双链损伤的DNA,而通过另外一种易错修复途径修复损伤的DNA,从而导致染色体组不稳定性,细胞周期抑制和细胞凋亡。
2 PARP 抑制剂
目前研究开发的PARP抑制剂大多数是可逆的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)类似物,以NAD+中的烟酰胺结构为母核,作用于PARP1的活性位点而发挥抑制活性。主要有奥拉帕尼、瑞卡帕尼、维利帕尼、尼拉帕尼、特拉帕尼、NMS-P118等。PARP抑制剂能够结合到PARP1(和/或PARP2)的NAD+结合口袋,引起构象异构,造成DNA-PARP的不可逆解离,使PARP保持对DNA的结合,这个过程被称为DNA-PARP复合物的“捕获(trapping)”,这导致DNA-PARP复合物长期存在,无法进行后续的修复。
PARP抑制剂的细胞毒性并不与其抑制“PAR化”的能力(即酶的催化活性)成正比,而与DNA-PARP复合物的“捕获”能力相关。现在临床上使用的PARP抑制剂基本都是催化抑制剂,按照捕获DNA-PARP复合物的能力大小依次为:特拉帕尼>>尼拉帕尼>奥拉帕尼=瑞卡帕尼>>维利帕尼,这个排序也与其细胞毒性的排序相同。FDA已经批准了奥拉帕尼、瑞卡帕尼和尼拉帕尼上市,这些药物目前主要用于卵巢癌和乳腺癌的治疗。目前,PARP抑制剂的临床试验适应症研究已经扩展到肺癌、胰腺癌、前列腺癌、胃癌、头颈部肿瘤等。PARP抑制剂的临床适应症研究主要有三类:一类是主要用于具有生殖系BRCA 突变(germline BRCA-mutated, gBRCAm)的晚期或转移的乳腺癌或卵巢癌患者的治疗,这类患者一般是经过3个疗程以后,单药使用PARP抑制剂治疗。这些临床试验主要是验证PARP抑制剂作为辅助或缓解治疗的疗效。第二类是用于治疗不具有gBRCAm,但具有其类似的临床和分子特征的相关肿瘤患者的治疗,即具有“BRCAness”特征的患者。这类肿瘤主要包括三阴性乳腺癌(triple-negative breast cancer, TNBC)、高分化浆液性(high-grade serous, HGS)或低分化的卵巢癌。这类患者可能对PARP抑制剂敏感。第三类PARP抑制剂临床试验主要是针对体细胞突变散发的肿瘤或其他DNA修复突变的基因的肿瘤,如胰腺癌和前列腺癌。
2.1奥拉帕尼奥拉帕尼是由阿斯利康公司开发的,目前研究最广泛的口服小分子PARP-1/2抑制剂。2014年,FDA通过快速审批途径批准奥拉帕尼用于治疗携带BRCA1或BRCA2突变的铂类敏感,且接受过三线及以上铂类为主化疗并复发的卵巢癌。2016年,FDA又赋予奥拉帕尼突破性疗法认定,单药用于治疗携带BRCA或ATM基因突变、且去势治疗无效的转移性前列腺癌患者。FDA批准奥拉帕尼用于治疗gBRCAm卵巢癌的主要根据是137名具有gBRCA1/2m的晚期卵巢癌患者的单盲试验结果,这些患者口服奥拉帕尼(每次400 mg,每日2次),直至病情恶化或出现不能耐受的毒性为止,以客观缓解率(objective response rate, ORR)和缓解持续时间(duration of response, DOR)作为临床观察指标。结果患者ORR为37%,中位DOR达7~9个月。
欧洲药品管理局(EMA)批准奥拉帕尼用于铂类化疗敏感的、具有gBRCA1/2m复发的高级别浆液性卵巢癌(HGSOC)、输卵管和原发的腹膜癌的维持治疗,这类患者一般经过铂类为基础的化疗后,达到完全缓解或部分缓解。在奥拉帕尼Ⅲ期多中心临床试验SOLO-2(NCT01874353)中,具有BRCA突变并且对铂类化疗敏感的卵巢癌复发的患者口服奥拉帕尼(每次300 mg,每日2次)作为维持治疗,结果表明奥拉帕尼能明显延长卵巢癌患者的PFS。SOLO-2和Study 19临床试验主要区别是奥拉帕尼的剂型不同,Study 19患者口服是胶囊,SOLO-2患者口服是片剂[11]。目前,奥拉帕尼Ш期临床试验的适应症扩展到乳腺癌、肺癌、前列腺癌和胰腺癌,Ⅰ/Ⅱ期临床试验用于前列腺癌、非小细胞肺癌和尤文氏肉瘤(Ewing’s sarcoma)[12]。
2.2瑞卡帕尼瑞卡帕尼是由Clovis Oncology公司开发的小分子口服PARP抑制剂,2016年12月由FDA批准上市,单药用于生殖细胞或体细胞BRCA突变的晚期卵巢癌患者治疗,这些患者一般均曾接受过两次以上的化疗。
瑞卡帕尼临床试验ARIEL2和Study 10汇总分析显示,106例复发的恶性卵巢癌患者口服瑞卡帕尼(每次600 mg,每日2次)后,治疗持续到疾病恶化或出现不能耐受的不良事件。结果ORR为54%,完全缓解或部分缓解率分别为9%和45%。中位缓解持续时间为9.2个月,无进展生存时间(progression-free survival, PFS)为10.0个月,41%患者PFS为12个月。但是,瑞卡帕尼对生殖细胞和体细胞BRCA突变卵巢癌患者的疗效无明显差异(53.4%vs46.2%),而且瑞卡帕尼对具有BRCA1和BRCA2突变患者之间(53.7%vs53.8%)、2次化疗和2次以上化疗患者之间(68.3%vs53.8%)、2次与2次以上的铂类化疗的患者之间(65.0%vs53.8%)的疗效均无明显差异[13]。ARIEL结果表明,同源重组缺陷(homologous recombination deficiency , HRD)的特征可以作为卵巢癌患者对瑞卡帕尼疗效反应的标记物[14]。BRCA基因突变患者和杂合丢失患者对瑞卡帕尼有较高的ORR。目前,瑞卡帕尼临床试验适应症主要包括卵巢癌、乳腺癌、前列腺癌、胰腺癌等。
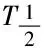
2.4其他PARP抑制剂目前,其他正在临床试验的PARP抑制剂包括维利帕尼、特拉帕尼(BMN-673)、NMS-P118等。维利帕尼由雅培公司研发,在FDA注册的维利帕尼单药或与其他药物联合应用的临床试验有90多项。临床试验的适应症主要包括卵巢癌、晚期或转移的乳腺癌、输卵管癌、前列腺癌、淋巴瘤等。在联合用药临床试验中,维利帕尼与多柔比星、替莫唑胺、拓扑替康、卡铂、紫杉醇、培美曲塞、环磷酰胺、吉西他滨等联合应用。
目前的两个Ⅱ期研究的结果分别为:维利帕尼的第1项Ⅰ/Ⅱ期临床试验是在BRCA突变的卵巢癌、接受过铂治疗的卵巢癌和基底样乳腺癌(BRCA野生型)患者中开展的。结果显示,其对携带BRCA1 和BRCA2 突变患者的疗效明显优于非BRCA突变患者,且无严重不良反应。另一项有关维利帕尼联合替莫唑胺治疗Ⅲ期或Ⅳ期转移性黑色素瘤患者的II期临床试验,入选患者346例。患者口服替莫唑胺的基础上,再口服维利帕尼(20 mg或40 mg)或安慰剂,每日2次,结果治疗组与对照组PFS分别为3.7个月、3.6个月及2个月;ORR分别为10.3%、8.7%及7.0%[15]。
特拉帕尼是一种可口服、强效PARP抑制剂,其IC50为0.58 nmol·L-1,目前正在进行II期非盲临床试验(NCT02401347),评价其在局部晚期或转移性乳腺癌的安全性和疗效。
3 PARP耐药机制
PARP抑制剂是相对新的药物,目前耐药机制研究多来自临床前研究。已知引起PARP抑制剂耐药的主要原因是BRCA1/2回复突变引起耐药。研究表明,在BRCA1或BRCA2肿瘤细胞中,继发性的体细胞突变可以恢复蛋白表达和重建HR,而引起对PARP抑制剂和铂类耐药[16-17]。在BCRA突变的肿瘤中,BRCA基因回复突变、启动子甲基化的恢复和HSP90稳定了BRCA1C末端结构域等也有可能恢复细胞的HR功能而引起耐药[18-19]。53BP1丢失也是引起PARP抑制剂耐药的一个原因,53BP1能阻止复制蛋白A(replication protein A, RPA)磷酸化。RPA具有单链结合和解旋的功能,在DNA损伤修复途径中,RPA能修复单链DNA损伤。53BP1丢失,RPA就不能结合在DNA上而修复损伤的DNA[18, 20]。另外,ATP结合转运蛋白的高表达,例如P-糖蛋白(p-glycoprotein, P-gp)是ATP 依赖性的外排泵,能够将细胞内的药物泵出细胞外,从而降低细胞内的药物浓度,进而降低药物的疗效,引起耐药。临床前研究表明,奥拉帕尼很容易通过细胞膜,表明正常情况下药物摄取不受限制;动物实验表明,细胞内的奥拉帕尼很容易通过P-gp将药物转运到细胞膜外[21]。细胞对PARP抑制剂耐药还可能因为多种调节机制(如启动子甲基化等)导致PARP1的表达降低或完全丢失,进而导致耐药[22]。
4 展望
PARP抑制剂是DDR通路抑制剂中目前研究最广泛的一类,临床主要用于对铂类化疗敏感,但经含铂类化疗方案治疗失败后的维持治疗,或者用于经过3-4线化疗失败后的治疗。由于其广泛的放化疗增敏及独特的“协同致死”效应,已成为目前肿瘤靶向治疗领域最大的热点之一,该类药物抗肿瘤效应明显,能明显延长卵巢癌和乳腺癌患者PFS,而且这类药物的临床适应症已经扩展到肺癌、胰腺癌、前列腺癌、胃癌、头颈部肿瘤等,因此,PARP抑制剂具有良好的抗肿瘤应用前景。由于 DNA损伤反应通路极其复杂,PARP抑制剂抗肿瘤作用机制还不完全清楚,因此,这类药物也面临很多挑战,如缺乏有效指导临床选择患者的生物标记物、肿瘤耐药和联合用药等问题。
(致谢:感谢安德森肿瘤中心左明新博士在本文写作过程中给予的帮助。)
[1] Jackson S P, Bartek J. The DNA-damage response in human biology and disease[J].Nature, 2009,461(7267):1071-8.
[2] Jeggo P A, Pearl L H, Carr A M. DNA repair, genome stability and cancer: a historical perspective[J].NatRevCancer, 2016,16(1):35-42.
[3] 王诗婧, 彭 军. 调节性坏死: 认识和防治损伤相关性疾病的新途径[J]. 中国药理学通报, 2017,33(2):153-7.
[3] Wang S J, Peng, J. Regulatory necrosis: a novel way to recognize and prevent injury-relevant diseases[J].ChinPharmacolBull, 2017,33(2):153-7.
[4] Ljungman M. Targeting the DNA damage response in cancer[J].ChemRev, 2009,109(7):2929-50.
[5] Pearl L H, Schierz A C, Ward S E, et al. Therapeutic opportunities within the DNA damage response[J].NatRevCancer, 2015,15(3):166-80.
[6] Reinhardt H C, Jiang H, Hemann M T, et al. Exploiting synthetic lethal interactions for targeted cancer therapy[J].CellCycle, 2009,8(19):3112-9.
[7] Konecny G, Kristeleit R. PARP inhibitors for BRCA1/2-mutated and sporadic ovarian cancer: current practice and future directions[J].BrJCancer, 2016,115(10):1157-73.
[8] Yap T A, Sandhu S K, Carden C P, de Bono J S. Poly (ADP-ribose) polymerase (PARP) inhibitors: exploiting a synthetic lethal strategy in the clinic[J].CACancerJClin, 2011,61(1):31-49.
[9] George A, Kaye S, Banerjee S. Delivering widespread BRCA testing and PARP inhibition to patients with ovarian cancer[J].NatRevClinOncol, 2017,14(5):284-96.
[10] Kim M Y, Zhang T, Kraus W L. Poly (ADP-ribosyl) ation by PARP-1:PAR-laying NAD+into a nuclear signal[J].GenesDev, 2005,19(17):1951-67.
[11] Kim G, Ison G, McKee A E, et al. FDA approval summary: olaparib monotherapy in patients with deleterious germline BRCA-mutated advanced ovarian cancer treated with three or more lines of chemotherapy[J].ClinCancerRes, 2015,21(19):4257-61.
[12] O’Sullivan Coyne G, Chen A P, Meehan R, Doroshow J H. PARP inhibitors in reproductive system cancers: current use and developments[J].Drugs, 2017,77(2):113-30.
[13] Kristeleit R, Shapira-Frommer R, Oaknin A, et al. Clinical activity of the poly (ADP-ribose) polymerase (PARP) inhibitor rucaparib in patients (pts) with high-grade ovarian carcinoma (HGOC) and a BRCA mutation (BRCAmut): analysis of pooled data from Study 10 (parts 1, 2a, and 3) and ARIEL2 (parts 1 and 2)[J].AnnOncol, 2016,27(suppl 6):8560.
[14] Swisher E M, Lin K K, Oza A M, et al. Rucaparib in relapsed, platinum-sensitive high-grade ovarian carcinoma (ARIEL2 Part 1): an international, multicentre, open-label, phase 2 trial[J].LancetOncol, 2017,18(1):75-87.
[15] Middleton M R, Friedlander P, Hamid O, et al. Randomized phase Ⅱ study evaluating veliparib (ABT-888) with temozolomide in patients with metastatic melanoma[J].AnnOncol, 2015,26(10):2173-9.
[16] Norquist B, Wurz K A, Pennil C C, et al.Secondary somatic mutations restoring BRCA1/2 predict chemotherapy resistance in hereditary ovarian carcinomas[J].JClinOncol, 2011,29(22):3008-15.
[17] Barber L J, Sandhu S, Chen L, et al. Secondary mutations in BRCA2 associated with clinical resistance to a PARP inhibitor[J].JPathol, 2013,229(3):422-9.
[18] Jenner Z B, Sood A K, Coleman R L. Evaluation of rucaparib and companion diagnostics in the PARP inhibitor landscape for recurrent ovarian cancer therapy[J].FutureOncol, 2016,12(12):1439-56.
[19] Meehan R S, Chen A P. New treatment option for ovarian cancer: PARP inhibitors. Gynecologic oncology research and practice[J].GynecolOncolResPract, 2016,3(1):3.
[20] Jaspers J E, Kersbergen A, Boon U, et al. Loss of 53BP1 causes PARP inhibitor resistance in BRCA1-mutated mouse mammary tumors[J].CancerDiscov, 2013,3(1):68-81.
[21] Rottenberg S, Jaspers J E, Kersbergen A, et al. High sensitivity of BRCA1-deficient mammary tumors to the PARP inhibitor AZD2281 alone and in combination with platinum drugs[J].ProcNatlAcadSci, 2008,105(44):17079-84.
[22] Liu X, Han E K, Anderson M, et al. Acquired resistance to combination treatment with temozolomide and ABT-888 is mediated by both base excision repair and homologous recombination DNA repair pathways[J].MolCancerRes, 2009,7(10):1686-92.