辣椒素通过抑制自噬活性抑制实验性自身免疫性神经炎
2018-01-24周寿红薛瑞瑞郭潇潇盛思敏夏嘉辉
周寿红,薛瑞瑞,郭潇潇,盛思敏,杜 倩,夏嘉辉,肖 婷,林 芬
(南华大学医学院生理学教研室,湖南 衡阳 421001)
实验性自身免疫性神经炎(experimental autoimmune neuritis, EAN)是一种自身免疫性疾病,是人类吉兰-巴雷综合征(Guillain-Barre syndrome, GBS)经典的动物模型[1]。EAN病变范围主要波及周围神经系统的髓鞘和轴索,其主要的病理特征是周围神经和神经根髓鞘脱失、轴索变性,神经干内及神经纤维周围巨噬细胞和淋巴细胞等炎症细胞浸润,属于神经变性疾病[2]。EAN和GBS的发病机制还未完全阐明,也缺乏理想的治疗手段。
辣椒素(capsaicin)是从茄科植物辣椒中提取的一种生物碱,其化学名称为8-甲基-N-草香酸-6-壬烯酰胺。辣椒素是瞬时受体电位通道香草醛亚型-1(transient receptor potential vanilloid type-1, TRPV1)的高选择性激动剂[3-4]。TRPVl在炎症的发展过程中发挥着重要作用,TRPV1激动后能影响P物质、降钙素基因相关肽、神经激肽A等的释放,发挥抗炎的作用[5-6]。但是辣椒素对EAN的作用目前还不清楚。自噬是真核生物细胞中降解和回收利用细胞内的长寿蛋白质、生物大分子和受损细胞器的过程。研究显示,细胞自噬参与了多种神经变性疾病的发病机制[7-8]。因此,本研究建立EAN大鼠模型,观察辣椒素对EAN的影响,从细胞自噬的角度探讨其可能的作用机制。
1 材料与方法
1.1药品与试剂辣椒素由碧云天生物技术公司提供(批号:P0045);周围神经髓鞘抗原(P257-81)多肽由上海吉尔生化有限公司提供(批号:2017040317);完全弗氏佐剂(批号:089M01721C)和雷帕霉素(rapamycin, RAPA,批号:09101748)购自美国Sigma公司;劳克坚牢蓝为上海远慕生物科技有限公司产品(批号:DJ548);兔抗大鼠Beclin-1(批号:sc-58742-R)、微管相关蛋白1轻链3(microtubule-associated protein light chain-3, LC3,批号:sc-47821)、p62(批号:sc-58241)、β-actin(批号:sc-58742-R)单克隆抗体和相应的辣根过氧化物酶标记的山羊抗兔二抗(批号:sc-58742-R),均购自美国Santa Cruz公司;肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α,批号:170305)、干扰素γ (interferon gamma, IFN-γ,批号:170226)、白介素-1β(interleukin 1β, IL-1β,批号:170308)和白介素-6(interleukin-6, IL-6,批号:170314)酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)检测试剂盒,购自武汉博士德生物工程有限公司。
1.2仪器TECNAI 20 U-TWIN型透射电镜为荷兰飞利浦电子光学公司产品;F.A.M.E.16/20型全自动酶标仪为瑞士哈美顿公司产品;UV-3600型紫外分光光度计为日本岛津产品;SZ51/SZ61型光学显微镜为日本奥林巴斯公司产品。
1.3动物模型的建立及实验分组♂ Lewis大鼠,8~10周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0006。将100 μg的P257-81多肽溶解于100 μL的磷酸盐缓冲液(phosphate buffer, PBS),再加入100 μL完全弗氏佐剂,混匀成抗原乳剂。通过在每只大鼠的后肢足底分别注射100 μL抗原乳剂,诱导EAN大鼠模型。实验分为对照组(Control)、EAN模型组(EAN)、辣椒素组(Capsaicin)、EAN+辣椒素组(EAN+Capsaicin)、雷帕霉素组(RAPA)、EAN+雷帕霉素组(EAN+RAPA)和EAN+辣椒素+雷帕霉素组(EAN+Capsaicin+RAPA),每组10只。辣椒素组大鼠每天给予辣椒素(1 mg·kg-1)灌胃[6],共15 d;EAN+辣椒素组大鼠每天在免疫后1 h给予辣椒素(1 mg·kg-1)灌胃,共15 d;雷帕霉素组大鼠在免疫后0.5 h通过腹腔注射给予雷帕霉素(2.5 mg·kg-1),共15 d;EAN+雷帕霉素组大鼠每天在免疫后0.5 h通过腹腔注射给予雷帕霉素(2.5 mg·kg-1),共15 d;EAN+辣椒素+雷帕霉素组大鼠每天在免疫后0.5 h通过腹腔注射给予雷帕霉素(2.5 mg·kg-1),再在免疫后1 h给予辣椒素(1 mg·kg-1)灌胃,共15 d。
1.4大鼠神经系统体征临床评分抗原乳剂注射后,每天对大鼠的神经系统体征进行评分,评分标准如下:大鼠没有表现出明显的异常评为0分;肌张力明显降低,鼠尾松弛无力评为1分;大鼠的翻正反射部分消失,鼠尾出现瘫痪评为2分;大鼠的翻正反射全部消失评为3分;大鼠出现姿态异常,并存在共济失调现象评为4分;大鼠的后肢出现轻度瘫痪评为5分;大鼠的后肢出现中度瘫痪评为6分;大鼠的后肢出现严重瘫痪评为7分;大鼠四肢均出现瘫痪评为8分;大鼠处在濒临死亡的状态评为9分;大鼠死亡评为10分[9]。
1.5坐骨神经病理形态学观察辣椒素处理15 d后处死动物,取出大鼠右侧坐骨神经,取靠近中枢的部分神经组织用于病理切片,余下的神经组织用于透射电镜检查。采用HE染色观察神经组织中炎症细胞浸润,劳克坚牢蓝染色观察神经纤维脱髓鞘现象。在显微镜下观察切片,每张切片随机取5个视野,计数大鼠坐骨神经横断面浸润的炎症细胞数量,结果以炎症细胞数/mm2组织切片表示。
1.6ELISA法检测大鼠血清TNF-α、IFN-γ、IL-1β、IL-6的水平辣椒素处理15 d后,尾静脉采血,1 500 r·min-1离心5 min,收集上清液。在酶标板的每个检测孔中加待测样本50 μL,每孔加入酶结合物50 μL,空白对照孔不加,37℃孵育2 h。弃去孔内液体,每孔先加入显色剂100 μL,混匀,37℃孵育15 min。空白对照孔调零,设定波长为450 nm,用酶标仪测定各孔的OD值。根据标准曲线,计算血清标本中TNF-α、IFN-γ、IL-1β、IL-6的水平。
1.7坐骨神经超微结构观察辣椒素处理15 d后处死动物,取余下的右侧坐骨神经,0.2 mol·L-1戊二醛在4℃固定2 h。经常规脱水、包埋、超薄切片和重金属染色后,采用透射电镜观察神经纤维的超微结构及细胞中的自噬体情况,并拍照记录,计算每个视野轴突横截面中自噬体数量。
1.8Westernblot检测辣椒素处理15 d后处死动物,取大鼠左侧坐骨神经,用预冷的PBS冲洗2遍,加入蛋白裂解液,冰上碾磨裂解30 min,提取总蛋白。2,2-联喹啉-4,4-二甲酸二钠法定量样本的蛋白浓度。总蛋白样本加入上样缓冲液,充分煮沸变性蛋白。SDS-PAGE电泳分离蛋白,转移到PVDF膜。牛血清白蛋白溶液室温下孵育2 h封闭非特异性抗原。加入Beclin-1(1 ∶150)、LC-3(1 ∶200)、p62(1 ∶200)、β-actin(1 ∶400)的一抗,4℃过夜。洗膜后加入相应的二抗,室温下脱色摇床上缓慢摇晃继续孵育2 h。洗膜后用ECL试剂盒显色,清洗终止反应。Chemi DocMP多色荧光凝胶成像分析系统观察并记录结果,采用Image J软件进行灰度分析,分析目的蛋白的相对表达水平。

2 结果
2.1辣椒素对EAN大鼠神经系统体征临床评分和体质量的影响如Fig 1所示,EAN组大鼠在免疫后d 6出现首发症状,临床评分为(1.53±0.24),此后神经系统体征临床评分逐渐升高,在免疫后d 15达到最高,临床评分为(7.54±0.56)。与对照组比较,EAN组大鼠从免疫后d 6~16神经系统体征临床评分均明显升高(P<0.05)。EAN组大鼠在免疫后d 2开始出现体质量的减轻,从免疫后d 3~16体质量均明显低于对照组(P<0.05)。对照组和辣椒素组大鼠没有观察到神经功能的缺损,两组大鼠体质量也没有明显差异(P>0.05)。与EAN组比较,EAN+辣椒素组大鼠从免疫后d 7~16神经系统体征临床评分均明显降低(P<0.05),从免疫后d 3~16体质量均明显增加(P<0.05)。
2.2辣椒素对EAN大鼠坐骨神经的髓鞘脱失和炎性细胞浸润的影响如Fig 2所示,与对照组比较,EAN组大鼠坐骨神经中可观察到明显的髓鞘脱失现象,炎症细胞浸润数明显增加(P<0.05)。与EAN组比较,EAN+辣椒素组大鼠坐骨神经中髓鞘脱失现象明显减少,炎症细胞浸润数明显减少(P<0.05)。
2.3辣椒素对EAN大鼠血清TNF-α、IFN-γ、IL-1β和IL-6水平的影响如Tab 1所示,与对照组比较,EAN组大鼠血清中促炎细胞因子TNF-α、IFN-γ、IL-1β、IL-6水平明显增加(P<0.05)。与EAN组比较,EAN+辣椒素组大鼠血清中促炎细胞因子TNF-α、IFN-γ、IL-1β、IL-6水平明显降低(P<0.05)。
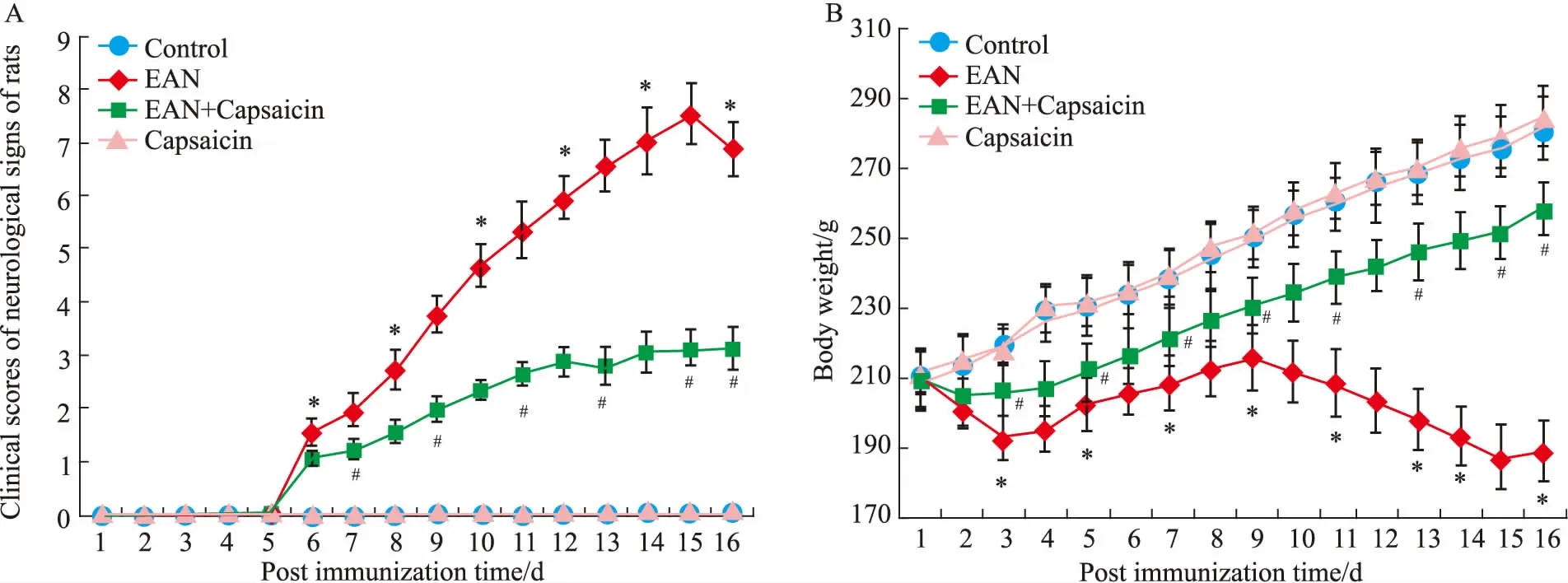
Fig 1 Effect of capsaicin on clinical scores of neurological signs (A) and body weight (B) in rats with EAN*P<0.05 vs control group; #P<0.05 vs EAN group
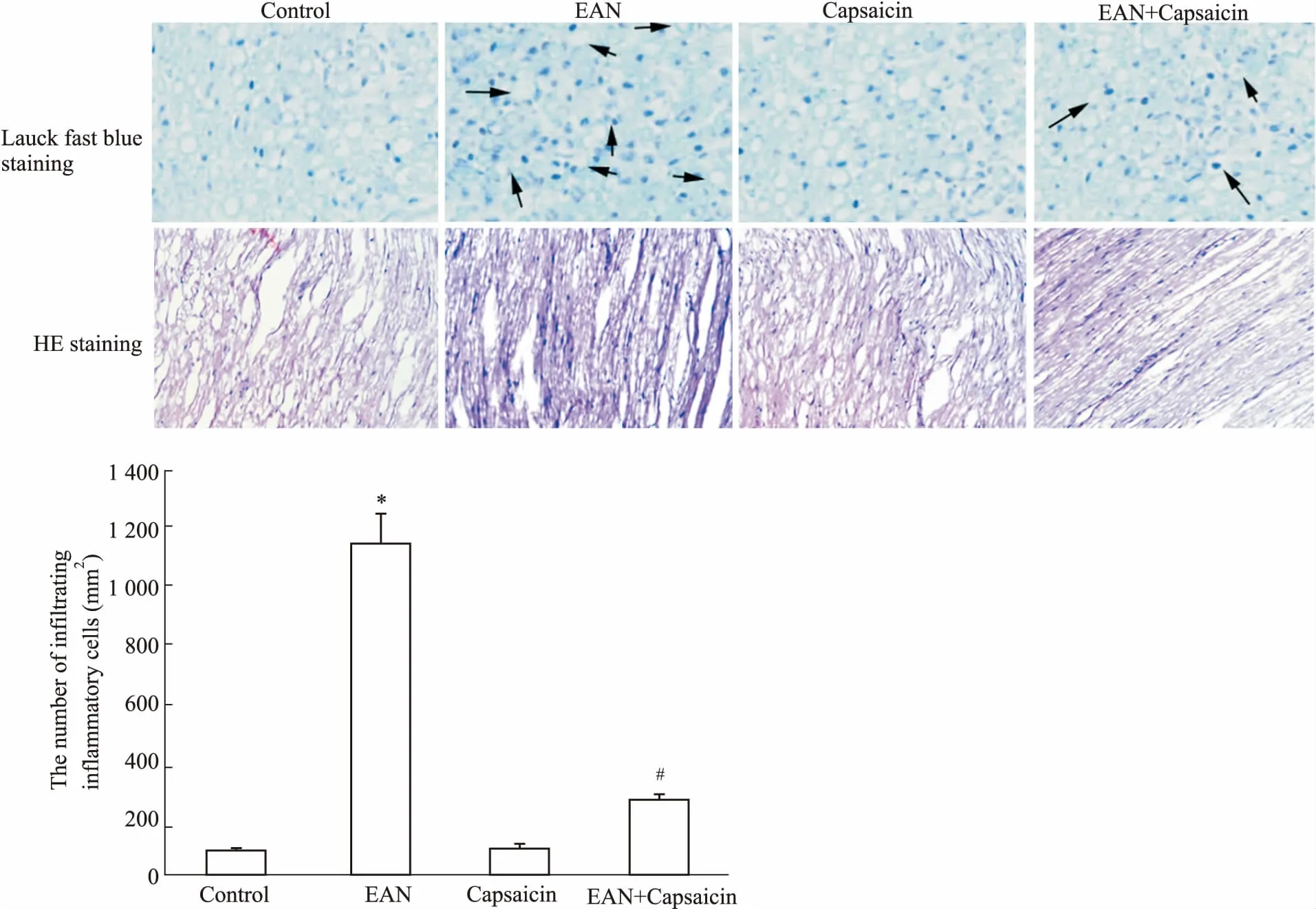
Fig2EffectofcapsaicinondemyelinationandinflammatorycellinfiltrationofsciaticnerveinratswithEAN(×200)
Arrows indicates nerve fiber with demyelination.*P<0.05vscontrol group;#P<0.05vsEAN group
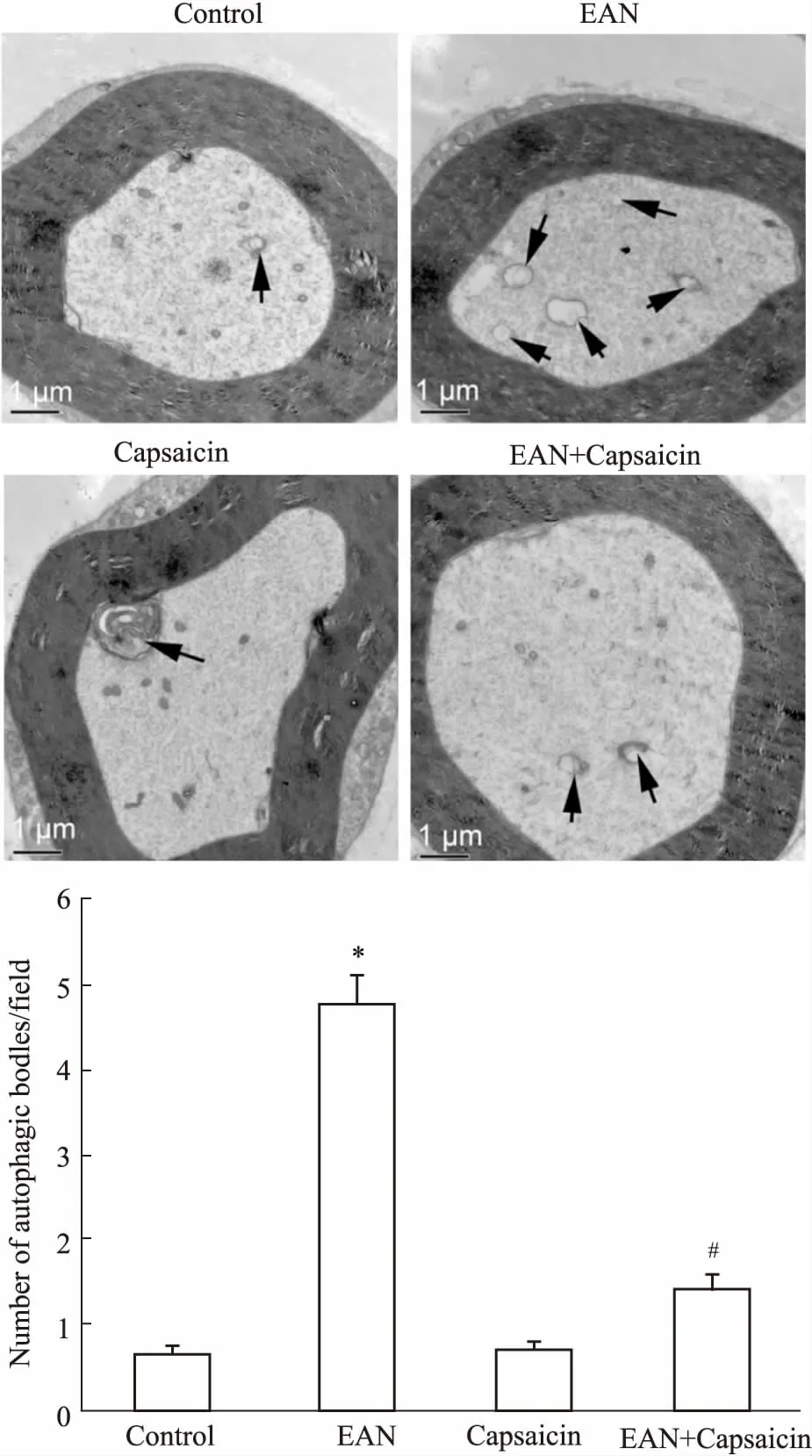
Fig 3 Effect of capsaicin on ultrastructure ofsciatic nerve in rats with EAN
Arrows indicates the autophagosome.*P<0.05vscontrol group;#P<0.05vsEAN group
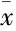
Tab 1 Effect of capsaicin on levels of serum TNF-α, IFN-γ, IL-1β and IL-6 in rats with EAN(±s, n=10)
*P<0.05vscontrol;#P<0.05vsEAN
2.4辣椒素对EAN大鼠坐骨神经超微结构的影响如Fig 3所示,与对照组比较,EAN组大鼠坐骨神经轴突中自噬体数量明显增加(P<0.05)。与EAN组比较,EAN+辣椒素组大鼠坐骨神经轴突中自噬体数量明显减少(P<0.05)。
2.5辣椒素对EAN大鼠坐骨神经组织中自噬相关蛋白表达的影响如Fig 4所示,与对照组比较,EAN组大鼠坐骨神经中Beclin-1、LC3-Ⅱ蛋白的表达及LC3-Ⅱ/LC3-Ⅰ比值均明显升高,p62的表达明显降低(P<0.05)。与EAN组比较,EAN+辣椒素组大鼠坐骨神经中Beclin-1、LC3-Ⅱ蛋白的表达及LC3-Ⅱ/LC3-Ⅰ比值均明显降低,p62的表达明显升高(P<0.05)。
Fig 4 Effect of capsaicin on expressions of autophagy relatedprotein Beclin-1, p62 and LC3-Ⅱ(A) and ratio of LC3-Ⅱ andLC3-Ⅰ (B) of sciatic nerve in rats with EAN
*P<0.05vscontrol group;#P<0.05vsEAN group
2.6自噬诱导剂RAPA对辣椒素抑制大鼠EAN作用的影响如Fig 5所示,与EAN+辣椒素组比较,EAN+辣椒素+雷帕霉素组大鼠从免疫后d 8~16神经系统体征临床评分均明显升高(P<0.05),从免疫后d 6~16体质量均明显增加(P<0.05),表明雷帕霉素部分逆转了辣椒素的作用。
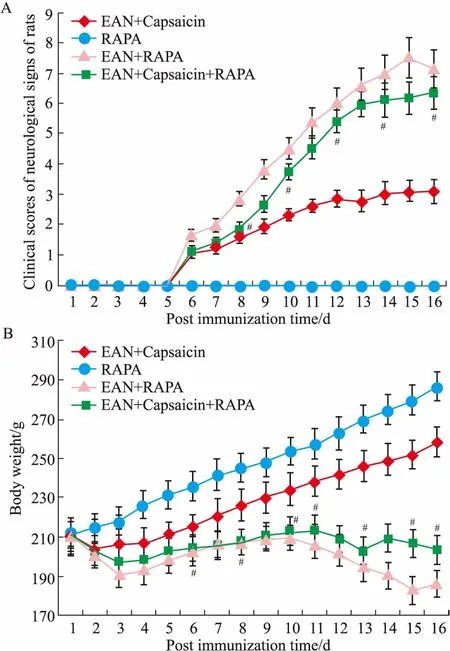
Fig 5 Effect of autophagy inducer RAPA on inhibitoryaction of capsaicin in rats with EAN
A: Clinical scores of neurological signs; B: Body weight.#P<0.05vsEAN+capsaicin group
3 讨论
GBS是一种周围神经和神经根的急性自身免疫性炎症性疾病,主要表现为四肢麻木、肢体无力、四肢对称性迟缓性瘫痪、面神经麻痹、眼外肌麻痹、共济失调、腱反射消失等症状。周围神经的脱髓鞘以及炎症细胞的浸润是本病的主要病理特点。EAN与人类的GBS具有相似的临床、组织病理学和电生理学特征及免疫学改变,是研究GBS的经典动物模型[10]。本实验结果显示,辣椒素能明显降低EAN大鼠的神经系统体征临床评分,明显增加EAN大鼠的体质量,减少EAN大鼠的坐骨神经髓鞘脱失现象,减少EAN大鼠的坐骨神经中炎症细胞浸润,降低大鼠血清中炎性细胞因子TNF-α、IFN-γ、IL-1β和IL-6的水平。这些结果表明辣椒素具有抗EAN的作用。
辣椒素是辣椒中最主要的有效成分,辣椒素通过与辣椒素受体结合后,开放阳离子通道,导致细胞外的钙离子内流,调节多种炎症介质包括组胺激肽、P物质和前列腺素的释放[11]。研究显示,辣椒素对炎症有抑制作用。周琦等[6]研究发现,辣椒素对慢性萎缩性胃炎具有良好的治疗作用。符涛等[12]的研究结果表明,辣椒素对急性痛风性关节炎的炎症反应具有抑制作用。本研究的结果也证实辣椒素具有抗炎作用,对EAN具有抑制作用,但其机制不明。
研究显示,自噬与神经退行性疾病的发生、发展关系密切,而EAN是一种以髓鞘脱失、轴索变性和炎症细胞浸润为特征的神经退行性疾病[13-14]。因此,进一步检测了EAN大鼠中自噬的水平。结果显示,EAN大鼠坐骨神经轴突中自噬体数量明显增加,Beclin-1、LC3-Ⅱ蛋白的表达及LC3-Ⅱ/LC3-Ⅰ比值均明显升高,p62的表达明显降低,表明在EAN中自噬活性水平的增加,因而EAN的神经轴突中自噬水平的增加可能是导致轴索变性的原因。但是神经轴突中自噬活性水平的增加是否参与髓鞘脱失的发生呢?有研究表明,小鼠视网膜节细胞轴突内自噬体可以释放到细胞周围,被周围的细胞吞噬处理[15]。构成髓鞘的施旺细胞同样具有吞噬能力,施旺细胞吞噬大量由轴突转移出来的自噬体后,可能损伤施旺细胞,导致髓鞘溶解和髓鞘脱失,但是这种可能还需进一步的研究证实。本研究的结果显示,辣椒素明显降低了EAN模型大鼠坐骨神经轴突中自噬体数量,降低Beclin-1、LC3-Ⅱ蛋白的表达及LC3-Ⅱ/LC3-Ⅰ比值,增加p62的表达,而自噬诱导剂雷帕霉素部分地逆转辣椒素的作用。这表明辣椒素抑制了EAN中自噬活性,这可能是辣椒素抑制EAN的机制之一。
(致谢:本实验在南华大学神经科学研究所实验室完成,对本实验的参与人员表示感谢。)
[1] Zhang H L, Zheng X Y, Zhu J. Th1/Th2/Th17/Treg cytokines in Guillain-Barré syndrome and experimental autoimmune neuritis[J].CytokineGrowthFactorRev, 2013,24(5): 443-53.
[2] Tran G T, Hodgkinson S J, Carter N M, et al. Membrane attack complex of complement is not essential for immune mediated demyelination in experimental autoimmune neuritis [J].JNeuroimmunol, 2010,229(1-2): 98-106.
[3] 方 东, 张宏伟, 任鹏飞. 辣椒素受体与神经痛[J]. 中国药理学通报, 2009,25(11): 1538-40.
[3] Fang D, Zhang H W, Ren P F. VR1 and neuropathic pain [J].ChinPharmacolBull, 2009,25(11): 1538-40.
[4] 马红雨, 任 曲, 魏利召, 等. 辣椒素受体参与骶髓后联合核神经元突触传递[J]. 中国药理学通报, 2011,27(10): 1413-7.
[4] Ma H Y, Ren Q, Wei L Z, et al. Involvement of capsaicin receptors in synaptic transmission in sacral dorsal commissural nucleus neurons [J].ChinPharmacolBull, 2011,27(10): 1413-7.
[5] 王 灿, 陈 素, 刘向明. 龙血素B抑制大鼠背根神经节细胞辣椒素诱发的电流反应[J]. 中国药理学通报, 2007,23(2): 211-4.
[5] Wang C, Chen S, Liu X M. Loureirin B inhibits capsaicin-induced currents in rat dorsal root ganglion neurons [J].ChinPharmacolBull, 2007,23(2): 211-4.
[6] 周 琦, 张其胜. 辣椒素对慢性萎缩性胃炎的作用[J]. 胃肠病学, 2015,20(5): 278-82.
[6] Zhou Q, Zhang Q S. Effect of capsaicin on chronic atrophic gastritis [J].ChinJGastroenterol, 2015,20(5): 278-82.
[7] Cosin-Roger J, Simmen S, Melhem H, et al. Hypoxia ameliorates intestinal inflammation through NLRP3/mTOR downregulation and autophagy activation [J].NatCommun, 2017,8(1): 98.
[8] 杨根梦, 陈 逊, 曾晓锋. 甲基苯丙胺诱导神经细胞自噬的研究进展[J]. 中国药理学通报, 2016,32(10): 1341-4.
[8] Yang G M, Chen X, Zeng X F. Research progress of methamphetamine inducing nerve cell’s autophagy [J].ChinPharmacolBull, 2016,32(10): 1341-4.
[9] Cavaletti G, Mata S, Fasano A, et al. Lipid-free versus lipid-bound P2 protein-induced experimental allergic neuritis: clinicopathological, neurophysiological, and immunological study [J].JNeurosciRes, 2000,62(5): 709-16.
[10] Ding Y, Han R, Jiang W, et al. Programmed death ligand 1 plays a neuroprotective role in experimental autoimmune neuritis by controlling peripheral nervous system inflammation of rats [J].JImmunol, 2016,197(10): 3831-40.
[11] Sun N N, Wong S S, Keith I, et al. Tachykinin substance P depletion by capsaicin exacerbates inflammatory response to sidestream cigarette smoke in rats [J].Toxicology, 2004 ,201(1-3): 39-50.
[12] 符 涛, 付玉梅, 江庆萍, 等. 辣椒素对大鼠痛风性关节炎的作用[J]. 中药材, 2014,37(3): 491-3.
[12] Fu T, Fu Y M, Jiang Q P, et al. Effect of capsaicin on the gouty arthritis in rats [J].JChinMedMater, 2014,37(3): 491-3.
[13] 刘立亚, 王慧晔, 黄秀兰. 基于细胞自噬的荭草苷抗心肌缺血/再灌注损伤的机制研究[J]. 中国药理学通报, 2016,32(4): 542-7.
[13] Liu L Y, Wang H Y, Huang X L. Cardioprotection of orientin against myocardial ischemia/reperfusion injury through induction of autophagy [J].ChinPharmacolBull, 2016,32(4): 542-7.
[14] Tan C C, Yu J T, Tan M S, et al. Autophagy in aging and neurodegenerative diseases: implications for pathogenesis and therapy [J].NeurobiolAging, 2014,35(5): 941-57.
[15] Burdett T C, Freeman M R. Astrocytes eyeball axonal mitochondria [J].Science, 2014,345(6195): 385-6.