槲皮素通过影响吲哚胺-2,3-双加氧酶活性抑制HeLa细胞增殖的研究
2018-01-24刘潇忆葛啸垠
张 薇,何 龙,刘潇忆,韩 琴,葛啸垠
(南京中医药大学医学与生命科学学院病原与免疫学系,江苏 南京 210023)
L-色氨酸是人体必需氨基酸,参与蛋白质以及一些重要生理物质代谢。最近研究发现,肿瘤细胞过度代谢色氨酸,其代谢产物犬尿氨酸可以促进肿瘤细胞生长迁移,并能抑制抗肿瘤免疫应答,且色氨酸代谢与肿瘤恶化程度及预后明显相关[1]。吲哚胺-2,3-双加氧酶(indoleamine-2,3-dioxygenase,IDO)是催化色氨酸生成犬尿氨酸的关键蛋白酶,且IDO对于免疫系统的调控也非常重要[2-4]。目前,已进入抗肿瘤临床试验阶段的IDO抑制剂主要包括INCB024360、NLG-919、1-MT等[5-7]。
槲皮素是一种多羟基黄酮类化合物(结构式见Fig 1),其药理作用广泛,对多种恶性肿瘤均有抑制其生长的作用[8-10]。据报道,槲皮素能够抑制LPS诱导的THP-1细胞中犬尿氨酸的产生,对IDO1有一定的抑制作用[11]。本研究从细胞水平、体外酶催化活性反应等多方面进一步确证了槲皮素对IDO1活性和色氨酸代谢的抑制作用,这可能是槲皮素抑制HeLa细胞增殖的机制之一。该研究为槲皮素抗肿瘤提供了又一理论依据,而且可以为指导临床妇科用药,特别是为更年期妇女保健及宫颈癌等肿瘤患者的用药提供参考。
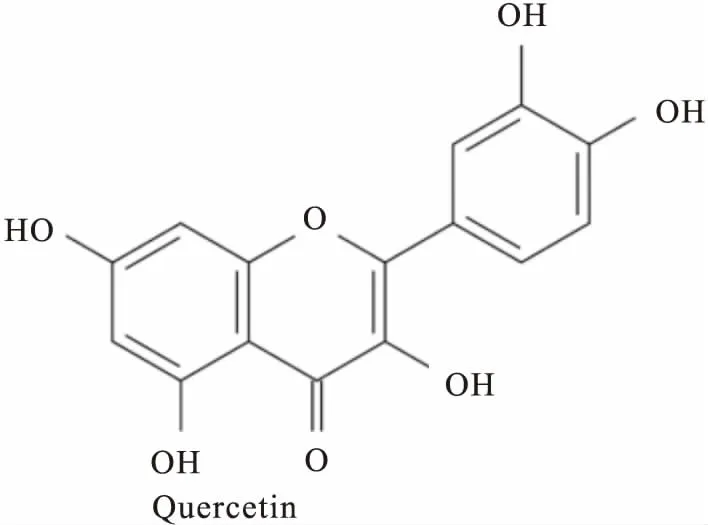
Fig 1 Chemical structure of quercetin
1 材料与方法
1.1细胞株人宫颈癌HeLa细胞、人宫颈上皮永生化H8细胞均购自ATCC。
1.2试剂DMEM培养基、胎牛血清、胰蛋白酶(美国Gibco公司);槲皮素、3-(N-吗啉基)丙磺酸[3-(N-morpholino) propanesulfonic acid,MOPS]、抗坏血酸、L-色氨酸、过氧化氢酶、亚甲基蓝、三氯乙酸、对二甲基氨基苯甲醛、L-犬尿氨酸、免疫印迹及其他所需试剂等,均购自Sigma-Aldrich;CCK-8试剂盒、细胞周期检测试剂盒,购自碧云天生物技术公司;人IFN-γ购自北京义翘神州生物技术有限公司;抗His抗体购自Cell Signaling Technology;引物由南京金斯瑞设计合成;RNA提取、反转录试剂盒(Promega);SYBR Green mix(日本TOYOBO)。
1.3仪器FACS CaliburTM流式细胞仪(Becton Dickinson公司),高效液相色谱仪STI-501 plus(配备N2000色谱工作站,杭州赛智公司),C1000实时荧光定量PCR系统、垂直板电泳仪(美国Bio-Rad公司),Spectra Max 250酶标仪(美国Molecular Devices公司),Flour Chem-FC2成像系统(美国Alpha Innotech)。
1.4细胞培养HeLa细胞置于DMEM培养基(10%胎牛血清)中,于37℃、5% CO2恒温培养箱中培养。传代时,用PBS洗涤2次,胰蛋白酶消化3 min,300×g离心5 min,更换新鲜的完全培养基。
1.5CCK-8法检测细胞增殖HeLa细胞接种于96孔板中,加入不同浓度的槲皮素,于37℃、5% CO2的恒温培养箱中培养48 h后,每孔加入10 μL CCK-8溶液,继续培养4 h,设置未处理的正常对照组以及未加CCK-8的背景空白组,酶标仪450 nm处检测其吸光值(A)。用以下公式计算细胞相对存活率:细胞相对存活率=(A处理组-A空白组)/(A对照组-A空白组)×100%。
1.6流式细胞术检测细胞周期5×105个HeLa细胞接种于培养皿中,待细胞贴壁后,更换无血清培养基培养12 h,使细胞统一在G0期,再更换完全培养基,加入不同浓度的槲皮素,继续培养48 h。收细胞,加入预冷的体积分数为0.7的乙醇,置于冰箱4℃过夜,弃去乙醇,PBS洗2遍,加入碘化丙啶染液(0.03 g·L-1)、RNaseA(0.3 g·L-1),37℃避光30 min,流式细胞仪检测细胞周期分布。
1.7qPCR检测IDO1基因的mRNA表达按照试剂盒说明书操作,提取HeLa细胞的总RNA,逆转录,然后用SYBR Green PCR Mix进行qPCR扩增反应。每组2个复孔,重复3次。结果以2-ΔΔCt表示实验组与对照组目的基因表达倍数关系,GAPDH作为内参基因。本项实验中用到的引物序列如下:IDO1-F:5′-AGGGTTCTGGGAAGACCCAA-3′,IDO1-R:5′-ATGTCCTCCACCAGCAGTCT-3′;GAPDH-F:5′-CATGTTCGTCATGGGTGTGAAC-3′,GAPDH-R:5′-AGTGATGGCATGGACTGTGGT-3′。
1.8HeLa细胞IDO的诱导表达及犬尿氨酸生成测定5×103个HeLa细胞接种于96孔培养板中,向培养基中加入人IFN-γ(终浓度为0.05 ng·L-1)和不同浓度的槲皮素,处理48 h后,取上清,加入三氯乙酸,50℃孵育30 min。离心去沉淀,加入质量体积比为0.02的对二甲氨基苯甲醛(溶剂为醋酸)并混匀,用酶标仪在480 nm波长处检测吸光度。
1.9IDO1蛋白的表达、纯化及体外催化反应系统将pCMV3-C-His-IDO1质粒转染293T细胞, 48 h后收细胞裂解蛋白,免疫印迹方法检测IDO1蛋白的表达情况,并用Ni柱纯化该蛋白,考马斯亮蓝染色法检测蛋白纯化的效率。IDO1蛋白体外酶活性反应实验的体系如下:2 mmol·L-1色氨酸,20 mmol·L-1抗坏血酸,3.5 μmol·L-1亚甲蓝,0.2 ng·L-1过氧化氢酶,10 μL IDO1蛋白裂解液,溶剂为50 mmol·L-1的MOPS缓冲液(pH 6.5),37°C温箱中反应6 h。
1.10高效液相色谱法(HPLC)检测色氨酸和犬尿氨酸含量的变化所用色谱柱是Hypersil Gold C8柱(5 μm,150 mm×4.6 mm,Thermo Fisher)。流动相是体积分数为0.09的乙腈,体积分数为0.001的乙酸和三氟乙酸。色谱柱的温度设定为25℃,流速为0.8 mL·min-1,使用紫外检测器,色氨酸的检测波长为280 nm,犬尿氨酸的检测波长为355 nm。

Fig 2 Inhibition of cell proliferation and cell cycle progression by quercetin in HeLa cells
A,B:Effect of quercetin on cell viability of HeLa cells;C:Quercetin induced cell cycle arrest in HeLa cells.*P<0.05,**P<0.01vscontrol group
1.11统计学分析统计学评估采用Student’sttest(两组比较)和One-way ANOVA(多组比较)。除非特殊说明,每个实验至少重复3次。数据用GraphPad Prism进行分析。
2 结果
2.1槲皮素抑制HeLa细胞的增殖分别用不同浓度的槲皮素处理人宫颈癌HeLa细胞24 h。如Fig 2A所示,与对照组相比,槲皮素对HeLa细胞增殖具有明显的抑制作用,呈现剂量依赖效应;用10 μmol·L-1槲皮素处理HeLa细胞,随着时间的增长,其抑制效应也增强,48 h作用最明显(Fig 2B)。此外,用不同浓度的槲皮素处理HeLa细胞48 h,流式细胞仪检测槲皮素对细胞周期的影响,结果显示,与对照组相比,槲皮素作用于HeLa细胞48h后,可明显增加G0/G1期细胞的比例,抑制细胞增殖,并呈现出剂量依赖性(Fig 2C)。
2.2槲皮素抑制INF-γ诱导的犬尿氨酸的生成HeLa细胞等肿瘤细胞在促炎因子(如IFN-γ)的诱导下,可表达大量内源性的IDO,因而在细胞培养上清中可检测到犬尿氨酸含量的变化。值得注意的是,在HeLa细胞中IFN-γ只能诱导IDO1的表达,而不能诱导IDO2或色氨酸-2,3-双加氧酶(tryptophan 2,3-dioxygenaes,TDO)的表达。在HeLa细胞中加入IFN-γ和不同浓度的槲皮素,48 h后收集细胞培养上清,经检测,槲皮素能够明显抑制IFN-γ诱导的犬尿氨酸生成(Fig 3)。
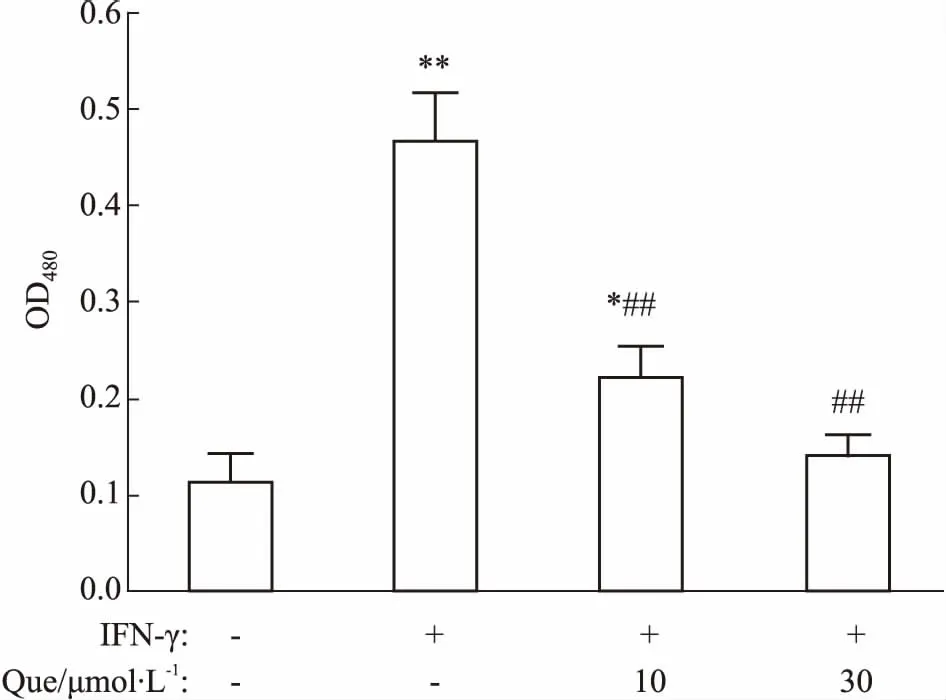
Fig 3 Effect of quercetin on kynurenine production
Quercetin potently inhibited kynurenine production in IFN-γ treated HeLa cells.*P<0.05,**P<0.01vscontrol group;##P<0.01vsIFN-γ treatment group without quercetin
2.3槲皮素抑制IDO1的体外酶催化活性为了验证槲皮素是否抑制人IDO1蛋白的酶活性,首先在293T细胞中表达了IDO1蛋白,用Ni柱纯化得到His-IDO1蛋白,并进行体外酶催化活性实验(Fig 4A、4B)。如Fig 4C、4D所示,加入IDO1蛋白的反应体系中犬尿氨酸(保留时间为6.8 min)的含量明显增加,底物色氨酸(保留时间为16.2 min)的含量相应减少,而加入1 μmol·L-1的槲皮素的样品中,犬尿氨酸的生成受到明显抑制,体系中还存在大量的底物色氨酸未发生反应,为排除蛋白和体系反应缓冲液的影响,我们对蛋白空白和体系空白也平行地进行了HPLC检测。该结果表明,槲皮素抑制IDO1的体外酶催化活性,导致色氨酸代谢受阻以及肿瘤细胞的增殖抑制。
2.4槲皮素不影响IDO1的表达为了进一步确定槲皮素抑制HeLa细胞增殖与IDO1的酶催化活性有关,本研究检测槲皮素处理对IDO1表达的影响。如Fig 5所示,人宫颈癌HeLa细胞与正常人宫颈上皮永生化细胞相比,其IDO1的mRNA水平以及蛋白表达明显升高,这与已报道的结果相一致。多种肿瘤细胞高表达IDO1,从而异常代谢色氨酸,导致色氨酸的代谢产物犬尿氨酸大量堆积,从而促进肿瘤细胞的生成和迁移。另外,加入不同浓度的槲皮素(10、30 μmol·L-1)处理HeLa细胞24 h以后,其IDO1的转录水平和蛋白表达均无明显变化,证明槲皮素并不影响IDO1的表达。
2.5外源性添加犬尿氨酸能够逆转槲皮素引起的增殖抑制犬尿氨酸与肿瘤的发生与发展密切相关,为了进一步证明槲皮素抑制HeLa细胞的增殖与色氨酸代谢受阻有关,我们用槲皮素处理细胞的同时,外源性添加不同浓度的犬尿氨酸,观察细胞的增殖情况。如Fig 6所示,外源性添加犬尿氨酸能够明显逆转槲皮素引起的增殖抑制,一定程度上抵消了槲皮素的抗肿瘤作用。
3 讨论
色氨酸是人体必需氨基酸,色氨酸摄入不足或者代谢异常可导致疾病的发生。另据报道,色氨酸代谢在肿瘤细胞中异常活跃,这与肿瘤的免疫逃逸密切相关。色氨酸在肿瘤细胞中主要通过IDO进行代谢,IDO可催化色氨酸降解生成犬尿氨酸,犬尿氨酸可以与芳香族化合物受体AHR结合,激活AHR通路,从而促进肿瘤细胞生长和迁移。这也可能是槲皮素抑制HeLa细胞增殖的更深入的分子机制,我们还在做进一步的研究。
IDO在肿瘤的发生发展中扮演了重要的角色。IDO在人类不同肿瘤中的表达均有所升高,如卵巢癌、肺癌、乳腺癌等,且IDO与肿瘤的预后也密切相关[12]。IDO不仅可催化色氨酸产生大量的犬尿氨酸,还可通过抑制抗肿瘤免疫反应,影响肿瘤的生长。临床试验证明,IDO的小分子抑制剂治疗能够恢复机体对肿瘤的排斥反应,而且可增强化疗药物的抗肿瘤效果。本研究表明,槲皮素对IDO的表达无影响,但具有明显抑制IDO酶活性的作用。

Fig 4 Expression and catalytic activity of IDO1 in vitro
A, B: The expression and purification of IDO1 protein; C: Determination ofL-tryptophan andL-kynurenine by using HPLC after treatment with or without quercetin; D: Quantitative values from integrated peak area of HPLC.**P<0.01vsgroup treated without quercetin

Fig 5 Effect of quercetin on IDO1 mRNA level(A) and protein expression (B) in HeLa cells
**P<0.01vsH8 cells group
槲皮素是一种多羟基黄酮类化合物,许多中草药中都含有槲皮素,其具有多种生物学活性,如抗肿瘤、抗氧化、抗炎、保护心血管系统等[13-14]。槲皮素抗肿瘤机制复杂,如槲皮素可引起肿瘤细胞的凋亡、抑制血管生成、促进肿瘤细胞自噬等。本研究发现,槲皮素可能通过抑制IDO1的酶催化活性,从而影响细胞色氨酸的代谢,这也可能是槲皮素发挥抑制HeLa细胞增殖的作用机制之一。天然的小分子化合物是宝贵的资源,本文为槲皮素抗肿瘤提供了又一新的理论依据,同时也为免疫检查点IDO抑制剂的筛选开拓了新的思路。

Fig 6 Addition of kynurenine reverses inhibitionof cell proliferation induced by quercetin
*P<0.05,**P<0.01vscontrol group;#P<0.05vsquercetin (10 μmol·L-1) treatment group without kynurenine addition;△P<0.05vsquercetin (30 μmol·L-1) treatment group without kynurenine addition
[1] Opitz C A, Litzenburger U M, Sahm F, et al. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor[J].Nature, 2011,478(7368):197-203.
[2] Sugimoto H, Oda S, Otsuki T, et al. Crystal structure of human indoleamine 2,3-dioxygenase: catalytic mechanism of O2 incorporation by a heme-containing dioxygenase[J].ProcNatlAcadSciUSA, 2006,103(8):2611-6.
[3] Dai W, Gupta S L. Molecular cloning, sequencing and expression of human interferon-gamma-inducible indoleamine 2,3-dioxygenase cDNA[J].BiochemBiophysResCommun, 1990,168(1):1-8.
[4] Mellor A L, Munn D H. IDO expression by dendritic cells: tolerance and tryptophan catabolism[J].NatRevImmunol, 2004,4(10): 762-74.
[5] Metz R, Rust S, Duhadaway J B, et al. IDO inhibits a tryptophan sufficiency signal that stimulates mTOR: a novel IDO effector pathway targeted by D-1-methyl-tryptophan[J].Oncoimmunology, 2012,1(9):1460-8.
[6] Seegers N, van Doornmalen A M, Uitdehaag J C, et al. High-throughput fluorescence-based screening assays for tryptophan-catabolizing enzymes[J].JBiomolScreen, 2014,19(9):1266-74.
[7] Beatty G L, O’Dwyer P J, Clark J, et al. First-in-human phase I study of the oral inhibitor of indoleamine 2,3-dioxygenase-1 epacadostat (INCB024360) in patients with advanced solid malignancies[J].ClinCancerRes, 2017,23(13):3269-76.
[8] Zheng Y Z, Deng G, Liang Q, et al. Antioxidant activity of quercetin and its glucosides from propolis: a theoretical study[J].SciRep, 2017,7(1):7543.
[9] 孙 涓, 余世春. 槲皮素的研究进展[J]. 现代中药研究与实践, 2011,25(3):85-8.
[9] Sun J, Yu S C. Research progress of quercetin[J].ResPractChinMed, 2011,25(3):85-8.
[10] 王艳芳, 王新华, 朱宇同. 槲皮素药理作用研究进展[J]. 天然产物研究与开发, 2003,15(2):171-3.
[10] Wang Y F, Wang X H, Zhu Y T. Advances in pharmacological effects of quercetin[J].NatProdResDev, 2003,15(2):171-3.
[11] Yamamoto R, Yamamoto Y, Imai S, et al. Effects of various phytochemicals on indoleamine 2,3-dioxygenase 1 activity: galanal is a novel, competitive inhibitor of the enzyme[J].PLoSOne, 2014,9(2):e88789.
[12] Smith C, Chang M Y, Parker K H, et al. IDO is a nodal pathogenic driver of lung cancer and metastasis development[J].CancerDiscov, 2012,2(8):722-35.
[13] 刘红亮, 胡 磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014,30(3):373-7.
[13] Liu H L, Hu L, Wang J K, et al. Protective effect of quercetin on the oxidative damage induced by hydrogen peroxide and mechanism in PC12 cells[J].ChinPharmacolBull, 2014,30(3):373-7.
[14] 施剑明, 殷嫦嫦, 孙维君, 等. 槲皮素联合顺铂对人骨肉瘤MG-63细胞增殖及凋亡的影响[J]. 中国药理学通报, 2014,30(10):1361-6.
[14] Shi J M, Yin C C, Sun W J, et al. Effect of quercetin combined with cisplatin on proliferation and apoptosis of human osteosarcoma cell line MG-63[J].ChinPharmacolBull,2014,30(10):1361-6.