抗氧化肽AOP1对小鼠皮肤烫伤创面愈合修复的影响
2018-01-24张慧杰杨希营陈艳通林维平李文辉孙同毅高媛媛
秦 迪,张慧杰,杨希营,陈艳通,林维平,李文辉,孙同毅,高媛媛
(潍坊医学院 1. 生物科学与技术学院,山东省高校生物药物重点实验室,2. 麻醉学系, 3. 药学院,山东 潍坊 261053)
皮肤烫伤是日常生活中常见的一种皮肤损伤形式。实验研究表明,皮肤烫伤后,常伴随着氧化应激反应的发生,过量的活性氧(reactive oxygen species,ROS)会导致烫伤创面再损伤,形成水肿、炎症反应和远离的器官的损伤,甚至产生休克[1-2]。此外,过度氧化应激反应与炎症反应会相互促进,进而使伤口修复发生恶性循环[3],导致伤口创面产生坏死[1],不利于创面愈合。
研究表明,两栖动物皮肤分泌物中的活性肽具有抗菌、抗炎、抗氧化、抗肿瘤等生物功能。王利锋等[4]已证实,大鲵皮肤分泌液中的抗菌肽对小鼠皮肤创面感染具有较好的保护作用。目前已知发挥生物功能的分子主要是蟾蜍二烯羟酸内酯类、蟾毒色胺类、甾醇类、吲哚总生物碱等化学成分[5-7],而对皮肤分泌物中蛋白和肽类的研究较少[8]。Liu等[9]研究表明,来源于无指盘臭蛙皮肤分泌物中的AH90具有加速伤口愈合的作用。来源于云南臭蛙(Odorranaandersonii)的AOP1,由9个氨基酸残基构成,相对分子质量为1 063.28 u。研究证明,AOP1对2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate), ABTS]和2,2-联苯基-1-1苦基肼基[1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl, DPPH]具有较好的清除能力,对因紫外产生的皮肤损伤具有良好的保护功能[10]。通常,皮肤烫伤会导致皮肤表皮细胞及真皮层成纤维细胞的损伤,在组织修复阶段,表皮细胞参与表皮重建,其增殖与迁移有利于创面修复,而成纤维细胞具有恢复皮肤正常形态与功能的作用[11]。为进一步研究该小分子活性多肽的功能,本实验通过验证抗氧化肽AOP1对自由基和细胞内ROS的清除能力,采用小鼠皮肤烫伤模型,以创面愈合率、皮肤组织中丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性等为指标,初步探讨天然抗氧化肽AOP1对皮肤烫伤创面愈合的保护作用。
1 材料与方法
1.1实验动物健康成年昆明♀小鼠40只,体质量(20±2)g,由济南朋悦实验动物繁育有限公司提供,动物生产许可证号:SCXK(鲁)2014-0007。
1.2细胞与试剂人永生化表皮细胞HaCaT和小鼠皮肤成纤维细胞L929购自中国典型培养物保藏中心。抗氧化肽AOP1(纯度:95%)由吉尔生化上海有限公司提供;过硫酸钾、ABTS、DPPH均购自美国Sigma公司;MEM培养液购自美国Hyclone公司;胎牛血清购自美国Gibco公司;MTT和胰蛋白酶购自索莱宝科技有限公司;ROS检测试剂盒购自碧云天生物技术研究所;总超氧化物歧化酶(T-SOD)测试盒、MDA测试盒购自南京建成生物工程研究所。
1.3仪器SpectraMax M5型多功能荧光酶标仪(Molecular Devices);BX53型荧光倒置显微镜(OLYMPUS);AR224CN型电子天平(奥豪斯仪器上海有限公司);Sorvall LYNX型高速离心机(Thermo);HHS型数显电热恒温水浴锅(上海博迅实业有限公司医疗设备厂)。
1.4方法
1.4.1DPPH自由基清除能力的测定 测定方法在Zhou等[12]方法上稍作修改,将抗氧化肽AOP1用无菌水配成5、10、20、30、40、50 μmol·L-15个浓度梯度。取上述各样品液200 μL于洁净试管中,每管各加入3.8 mL浓度为5×10-5mol·L-1的DPPH溶液,混匀后,在室温下避光反应30 min。517 nm波长处检测各管吸光值。清除率按照下列公式计算:清除率=[1-(Ai-Aj)/A0]×100%。式中A0表示DPPH溶液的吸光值;Ai为加入样品后溶液的吸光值;Aj为样品溶液的吸光值。
1.4.2ABTS+·自由基清除能力的测定 按照参考文献[13]的方法并略作修改,将浓度为2.8 mmol·L-1的过硫酸钾溶液加入到7 mmol·L-1的ABTS+储备液后,于37℃避光条件下温育6 h以上。各取800 μL浓度为5、10、20、30、40、50 μmol·L-1的样品液于5个洁净试管中,分别加入3.2 mL用无菌水稀释50倍后的ABTS+·工作液,混合均匀,光下反应10 min 。用无菌水调零,在415 nm波长处测定各样品的吸光值。清除率按照下列公式计算:清除率=[1-(Ai-Aj)/A0]×100%。式中A0表示ABTS工作溶液的吸光值;Ai为加入样品后溶液的吸光值;Aj为样品溶液的吸光值。
1.4.3MTT法检测细胞活性 将生长状态良好的HaCaT和L929细胞,按8×107·L-1的细胞量接种于96孔板中。培养24 h后,每孔加入100 μL含药无血清培养基(AOP1浓度梯度为5、10、20、50、100 mg·L-1),继续培养24 h 。结束后,每孔加入10 μL浓度为5 g·L-1的MTT溶液反应4 h,弃上清,并加入DMSO溶液150 μL,37℃恒温震荡15 min后,于490 nm波长处检测各孔A490值,并计算细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4.4细胞迁移实验 将HaCaT细胞接种于培养板,细胞融合后,通过划痕模拟伤口,并用D-Hank’s缓冲液清洗3遍。加入2 mL浓度为100 mg·L-1抗氧化肽AOP1培养观察。用显微镜从0 h开始,每隔6 h观察直至培养48 h。细胞的覆盖面积用Jmicro Vision软件分析。模拟伤口愈合率按照下列公式计算:伤口愈合率=(初始划痕面积-各时间点划痕面积)/初始划痕面积×100%。
1.4.5细胞ROS的测定 选择生长状况良好的HaCaT和L929细胞,稀释成8×107·L-1的单细胞混悬液,接种于48孔板中,培养18~24 h。实验组每孔加入200 μL抗氧化肽AOP1稀释液(浓度为5、10、20、50、100 mg·L-1),正常孔和对照孔加入等量无血清培养液(每个样品设置3个复孔),继续培养23.5 h。正常孔加入200 μL无血清培养基,对照孔和实验孔加入H2O2稀释液(浓度500 μmol·L-1)诱导30 min,装载浓度为4 μmol·L-1的DCFH-DA探针20 min。PBS清洗3遍,收集细胞并于488 nm激发光、525 nm发射光条件下,用多功能荧光酶标仪检测荧光值。
1.4.6小鼠皮肤烫伤模型的制备 将小鼠正常饲养7 d后,涂抹质量浓度为10 g·L-1的Na2S进行小鼠背部脱毛处理,37℃温水擦洗干净。24 h后,小鼠腹腔注射质量浓度为35 g·L-1的水合氯醛(10 mL·kg-1)进行麻醉。将自制带手柄、直径为1 cm的铜圆柱体放于80℃水中2 min,取出后立即紧贴小鼠背部去毛皮肤区域持续10 s。皮肤烫伤30 min后,随机将小鼠分为对照组和AOP1组,分笼饲养18 d。动物模型建立后前9 d,每天皮肤涂药1次(药物浓度100 mg·L-1);后9 d不作处理。
1.4.7皮肤烫伤创面愈合观察 通过观察皮肤烫伤创面的愈合情况,确定烫伤愈合所需时间。烫伤面积的计算以小鼠烫伤模型建立12 h后形成的面积为基准,在烫伤后12 h及3、6、9、12、15、18 d不同采样点,每组各取3只小鼠,数码相机采集每只小鼠不同时间点的创面,利用Image J图像处理与分析软件,分析每只小鼠不同时间点的创面面积。创面愈合率=(初始烫伤面积-各时间点创面面积)/初始烫伤面积×100%。
1.4.8组织病理学切片与观察 分别在小鼠烫伤后12 h及3、6、9、12、15、18 d不同采样点,取包含烫伤创面组织周围直径5 mm的组织,置于4%的多聚甲醛中固定。将固定好的组织脱水、包埋、切片,进行苏木精-伊红(HE)染色和Masson染色,光学显微镜下观察微观结构。
1.4.9小鼠皮肤创面组织中MDA含量和SOD活性的测定 分别在小鼠烫伤后12 h及3、6、9、12、15、18 d不同采样点,每组各取3只小鼠,迅速采集创面组织,于冰浴条件下组织匀浆,在4℃条件下4 000 r·min-1离心10 min,取上清液,即得组织匀浆液。然后分别按照SOD试剂盒和MDA测定试剂盒的操作使用说明,分别于450 nm和532 nm波长处检测各样品的吸光值,并分析SOD活性及MDA的含量。

2 结果
2.1AOP1对自由基的清除作用如Fig 1所示,来源于云南臭蛙皮肤中的具有天然活性的抗氧化肽AOP1对DPPH具有清除作用,当AOP1浓度为50 μmol·L-1时,其对DPPH的清除率为29.56%;AOP1对ABTS+· 同样具有清除作用,且对ABTS+·的清除率与AOP1浓度呈现量效关系,当AOP1浓度为50 μmol·L-1时,其对ABTS+·自由基的清除率达到26.38%。说明抗氧化肽AOP1对自由基具有较好的清除作用。

Fig 1 The free radical scavenging rate ofantioxidant peptide AOP1(±s, n=3)
A: The clearance rate of AOP1to ABTS free radicals; B: The clearance rate of AOP1to DPPH free radicals.
2.2AOP1对正常细胞活性的影响选用HaCaT和L929细胞检测抗氧化肽AOP1的毒性,如Fig 2所示,与空白对照组相比,不同浓度的抗氧化肽AOP1作用于HaCaT和L929细胞24 h后,当AOP1浓度大于5 mg·L-1时,L929细胞和HaCaT细胞存活率均为100%以上。说明在一定浓度范围内,抗氧化肽AOP1对HaCaT和L929细胞无毒副作用,且能够促进细胞生长,提高正常细胞的活性。

Fig 2 Effect of antioxidant peptideAOP1 on normal cell viability (±s, n=5)
A: Effect of antioxidant peptide AOP1on survival rate of HaCaT cells; B: Effect of antioxidant peptide AOP1on survival rate of L929 cells.
2.3AOP1对体外细胞迁移与增殖的影响表皮细胞在炎症阶段和伤口愈合阶段参与表皮的重建,用HaCaT细胞探究AOP1对正常皮肤细胞增殖和迁移的影响。如Fig 3所示,与空白对照组对比,AOP1具有明显促使HaCaT细胞迁移与增殖的作用,并且在48 h内能明显促进伤口愈合(P<0.01)。说明AOP1能促使细胞的迁移与增殖,明显改善烫伤创面的愈合情况,提高伤口愈合速率。
2.4AOP1对细胞内ROS的清除作用HaCaT和L929细胞经H2O2诱导30 min后,如Fig 4所示,当HaCaT细胞内ROS升高25.08%时,L929细胞升高36.90%。与对照组相比,不同浓度的AOP1均能降低HaCaT细胞内H2O2诱导的ROS(P<0.05或P<0.01);随着AOP1浓度的增加,L929细胞内ROS的含量呈下降趋势,其中,AOP1浓度为100 mg·L-1时,能明显降低L929细胞中ROS的含量(P<0.05)。说明AOP1对HaCaT和L929细胞内的ROS具有较好的清除作用,能够保护皮肤细胞免受过量ROS的损伤。

Fig 3 The healing rate of HaCaT cellsin different time points (±s, n=3)
**P<0.01vscontrol group

Fig 4 Effect of antioxidant peptide
A: Effect of AOP1on H2O2-induced ROS of HaCaT cells; B: Effect of AOP1on H2O2-induced ROS of L929 cells.*P<0.05,**P<0.01vsH2O2control group.
2.5小鼠创面愈合观察形态学观察发现,如Fig 5A所示,小鼠皮肤烫伤12 h后,两组无明显差异。9 d后,对照组小鼠皮肤炎症反应严重,组织出现坏死,组织液渗出较多;与对照组相比,AOP1组无坏死、炎症反应,没有组织液渗出,并已结痂,新生皮肤形成。烫伤形成15 d后, AOP1组小鼠烫伤创面基本完成结痂,并形成红润且富有弹性的复生皮肤组织;而对照组小鼠复生皮肤组织刚刚形成。提示AOP1能够抑制组织坏死和炎症反应,加速伤口愈合。伤口的愈合状况常用伤口愈合率作为重要指标。如Fig 5B所示,6 d后,与对照组比较,AOP1组小鼠皮肤伤口愈合率明显提高(P<0.01)。说明抗氧化肽AOP1能够有效缩短创面愈合时间,减轻炎症反应,促进伤口结痂和新生组织的生长,有利于伤口愈合。
2.6小鼠皮肤创面组织学观察皮肤烫伤后3 d,如Fig 6A所示,对照组皮肤结构紊乱,表皮脱落,炎性细胞大量富集;而AOP1组创面各级组织结构较为完整,组织基本无水肿现象。15 d后,AOP1组小鼠皮肤创面基本愈合,复生表皮及真皮层,排列规则有序;而对照组小鼠皮肤构造紊乱,炎性细胞浸润明显。与对照组相比,AOP1组新生上皮组织增厚,各组织层结构界限清晰完整,组织排列有序,血管复原良好,且无充血现象。说明AOP1可减轻炎性反应,促进新生组织的形成和皮肤结构的有序排列,加速伤口愈合。Masson染色结果如Fig 6B显示,AOP1组小鼠在烫伤6 d后,大量胶原纤维(蓝色)在组织结构中生成;而对照组皮肤组织中仅有少量胶原纤维存在。小鼠皮肤烫伤18 d,AOP1组形成较厚的上皮组织,皮肤附属器较多,胶原纤维排列规则、有序,趋向于正常皮肤;而对照组新生上皮组织较薄,并富集有大量粗胶原纤维,排列杂乱无序。说明AOP1能够促进胶原纤维的形成及有序排列,进而促进小鼠创面愈合。
2.7AOP1对小鼠皮肤组织中MDA含量和SOD活性的影响采用TBA法检测小鼠创伤皮肤中MDA含量。如Fig 7所示,在相同时间点中,与对照组相比,AOP1组的小鼠皮肤中MDA含量明显低于对照组(P<0.05)。随着创面伤口的愈合,虽然AOP1组和对照组小鼠皮肤组织中SOD活性无明显差异(P>0.05),但两组小鼠皮肤中SOD活性均逐渐增强。说明AOP1可降低皮肤创面愈合过程中MDA含量,从而对皮肤烫伤愈合起保护作用。

A: Morphological observation of skin healing in back of mice; B: Changes in healing rate of wounds.**P<0.01vscontrol group.
3 讨论
皮肤烫伤会造成皮肤组织细胞氧化应激而产生大量ROS,进而使创面组织发生水肿和炎症反应,延缓创面愈合的进程[2-3]。复杂有序的皮肤创面愈合,包含着伤口发生炎症反应、细胞增殖与迁移形成皮肤肉芽组织和重塑基质组织结构等不同的过程[14]。前期研究表明,来源于云南臭蛙的AOP1具有较好的清除ABTS及DPPH自由基的能力[10]。创面愈合过程中,表皮细胞参与表皮重建,其增殖与迁移能够促进伤口愈合。在此基础上,细胞迁移与增殖实验结果显示,与空白对照相比,100 mg·L-1的AOP1在12 h内可明显提高模拟伤口愈合率;药物作用48 h后,模拟伤口愈合率可提高20.42%。说明抗氧化肽AOP1可促进伤口愈合,并证实其对HaCaT 和L929细胞均无细胞毒性。
大量实验证实,皮肤烫伤后,伤口表面常伴随氧化应激的产生[1]。本研究中,利用H2O2模拟皮肤烫伤后组织细胞产生ROS,结果显示,不同细胞内ROS的量与药物浓度均呈现一定的联系;当AOP1浓度为100 mg·L-1时,对HaCaT和L929细胞内ROS的清除率分别为41.24%和21.86%。提示AOP1对HaCaT和L929细胞内的ROS具有较好的清除作用,能够保护皮肤细胞免受ROS损伤。
本实验中,抗氧化肽AOP1用纯水溶解,为消除其性状、溶解方式和给药途径的影响,选用纯水为对照组。结果显示,连续涂抹9 d抗氧化肽AOP1可明显促进小鼠烫伤创面愈合,缩短创面愈合所需时间,提高创面愈合率;在创面形成后15 d,AOP1组小鼠皮肤伤口愈合率可达94.45%。新生组织色泽与原皮肤基本一致,且富有弹性。
机体对自由基的清除能力常用SOD的活性反映,而MDA常被作为脂质过氧化和细胞受损程度的重要指标。实验中,MDA含量和SOD活性的联合检测常用来评估机体的抗氧化能力和受损水平[15]。本研究中,两组小鼠皮肤中SOD活性均呈升高趋势,但AOP1组与对照组相比,烫伤创面组织中MDA含量明显下降。提示抗氧化肽AOP1可抑制氧自由基对创面的损伤,提高机体清除自由基的能力,有益于小鼠烫伤皮肤愈合。
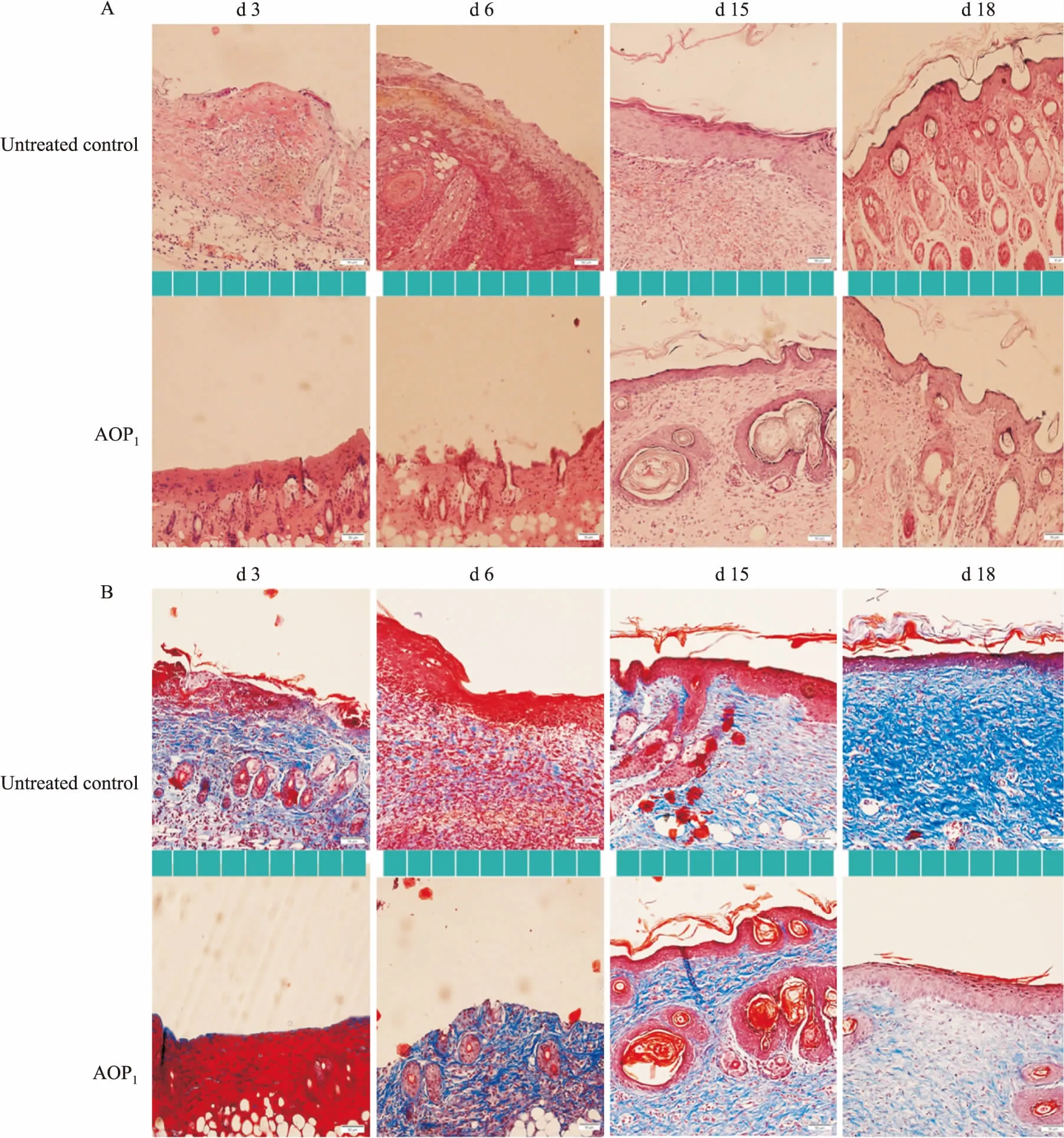
Fig 6 Morphological observation of mouse skin tissues

Fig 7 Comparison of MDA content in wound tissue ofmice at different time points (±s, n=3)
*P<0.05,**P<0.01vscontrol group.
综上所述,本研究从细胞和动物水平证实了抗氧化肽AOP1可对小鼠皮肤烫伤的伤口愈合修复起到促进作用,能够缩短创面愈合时间;其途径主要是通过降低ROS的含量,进而防止创面组织中脂质过氧化的程度。关于抗氧化肽AOP1对皮肤烫伤修复进程中涉及的有关分子机制和信号通路,尚需进一步研究。
(致谢:本研究所有实验均在潍坊医学院生物科学与技术学院山东省高校生物药物重点实验室完成,衷心感谢本课题组所有老师的指导和同学的帮助。)
[1] Parihar A, Parihar M S, Milner S, et al. Oxidative stress and anti-oxidative mobilization in burn injury[J].Burns, 2008,34(1):6-17.
[2] Deng J, Wang G, Huang Q, et al. Oxidative stress-induced leaky sarcoplasmic reticulum underlying acute heart failure in severe burn trauma[J].FreeRadicBiolMed, 2008,44(3):375-85.
[3] Biesalski H K, Mcgregor G P. Antioxidant therapy in critical care-is the microcirculation the primary target[J]?CritCareMed, 2007,35(9 Suppl):577-83.
[4] 王利锋, 李学英, 王大忠. 大鲵皮肤分泌液中抗菌肽对铜绿假单胞菌感染小鼠创面的抗菌作用[J]. 华西药学杂志, 2011,26(4):336-9.
[4] Wang L F, Li X Y, Wang D Z. Antibacterial effect of antimicrobial peptide from skin secretions of Audrias davidiauus on the wound of Pseudomouas aerugiuosa infection in mice[J].WestChinaJPharmSci, 2011,26(4):336-9.
[5] Wang D L, Qi F H, Tang W, et al. Chemical constituents and bioactivities of the skin of Bufo bufo gargarizans Cantor[J].ChemBiodivers, 2011,8(4):559-67.
[6] Li X, Guo Z, Wang C, et al. Purification of bufadienolides from the skin of Bufo bufo gargarizans, Cantor with positively charged C18 column[J].JPharmBiomedAnal, 2014,92:105-13.
[7] 马丽娜, 宋 兵, 金 花,等. 华蟾素对乳腺癌细胞株MCF-7的杀伤作用研究[J]. 中国药理学通报, 2011,27(1):37-41.
[7] Ma L N, Song B, Jin H, et al. Research of the killing effects of cinobufacini on MCF-7 cells[J].ChinPharmacolBull, 2011,27(1):37-41.
[8] 展 波, 高媛媛, 林维平,等. 中华大蟾蜍皮肤Cathelicidin家族新型抗菌肽的鉴定及其抗菌活性[J]. 中国中药杂志, 2016,41(4):630-5.
[8] Zhan B, Gao Y Y, Lin W P, et al. Identification and bactericidal activity of a novel Cathelicidin family member from skin of Bufu bufo gargarizans[J].ChinaJChinMaterMed, 2016,41(4):630-5.
[9] Liu H, Mu L, Tang J, et al. A potential wound healing-promoting peptide from frog skin[J].IntJBiochemCellBiol, 2014,49:32-41.
[10] Yang X, Wang Y, Zhang Y, et al. Rich diversity and potency of skin antioxidant peptides revealed a novel molecular basis for high-altitude adaptation of amphibians[J].SciRep, 2016,6:19866.
[11] Guo L, Huang X, Liang P, et al. Role of XIST/miR-29a/LIN28A pathway in denatured dermis and human skin fibroblasts (HSFs) after thermal injury[J].JCellBiochem, 2017 Aug 3. doi: 10.1002/jcb.26307. [Epub ahead of print]
[12] Zhou H C, Lin Y M, Wei S D, et al. Structural diversity and antioxidant activity of condensed tannins fractionated from mangosteen pericarp[J].FoodChem, 2011,129(4):1710-20.
[13] Cai Y, Luo Q, Sun M, et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J].LifeSci, 2004,74(17):2157-84.
[14] Schreml S, Szeimies R M, Prantl L, et al. Wound healing in the 21st century.[J].JAmAcadDermatol, 2010,63(5):866-81.
[15] 苏 爱, 朱红燕, 徐宏伟,等. 海兔素对大鼠原代肝细胞酒精性氧化损伤的保护作用[J]. 中国药理学通报, 2016,32(2):251-7.
[15] Su A, Zhu H Y, Xu H W, et al. Effect of Aplysin on ethanol-induced oxidative damage in rat primary hepatocytes [J].ChinPharmacolBull, 2016,32(2):251-7.