ERK信号蛋白在吗啡预处理减轻大鼠全心缺血/再灌注损伤中的作用
2018-01-24金世云产进中何淑芳
黄 俊,杨 婉,金世云,产进中,刘 中,张 野,何淑芳
(安徽医科大学第二附属医院麻醉科,安徽 合肥 230601)
全心缺血/再灌注损伤常见于体外循环下的心脏及大血管手术、心跳骤停后心肺复苏等,缺血的心肌在循环开放或冠脉血流恢复后,可能发生更为严重的心肌损伤[1-2],认识和防治心肌缺血/再灌注损伤已成为心脏病学和麻醉学领域的重要课题。本课题组前期研究结果显示,吗啡预处理对大鼠局部心肌缺血/再灌注损伤以及H9c2心肌细胞缺氧/复氧损伤具有减轻作用[3-4],而吗啡预处理(morphine preconditioning, MPC)对大鼠全心缺血/再灌注损伤的作用及其机制鲜有报道。细胞外信号调节激酶(extracellular signaling-regulated kinase, ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族成员,ERK信号通路活化有利于减轻心肌缺血/再灌注损伤[5]。本研究中,我们采用Langendorff离体灌注模型,观察MPC对大鼠全心缺血/再灌注损伤的影响,并探讨ERK信号蛋白所发挥的作用。
1 材料与方法
1.1药品、试剂与仪器盐酸吗啡注射液(批号:130113.2,东北制药集团沈阳第一制药有限公司);2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride, TTC)(批号:129K1867V, 美国Sigma公司);乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒(南京建成生物工程研究所);ERK抑制剂PD98059(Cell Signaling公司);鼠抗β-actin单克隆抗体(美国Santa Cruz公司);兔抗p-ERK1/2(Thr202/204)、ERK1/2单克隆抗体(Cell Signaling公司);ECL发光试剂盒(美国Pierce公司)。PowerLab数据采集系统(澳大利亚AD公司);Langendorff灌注系统(安徽淮北正华有限责任公司);Tanon全自动凝胶成像系统(上海天能科技有公司)。
1.2动物模型制备与分组处理健康♂成年SD大鼠,体质量200~250 g,由安徽医科大学动物实验中心提供,动物合格证号:SCXK(皖)2005-001。采用随机数字表法分为6组(n=10):对照组(CON组)、缺血/再灌注组(I/R组)、缺血预处理组(ischemia preconditioning, IPC组)、 吗啡1 μmol·L-1预处理组(MPC组)、 吗啡预处理+PD98059 (10 μmol·L-1) 组(MPD组)、PD98059 (10 μmol·L-1) 组(PD组)。参照文献[6]介绍的方法制备全心缺血/再灌注损伤模型,大鼠迅速断头处死,取出心脏,置于4℃ K-H液中,立即悬挂于Langendorff灌注装置上,经主动脉逆行灌注K-H液(NaCl 118.5、KCl 4.7、MgSO41.2、KH2PO41.2、CaCl22.5、NaHCO325.0、葡萄糖11.0,单位: μmol·L-1)。K-H液用95% O2∶5% CO2混合气进行预充平衡,维持K-H液pH值7.35~7.45,灌注压9.8 kPa,温度37℃。将一注水橡胶球囊经左心耳置入至左心室,连接PowerLab压力传感器,测量左心室压力。操作完成,待心脏稳定后,有明显心律失常或左室发展压(left ventricular developed pressure, LVDP)<12 kPa的心脏弃之不用。通过夹闭灌流导管停灌40 min,恢复K-H液灌注90 min制备大鼠离体心脏缺血/再灌注损伤模型。CON组持续灌注K-H液175 min。I/R组于缺血/再灌注之前灌注K-H液45 min。IPC组先灌注15 min,再进行缺血预处理,即缺血5 min,恢复灌注K-H液5 min,共3个循环,然后制备心脏缺血/再灌注损伤模型。MPC组先灌注K-H液15 min,再灌注含1 μmol·L-1吗啡的K-H液5 min,再灌注不含吗啡的K-H液5 min,共3个循环;MPD组于MPC前10 min持续灌注含有PD98059(10 μmol·L-1)的K-H液,直至再灌注5 min;PD组在相同时间点灌注含PD98059(10 μmol·L-1)的K-H液,但不进行预处理,然后分别制备心脏缺血/再灌注损伤模型。
1.3LDH活性检测所有组分别于心脏稳定灌注15 min(基线)、再灌注5、10 min时,收集冠脉流出液,采用化学比色法检测LDH活性。
1.4Westernblot测定p-ERK相对表达于再灌注10 min时取下大鼠心脏(每组4只),加入RIPA裂解液,冰上静置30 min后,15 000 r·min-1、4℃离心10 min后吸取上清,BCA法测定蛋白浓度。蛋白质样本按1 ∶4加入5×上样缓冲液,95℃变性5 min,使用蛋白预制胶进行SDS-PAGE电泳。140 V电泳60 min,然后电转移至PVDF膜,将PVDF 膜在封闭液(含5%脱脂牛奶的TBST 溶液)中室温孵育2 h,TBST液漂洗10 min×3次,分别加入p-ERK、ERK单克隆兔抗(1 ∶800稀释)或β-actin(1 ∶500稀释)单克隆鼠抗,4℃孵育过夜。次日TBST液漂洗10 min×3次,在山羊抗兔IgG(1 ∶10 000稀释)或山羊抗小鼠IgG(1 ∶20 000稀释)中室温孵育1 h,TBST液漂洗5 min×3次,采用ECL发光试剂盒,在Tanon全自动凝胶成像系统中自动曝光采集图像。采用Image J 1.38e图像分析软件进行条带光密度分析,以p-ERK蛋白与ERK及β-actin蛋白灰度值的比值表示p-ERK的相对表达量。
1.5心脏梗死体积测定每组另外6只心脏于再灌注90 min时,取下大鼠心脏;置于-80℃冰箱中,待充分冷冻后,行冰冻切片,沿心脏纵轴线切5~6片,每片厚约2 mm。切片放于1% TTC溶液中,37℃水浴锅中孵育15 min;随后用10%中性福尔马林液固定过夜,缺血危险区中呈白色为梗死区,呈红色为非梗死区。采用Image J 1.38e图像分析软件,计算缺血危险区(area at risk, AAR)、 梗死区(infarct size, IS) 及IS/AAR比值。
1.6心功能指标检测通过Power Lab系统分别记录各组平衡15 min(baseline)、预处理结束后(treatment),再灌注90 min(Reperfusion-90, Re-90)时的心率(heart rate, HR)、LVDP以及冠脉流出液(coronary out-flow, CF)。

2 结果
2.1心肌梗死体积Fig 1的TTC结果显示,与对照组比较,I/R组IS/AAR明显增加;而IPC和MPC组明显减少了IS/AAR,这提示MPC可以发挥心肌保护作用。与MPC比较,MPD组IS/AAR增加,提示ERK抑制剂能够完全或部分阻断吗啡的心肌保护作用。PD组IS/AAR与对照组差异有统计学意义,与I/R组差异无统计学意义。各组之间AAR差异无统计学意义(P>0.05)。
2.2冠脉流出液LDH活性如Fig 2所示,与对照组LDH活性比较,再灌注5、10 min时,I/R组LDH活性明显升高,而IPC和MPC明显降低了LDH的活性,ERK抑制剂阻断了MPC降低LDH的作用。PD组各时间点LDH活性与对照组比较差异有统计学意义,与I/R组比较差异无统计学意义。各组LDH基础值(baseline)差异无统计学意义。
2.3心功能测量与对照组比较,再灌注90 min(Re-90)末时的LVDP、HR、CF差异有统计学意义;与I/R组比较,MPC能够促进再灌注90 min(Re-90 min)末时的心功能恢复(Tab 1)。
2.4MPC对ERK蛋白磷酸化的影响Fig 3 Western blot结果显示,与对照组比较,I/R组p-ERK轻微增加,但无统计学意义(P>0.05),而IPC和MPC组明显增加了p-ERK的表达(P<0.01)。
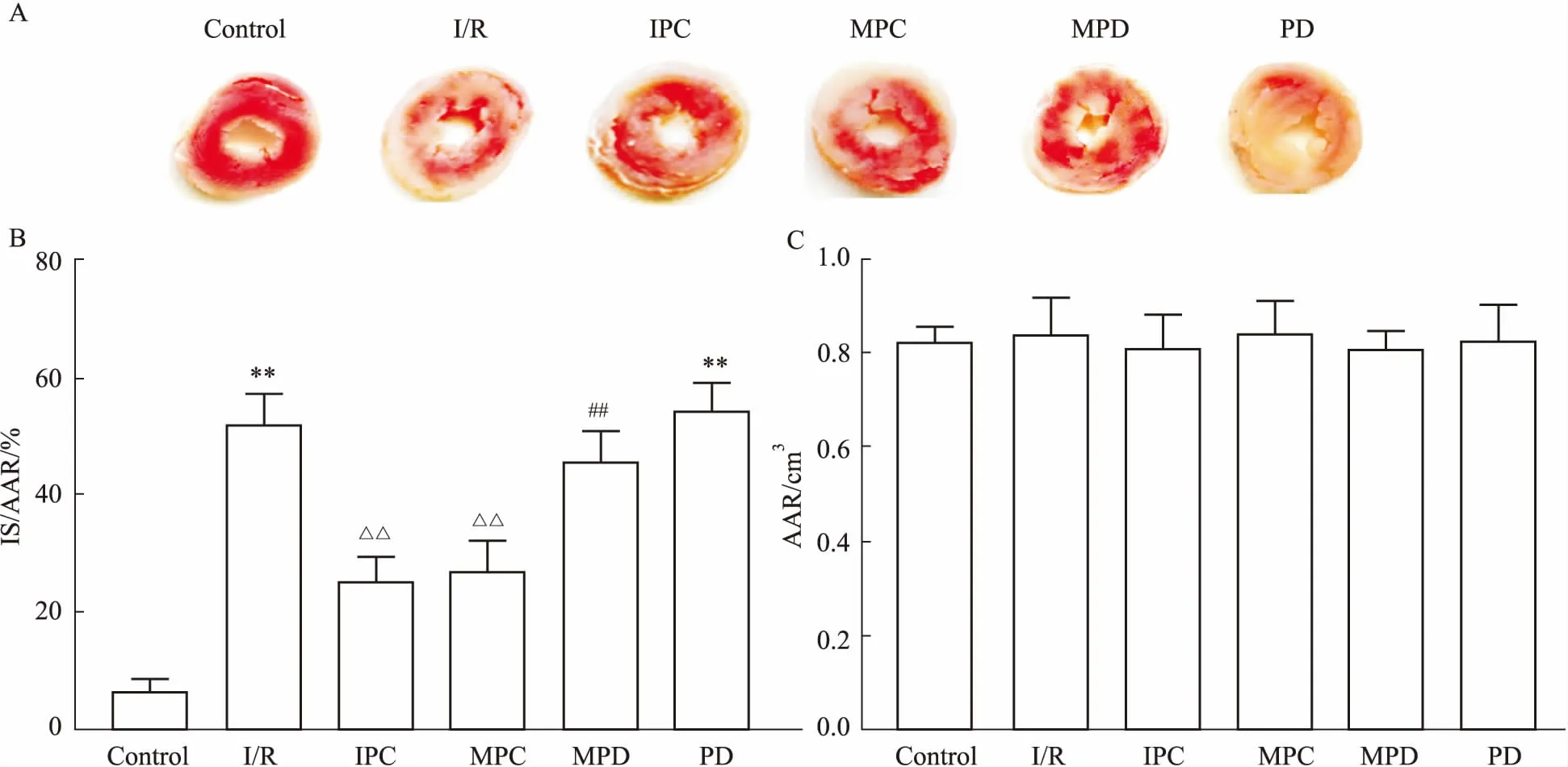
Fig 1 Infarct size expressed by IS/AAR using TTC staining (±s, n=6)
A: Representative images of TTC staining showing infarct size (white) and area at risk (red); B: Myocardial injury expressed as a percentage of infarct size (IS) with respect to the area at risk (AAR).**P<0.01vscontrol group;△△P<0.01vsI/R group;##P<0.01vsMPC group; C: The value of AAR.
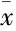
Tab 1 The hemodynamic parameters (±s, n=6)
**P<0.01vscontrol group;△P<0.05,△△P<0.01vsI/R group
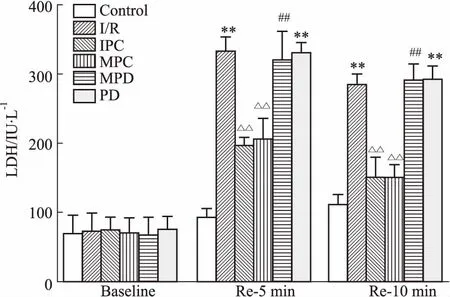
Fig 2 LDH activity of coronary effluent (±s, n=6)
The LDH activity was detected at baseline, 5 and 10 min of reperfusion, respectively.**P<0.01vscontrol group;△△P<0.01vsI/R group;##P<0.01vsMPC group.
与MPC组比较,ERK抑制剂明显降低了MPC上调p-ERK的作用(P<0.01)。
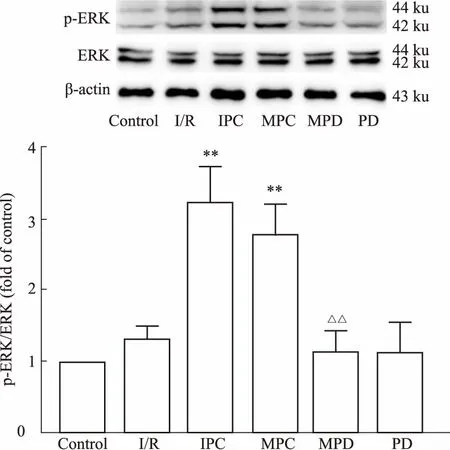
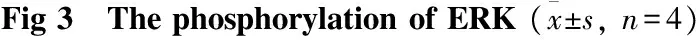
**P<0.01vsI/R group;△△P<0.01vsMPC group
3 讨论
围手术期心肌损伤是心脏手术后的重要并发症,严重影响患者的预后和转归。其中,由于体外循环、心脏长时间停跳所致的全心缺血/再灌注损伤,是引起围手术期心肌损伤和功能障碍的重要原因之一[7]。本研究采用大鼠离体心脏全心停灌-再灌注模型,模拟临床体外循环下心脏或冠脉手术过程中的心脏停跳-复跳过程,证明吗啡预处理对大鼠全心缺血/再灌注损伤具有明显减轻作用,并发现ERK信号通路蛋白活化在吗啡预处理介导的心肌保护中发挥重要作用。
本研究参照文献[6]的方法,采用Langendorff离体灌注系统制备全心缺血40 min,再灌注90 min的损伤模型。结果表明,全心缺血/再灌注可造成广泛性心肌梗死,再灌注5、10 min时冠脉流出液LDH活性明显升高,而且再灌注结束时LVDP明显降低,提示大鼠离体全心缺血/再灌注损伤模型制备成功。全心缺血/再灌注损伤不同于冠脉结扎引起的局部心肌损伤,心肌梗死的面积更为广泛,对心脏功能的影响更为明显。因此,利用大鼠全心缺血/再灌注损伤模型,有利于更好地模拟临床实际情况,为心脏或冠脉手术患者的围手术期心肌保护策略研究提供基础。
吗啡是临床麻醉中常用的阿片类镇痛药物,广泛应用于心血管手术麻醉和术后镇痛,与经典的IPC相比,在心脏或冠脉手术前应用吗啡预处理,具有给药方便、无损伤性、符合伦理等优点。大量研究表明,吗啡预处理可模拟IPC,明显减轻大鼠冠状动脉结扎诱导的局部心肌缺血/再灌注损伤[8-9],但关于其对抗全心缺血/再灌注损伤的研究相对较少。本研究发现,吗啡预处理可明显降低心肌梗死面积以及再灌注5、10 min的LDH活性,且再灌注结束时LVDP明显改善,与经典IPC介导的心肌保护效应相当,说明吗啡预处理可对抗全心缺血/再灌注损伤,并有效促进心脏功能恢复。与本研究一致的是,临床试验研究表明,吗啡术前给药可预防体外循环下心脏手术或冠脉手术后心肌缺血损伤、促进心肌功能恢复[10],然而其作用机制尚不明确。
阿片类药物预处理主要通过激活心脏上的阿片受体,其中以激动δ和κ阿片受体为主,继而活化下游的多种蛋白激酶,如蛋白激酶C (protein kinase C, PKC)、蛋白激酶B(protein kinase B, Akt)、ERK等。这些信号通路的活化,最终导致线粒体渗透性转化孔(mitochondrial permeability transition pore, mPTP)关闭,从而减少线粒体内凋亡因子的释放,抑制心肌细胞凋亡;或通过开放线粒体ATP敏感钾通道,使得钙通道关闭,抑制钙离子超载对心肌细胞的损伤[11]。ERK蛋白是一种重要的促生存激酶,再灌注期间ERK通路激活可通过抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)活性,继而作用于mPTP,维持线粒体的完整性及功能[11-12]。已有研究报道,阿片类药物减轻局部心肌缺血/再灌注损伤与ERK信号通路活化密切相关[13-14],但吗啡预处理对抗全心缺血/再灌注损伤是否也通过激活ERK信号通路,仍不清楚。本实验中,吗啡预处理和IPC均能明显增强ERK磷酸化水平,提示吗啡预处理介导的心肌保护作用与ERK激酶活化有关。ERK信号通路抑制剂PD98059可明显阻断吗啡的心肌保护作用,增加心肌梗死面积和LDH活性,并影响心脏功能恢复,进一步提示吗啡预处理减轻全心缺血/再灌注损伤,可能依赖于ERK信号蛋白的活化,然而其下游信号分子机制仍待进一步探讨。
综上所述,本研究证明吗啡预处理能够减轻大鼠离体全心缺血/再灌注损伤,促进再灌注期间心脏功能的恢复,其心肌保护作用可能依赖于ERK信号蛋白的磷酸化,为临床心脏手术患者围手术期心肌损伤的防治提供了理论基础和依据。
(致谢:感谢安徽医科大学第二附属医院中心实验室为本课题研究提供仪器设备和技术支持。)
[1] Zhao Z G, Tang Z Z, Zhang W K, et al. Protective effects of embelin on myocardial ischemia-reperfusion injury following cardiac arrest in a rabbit model[J].Inflammation, 2015,38(2): 527-33.
[2] Wang G X, Zhang Q, Yuan W, et al. Enalapril protects against myocardial ischemia/reperfusion injury in a swine model of cardiac arrest and resuscitation[J].IntJMolMed, 2016,38(5): 1463-73.
[3] 韩正怡, 何淑芳, 程 洁, 等. 吗啡预处理对 H9c2 心肌细胞缺氧/复氧时 microRNA 表达的影响[J]. 中国药理学通报, 2015,31(11): 1552-7.
[3] Han Z Y, He S F, Cheng J, et al. Effects of morphine preconditioning on expression of microRNAs during hypoxia-reoxygenation in H9c2 myocardial cells[J].ChinPharmacolBull, 2015,31(11): 1552-7.
[4] 张 引,金世云,何淑芳,等. JNK信号通路和p38MAPK信号通路在吗啡预处理减轻心力衰竭大鼠心肌缺血/再灌注损伤中的作用[J].中华麻醉学杂志,2016,36(2):219-22.
[4] Zhang Y, Jin S Y, He S F, et al. Role of JNK and p38MAPK signaling pathways in reduction of ischemia-reperfusion injury by morphine preconditioning in rats with heart failure[J].ChinJAnesthesiol, 2016,36(2): 219-22.
[5] Liu Z, Chen J M, Huang H, et al. The protective effect of trimetazidine on myocardial ischemia/reperfusion injury through activating AMPK and ERK signaling pathway[J].Metabolism, 2016,65(3): 122-30.
[6] Feng J H, Fischer G, Lucchinetti E, et al. Infarct-remodeled myocardium is receptive to protection by isoflurane postconditioning——role of protein kinase B/Akt signaling[J].Anesthesiology, 2006,104(5):1004-14.
[7] Woods C E, Shang C, Taghavi F, et al.Invivopost-cardiac arrest myocardial dysfunction is supported by Ca2+/calmodulin-dependent protein kinase Ⅱ-mediated calcium long-term potentiation and mitigated by Alda-1, an agonist of aldehyde dehydrogenase type 2[J].Circulation, 2016,134(13): 961-77.
[8] 胡 军, 张 野, 陆 姚, 等. NO/cGMP 信号通路在鞘内吗啡预处理减轻大鼠心肌缺血/再灌注损伤中的作用[J]. 中国药理学通报, 2014,30(6): 829-33.
[8] Hu J, Zhang Y, Lu Y, et al. Role of NO/cGMP in the cardioprotective effects of intrathecal morphine preconditioning against myocardial ischemia-reperfusion injury in rats[J].ChinPharmacolBull, 2014,30(6): 829-33.
[9] Zhang X, Li J, Yang J, et al. Fentanyl combined with butorphanol protects myocardial ischemia/reperfusion injury via κ-opioid receptor-mediated Nrf2-ARE signaling[J].IntJClinExpMed, 2016,9(2): 2500-6.
[10] Murphy G S, Szokol J W, Marymont J H, et al. Opioids and cardioprotection: the impact of morphine and fentanyl on recovery of ventricular function after cardiopulmonary bypass[J].JCardiothoracVascAnesth, 2006,20(4): 493-502.
[11] Headrick J P, See Hoe L E, Du Toit E F,Peart J N. Opioid receptors and cardioprotection- ‘opioidergic conditioning’ of the heart[J].BrJPharmacol, 2015,172(8): 2026-50.
[12] Wu N, Zhang X W, Guan Y, et al. Hypercholesterolemia abrogates the cardioprotection of ischemic postconditioning in isolated rat heart: roles of glycogen synthase kinase-3 beta and the mitochondrial permeability transition pore[J].CellBiochemBiophys, 2014,69(1): 123-30.
[13] He S F, Jin S Y, Wu H, et al. Morphine preconditioning confers cardioprotection in doxorubicin-induced failing rat hearts via ERK/GSK-3beta pathway independent of PI3K/Akt[J].ToxicolApplPharmacol, 2015,288(3): 349-58.
[14] Peart J N, Gross E R, Gross G J. Opioid-induced preconditioning: recent advances and future perspectives[J].VasculPharmacol, 2005,42(5-6): 211-8.
