百里香黄酮微胶囊的制备及抑菌活性研究
2018-01-23王娣柯春林谢海伟曹珂珂李妍许晖
王娣,柯春林,谢海伟,曹珂珂,李妍,许晖
(蚌埠学院 生物与食品工程系,安徽 蚌埠 233030)
百里香(Thymusmongolicus)属唇形科属,在我国主要分布于长江以北区域,国际标准化组织(ISO)确定它为食品调味品之一[1-4],可用于烹饪时除腥提鲜,有较高的食用价值。国内外学者研究发现百里香属植物茎叶中富含黄酮、百里香酚等活性成分,可用于医药、食品等领域[5-9]。但百里香活性成分易受外界环境影响而挥发和氧化,限制了其在食品工业中的应用。微胶囊技术使囊心被壁材包埋,与外界环境隔离,免受不良因素造成的影响[10-14]。酵母细胞是天然微胶囊原料,小分子物质可以渗透进入细胞形成微胶囊[15]。本文以安琪酵母为壁材,采用响应面试验优化百里香黄酮微胶囊制备工艺,研究不同因素对其微胶囊形成的影响,并对黄酮微胶囊进行抑菌作用初探,以期为百里香活性物质的提取利用提供理论依据。
1 材料与方法
1.1 材料与试剂
百里香(市售,含水量10.5%):粉碎过筛(60目)备用;聚酰胺树脂(30~60目):国药集团化学试剂有限公司;安琪活性干酵母:湖北安琪酵母股份有限公司;芦丁标品(纯度≥95%)、无水乙醇(分析纯)、氯化钠(分析纯):中国医药(集团)上海化学试剂公司。
大豆油:实验室自榨提供;金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli):蚌埠学院生物工程实验中心微生物实验室保藏;单增李斯特菌(Listeriamonocytogenes,编号:1.10753):中科院微生物所购买;胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA):青岛海博生物技术有限公司。
1.2 仪器与设备
AB323电子天平 上海海康电子仪器厂;XFB-200高速中药粉碎机 吉首市中诚制药机械厂;CHR-ST冷冻干燥机 德国Christ公司;MZKR022-R高速冷冻离心机 德国Hettich公司;SHA-B恒温震荡器 常州电器有限公司;DL-360A超声清洗器 上海之信仪器有限公司;RE200B旋转蒸发仪 巩义市予华仪器有限责任公司;YXQ-LS-50G灭菌锅 上海博讯有限公司;SHP-250生化培养箱 上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 百里香黄酮提取液制备和含量测定
1.3.1.1 百里香黄酮提取液的制备
准确称取10.0 g 百里香粉,加入70%乙醇,超声波50 ℃辅助提取百里香黄酮,抽滤后的滤液经聚酰胺树脂分离纯化,90%乙醇洗脱,40 ℃旋转蒸发浓缩至10 mL备用。
1.3.1.2 百里香黄酮含量的检测
a.标准曲线的制定
准确称取芦丁标准品0.020 g,用30%乙醇定容至100 mL容量瓶中。吸取芦丁标准溶液0,1.0,2.0,3.0,4.0,5.0 mL,各加入0.3 mL 5%的NaNO2溶液6 min(还原),加0.3 mL 10%的Al(NO3)3溶液6 min(络合),再加4 mL 1 mol/L NaOH溶液,用30%乙醇定容于10 mL容量瓶中,摇匀显色15 min,510 nm处测吸光度[16]。得芦丁标准曲线回归方程y=0.0115x+0.0063,R2=0.9997,具有良好的线性关系,见图1。

图1 芦丁标准曲线Fig.1 The standard curve of rutin
b.黄酮提取液含量检测
准确吸取样液1 mL,置于10 mL容量瓶中,按步骤a测定吸光度,计算得到黄酮含量。
1.3.2 百里香黄酮微胶囊的制备
1.3.2.1 酵母细胞预处理
称取一定量的安琪活性干酵母,加入10倍量的5% NaCl溶液,50 ℃水浴恒温振荡24 h,离心,无菌水洗3次,冷冻干燥,备用。
1.3.2.2 百里香黄酮微胶囊的制备方法
将百里香黄酮浓缩液按比例加入预处理好的酵母细胞中,恒温振荡,离心,无菌水洗3 次,冷冻干燥得百里香黄酮微胶囊。
1.3.3 黄酮微胶囊的制备工艺优化
1.3.3.1 单因素试验
以包埋率为指标,研究不同芯壁比、包埋时间以及包埋温度对百里香黄酮微胶囊制备的影响。
a.芯壁比对包埋率的影响
以1∶2,1∶1,2∶1,3∶1,4∶1 不同的芯壁比(g/g)将百里香黄酮浓缩液加到预处理后的酵母中,40 ℃恒温水浴振荡6 h,5000 r/min离心10 min,冷冻干燥,测定百里香黄酮包埋率。
b.包埋时间对包埋率的影响
以芯壁比3∶1(g/g)将百里香黄酮浓缩液加入预处理后的酵母中,40 ℃恒温振荡2,4,6,8,10 h,5000 r/min离心10 min,冷冻干燥,测定百里香黄酮包埋率。
c.包埋温度对包埋率的影响
以芯壁比3∶1(g/g)将百里香黄酮浓缩液加到预处理后酵母中,不同温度30,40,50,60,70 ℃下振荡6 h,5000 r/min离心10 min,冷冻干燥,测定百里香黄酮包埋率。
百里香黄酮包埋率=1-未包埋的游离黄酮量加入的总黄酮量×100%。
1.3.3.2 响应面试验优化
采用Design-Expert V8.0.6软件,在单因素试验基础上,以芯壁比(A)、包埋时间(B)、包埋温度(C)为自变量,百里香黄酮包埋率为响应值,进行Box-Behnken试验设计,三因素三水平响应面试验见表1。
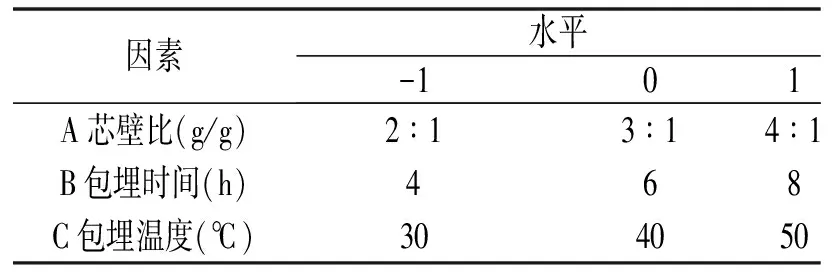
表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiment
1.3.4 百里香黄酮微胶囊抑菌活性研究
接种斜面细菌菌落至50 mL灭菌冷却的TSB中,120 r/min 37 ℃培养过夜,取0.1 mL培养液接入10 mL TSB中继续培养8 h,得到对数生长期细胞,离心后用pH 7.2的PBS(0.01 mol/L)洗涤2次,悬浮菌体浓度至106~107cfu/mL备用。精确称取百里香黄酮微胶囊5.0,10.0,15.0,20.0,25.0 mg,紫外灭菌20 min,置于10 mL菌悬液中处理10 min,以不加微胶囊作为对照处理,处理后的液体吸取0.10 mL稀释液涂布于TSA平皿中(n=3),37 ℃培养24 h,计算菌落数,计算百里香黄酮微胶囊的抑菌率。
抑菌率(%)=空白平均菌落数-微胶囊处理后平均菌落数空白平均菌落数。
2 结果与分析
2.1 单因素试验结果

图2 芯壁比对百里香黄酮包埋率的影响Fig.2 The effect of ratio of core material and wall material on embedding rate of thyme flavonoids
由图2可知,芯壁比(g/g)的变化对百里香黄酮包埋率的影响较大,随着芯壁比的增大,包埋率出现快速上升,到3∶1 时包埋率最大,达到饱和。综合考虑,选择芯壁比3∶1左右为宜。

图3 包埋时间对百里香黄酮包埋率的影响Fig.3 The effect of embedding time on embedding rate of thyme flavonoids
由图3可知,随着包埋时间的延长,百里香黄酮的包埋率呈上升趋势,在6 h 时百里香黄酮的包埋率达到最高,之后趋于稳定,基本保持不变。综合考虑,选取包埋时间6 h 左右为宜。

图4 包埋温度对百里香黄酮包埋率的影响Fig.4 The effect of embedding temperature on embedding rate of thyme flavonoids
由图4可知,随着包埋温度的增加,百里香黄酮包埋率先略上升后下降,可能是开始时扩散速率随着温度的升高而增大,导致包埋率出现上升,而当温度继续升高超过50 ℃时,高温使部分酵母细胞蛋白质变性失活,同时高温对百里香黄酮可能也有一定程度的破坏,因此,选取40 ℃左右为宜。
2.2 响应面试验结果与分析
2.2.1 响应面试验结果
响应面试验结果见表2。

表2 响应面试验设计及结果Table 2 The experimental design and results for response surface experiment
2.2.2 数型的建立与响应面方差分析结果
采用Design-Expert V8.0.6软件对响应面试验数据进行分析,得到的百里香黄酮微胶囊包埋率与各因变量的模拟方程为:Y=68.24+0.96A+0.46B-0.48C-2.31A2-1.50B2-0.84C2-0.39AB-0.050AC-0.83BC。回归方程抛物面开口向下,具有极大值点,可以对百里香黄酮微胶囊工艺条件进行优化[17,18]。方差分析结果见表3。

表3 二次响应面回归模型方差分析Table 3 Analysis of variance of quadratic response surface regression model
注:*,P<0.05表示差异显著;**,P<0.01表示差异极显著。
由表3可知,该回归模型的P<0.0001,极显著;方程失拟项值为0.0805>0.05,不显著,说明该模型与实际情况拟合度比较好,可以代替试验真实点对百里香黄酮微胶囊工艺试验结果进行分析和预测。R2=0.9795说明该回归模型的拟合度比较好;模型调整系数RAdj2=0.9532,说明该模型的实际值与预测值之间相关性较好;模型精密度为19.959,说明该模型是可行的[19]。由表3中F值的大小判断各因素对百里香黄酮微胶囊包埋率影响的强弱,F值越大,对包埋率影响作用越强[20-23]。各因素影响大小为A(芯壁比)>C(包埋温度)>B(包埋时间)。其中A对百里香黄酮包埋率的影响极显著(P<0.01),B,C对百里香黄酮包埋率的影响显著(P<0.05)。
2.2.3 响应面优化分析
等高线图能直观反映影响因素之间交互作用是否显著,圆形表明交互作用不显著,椭圆形则表明交互作用显著[24]。等高线和响应面图见图5。


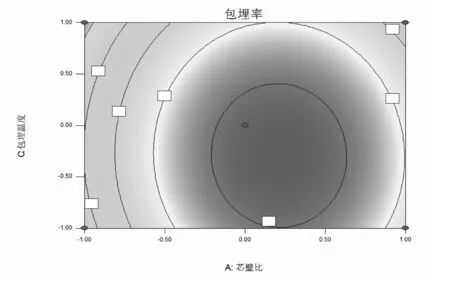


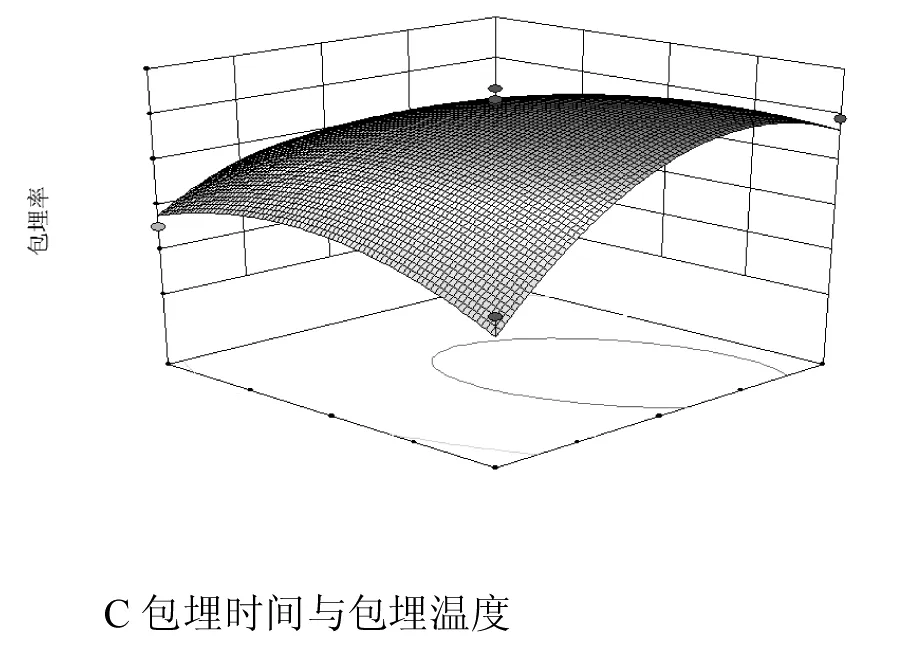
图5 各因素交互对百里香黄酮包埋率影响的等高线和响应面图
由图5中a可知,随着芯壁比和包埋时间的增加,百里香黄酮包埋率先升高后缓慢降低。适当地增大芯壁比可以提高百里香黄酮包埋率。由图5中b可知,随着芯壁比与包埋温度的增加,百里香黄酮包埋率同样出现先增加后下降的趋势。由图5中c可知,随着包埋时间和包埋温度的增加,百里香黄酮包埋率先快速增加后下降。
2.2.4 验证试验
利用Design-Expert V8.0.6软件预测百里香黄酮微胶囊制备的最优工艺条件为芯壁比3.19∶1,包埋时间6.48 h,包埋温度35.9 ℃,在此条件下百里香黄酮微胶囊包埋率理论上可达68.49%。为操作方便,将最佳工艺条件修正为芯壁比3∶1,包埋时间6.5 h,包埋温度36 ℃,百里香黄酮微胶囊包埋率平均值为(68.50±0.36)%(n=3),与预测值接近。
2.3 百里香黄酮微胶囊的抑菌活性研究
百里香黄酮微胶囊的抑菌作用见表4~表6。

表4 百里香黄酮微胶囊浓度对金黄色葡萄球菌抑制率的影响Table 4 Effect of thyme flavonoid microcapsule content on inhibitory rate of S.aureus

表5 百里香黄酮微胶囊浓度对单增李斯特菌抑制率的影响Table 5 Effect of thyme flavonoid microcapsule content on inhibitory rate of L.monocytogenes

表6 百里香黄酮微胶囊浓度对大肠杆菌抑制率的影响Table 6 Effect of thyme flavonoid microcapsule content on inhibitory rate of E.coli
试验结果显示:百里香黄酮微胶囊对3种常见食品污染菌均有一定抑制作用。当微胶囊量添加较小时,对E.coli和L.monocytogenes的抑制效果均不明显;但随着百里香黄酮微胶囊浓度的增加,对S.aureus,E.coli和L.monocytogenes的抗菌能力在逐渐增强。经SPSS 20.0统计分析,不同浓度的百里香黄酮微胶囊对3种细菌抑制率的影响具有显著差异(P<0.05)。当黄酮微胶囊浓度达到20 mg/mL时,对S.aureus,E.coli和L.monocytogenes的抑制率(%)分别为98.50±0.07,87.10±0.05和93.20±0.13,再继续增加黄酮微胶囊的量,细菌抑制率增加不明显。数据分析对比得出:在黄酮微胶囊浓度相同时,对S.aureus的抑制率要比E.coli和L.monocytogenes的抑制率高,黄酮微胶囊对细菌的抑菌效果大小为:S.aureus>L.monocytogenes>E.coli。
3 结论
采用响应面试验对百里香黄酮微胶囊进行制备,结果表明芯壁比对包埋率的影响最大,芯壁比>包埋温度>包埋时间,得到百里香黄酮微胶囊制备最优条件为芯壁比3∶1,包埋时间6.5 h,包埋温度36 ℃,包埋率为(68.50±0.36)%(n=3)。百里香黄酮微胶囊抑菌作用研究表明:百里香黄酮微胶囊对S.aureus,E.coli和L.monocytogenes均有一定抑制作用,抑制作用大小为S.aureus>L.monocytogenes>E.coli。
[1]Rasooli I,Abyaneh M R.Inhibitory effects of thyme oils on growth and aflatoxin production byAspergillusparasiticus[J].Food Control,2004,15(6):479-483.
[2]员铭,吕国华.百里香应用价值研究[J].安徽农学通报,2007,13(2):89-91.
[3]卞金山,杜广明,赵波.我国百里香属植物研究进展[J].草原与草坪,2007(1):78-81.
[4]王娣,任茂生,许晖.利用微胶囊双水相体系萃取百里香精油的研究[J].中国调味品,2012,37(4):31-33.
[5]Horváth G,Kovács K,Kocsis B,et al.Effect of thyme (ThymusvulgarisL.)essential oil and its main constituents on the outer membrane protein composition of Erwinia strains studied with microfluid chip technology[J].Chromatographia,2009,70:1645-1650.
[6]Hotta,Nakata M,Katsukawa R,et al.Carvacrol,a component of thyme oil,activates PPAR-α and γ and suppresses COX-2 expression[J].The Journal of Lipid Research,2010,51:132-139.
[7]Tugca Bilenler,Incilay Gokbulut,Kubra Sislioglu,et al.Antioxidant and antimicrobial properties of thyme essential oil encapsulated in zein particles[J].Flavour and Fragrance Journal,2015,30:392-398.
[8]Dragoljub L Miladinovic,Budimir S Ilic,Branislava D Kocic,et al.Antibacterial investigation of thyme essential oil and its main constituents in combination with tetracycline[J].Journal of Medicinal Food,2015,18(8):935-937.
[10]王芳,田建文.微胶囊技术在食品抗氧化剂中的应用研究进展[J].食品与机械,2010,26(4):149-152.
[11]郝红,梁国正.微胶囊技术及其应用[J].现代化工,2002,22(3):60-62.
[12]袁青梅,杨红卫,张发广,等.生物农药微胶囊制备研究[J].云南大学学报,2005,27(1):57-59.
[13]王家良,王永斌,陈龙.八角油树脂微胶囊的制备[J].中国粮油学报,2008,23(3):107-110.
[14]王芳,淡小艳,邓刚,等.橘皮精油微胶囊的制备及其稳定性研究[J].中国粮油学报,2012,12(2):78-83.
[15]邹克琴,王金宇,李淑芬,等.利用干酵母细胞微胶囊化丁香油的研究[J].农业工程学报,2006,22(9):206-209.
[16]王娣,柯春林,曹珂珂,等.纤维素酶法提取百里香黄酮的工艺优化研究[J].中国调味品,2016,41(12):38-41.
[17]徐晶,刘欢,夏光辉,等.β-环糊精包埋柠檬醛微胶囊工艺优化及其缓释性能[J].食品科学,2014,35(14):82-86.
[18]阙淼琳,蒋玉蓉,曹美丽,等.响应面试验优化藜麦种子多酚提取工艺及其品种差异[J].食品科学,2016,37(4):7-12.
[19]韩爱芝,蒋卉,贾清华,等.响应面试验优化黑果枸杞花色苷微胶囊制备工艺及其稳定性分析[J].食品科学,2016,37(10):82-87.
[20]Sutaphanit P,Chitpraser T P.Optimisation of microencapsulation of holy basil essential oil in gelatin by response surface methodology[J].Food Chemistry,2014,150(7):313-320.
[21]张初署,禹山林,潘丽娟,等.响应面法优化花生根中白藜芦醇提取工艺研究[J].食品科学,2009,30(6):34-38.
[22]崔凤杰,许泓瑜,舒畅,等.响应曲面法优化灰树花水溶性多糖提取工艺的研究[J].食品科学,2006,27(4):142-147.
[23]陈义勇,窦祥龙,黄友如,等.响应面法优化超声-微波协同辅助提取茶多糖工艺[J].食品科学,2012,33(4):100-103.
[24]代文亮,程龙,陶文沂,等.响应面法在紫杉醇产生菌发酵前体优化中的应用[J].中国生物工程杂志,2007,27(11):66-72.
