正相高效液相色谱法同时测定腌腊肉制品中13-HODE和9-HODE含量
2018-01-22,,*,,*,,,,,
, ,*,,*, ,,,,
(1.南京师范大学金陵女子学院食品科学系,江苏南京 210097; 2.江苏省农业科学院农产品加工研究所,江苏南京 210014; 3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095)
亚油酸(Linoleic acid,LA)是磷脂中主要的多不饱和脂肪酸,也是内皮细胞中甘油三酯的重要组分[1-2]。在自由基诱导的自动氧化或脂氧酶(LOX)作用下的氧化途径中,LA首先被氧化为氢过氧化十八碳二烯酸(hydroperoxyoctadecadienoic acids,HPODEs)[3]。HPODEs不稳定,可以降解形成含羟基、羰基等的一系列次级氧化产物。在谷胱甘肽过氧化物酶(GSH-Px)或Fe2+等作用下,HPODE被还原形成羟基十八碳二烯酸(HODEs)[4]。HODEs主要有两种位置异构体:9-HODE和13-HODE。9-HODE和13-HODE的比例与LA的氧化途径密切相关,自由基诱导的自动氧化产生等量的9-HODE和13-HODE,而在LOX催化的氧化中二者的比例取决于LOX的来源,哺乳动物的LOX催化LA氧化产生的HODEs以13-HODE为主[5]。研究表明,HODEs可诱导巨噬细胞释放白介素1β[6],阻止细胞程序性死亡[7],导致线粒体肿胀[8],体内HODEs水平升高会促进动脉粥样硬化,并与某些癌症的发生或发展密切相关[9-11]。值得关注的是,HODEs广泛存在于富含油脂、高温加工或加工周期较长的食品中[12-13],在腌腊肉制品中含量尤其丰富[14]。虽然外源性HODEs是否具有同样的病理生理学作用尚未可知,但已有研究证实,膳食中13C标记的羟基脂肪酸被摄入后,可不经修饰直接进入人体血液[15]。由此可见,腌腊肉制品中高含量的HODEs具有潜在的食品安全隐患。
目前,HODEs的分析主要应用于病理生理学等研究领域。常用的检测方法有:GC-MS[16-17]、酶联免疫吸附分析[18-19]、放射免疫分析[20]、HPLC-UV[21-22]、LC-MS/MS[23-24]等。近年来,膳食中包括HODEs在内的脂质氧化产物与人类多种疾病的关系越来越受到关注,其分析方法、形成规律及机理等已成为食品科学的一大研究热点。对食品中的13-HODE和9-HODE同时进行分析,可以完整地了解食品中的HODEs含量水平,为进一步开展暴露评估提供数据。另一方面,由此得到的二者比例可用于评价亚油酸氧化中酶促氧化和非酶促氧化途径的贡献,是研究腌腊肉制品中HODEs形成机制的重要内容[4,21]。Püssa 等[13]和Song等[14]建立了肉制品中HODEs含量的LC-MS/MS分析方法。LC-MS/MS在灵敏度、准确性等方面具有显著的优势,但设备昂贵,难以在非专业分析实验室普及推广。本文利用HODEs存在共轭双键,在234 nm具有紫外吸收的特性,建立同时测定9-HODE和13-HODE的正相HPLC-DAD分析方法。方法操作简便、快捷,具有较好的灵敏度和准确性,满足腌腊肉制品9-HODE和13-HODE含量分析的要求,适于非专业化学分析实验室推广应用。
1 材料与方法
1.1 材料与仪器
农家腊肠、肉丁香肠及咸肉 购自附近农贸市场;柴火腊肉、纯肉丁香肠、金字香肠、雨润台式香肠、苏式香肠 购自BHG超市;双汇特嫩方腿香肠、双汇蒜蓉烤肠、双汇台式烤香肠、荷尔美加州香肠、荷尔美鲜嫩香肠 购自苏果超市;标准品0.1 mg/mL 9-HODE及0.5 mg/mL 13-HODE 上海甄准生物科技有限公司;Sep-Pak C18固相萃取柱(500 mg/3 mL) 美国Waters公司;正己烷、异丙醇及乙酸 均为色谱纯;其余试剂 均为分析纯。
高效液相色谱Waters e2695 美国Milford公司,配有二极管阵列检测器(DAD);Biofuge stratos高速离心机 德国Heraeus公司;T25高速匀浆机 德国IKA公司;氮吹仪 美国Organomation公司。
1.2 实验方法
1.2.1 标准溶液的配制 吸取适量体积质量浓度为0.5 mg/mL的13-HODE、0.1 mg/mL 9-HODE的标准溶液小心氮吹,用正己烷分别配制成浓度为20 μg/mL的储备液。再取适量储备液,配制13-HODE和9-HODE的系列混合工作溶液,浓度范围分别为0.5~20 μg/mL和1~12.5 μg/mL,置于-40 ℃储存,有效期为一个月。
1.2.2 固相萃取条件的优化
1.2.2.1 甲醇浓度对净化效果的影响 用不同浓度甲醇水溶液(40%~90%,v/v)配制质量浓度均为0.5 μg/mL的13-HODE,9-HODE的混合标准溶液,分别吸取5 mL溶液过C18小柱(预先用3 mL甲醇、3 mL水进行活化与平衡),然后再进行甲醇(2 mL)洗脱,氮吹后正己烷(200 μL)溶解,并进行色谱分析(每个浓度的甲醇水溶液做三个重复)。
1.2.2.2 甲醇体积对净化效果的影响 用40%(v/v)的甲醇水溶液配制质量浓度均为0.5 μg/mL的13-HODE,9-HODE的混合标准溶液,分别吸取5 mL溶液过C18小柱(预先用3 mL甲醇、3 mL水进行活化与平衡),然后分别选用不同体积的甲醇(0.5~3 mL)洗脱,氮吹后正己烷(200 μL)溶解,并进行色谱分析(每个体积的甲醇水溶液做三个重复)。
1.2.3 样品处理 根据Song等[14]的方法,并作修改。将选购的腌腊肉制品切碎至均匀肉馅状,装入密封袋,置于-20 ℃储存备用。称取2 g样品于80 mL离心管中,加入15 mL甲醇后5000 r/min均质2 min,加水10 mL,混合均匀后3200 r/min离心10 min。吸取5 mL上清液过C18固相萃取柱(预先用3 mL甲醇、3 mL水进行活化与平衡),然后用2 mL甲醇洗脱,洗脱液在30 ℃下氮吹至干,溶于200 μL正己烷(对于HODEs含量高的样品,需根据HODE的含量增加正己烷用量,保证目标分析物的浓度在线性范围内),过0.22 μm滤膜,用于色谱分析。
样本处理换算公式:
HODE的含量(μg/g)=5c×v/2
其中,c为样品中HODE的质量浓度(μg/mL),v为氮吹后溶于正己烷的体积(mL),2为样品的质量(g),5为总样品液与C18小柱上样液的体积之比。
1.2.4 色谱条件 色谱柱:Lichrosorb Si 60(250 mm×4.0 mm,5 μm);流动相:正己烷/异丙醇/乙酸(98∶2∶0.5,v/v/v);流速:1 mL/min;柱温:30 ℃;检测器:二极管阵列(DAD),波长:234 nm;进样量:10 μL。
1.2.5 标准曲线的绘制 将13-HODE和9-HODE系列混合标准工作溶液,进行HPLC-DAD分析,每个浓度重复测定3次。以标准品浓度(μg/mL)为x,以峰面积为y,绘制标准曲线。按照3倍信噪比(S/N=3)和10倍信噪比(S/N=10)计算方法的检出限和定量限,并根据样本处理换算公式得到样本的检出限和定量限。
1.2.6 精密度实验 分别选用高、中、低HODEs含量的三种腌腊肉制品,按照1.2.3进行样品处理。日内精密度实验:在1 d内,样品按6个重复进行处理、并完成高效液相色谱分析;日间精密度实验:每天按3个重复处理样品,并完成高效液相色谱分析,连续进行4 d。以测得的结果分别计算日内和日间的精密度(以相对标准偏差RSD表示)。
1.2.7 回收率实验 分别选用高、中、低HODEs含量的三种腌腊肉制品,进行13-HODE和9-HODE的回收率实验。根据样品中13-HODE和9-HODE的含量分别添加水平相近的13-HODE和9-HODE标准品,按1.2.3进行处理,每个添加水平做3个重复,测定其13-HODE和9-HODE的含量,计算两种目标分析物的回收率。
1.2.8 两种方法同时检测14种腌腊肉制品中13-HODE和9-HODE的含量 运用本文建立的HPLC-DAD方法对14种腌腊肉制品中的13-HODE和9-HODE的含量进行测定,同时根据Song等[14]的方法,采用LC-MS/MS对这几种腌腊肉制品中的目标分析物进行测定,并对其测定结果进行比较,进一步验证本方法的准确性。
1.3 数据处理
采用SPSS statistics 17.0进行单因素方差分析与相关性分析。
2 结果与分析
2.1 固相萃取条件的优化
生物样本中HODEs的分析检测多采用溶剂萃取的方法,常用的提取溶剂有乙酸乙酯[21]、甲醇[16-17]、乙醚等[22,25]。因此,本文选择乙酸乙酯、甲醇、乙醚等溶剂提取腌腊肉制品中的HODEs,并对提取效率进行了比较。结果表明,甲醇的提取效率最高。但腌腊肉制品富含蛋白、脂肪等,简单的液液萃取难以有效去除这些杂质,影响HODEs的定性、定量分析。Pussa 等[13]和Song等[14]运用固相萃取(SPE)进行净化,采用提取液直接过C18小柱的方法,可以满足LC-MS/MS分析的要求。但这样的SPE方法不适于本文建立的正相HPLC-DAD检测方法。
为了优化腌腊肉制品甲醇提取液中HODEs的固相萃取条件,本文利用HODEs标准溶液,观察了不同浓度甲醇水溶液(40%~90%,v/v)对HODEs在C18小柱上保留的影响,结果如图1。由图1可看出,当甲醇浓度大于65%(v/v)时,溶液中的HODEs不能完全保留在C18小柱上。最终将提取液甲醇浓度调整至60%(v/v),然后离心、上样,以确保样品中的HODEs完全保留在C18小柱上。在此基础上,进一步研究了洗脱C18小柱上HODEs所需的最小甲醇使用量,结果如图2。由图2可知,当洗脱液甲醇体积≥1.5 mL时,均可将HODEs从C18小柱上洗脱下来,最终选择2 mL甲醇用量以求完全洗脱HODEs。本文建立的腌腊肉制品中HODEs的C18小柱SPE净化方法,最大限度的去除了杂质,较好地体现了SPE净化、浓缩的特点。
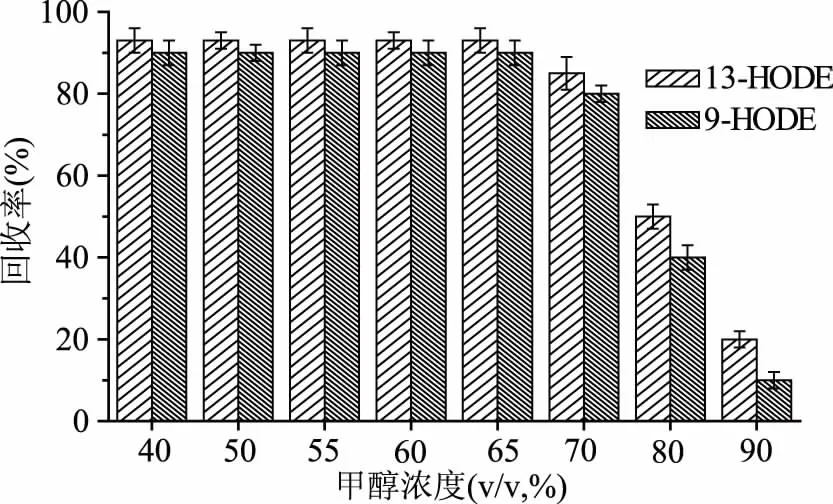
图1 甲醇浓度对回收率的影响Fig.1 Effects of methanol concentration on recovery rate
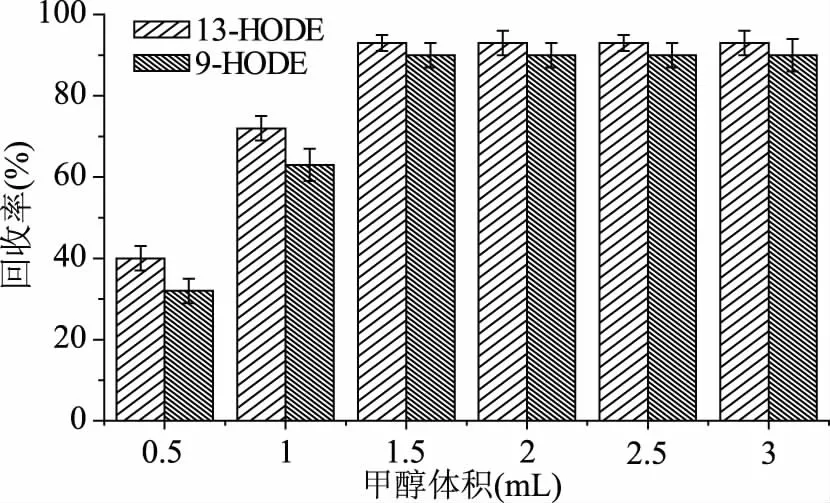
图2 甲醇体积对回收率的影响Fig.2 Effects of methanol volume on recovery rate
2.2 色谱条件的优化
HODEs具有共轭双键,在234 nm具有的特征吸收使建立HODEs的HPLC-UV或HPLC-DAD分析方法成为可能。为了实现同时分析腌腊肉制品中的13-HODE和9-HODE,本文利用混合标准溶液比较了二者在反相柱(C18柱)和正相柱(Si 60柱)的保留行为。当选用C18柱时,13-HODE和9-HODE的保留时间极为接近,先后采用等度和多种模式的梯度洗脱,都无法实现二者的完全分离。当选用Si 60柱时,二者在等度条件下即可以获得完全分离。因此,本文选用Si 60柱作为色谱分离柱,在此基础上对色谱条件进行了优化。
基于腌腊肉制品成分复杂,本文参考文献[16]选择正己烷、异丙醇为主要成分构成流动相,观察了两者比例对杂质和HODEs分离的影响。正己烷与异丙醇的比例显著影响13-HODE和9-HODE的保留时间,HODEs的保留时间随着异丙醇比例的增加而缩短,当正己烷:异丙醇的比例为98∶2(v/v)时,HODEs的保留时间适中,可与杂质实现基线分离。HODEs为含羟基的长碳链羧酸,流动相pH影响对其保留行为也有影响。本文选择乙酸降低流动相pH,抑制HODEs的解离。在0.05%~1.2%(v/v)的范围内,随着乙酸的增加,HODEs的峰型逐步得到改善,但由于其截止波长(230 nm)与HODEs特征吸收波长234 nm相近,导致基线噪声不断上升,影响HODEs的灵敏度。因此,最终将乙酸浓度设定在0.5%(v/v)。
本文还观察了流速、柱温对HODEs在Si 60柱上保留的影响。流速、柱温的提高均可以缩短HODEs的保留时间,提高分析效率,但过度的增加流速和柱温也会影响HODEs与杂质的分离,同时提升仪器系统压力。综合考虑,本文设定的流速为1 mL/min,柱温为30 ℃。
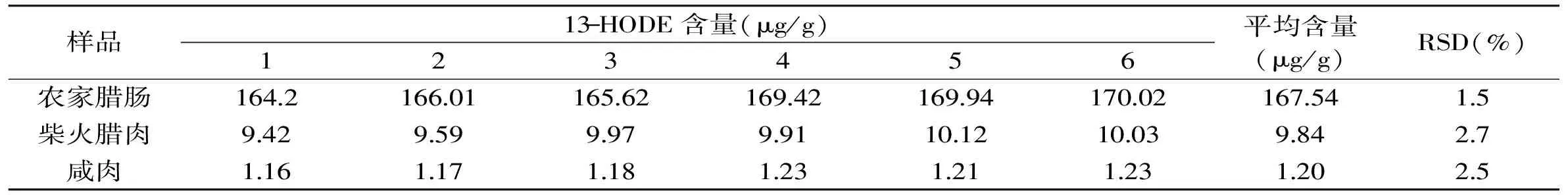
表2 13-HODE的日内精密度实验结果Table 2 Intra-day precision of the method for determination of 13-HODE
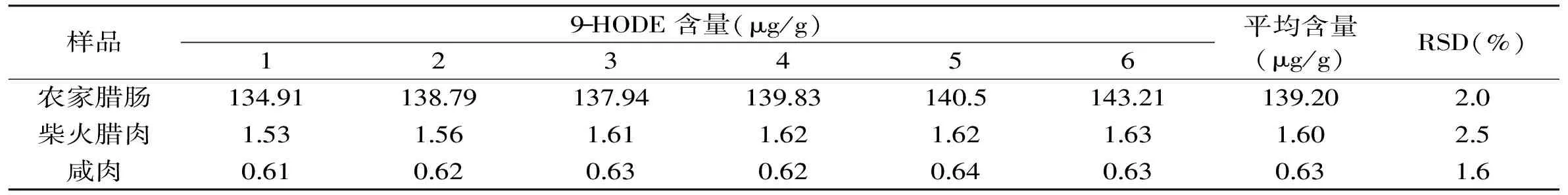
表3 9-HODE的日内精密度实验结果Table 3 Intra-day precision of the method for determination of 9-HODE
在本文设定的色谱条件下,HODEs具有适中的保留时间(分别为7.12 min和9.22 min)和良好的峰型,与杂质完全分离。图1中的A和B分别是13-HODE和9-HODE混合标准品和样品的色谱图。
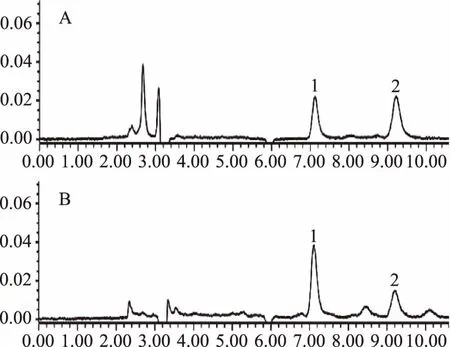
图3 混标与香肠样品的液相色谱图Fig.3 HPLC chromatograms of HODEs in mixed standard solution and in sausage sample注:A:混标1=13-HODE(5.0 μg/mL);2=9-HODE (10.0 μg/mL);B:肉丁香肠1=13-HODE (4.91 μg/g);2=-HODE(2.5 μg/g)。
2.3 线性范围及最低检测限
配制13-HODE和9-HODE浓度分别为0.5~20 μg/mL和1~12.5 μg/mL的系列混合标准溶液,然后进行HPLC-DAD测定。以标准品浓度(μg/mL)为x,其对应的峰面积为y,绘制标准曲线,线性相关系数(R2)均大于0.999,由此可见在本文设定的范围内,13-HODE和9-HODE 浓度与峰面积具有良好的线性关系。按照3倍信噪比(S/N=3)和10倍信噪比(S/N=10)计算方法的检出限和定量限,13-HODE和9-HODE的检出限分别为0.075 μg/g和0.15 μg/g,定量限分别为0.25 μg/g和0.50 μg/g(见表1)。腌腊肉制品中HODEs的含量普遍高于1 μg/g,甚至高达100 μg/g以上[14]。因此,本文建立的腌腊肉制品中13-HODE和9-HODE的分析方法可以满足同时分析腌腊肉制品中13-HODE和9-HODE含量的要求。

表1 方法的线性、检出限以及定量限Table 1 The linearity,detection limits, quantification limits of the proposed method
2.4 精密度实验
本方法的精密度通过对高、中、低三种HODEs水平的腌腊肉制品中13-HODE和9-HODE的日内和日间实验进行评价,实验结果见表2~表5。13-HODE的日内和日间相对标准偏差(RSD)分别为1.5%~2.7%和2.2%~2.5%,9-HODE日内和日间RSD分别为1.6%~2.5%和2.3%~3.1%。由此可见,本文建立的腌腊肉制品中13-HODE和9-HODE的分析方法具有较好的精密度。
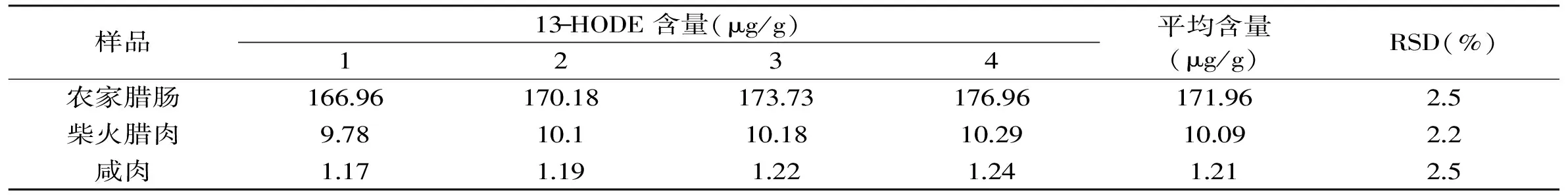
表4 13-HODE的日间精密度实验结果(n=3)Table 4 Inter-day precision of the method for determination of 13-HODE(n=3)

表5 9-HODE的日间精密度实验结果(n=3)Table 5 Inter-day precision of the method for determination of 9-HODE(n=3)
2.5 回收率实验
本文通过添加回收实验验证方法的准确性。选择高、中、低三种HODEs水平的腌腊肉制品,分别添加与其自身HODEs水平相近的13-HODE和9-HODE标准品,通过分析添加前后的样品中HODEs的含量,计算回收率,结果见表6。
由表6可以看出,在3~15 μg/g的添加范围内,13-HODE的回收率在83.3%~91.7%之间,平均回收率为88.2%;在1~6 μg/g 的添加范围内,9-HODE的回收率在82.0%~89.2%之间,平均回收率为86.0%。由此可见,本文建立的腌腊肉制品中13-HODE和9-HODE的分析方法具有较好的准确性。

表6 分析物在不同添加水平的回收率(n=3)Table 6 Recoveries of the analytes at different spiked levels(n=3)
2.6 实际样品分析
为了验证建立的腌腊肉制品中13-HODE和9-HODE的HPLC-DAD分析方法,本文采集了附近农贸市场、超市的14种腌腊肉制品,包括生制腌腊肉制品9种和即食腌腊肉制品5种,采用1.2.3的样品前处理方法,并在1.2.4的色谱条件下对其中13-HODE和9-HODE的含量进行了分析,结果见表7。
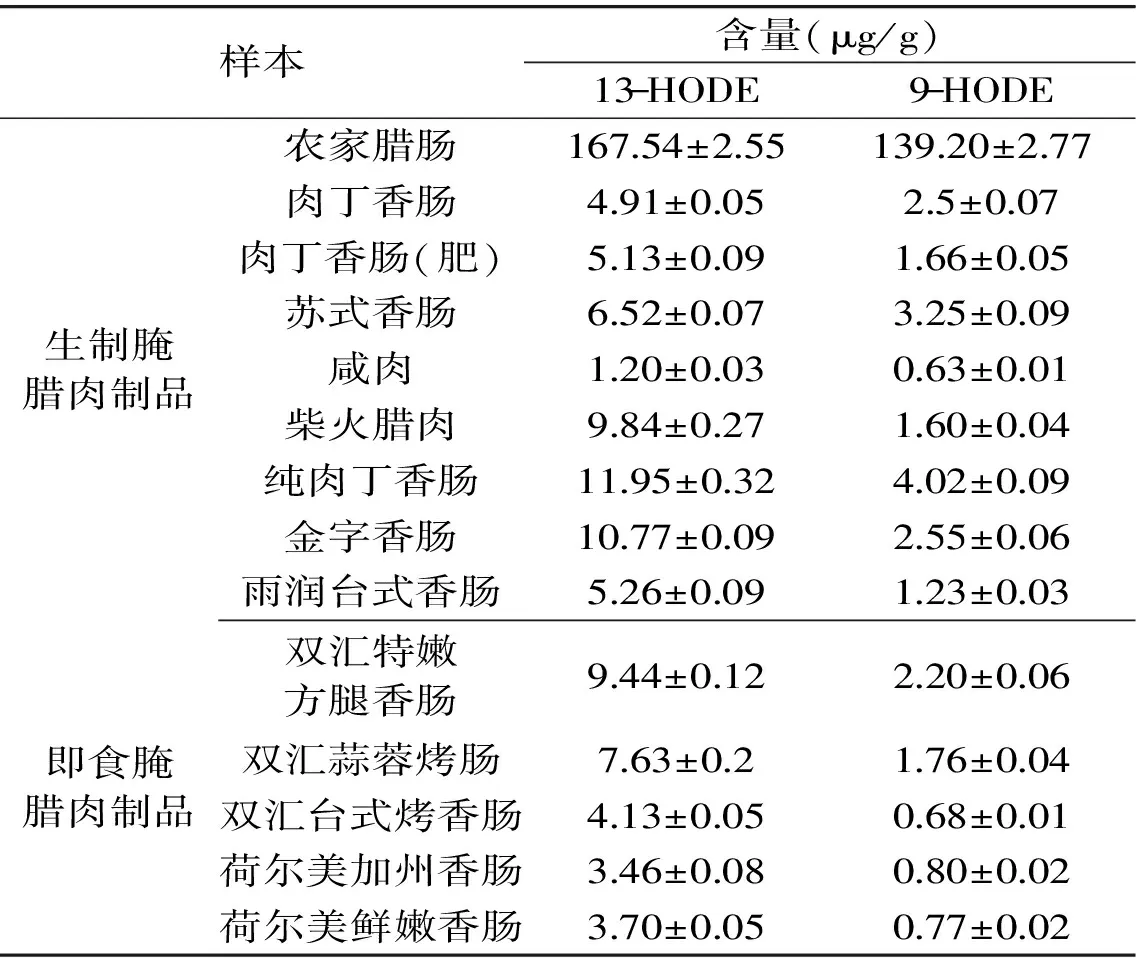
表7 实际样品中13-HODE和9-HODE的含量(n=3)Table 7 Contents of 13-HODE and 9-HODE in practical samples(n=3)
从表7中可以看出,所有样本都含有13-HODE和9-HODE,其中13-HODE的含量1.20~167.54 μg/g,9-HODE的含量0.63~139.20 μg/g。不同产品中的HODEs含量差异巨大,这一现象与Song等[14]的报道一致。腌腊肉制品种类繁多,原辅料以及加工工艺也大不相同。原料中脂质含量、加工温度、时间以及添加剂等对脂质氧化程度及其产物都具有重要影响[26],这可能是导致不同腌腊肉制品中HODEs含量差异巨大的原因。
为了进一步验证本文建立的腌腊肉制品中13-HODE和9-HODE的分析方法,我们参考Song等[14]的方法,采用LC-MS/MS对上述腌腊肉制品中农家腊肠、双汇特嫩方腿香肠和荷尔美鲜嫩香肠中13-HODE和9-HODE的含量同时进行了分析,两种方法的结果列于表8。统计分析显示,两种方法的结果之间无显著差异,进一步表明本文建立的腌腊肉制品中13-HODE和9-HODE的分析方法具有优良的准确性。
3 结论

表8 两种测定方法检测三种腌腊肉制品中13-HODE和9-HODE的含量(n=3)Table 8 Contents of 13-HODE and 9-HODE in three practical samples(n=3)by two methods
本文通过样本处理条件以及色谱条件的优化,建立了同时测定腌腊肉制品中13-HODE、9-HODE的HPLC-DAD分析方法。腌腊肉制品中13-HODE和9-HODE用甲醇提取,经固相萃取柱净化浓缩,在Si 60色谱柱上进行分离,流动相为正己烷/异丙醇/乙酸(98∶2∶0.5,v/v),在234 nm对13-HODE、9-HODE进行检测。结果表明,13-HODE、9-HODE分别在0.5~20、1.0~12.5 μg/mL的范围内具有较好的线性关系(R2>0.999),检出限分别为0.075、0.15 μg/g,定量限分别为0.25、0.50 μg/g,不同添加水平的平均回收率分别为88.2%,86.0%。对14种腌腊肉制品含量分析表明,所有样本都含有13-HODE和9-HODE,含量分别在1.2~167.54、0.63~139.20 μg/g范围内。腌腊肉制品普遍含有羟基十八碳二烯酸,其形成规律及机理、膳食暴露等值得进一步研究。
[1]Mueller H W,O’Flaherty J T,Wykle R L. Ether lipid content and fatty acid distribution in rabbit polymorphonuclear neutrophil phospholipids[J]. Lipids,1982,17(2):72.
[2]Lagarde M,Sicard B,Guichardant M,et al. Fatty acid composition in native and cultured human endothelial cells[J].InVitroCellular & Developmental Biology-Plant,1984,20(1):33.
[3]Niki E,Yoshida Y,Saito Y,et al. Lipid peroxidation:Mechanisms,inhibition,and biological effects[J]. Biochemical & Biophysical Research Communications,2005,338(1):668-676.
[4]Niki E. Lipid peroxidation:Physiological levels and dual biological effects[J]. Free Radical Biology & Medicine,2009,47(5):469-484.
[5]Gardner H W. Isolation of a pure isomer of linoleic acid hydroperoxide[J]. Lipids,1975,10(4):248-252.
[6]Ku G,Thomas C E,Akeson A L,et al. Induction of interleukin 1 beta expression from human peripheral blood monocyte-derived macrophages by 9-hydroxyoctadecadienoic acid[J]. Journal of Biological Chemistry,1992,267(20):14183.
[7]Mangan D F,Welch G R,Wahl S M. Lipopolysaccharide,tumor necrosis factor-alpha,and IL-1 beta prevent programmed cell death(apoptosis)in human peripheral blood monocytes[J]. Journal of Immunology,1991,146(5):1541-1546.
[8]Blondin G A. Isolation,properties,and structural features of divalent cation ionophores derived from beef heart mitochondria[J]. Annals of the New York Academy of Sciences,1975,264(1 Carriers and):98-111.
[9]Choque B,Catheline D,Rioux V,et al. Linoleic acid:Between doubts and certainties[J]. Biochimie,2014,96(1):14-21.
[10]Jira W,Spiteller G,Carson W,et al. Strong increase in hydroxy fatty acids derived from linoleic acid in human low density lipoproteins of atherosclerotic patients[J]. Chemistry & Physics of Lipids,1998,91(1):1-11.
[11]Reddy N,Everhart A,Eling T,et al. Characterization of a 15-lipoxygenase in human breast carcinoma BT-20 cells:stimulation of 13-HODE formation by TGF alpha/EGF[J]. Biochemical & Biophysical Research Communications,1997,231(1):111-116.
[12]Martínez-Yusta A,Goicoechea E,Guillén M D. A Review of Thermo-Oxidative Degradation of Food Lipids Studied by 1 H NMR Spectroscopy:Influence of Degradative Conditions and Food Lipid Nature[J]. Comprehensive Reviews in Food Science and Food Safety,2014,13(5):838-859.
[13]Püssa T,Raudsepp P,Toomik P,et al. A study of oxidation products of free polyunsaturated fatty acids in mechanically deboned meat[J]. Journal of Food Composition & Analysis,2009,22(4):307-314.
[14]Song H,Wu H,Geng Z,et al. Simultaneous determination of 13-HODE,9,10-DHODE,and 9,10,13-THODE in cured meat products by LC-MS/MS[J]. Food Analytical Methods,2016(10):1-10.
[15]Montine T J,Quinn J,Kaye J,et al. F(2)-isoprostanes as biomarkers of late-onset Alzheimer’s disease[J]. Journal of Molecular Neuroscience,2007,33(1):114-119.
[16]Inouye M,Mio T,Sumino K. Formation of 9-hydroxy linoleic acid as a product of phospholipid peroxidation in diabetic erythrocyte membranes.[J]. Biochimica Et Biophysica Acta,1999,1438(2):204.
[17]Li L,Duker J S,Yoshida Y,et al. Oxidative stress and antioxidant status in older adults with early cataract[J]. Eye,2009,23(6):1464-1468.
[18]Spindler S A,Clark K S,Callewaert D M,et al. Significance and immunoassay of 9-and 13-hydroxyoctadecadienoic acids[J].Biochemical & Biophysical Research Communications,1996,218(1):187.
[19]Spindler S A,Clark K S,Blackburn M L,et al. Occurrence of 13(S)-Hydroxyoctadecadienoic Acid in Biological Samples-Importance of lipoxygenases in modulating epidermal growth factor-dependent mitogenesis[J]. Prostaglandins,1997,54(6):875-880.
[20]Tonogai Y,Tai H H. Quantitation of 13-hydroxyoctadecadienoic acid(13-HODE)by radioimmunoassay[J]. Prostaglandins Leukotrienes & Essential Fatty Acids,1990,39(39):125-129.
[21]Cho H,Gallaher D D,Csallany A S. Nonradiometric HPLC measurement of 13(S)-hydroxyoctadecadienoic acid from rat tissues[J]. Analytical Biochemistry,2003,318(1):47-51.
[22]Gata J L,Pinto M C,Macias P. Lipoxygenase activity in pig muscle:purification and partial characterization.[J]. Journal of Agricultural & Food Chemistry,1996,44(9):2573-2577.
[23]Levandi T,Püssa T,Vaher M,et al. Oxidation products of free polyunsaturated fatty acids in wheat varieties[J]. European Journal of Lipid Science & Technology,2009,111(7):715-722.
[24]Yuan Z X,Rapoport S I,Soldin S J,et al. Identification and profiling of targeted oxidized linoleic acid metabolites in rat plasma by quadrupole time-of-flight mass spectrometry[J]. Biomedical Chromatography,2013,27(4):422-432.
[25]Teng J I,Smith L L. High-performance liquid chromatography of linoleic acid hydroperoxides and their corresponding alcohol derivatives[J]. J Chromatogr,1985,350(2):445-451.
[26]Jin G F. Lipolysis and lipid oxidation in bacon during curing and drying-ripening.[J]. Food Chemistry,2010,123(2):465-471.
