鲍鱼不同部位肌肉的成分和热特性
2018-01-22,,,,,,,,,*
, ,,,,,,,,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.厦门市海洋功能食品重点实验室,福建厦门 361021)
鲍鱼是一种单壳软体动物,营养丰富,在中国、日本、韩国以及东南亚等国家被视为名贵的海珍品之一。我国近年来鲍鱼产量猛增,2015年产量已突破12万吨,其中福建省的产量约占全国总产量的79%[1]。由于鲍鱼养殖较集中,鲜活鲍鱼不易长途运输,需要加工成产品供应全国各地,因此有必要对鲍鱼肌肉的成分和热特性进行深入探究,为鲍鱼的热加工工艺改良提供基础数据。
腹足肌肉是鲍鱼的主要可食部分,其蛋白主要由肌原纤维蛋白和胶原蛋白组成[2]。Olaechea Porturas等[3]发现100 g日本三浦半岛皱纹盘鲍肌肉裙边中含有7.83 g胶原蛋白,明显高于闭壳肌。肖桂华等[4]在研究大连皱纹盘鲍肌肉组织结构时,发现裙边的胶原纤维较多,肌纤维较少,硬度较大。Gao等[5-8]考察了蒸、煮等热加工工艺对鲍鱼肌肉的流变学特性和组织结构的影响,发现热处理会引起肌原纤维蛋白的变性、胶原蛋白的明胶化,结果导致鲍鱼肌肉流变性质发生变化。因此,鲍鱼不同部位的肌肉组成及其热特性可能存在一定的差异,但这方面的研究却鲜有报道。
南日鲍是皱纹盘鲍与日本盘鲍杂交所得的品种,个体大、耐高温,在南日岛海域可以全年养殖,具有体肥壳艳,鲍肉细嫩,味道鲜美独特,接近野生等特征,于2007年获得中国国家地理标志产品保护[9-10]。本研究以南日鲍为研究对象,考察了鲍鱼腹足肌肉贝柱、过渡和裙边三个部位的基本成分、氨基酸组成、蛋白组分分布、微观组织结构、二级结构和热变性温度,为南日鲍的加工提供参考。
1 材料与方法
1.1 材料与仪器
鲜活的南日鲍 6月份购买于厦门市东月屿海洋食品有限公司;鲍鱼肌原纤维蛋白 由集美大学水产品加工研究室提供;过碘酸雪夫氏(PAS)染色试剂盒 上海杰美基因医药科技有限公司;盐酸、硫酸、戊二醛、磷酸二氢钾和磷酸氢二钾等试剂 分析纯,西陇化工股份有限公司。
Sigma 3-18k高速冷冻离心机 德国Sigma公司;Q2000差示扫描量热仪 美国TA仪器公司;Samdri-PVT-3D临界点干燥仪 美国Tousimis公司;E-1010离子溅射仪、S-480扫描电子显微镜 日本日立制造所;Nicolet iS50傅立叶红外光谱分析仪 美国Thermo Scientific公司。
1.2 实验方法
1.2.1 鲍鱼样品前处理 将鲍鱼肌肉表面粘液刷洗干净,去壳去内脏,将鲍鱼肌肉按图1划分为贝柱、过渡和裙边三个部位,分别进行理化性质的测定。

图1 鲍鱼肌肉部位的划分Fig.1 Division of abalone muscle注:A:贝柱部位;B:过渡部位;C:裙边部位。
1.2.2 基本成分的测定 水分含量的测定采用GB/T 5009.3-2010直接干燥法;蛋白含量的测定采用GB/T 5009.5-2010凯氏定氮法,蛋白质的换算系数为6.25;糖含量的测定采用GB/T 15672-2009苯酚硫酸法;脂肪测定采用GB/T 14772-2008索氏抽提法;灰分含量测定采用GB/T 5009.4-2010高温灼烧法。
1.2.3 氨基酸组成的测定 参考Park等[11]报道的氨基酸测定方法,取一定量的鲍鱼肌肉样品放在消化管中,加入1 mL 6 mol/L HCl及20 μL苯酚,充氮气密封后置于110 ℃下水解22 h,水解液赶酸后用0.02 mol/L盐酸溶解,过0.22 μm聚醚砜膜,再用邻苯二甲醛(OPA)和9-芴甲基氯甲酸酯(FMOC)进行柱前衍生,最后利用高效液相色谱仪测定氨基酸组成。色谱条件:色谱柱为Zorbax Eclipse-AAA分析柱,柱温为40 ℃,流动相A为40 mm Na2HPO4(pH7.8),流动相B为乙腈-甲醇-水(体积比为45∶45∶10),流速为2 mL/min,检测波长分别为338 nm和262 nm。
1.2.4 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 鲍鱼不同部位的肌肉利用2% SDS-8 mol/L尿素-20 mmol/L Tris-HCl(pH8.8)的蛋白变性剂均质溶解后,经离心(10000 r/min,15 min,20 ℃),上清液利用SDS-PAGE进行分析。电泳样品用4%的浓缩胶,12%的分离胶在8 mA的电流下进行电泳后,分别用考马斯亮蓝染色和PAS染色对鲍鱼肌肉蛋白和糖蛋白进行分析。
1.2.5 扫描电子显微镜(SEM)观察 参考Weng等[12]报道的处理方法,将鲍鱼肌肉切成2~3 mm正方体块状,在4 ℃下用含2.5%的戊二醛的0.1 mol/L的磷酸盐缓冲溶液(pH7.2)固定24 h后,用0.1 mol/L的磷酸盐缓冲溶液(pH7.2)清洗3次,再经过乙醇溶液进行梯度脱水和CO2临界点干燥仪干燥,用离子溅射仪镀金后,最后利用SEM对鲍鱼肌肉纵切面微观结构进行观察。
1.2.6 傅里叶变换红外光谱(FTIR) 鲍鱼不同部位的肌肉切成均匀的薄片,利用傅里叶变换红外光谱进行扫描,波长范围为4000~1000 cm-1,光谱分辨率为4 cm-1,扫描次数16次。
1.2.7 差示扫描量热仪(DSC)分析 利用DSC对鲍鱼不同部位肌肉的热转变温度(Tm)进行测定。准确称取20 mg的新鲜鲍鱼肌肉放入坩埚中,以空坩埚作为参比。样品先分别在40、50、60 ℃下保温10 min,然后以1 ℃/min升温至90 ℃,同时以直接降温的样品和鲍鱼肌原纤维蛋白作为对照。利用DSC配套分析软件对DSC曲线进行分析,鲍鱼肌肉的Tm为吸热峰所对应的峰值温度。
1.2.8 数据统计与分析 每组数据至少测定3个平行,结果取平均值。采用SPSS17.0软件和Microsoft Excle 2003进行分析,显著性检验方法为Duncan多重检验,检测限为0.05。
2 结果与分析
2.1 基本成分
表1显示了鲍鱼不同部位肌肉的基本成分。由表1可以看出鲍鱼的贝柱、过渡和裙边部位肌肉的水分含量依次增加,而蛋白、总糖和脂肪含量却出现下降趋势。此外,贝柱和过渡部位的灰分含量明显低于裙边部位。肖桂华等[4]研究大连皱纹盘鲍的性质时,也发现鲍鱼肌肉裙边部位的糖含量远低于其它部位。表1的结果还表明了鲍鱼是一种富含蛋白和糖、低脂肪的贝类食品。

表1 鲍鱼不同部位肌肉的基本成分Table 1 Proximate compositions in the different parts of abalone muscle
注:同行肩标不同小写字母表示差异显著(p<0.05),表2同。
2.2 氨基酸组成
表2是鲍鱼不同部位肌肉的氨基酸组成。鲍鱼三个部位肌肉的氨基酸总量变化趋势与蛋白含量变化趋势(表1)一致。在贝柱部位,谷氨酸含量最高,其次是精氨酸、天冬氨酸、亮氨酸和甘氨酸,而胱氨酸含量最低。过渡部位的鲍鱼肌肉氨基酸组成与贝柱部位类似,但与裙边部位肌肉存在明显的差异。裙边部位肌肉的谷氨酸、组氨酸、精氨酸、蛋氨酸、缬氨酸、亮氨酸和赖氨酸含量显著低于其他部位,而甘氨酸、脯氨酸和羟脯氨酸含量显著高于其他部位。据报道,甘氨酸、脯氨酸和羟脯氨酸是胶原蛋白的主要成分,其中羟脯氨酸是胶原蛋白的特征氨基酸,占胶原蛋白的10.2%[3,13-14]。因此,根据表2的结果可知南日鲍裙边部位的胶原蛋白占肌肉的10%左右,明显高于其他部位。
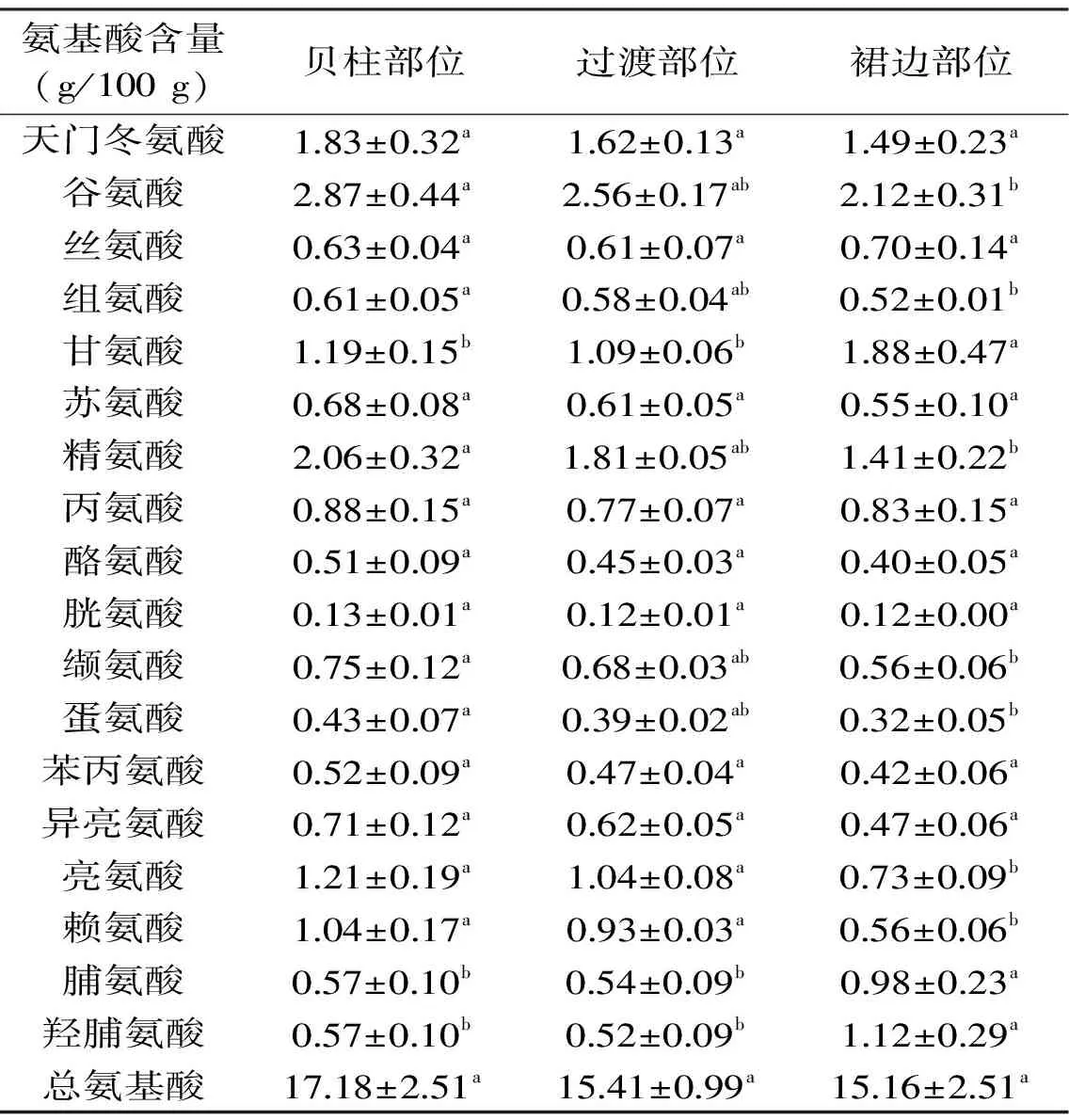
表2 鲍鱼不同部位肌肉的氨基酸组成Table 2 Amino acid compositions in the different parts of abalone muscle
2.3 SDS-PAGE
图2是鲍鱼不同部位肌肉的SDS-PAGE图谱。当电泳分离的蛋白条带经考马斯亮蓝染色后,发现贝柱和过渡部位的肌肉蛋白分布基本一致,均在40 kDa和100 kDa附近出现两个颜色较深的蛋白条带,以及200 kDa附近高分子组分,表明鲍鱼贝柱和过渡部位的肌肉主要是由肌动蛋白(Actin)、副肌球蛋白(PM)和肌球蛋白重链(MHC)等组成。这与Konieczny等[15]报道的河蚌肌肉蛋白组成类似。然而,在鲍鱼肌肉裙边部位中Actin和PM条带颜色明显变浅,却在150 kDa附近出现一些连续分布的蛋白条带(图2),这可能是裙边部位的胶原蛋白[14,16]。当蛋白条带经PAS染色后,贝柱和过渡部位均在35、40、50、100 kDa处出现四条红色的糖蛋白条带。然而,在裙边部位只有在40 kDa和100 kDa处出现两个糖蛋白条带。这个结果不仅暗示鲍鱼裙边部位糖蛋白含量低,与表1的结果相吻合,还表明鲍鱼肌肉多糖主要与PM和小分子蛋白结合。

图2 鲍鱼不同部位肌肉的SDS-PAGE图谱Fig.2 SDS-PAGE patterns of different parts of abalone muscle注:M:标准蛋白;1:贝柱部位;2:过渡部位;3:裙边部位。
2.4 微观结构

图3 鲍鱼不同部位肌肉的扫描电镜图谱Fig.3 SEM-micrographs of different parts of abalone muscle
图2是鲍鱼不同部位肌肉的SEM图,从图2中可以发现鲍鱼的贝柱、过渡和裙边部位肌肉的纤维网络结构逐渐变得致密,尤其裙边部位出现块状和束状聚集。这种差异可能与鲍鱼腹足吸附和运动功能有关[17],鲍鱼肌肉无骨骼支撑,因此需要依靠精细的肌肉纤维结构来完成各种动作[18]。Olaechea Porturas等[3]在研究鲍鱼肌肉硬度与胶原含量关系时,也发现鲍鱼的闭壳肌(贝柱部位肌肉)主要由肌原纤维组成,而接近裙边的腹足肌肉主要由富含胶原蛋白的结缔组织组成。Voltzow 等[19]在研究海洋螺类的结构形态时,也发现螺肉腹足的纤维结构比贝柱部位更细。
2.5 FTIR分析
蛋白质和多糖在红外光谱中均具有独特的指纹特征[20],因此利用傅里叶变换红外光谱(FTIR)对鲍鱼不同部位肌肉进行分析,结果如图4所示。在鲍鱼贝柱肌肉的FTIR图谱中,可以看到明显的酰胺A,酰胺Ⅰ和酰胺Ⅱ的吸收峰。鲍鱼过渡部位肌肉的FTIR图谱与鲍鱼贝柱肌肉类似,而裙边的酰胺Ⅱ吸收峰强度明显增强,并出现了酰胺Ⅲ吸收峰。据报道,酰胺Ⅱ和酰胺Ⅲ均代表N-H弯曲振动和C-N的伸缩振动[21],但前者主要是N-H弯曲振动,后者主要是C-N伸缩振动[22]。而且,酰胺Ⅱ的吸收峰容易受侧链氨基酸的影响[23]。因此,图4的结果表明鲍鱼的贝柱和过渡部位在二级结构上相似度较高,而裙边部位蛋白一级结构的侧链氨基酸可能与其他部位不同,结果导致FTIR的酰胺Ⅱ和酰胺Ⅲ吸收峰出现明显的差异。

图4 鲍鱼不同部位肌肉的FTIR图谱Fig.4 FTIR spectra of different parts of abalone muscle
2.6 DSC分析
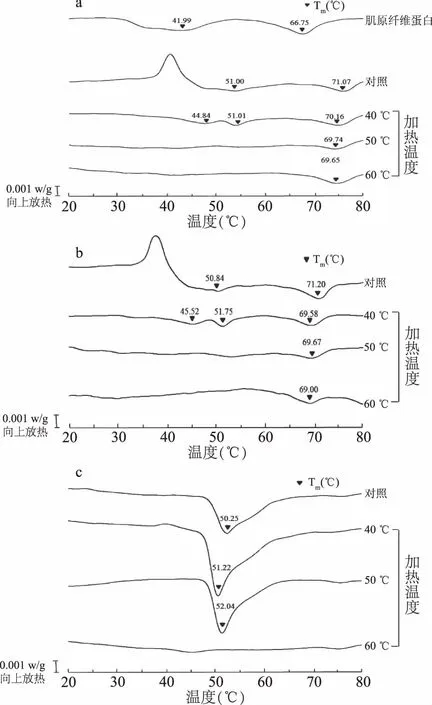
图5 鲍鱼肌原纤维蛋白和不同部位肌肉的DSC图谱Fig.5 DSC thermograms of different parts of abalone myofibrillar protein and abalone muscle 注:a:贝柱部位;b:过渡部位;c:裙边部位; 对照:未经加热变性样品。
为探究鲍鱼不同部位肌肉的热特性,利用差示扫描量热仪测定了鲍鱼肌原纤维蛋白和肌肉的Tm,结果如图5所示。在鲍鱼肌原纤维蛋白DSC曲线中含有两个吸热峰,类似于Paredi等[24]报道扇贝肌原纤维蛋白的DSC曲线,分别代表肌球蛋白和副肌球蛋白的叠加变性峰和肌动蛋白的变性峰。由图5a可以发现,在未加热变性的鲍鱼贝柱部位肌肉的DSC曲线中,发现一个放热峰和两个吸热峰。然而,当贝柱部位肌肉经过40 ℃加热后,DSC曲线中放热峰消失而出现了三个吸热峰。随着加热温度的提高,低于加热温度的吸热峰逐渐消失。鲍鱼肌肉过渡部位的DSC曲线(图5b)与贝柱部位类似,而裙边部位肌肉(图5c)只在51 ℃附近出现一个吸热峰。由于裙边主要是由胶原蛋白组成,因此51 ℃附近的吸热峰代表了鲍鱼胶原蛋白的变性峰。有研究报道罗非鱼肌肉DSC曲线的放热峰可能是由于肌肉三磷酸腺苷(ATP)快速水解的缘故[25]。而且,鲍鱼的贝柱和过渡部位的ATP含量显著高于裙边部位[26]。因此,鲍鱼贝柱和过渡部位肌肉的DSC曲线出现放热峰,而在裙边部位肌肉没有发现。图5的结果还表明了鲍鱼肌肉的最大变性温度在71 ℃附近,因此围绕该温度开展鲍鱼热加工工艺的优化,将可以防止采用过高加热温度使鲍鱼胶原蛋白明胶化[27-28],避免营养流失。
3 结论
南日鲍腹足肌肉的水分含量从贝柱到裙边依次增加,而蛋白、多糖和脂肪含量却逐渐减小。鲍鱼贝柱和过渡部位肌肉主要由肌原纤维蛋白组成,在氨基酸组成、蛋白和糖蛋白的分布、二级结构和热特性方面基本一致,而鲍鱼裙边富含胶原蛋白,肌肉纤维网络结构致密,但热变性温度低。因此,在鲍鱼热烫预处理中需要控制热烫温度和热烫时间,今后将围绕在70 ℃附近开展鲍鱼热加工工艺改良研究。
[1]中国渔业年鉴[M]. 北京:中国农业出版社,2016.
[2]邓丽. 鲍鱼腹足蛋白质热加工过程中化学作用力的研究[D]. 大连:大连工业大学,2014.
[3]Olaechea Porturas R,Ushio H,Watabe S,et al. Toughness and collagen content of abalone muscles[J]. Bioscience,Biotechnology and Biochemistry,1993,57(1):6-11.
[4]肖桂华,朱蓓薇,董秀萍,等. 鲍鱼腹足不同部织位的质构特性及组结构研究[J]. 食品科技,2010,35(11):155-159.
[5]Gao X,Ogawa H,Tashiro Y,et al. Rheological properties and structural changes in raw and cooked abalone meat[J]. Fisheries Science,2001,67:314-320.
[6]Gao X,Tashiro Y,Ogawa H. Rheological properties and structural changes in steamed and boiled abalone meat[J]. Fisheries Science,2002,68:499-508.
[7]Gao X,Tashiro Y,Ogawa H. The correlation rheological properties and characteristic values of structure for steamed abalone meat[J]. Food Science and Technology Research,2002,8:304-310.
[8]Gao X,Tang Z X,Zhang Z H,et al. Rheological properties and structural changes in different sections of boiled abalone meat[J].Journal of Ocean University of Qingdao,2003,2(1):44-48.
[9]李太武,苏秀榕,丁明进,等. 鲍的生物学[M]. 北京:科学出版社,2004.
[10]沈质宣. 南日鲍喜获国家地理标志产品保护[J]. 福建质量管理,2007,10:53.
[11]Park S,Arasu M V,Lee M K,et al. Analysis and metabolite profiling of glucosinolates,anthocyanins and free amino acids in inbred lines of green and red cabbage(BrassicaoleraceaL.)[J]. LWT-Food Science and Technology,2014,58(1):203-213.
[12]Weng W,Zheng W. Silver carp(Hypophthalmichthysmolitrix)surimi acid-induced gel extract characteristics:a comparison with heat-induced gel[J]. International Journal of Food Properties,2015,18(4):821-832.
[13]Reddy G K,Enwemeka C S. A simplified method for the analysis of hydroxyproline in biological tissues[J]. Clinical Biochemistry,1996,29(3):225-229.
[14]马少抗,陈俊,郝更新,等. 鲍鱼肌肉胶原蛋白提取与性质研究[J]. 现代食品科技,2017,33(2):29-34.
[15]Konieczny P,Tomaszewska-Gras J,Andrzejewski W. DSC and electrophoretic studies on protein denaturation of Anodonta woodiana(Lea,1834)[J]. Journal of Thermal Analysis and Calorimetry,2016,126(1):69-75.
[16]Dong X P,Yuan Q X,Qi H,et al. Isolation and characterization of pepsin-soluble collagen from abalone(Haliotisdiscushannai)gastropod muscle Part II[J]. Food Science and Technology Research,2012,18(2):271-278.
[17]Faccioni-Heuser M C,Zancan D M,Lopes C Q,et al. The pedal muscle of the land snail Megalobulimus oblongus(Gastropoda,Pulmonata):an ultrastructure approach[J]. Acta Zoologica,1999,80(4):325-337.
[18]Øiseth S K,Delahunty C,Cochet M,et al. Why is abalone so chewy? Structural characterization and relationship to textural attributes[J]. Journal of Shellfish Research,2013,32(1):73-79.
[19]Voltzow J. The functional morphology of the pedal musculature of the marine gastropodsBusyconcontrariumandHaliotiskamtschatkana[J]. The Veliger,1990,33(1):1-19.
[20]Guerrero P,Kerry J P,De la caba K. FTIR characterization of protein-polysaccharide interactions in extruded blends[J]. Carbohydrate Polymers,2014,111:598-605.
[21]Kobayashi Y,Mayer S G,Park J W. FTIR and Raman spectroscopies determine structural changes of tilapia fish protein isolate and surimi under different comminution conditions[J]. Food Chemistry,2017,226:156-164.
[22]翁诗甫. 傅里叶变化红外光谱分析[M]. 北京:化学工业出版社,2010:323.
[23]Cai S,Singh B R. A distinct utility of the amide III infrared band for secondary structure estimation of aqueous protein solutions using partial least squares methods[J]. Biochemistry,2004,43(9):2541-2549.
[24]Paredi M E,Tomas M C,Crupkin M. Thermal denaturation of myofibrillar proteins of striated and smooth adductor muscles of scallop(Zygochlamyspatagonica). A differential scanning calorimetric study[J]. Journal of Agricultural and Food Chemistry,2002,50(4):830-834.
[25]Park J W,Lanier T C. Calorimetric changes during development of rigor mortis[J]. Journal of Food Science,1988,53(5):1312-1314.
[26]Watanabe H,Yamanaka H,Yamakawa H. Biochemical and anatomical differences of extractive components in adult and juvenile disk abalone[J]. Bulletin of the Japanese Society of Scientific Fisheries,1993,59:501-506.
[27]Hatae K,Nakai H,Tanaka C,et al. Taste and texture of abalone meat after extended cooking[J]. Fisheries Science,1996,62(4):643-647.
[28]Zhu B,Dong X,Sun L,et al. Effect of thermal treatment on the texture and microstructure of abalone muscle(Haliotisdiscus)[J]. Food Science and Biotechnology,2011,20(6):1467-1473.
