超高效液相色谱-串联质谱法测定运动饮品中的叶酸
2018-01-22
(沈阳理工大学,辽宁沈阳 110159)
叶酸(folic acid)又称VB9,是一种重要的B族维生素,是维持人体正常物质代谢和某些特殊生理功能不可缺少的一类低分子有机化合物,在人体生长、代谢、发育过程中发挥着重要的作用[1-3]。运动饮品是根据人体运动的生理消耗而配制的,主要含有碳水化合物、电解质、维生素和氨基酸等营养成分。人体饮用运动饮品后能合理补充所需的营养成分,平衡新陈代谢,提高机体的抗疲劳能力4-5]。国标GB 15266-2009《运动饮料》中[6],仅针对维生素C、硫胺素和核黄素这3种维生素作出了限量要求,并未对叶酸含量作出限量要求,但是针对特殊人群的饮品,有必要了解其叶酸的含量,以便保障人们科学、定量地摄入此种维生素。
国内外文献中检测叶酸的方法有紫外分光光度法、荧光法、液相色谱法、气质联用和高效液相色谱质谱联用等[7-13]。国标方法中,GB/T 5009.211-2008《食品中叶酸的测定》和GB 5413.16-2010《婴幼儿配方食品和乳品中叶酸(叶酸盐活性)测定》中对食品、婴儿食品和乳制品中叶酸的测定采用微生物法[14-15],此方法周期长、步骤繁琐、重复性差,影响因素多。本研究利用质谱的多反应监测模式的选择性和特异性,结合运动饮品的基质成分相对简单的特点,简化了样品的前处理过程,建立一种超高效液相色谱-串联质谱法测定运动饮品中叶酸的方法,灵敏度高、线性范围宽,极大地提高了检测效率,推广可行性较高,为运动饮品中叶酸含量的测定提供技术支持和参考。
1 材料与方法
1.1 材料与仪器
标准品叶酸 美国Sigma公司;乙腈、甲醇 色谱纯,美国Fisher Scientific公司;甲醇、乙醇、亚铁氰化钾、乙酸锌 分析纯,国药集团化学试剂有限公司;超纯水 由Mmi-Q Advantage A10超纯水机制得。
超高效液相色谱仪 美国安捷伦公司;四极杆串联质谱仪 美国AB公司。
1.2 实验方法
1.2.1 超高效液相色谱条件的优化 本实验先对色谱条件中的色谱柱及流动相进行优化。色谱柱比较了C18(2.1 mm×150 mm,3 μm)和T3(2.1 mm×150 mm,3 μm)这2种常用的色谱柱[16-18];对甲醇(A)-水(B)、甲醇(A)-0.1%甲酸水溶液(B)以及10%甲醇水溶液(A)-0.1%甲酸水溶液(B)3种流动相进行优化选择,流动相梯度洗脱程序见表1。

表1 流动相梯度洗脱程序Table 1 Gradient elution program of mobile phase
1.2.2 质谱检测器参数的优化 采用针泵连续进样的方式,在正离子模式(ESI+)下,对浓度为100 ng/mL的叶酸的标准溶液进行母离子全扫描,确定其分子离子,优化母离子的锥孔电压。再在上述母离子的基础上,对其子离子进行全扫描,选择两组丰度最高的离子,较高的作为定量离子,次之的为定性离子,并对喷雾电压、离子源温度、碰撞气、扫描停滞时间、去簇电压及碰撞电压等参数进行优化。
1.2.3 标准曲线的配制 称取一定量的叶酸标准品,配制成浓度为2.0、10.0、20.0、50.0、100.0 ng/mL的系列标准溶液,现用现配。
1.2.4 样品前处理条件的优化 运动饮品若直接上样测定其中的叶酸含量,样品中的干扰成分太多会影响测定结果,故要对运动饮品中的一些干扰基质进行沉淀以达到净化的效果。在对叶酸目标物提取的过程中,目标成分为水溶性维生素,容易在提取过程中被破坏或被样品中沉淀物所吸附[19],本实验参考相关文献[20-23],结合叶酸是水溶性物质的特性以及样品为运动饮品的特性,本实验结合叶酸成分的化学性质以及运动饮品的特性,比较了亚铁氰化钾溶液(106 g/L)+乙酸锌溶液(219 g/L)混合液、10%甲醇、10%乙醇、10%乙腈等4种提取液对目标物的提取效果。分别称取10 g的运动饮料,加入10 mL提取溶液,用去离子水定容至50 mL,剧烈震摇1 min,以5000 r/min的速度离心5 min,取上清液过0.45 μm滤膜后进行上机检测。
1.2.5 加标回收及与国标方法对比实验 以已知目标成分含量的运动饮品为基质,加入叶酸标准溶液,选择优化后的条件上机检测,并与现有国标方法(GB/T 5009.211-2008)的测定结果对比,检验其方法的有效性。
2 结果与讨论
2.1 色谱柱及流动相的选择
食品中叶酸的检测比较常用的色谱柱有C18柱和T3柱,叶酸在反相C18柱上的保留能力较弱,目标物总离子流图的分析效果不理想;但是在T3柱上保留效果较好,原因是由于以离子形态存在的叶酸组分能与T3柱上基团的离子键形成氢键,这种结合力比C18反相柱上的分子间作用力更强,在分离时更具有优势,目标物的分离效果更好,所以本实验选择T3柱作为叶酸的分析色谱柱。
在选择T3柱作为叶酸分析色谱柱的前提下,参考相关文献[24-28],考察甲醇-水、甲醇-0.1%甲酸水以及10%甲醇-0.1%甲酸3种流动相对叶酸分析结果的影响。结果发现,10%甲醇-0.1%甲酸作为流动相时,叶酸的分离效果最好,分离度高,峰形尖锐,基线稳定。
2.2 质谱检测器参数的优化
优化后的质谱参数为:喷雾电压4000 V、离子源温度400 ℃、氮气流量20 L/min、扫描停滞时间50 ms,其他质谱参数见表2。

表2 叶酸的多反应监测扫描模式的质谱参数Table 2 Mass spectrometric parameters of a multi reaction monitoring scan for folic acid
注:“*”定量离子(Quantitative ion)。
依照表2所设定的质谱条件,以及超高效液相色谱的条件,选择多反应监测模式(MRM)进行检测,叶酸与其他成分能在5 min内快速分离,叶酸的MRM图如图1所示,子离子扫描图如图2所示。
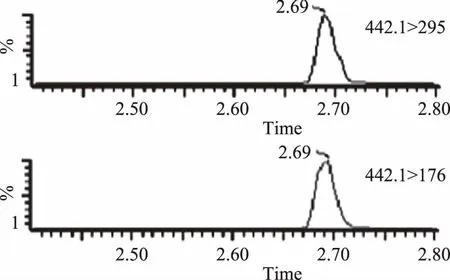
图1 叶酸的MRM图Fig.1 MRM chromatogram of folic acid

表3 叶酸的保留时间、标准曲线、相关系数、检出限与定量限Table 3 Retention time,standard curve,correlation coefficient,detection limit and quantitative limit of folic acid
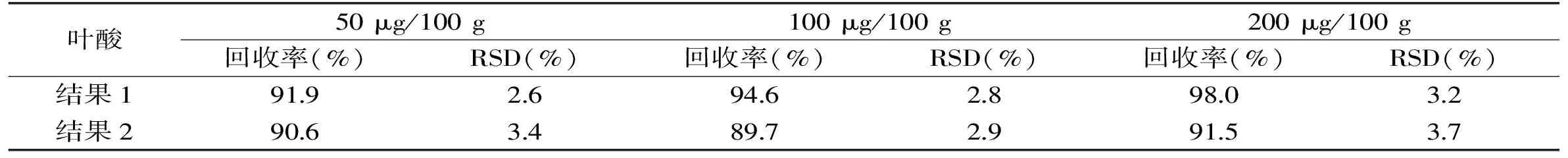
表4 方法的回收率及相对标准偏差(n=5)Table 4 Recoveries and relative standard deviations(RSD)of the method(n=5)
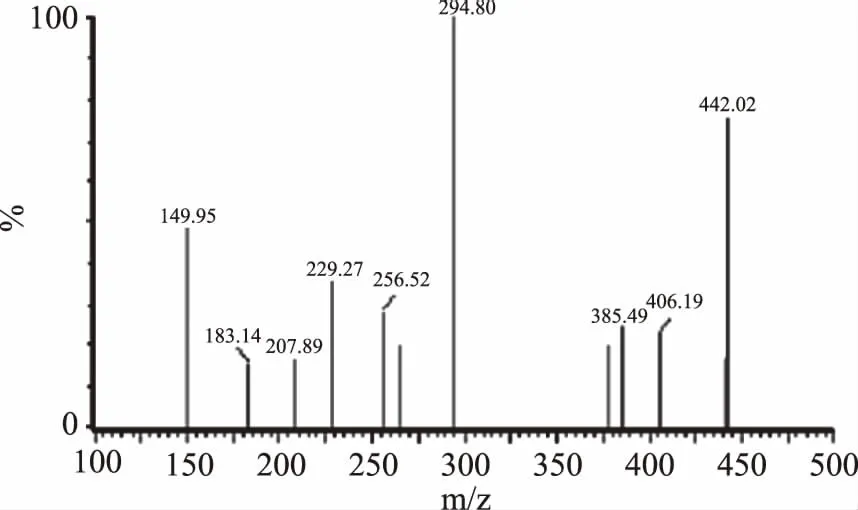
图2 叶酸的离子扫描质谱图 Fig.2 Ion scan of folic acid
注:“结果1”为按本实验优化后条件测定的加标回收结果,“结果2”为按国标GB/T 5009.211-2008 《食品中叶酸的测定》测定的加标回收结果。
2.3 标准曲线的配制
实验结果表明,叶酸在2.0~100.0 ng/mL内均具有良好的线性关系(R2>0.999),目标组分的检出限为1.0 μg/kg,定量限为3.0 μg/kg,结果见表3。
2.4 样品前处理条件的优化
4种提取液对叶酸回收率的影响如图3所示,其中10%乙腈为提取液时,运动饮品中的叶酸回收率最高,然后依次为10%乙醇、10%甲醇和混合沉淀剂;当提取液为亚铁氰化钾溶液(106 g/L)+乙酸锌溶液(219 g/L)混合沉淀剂时,虽然样品中的基质沉淀效果明显,但是叶酸的回收率不高,可能是混合沉淀剂对运动饮品中的叶酸有一定的吸附作用;其中10%乙醇提取率虽不及10%乙腈的提取效果好,但是考虑到乙腈的毒性比乙醇大,以及成本问题,所以本实验选择10%乙醇作为运动饮品叶酸成分的提取液。
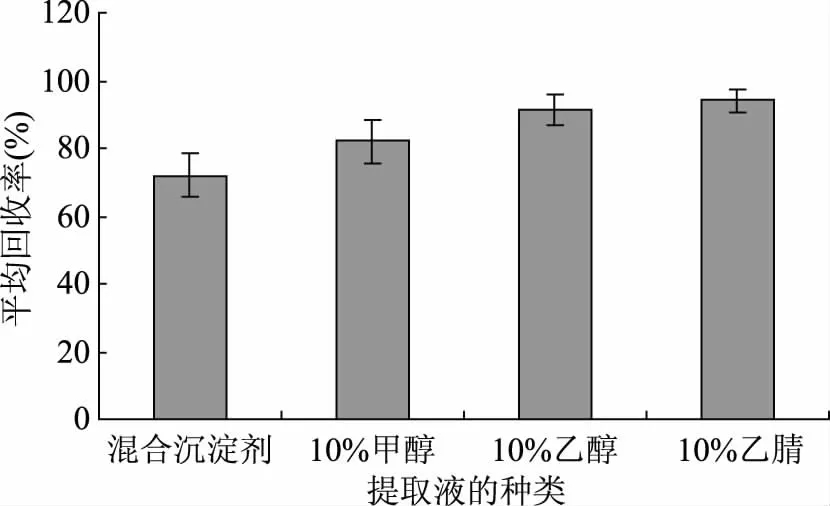
图3 提取液对叶酸的平均回收率的影响Fig.3 The effect of extract solution on the average recovery rate of folic acid
样品经过前处理与未经前处理的色谱图对比如图4所示,我们可以很直观的看出来,样品经10%乙醇处理后,可以有效地去除掉一些杂质干扰峰,减少基质效应的干扰,能够更准确的定量目标化合物。
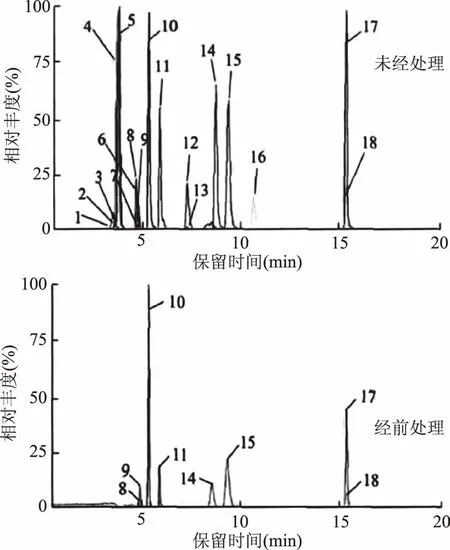
图4 两种处理方式的色谱图比较Fig.4 The chromatograms of two treatment methods for comparison
2.5 加标回收及与国标方法对比实验
在上述优化后的条件下,利用已测定叶酸含量的运动饮品进行加标回收率实验,分别添加50、100、200 μg/100 g 3个梯度浓度的标准溶液,每个浓度平行测定5次,测定结果见表4。
由表4可见,结果1叶酸的加标回收率为91.9%~98.0%,相对标准偏差(RSD)为2.6%~3.2%,说明本实验所建立的方法具有可靠的准确度和精密度。与结果2对比发现,本实验的测定结果与国标方法基本一致,符合检测要求。
3 结论
本文建立了一种超高效液相色谱-串联质谱检测运动饮品中叶酸含量的分析方法。结果表明,通过优化后的色谱及质谱条件,在MRM扫描模式下,样品经过10%乙醇提取后,可有效去除运动饮品中的复杂基质,可实现对目标化合物的净化,能准确、快速、有效地检测运动饮品中的叶酸成分。本方法具有快速、简单、准确、灵敏等特点,可对较宽浓度范围内的叶酸含量进行分析,有助于提高食品检测实验室的分析效率,降低成本,为运动饮品中叶酸的测定提供参考。
[1]蒲明清,戴舒春,张连龙,等.超高效液相色谱法测定保健食品中的多种水溶性维生素[J].现代食品科技,2012,28(7):886-889.
[2]Aslam J,Khan S H,Khan S A. Quantification of water soluble vitamins in six date palm(Phoenix dactylifera L.)cultivar’s fruits growing in Dubai,United Arab Emirates,through high performance liquid chromatography[J]. Journal of Saudi Chemical Society,2013,17(1):9-16.
[3]Beitane I,Ciprovica I. The study of added prebiotics on B group vitamins concentration during milk fermentation[J]. AC Romanian Biotechnology Letters,2011,16(6):92-96.
[4]蒋俊树,赵彬.高效液相色谱法测定能量饮料中多种水溶性维生素[J].食品科学,2008,29(12):635-637.
[5]王荣艳,贾丽,钱春燕. HPLC-PDA法同时测定功能性饮料中9种水溶性维生素[J].现代科学仪器,2010,8(4):98-101.
[6]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15266-2008 运动饮料[S]. 北京:中国标准出版社,2008
[7]刘莉治,罗晓燕,周洪伟,等.高效液相色谱柱后衍生法测定婴幼儿食品中的叶酸[J]. 中国卫生检验杂志,2007,17(7):1179-1180.
[8]聂启兴,冯蕾,张媛媛,等.高效液相色谱法同时测定发酵前后果蔬中4种水溶性维生素[J].食品科学,2015,36(20):101-104.
[9]陈新,张风,李健.反相离子对高效液相色谱法测定啤酒中的B族维生素[J].酿酒科技,2015(12):119-121.
[10]叶翠平,谭兆平,区硕俊.反相离子色谱法同时检测皮炎软膏中的6种水溶性维生素成分含量[J].食品安全质量检测学报,当代化工,2016(8):2050-2053.
[11]Champagne C P,Tompkins T A,Buckley N D,et al. Effect of fermentation by pure and mixed cultures of Streptococcus thermophilus and Lactobacillus helveticus on isoflavone and B-vitamin content of a fermented soy beverage[J]. Food Microbiology,2010,27(7):968-972.
[12]任丹丹,谢云峰,刘佳佳,等.高效液相色谱法同时测定食品中9种水溶性维生素[J].食品安全质量检测学报,2014(3):899-903.
[13]张志清,白琦,湛珺雯. RP-HPLC法测定功能性饮料水溶性维生素含量[J]. 食品科学,2010,31(14):212-215.
[14]国家质量监督检验检疫总局. GB/T 5009.211-2008 食品中叶酸的测定[S]. 北京:中国标准出版社,2008.
[15]国家质量监督检验检疫总局.GB 5413.16-2010 婴幼儿食品和乳品中叶酸的测定[S].北京:中国标准出版社,2010.
[16]周围,王波,刘倩倩,等.超高效合相色谱法同时测定复合维生素片中11种脂溶性维生素及其衍生物[J].分析化学,2015,43(1):115-120.
[17]张榕杰,苏永恒,王爱月.超高效液相色谱法同时测定维生素强化食品中多种水溶性维生素[J].中国卫生工程学,2008,7(1):34-36.
[18]贺利民,吕岱竹,苏贻娟. 高效液相色谱法同时测定多种水溶性维生素[J].海南大学学报:自然科学版,2004,22(1):54-60.
[19]荣琳,邵丽华,王淑娥,等. HPLC-二极管阵列检测器同时测定保健品中7种水溶性维生素[J].卫生研究,2009,38(5):541-542.
[20]白靖,向柏,申磊,等. HPLC法同时测定复合维生素口服液中4种水溶性维生素的含量[J]. 中国药房,2011,22(29):2747-2749.
[21]李强,李挥,庞坤,等.功能性饮料中11种水溶性维生素的高通量检测技术研究[J].河北省科学院学报,2012,29(3):44-48.
[22]宋萍萍,刘书慧.反相高效液相色谱法测定果醋中的8种维生素[J].食品科学,2012,33(12):181-184.
[23]华晶忠,刘笑笑,武巍,等.苜蓿中维生素C含量测定及变化规律[J]. 食品研究与开发,2016(1):45-47.
[24]郭玉华,郁有祝.高效液相色谱法测定茶叶中五种水溶性维生素[J].食品研究与开发,2012(8):138-140.
[25]李克,王华娟,潘朝晖,等. 离子对反相高效液相色谱法同时测定复合维生素片中4种水溶性维生素[J].色谱,2013,21(1):66-68.
[26]黄力,张宝川.HPLC法测定多维片中的水溶性维生素[J].中国药事,2007,21(4):255-257.
[27]高旭,李淑娟,安娟,等.高效液相色谱法同时测定食品中8种水溶性维生素[J].中国医药指南,2008,6(19):36-38.
[28]张晓娜,校瑞,牛家华,等. HPLC同时测定维生素B片中4种水溶性维生素的含量[J].河南大学学报:自然科学版,2016(9):583-586.
