人、猪和鸡源SAMHD1蛋白的酶活性研究
2018-01-20贺双意王媚媚米立志秦晓红
贺双意,孔 佳, 2,王媚媚,米立志,秦晓红, 3
人、猪和鸡源SAMHD1蛋白的酶活性研究
贺双意1,孔 佳1, 2,王媚媚1,米立志1,秦晓红1, 3
(1. 天津大学生命科学学院,天津 300072;2. 天津大学化工学院,天津 300350;3. 南开大学药物化学生物学国家重点实验室,天津 300071)
SAMHD1蛋白是一种天然免疫限制因子,利用其dNTP水解酶活性或核酸酶活性抑制病毒的复制,具有广谱抗病毒功能.利用生物信息学分析该蛋白家族序列保守性,并借助HPLC层析色谱分析与酶活性测定和酶标仪方法,对人源、猪源和鸡源三物种SAMHD1蛋白的酶活性进行了比较.比对发现SAMHD1蛋白在活性空腔、变构位点及磷酸化位点等处序列上具有高度的保守性;而且发现猪源和鸡源SAMHD1蛋白同样具有dNTP水解酶和核酸酶活性;3种蛋白中,人源SAMHD1蛋白dNTP水解酶活性最高,猪源蛋白核酸酶活性最低.这一结果为研究SAMHD1蛋白家族的结构功能关系及为畜牧业优良品种的开发提供启示.
SAMHD1;物种;蛋白表达与纯化;三磷酸水解酶活性;核酸酶活性
不育a基序和组氨酸/天冬氨酸蛋白1(sterilea-motif/histidine-aspartate domain-containing protein 1,SAMHD1)是一种天然免疫限制因子,广泛存在于生物体内,在抑制病毒感染方面发挥重要作用.该蛋白由3个结构域组成,分别是N末端域、催化核心域和C末端域.其中,催化核心域也称HD结构域,该结构具有三磷酸水解酶(dNTP酶)及核酸酶活性[1-5](见图1).SAMHD1蛋白具有广谱抗病毒功能[6],其中人源SAMHD1蛋白因具有抗艾滋病病毒活性而成为该领域的研究热点.人源SAMHD1蛋白可抑制HIV-1、HBV、HSV-1等多种病毒[7-10].目前的研究表明,人源SAMHD1主要通过其dNTP酶与核酸外切酶两种方式抑制入侵的病毒.在生理条件下SAMHD1以一种无活性的单体或二体状态存在,变构剂GTP/ dGTP可以诱导其四聚化,在Mg2+存在的条件下,活化的四聚体水解结合在其底物空腔的dNTP[11],降低细胞内dNTP含量,从而抑制病毒的复制.此外,催化核心域还具有核酸外切酶活性,可以结合病毒的单链核酸(ssDNA/ssRNA),通过直接水解入侵病毒的核酸来抑制病毒[12-13].虽然人源SAMHD1结合DNA/RNA的体外实验结果具有一致性,但关于其核酸外切酶活性的催化与调节机制仍颇有争议[12-15].在分裂细胞中,SAMHD1的Thr592磷酸化可以调节该蛋白的核酸外切酶活性及其抗病毒功能,但到目前为止,人源SAMHD1蛋白的磷酸化是如何调节其活性的具体机制尚不清楚[16-18].
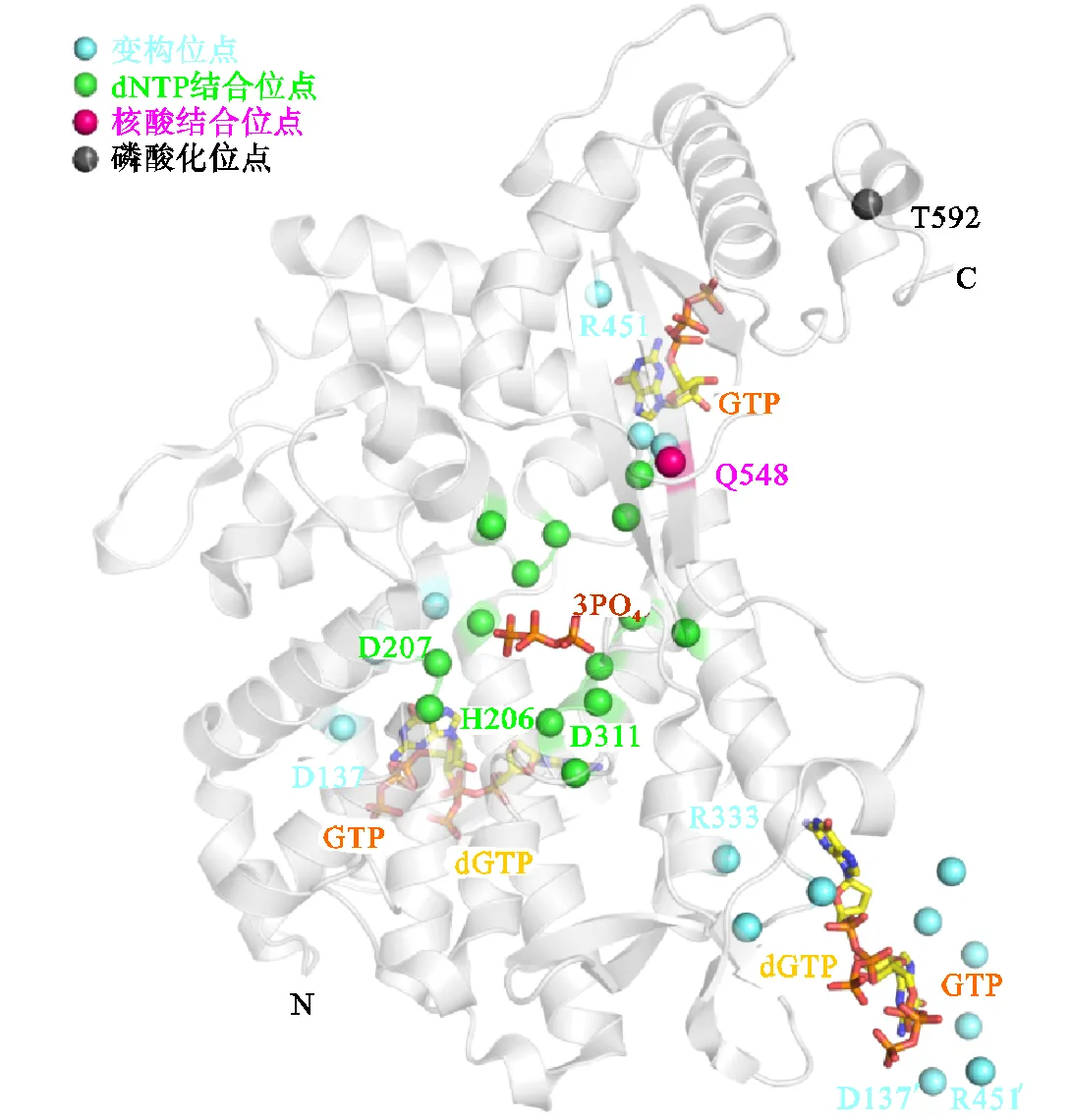
图1人源SAMHD1蛋白催化核心域晶体结构及主要活性位点示意
猪源SAMHD1蛋白已被证明可抑制猪繁殖和呼吸障碍综合症病毒(PRRSV,即猪蓝耳病病毒)[7],该病毒会引发严重的猪传染病——猪蓝耳病,给包括中国、美国等在内的诸多国家造成了巨大的经济损 失[19-21].禽类病毒同样会给畜牧业带来巨大损失,禽流感病毒可以通过突变和跨物种传播感染人类及其他动物.笔者通过对SAMHD1蛋白家族进行比较分析,推测鸡源SAMHD1可能在禽类中发挥类似人源SAMHD1的抗病毒功能.
迄今为止,关于SAMHD1蛋白的研究主要集中在人源蛋白,而对于其他物种的研究相对较少,多物种SAMHD1蛋白之间的酶活性差异也鲜见报道.本研究成功构建了人源、猪源和鸡源SAMHD1的原核表达体系,并在体外检测了猪源与鸡源SAMHD1蛋白的dNTP酶与核酸酶活性.笔者对这3个物种SAMHD1蛋白的dNTP水解酶活性以及核酸酶活性进行了比较,并对序列保守性进行了分析,结合已有的人源SAMHD1蛋白三维结构,从分子水平上分析不同SAMHD1酶活性差异的机制,为畜牧业相关的抗病毒研究提供新的思路.
1 材料与方法
1.1 实验材料和仪器
本实验室存有编码人源、猪源和鸡源基因的质粒,该基因对应的GeneBank序列号分别为NM_015474.3、NM_001292105.1和NC_006107.4.上述基因分别克隆至pET28a-Plus(N-6His)载体,目的基因扩增及表达所用菌株XL-10-gold、BL21 (DE3)为本实验室保存.扩增目的基因时所用Trans Start Fast Pfu酶购自北京全式金生物技术有限公司,限制性内切酶HI、I与T4 DNA连接酶均购自美国Thermo Fisher公司;胶回收试剂盒和质粒提取试剂盒购自康为世纪公司;PCR扩增仪购自A&B公司;高效液相色谱柱购自艾杰尔科技公司;超速离心管购自美国Beckman公司;多功能酶标仪购自美国珀金埃尔默公司;高压细胞破碎仪购自广州聚能生物科技有限公司;蛋白质电泳仪购自Bio-Rad公司;Ni-NTA亲和层析柱、Superdex 200分子筛以及AKTA purifier均购自美国GE公司.
1.2 实验方法
1.2.1 构建pET28a-Plus(N-6His)-原核表达质粒
人源SAMHD1蛋白由626个氨基酸组成,而猪源与鸡源SAMHD1蛋白分别由627和614个氨基酸组成(见图2),鉴于该蛋白的dNTP酸和核酸酶活性位点皆位于HD结构域,本研究分别以人、猪以及鸡源SAMHD1蛋白截短体的基因为模板(以下用表示),用Pfu高保真PCR酶扩增目的基因,三物种所用的引物如表1所示,延伸时间为2,min,共扩增30个循环.扩增结束后,以PCR产物为底物,加入限制性核酸内切酶HI和I,进行酶切消化,同时用相同的限制性内切酶消化pET28a-Plus(N-6His)载体,消化反应于37,℃进行2,h,待反应完成后,利用琼脂糖凝胶电泳回收酶切产物,并用T4连接酶将目的基因连接到pET28a-Plus(N-6His)载体中.并将连接产物转化到XL-10-gold感受态细胞中,挑取菌落,并提取质粒,3种质粒pET-均经测序鉴定正确.
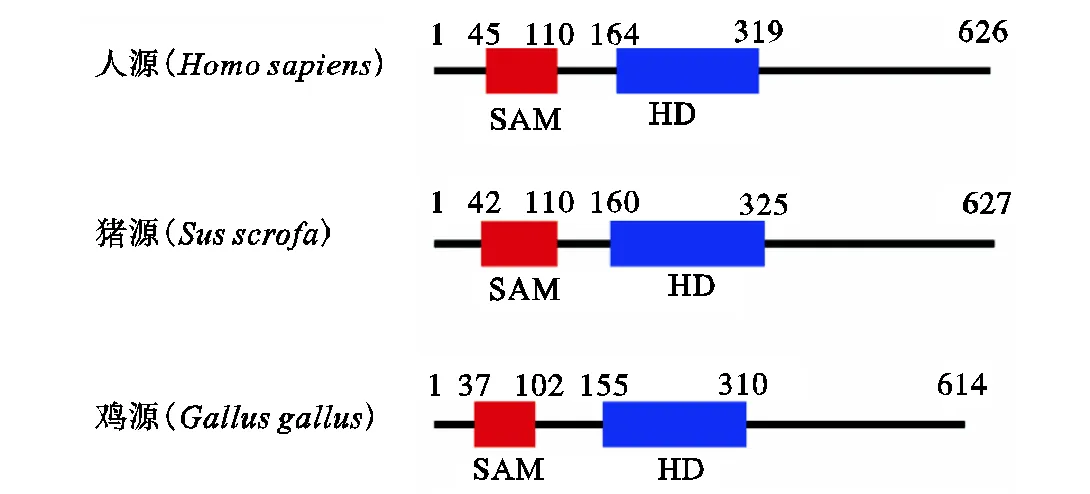
图2 人、猪、鸡源SAMHD1蛋白结构域示意
表1 三物种基因扩增引物序列

Tab.1 Sequences of PCR primers for cloning the three Samhd1c genes
1.2.2 三物种SAMHD1c蛋白的表达
将测序正确的质粒转化至BL21(DE3)感受态细胞中,挑取单克隆菌落至含100,μg/mL卡那霉素的5,mL LB培养液中,37,℃ 220,r/min摇床培养过夜,然后将5,mL培养液接种于含卡那霉素的1,L LB培养液中,37,℃ 220,r/min培养至浓度达到OD600约为1.0时,降温至20,℃培养,并加入200,μmol/L IPTG诱导蛋白表达,16,h后收集菌体.
1.2.3 三物种SAMHD1c蛋白的纯化
上述菌液经4,000,r/min离心15,min后收集菌体,并将菌体重悬于裂解缓冲液(300,mmol/L NaCl,20,mmol/L Tris pH,8.0,5%甘油,10,mmol/L咪唑,1,mmol/L PMSF),利用高压细胞破碎仪破碎菌体,18,000,r/min离心30,min后收集上清液,经Ni-NTA亲和层析初步纯化和Superdex200分子筛层析纯化后,利用SDS-PAGE检测SAMHD1c蛋白纯度,浓缩后速冻蛋白,存于-80,℃冰箱保存.
1.2.4 三物种SAMHD1c蛋白dNTP酶活性分析
以反应底物为dGTP为例,分别将纯化的人、猪、鸡源SAMHD1c蛋白(0.8,μmol/L)与500,μmol/L的dGTP在反应缓冲液(20,mmol/L Tris-HCl,pH,8.0,150,mmol/L NaCl,5,mmol/L MgCl2)中混匀,总体系为250,μL.将反应体系置于25,℃,待反应一定时间后,用10,mmol/L EDTA终止反应.利用0.5,mL截留分子质量为104,g/mol的浓缩管在12,000下离心20,min,以分离蛋白与小分子产物.核苷酸水解产物经MP-C18高效液相色谱(HPLC)分析,利用缓冲液B(甲醇)以1,mL/min的速度进行线性梯度洗脱(在8,min内甲醇体积分数由0线性升至35%),利用样品在260,nm处的紫外吸收值计算产物种类及数量. 在酶动力学参数测量中,dGTP浓度分别为100,μmol/L、200,μmol/L、400,μmol/L、600,μmol/L与800,μmol/L,反应在25,℃中进行3,min,其他操作与上述步骤一致.
1.2.5 三物种SAMHD1c蛋白核酸酶活性分析
分别运用两种方法测定SAMHD1c蛋白核酸酶活性.方法1利用HPLC方法进行分析,具体操作与第1.2.4节中描述一致,其中底物换为单链DNA (ATCGC).方法2利用酶标仪来测定SAMHD1蛋白的核酸酶活性,底物为5-FAM荧光基因和3-BHQ1淬灭基因修饰的单链核酸(ssDNA),序列为:5-TACAGATCTACTAGTGATCTATGACTGATCTGTACATGATCTACA-3.先将底物ssDNA(10,μmol/L)与SAMHD1c蛋白(3,μmol/L)分别溶于反应液(50,mmol/L Tris,pH,7.5,5,mmol/L MgCl2,50,mmol/L NaCl).再将蛋白溶液分装至384孔板中,每孔25,μL,然后快速向每孔中加入25,μL底物.利用酶标仪测定485,nm光激发下的528,nm处发射光的荧光信号.
1.2.6 三物种SAMHD1蛋白序列比对
利用ESPript 3.0在线软件(http://espript.ibcp.fr/ ESPript/cgi-bin/ESPript.cgi)对人、猪与鸡源的SAMHD1蛋白序列进行分析,其中以已经解析出结构的人源SAMHD1蛋白(PDB ID:4Q7H)的二级结构作为参考.3种SAMHD1蛋白分别来自物种(NM_015474.3)、(NM_001292105.1)和(NC_ 006107.4).
2 实验结果
2.1 三物种SAMHD1蛋白序列比较分析
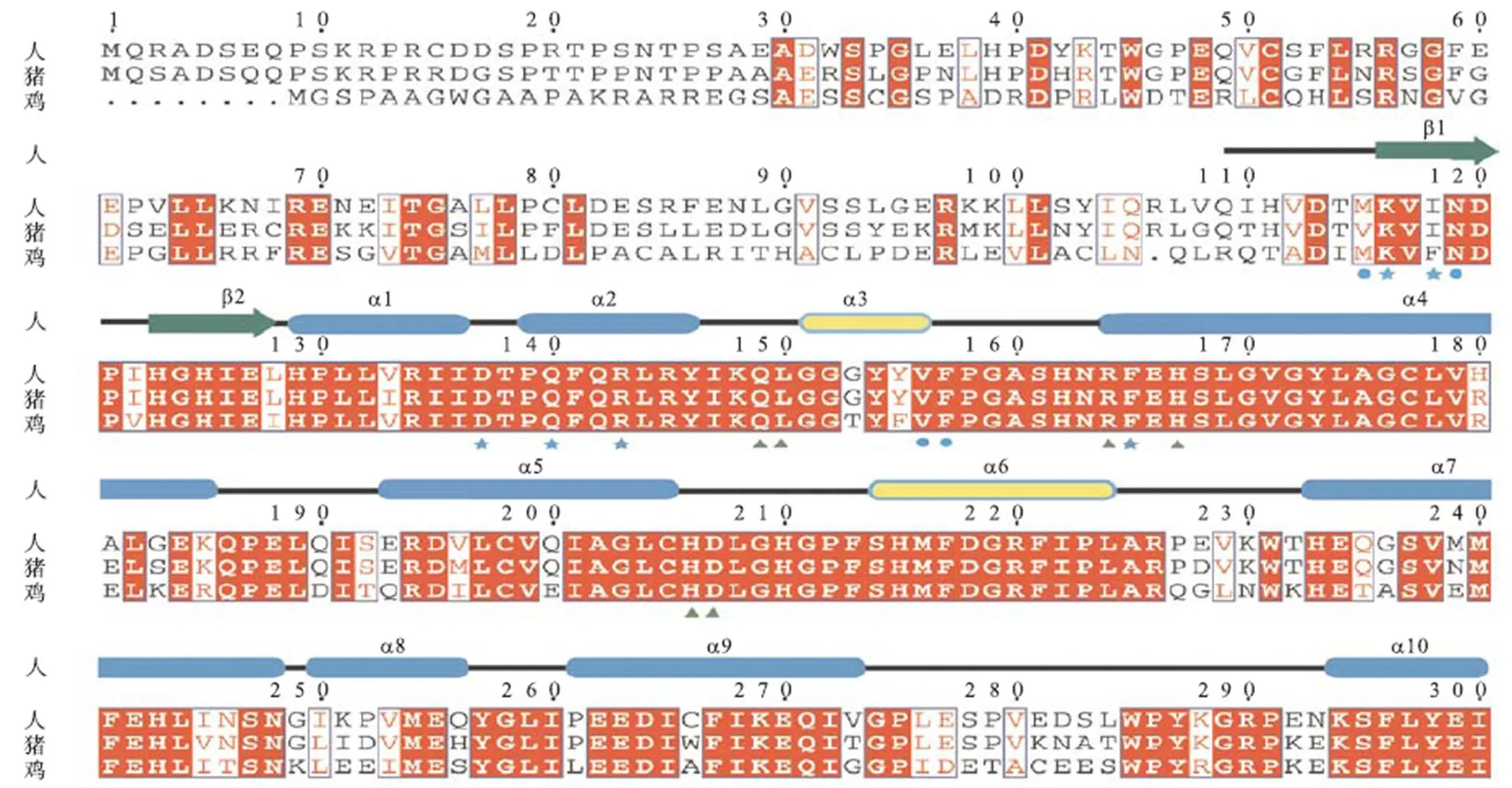
人源SAMHD1蛋白具有抗HIV-1病毒及细胞周期调节等功能,其抗病毒机制研究较为广泛,猪源SAMHD1蛋白也具有相似的抗病毒活性[7,,22-23].图3给出了人源、猪源及鸡源三物种SAMHD1蛋白序列比对分析,其中五角星代表变构位点1,蓝色圆圈代表变构位点2,绿色三角形代表底物结合位点,红色箭头代表核酸结合位点,黑色箭头代表磷酸化位点.结果显示,猪源SAMHD1与人源的SAMHD1的序列一致性为80.5%,而鸡源SAMHD1与人源的SAMHD1的序列一致性为60.0%,具有较高的序列同源性.而特别值得注意的是,构成SAMHD1变构位点的15个氨基酸中,其中有13个在3个物种的蛋白序列上保持完全一致,另外两个在3个物种SAMHD1序列上为性质相似的疏水氨基酸,并且构成SAMHD1 dNTP底物结合位点的14个氨基酸和1个已知的核酸结合位点在3个物种蛋白序列上保持一致.这种序列上的高度保守性暗示3者可能以相同的方式进行变构调节以及底物水解.同时,笔者发现人、猪与鸡源SAMHD1蛋白在其他一些功能位点上同样具有高度保守性(如SAMHD1蛋白磷酸化位点T592的序列一致性为100%),暗示了多物种SAMHD1蛋白在磷酸化调节其酶活性及抗病毒功能上可能也具有保守性.这些分析不仅令笔者推测鸡源SAMHD1也具有dNTP酶活性和核酸酶活性,并因此具有可能的抗病毒功能.同时,也令笔者思考对于SAMHD1这一蛋白,在其活性部位序列高度保守或一致的情况下,其生物学活性是否由于其他部分序列或结构上的差异而产生不同.接下来,笔者开展实验,比较三物种SAMHD1蛋白dNTP酶与核酸酶活性,以期更好地理解不同物种的生物学功能.
2.2 构建Samhd1c基因原核表达载体
SAMHD1蛋白的SAM结构域可能参与蛋白与核酸的相互作用,而HD结构域则具有dNTP酶及核酸酶活性,且单独的HD结构域具有和全酶近似的dNTP酶和核酸酶活性[4-5].因此,这里分别构建了编码人源SAMHD1(109~626)、猪源SAMHD1(109~627)与鸡源SAMHD1(101~614)的原核表达载体. 实验中,取5,μL PCR产物进行琼脂糖凝胶电泳分析,通过与DNA Marker对比,扩增片段大小与预期相符(见图4),其中编码人源SAMHD1(109~626)的基因为1,554,bp,编码猪源SAMHD1(109~627)的基因为1,557,bp,编码鸡源SAMHD1(101~614)的基因为1,542,bp.剩余PCR产物与克隆载体经双酶切后进行琼脂糖凝胶电泳分离,目的基因片段经回收纯化后,用T4连接酶连接至pET28a-Plus(N-6His)载体,连接产物转化至XL-10-gold感受态细胞中,挑取单克隆菌落过夜培养后提取质粒.质粒经测序验证,确认成功.
2.3 SAMHD1c蛋白的表达及纯化
分别将构建成功的pET28a-Plus(N-6His)-质粒转化至大肠杆菌BL21(DE3)感受态细胞中,挑取单克隆菌株进行培养,利用IPTG诱导蛋白表达,经过夜培养后收集菌体.将菌体用高压裂解,经Ni-NTA亲和层析与Superdex 200分子筛层析两步纯化,然后分别取3种纯化的蛋白样品进行SDS-PAGE电泳分析(见图5).根据蛋白质一级序列已知,人源6His-SAMHD1(109~626)蛋白大小为60.9,kg/mol,猪源6His-SAMHD1(109~627)蛋白大小为60.8,kg/mol,鸡源6His-SAMHD1(101~614)蛋白大小为60.4,kg/mol.通过SDS-PAGE电泳分离并与已知标准蛋白进行分子质量对比可知,所分离纯化的三物种SAMHD1c蛋白的分子质量与预期相符,目的蛋白的纯度均大于95%,适于后续酶活性实验.
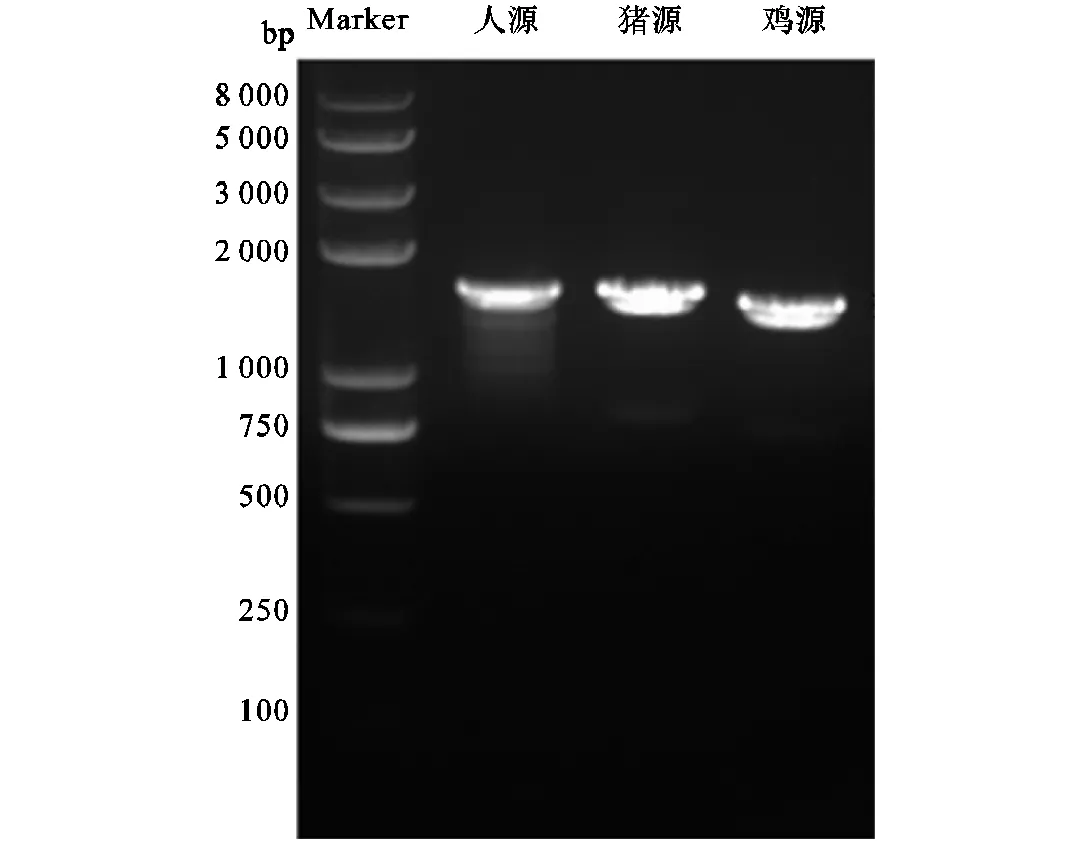
图4 三物种Samhd1c基因PCR结果
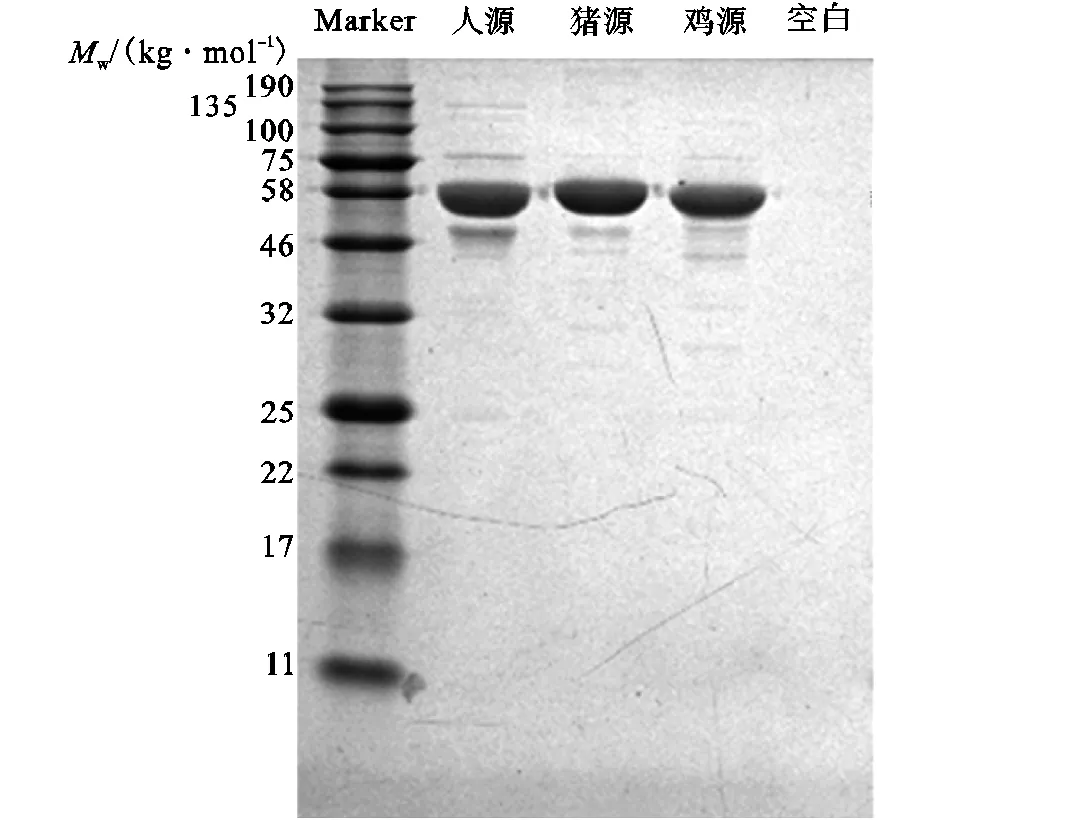
图5 人、猪和鸡源SAMHD1c蛋白SDS-PAGE结果
2.4 三物种SAMHD1c蛋白dNTP酶活性分析
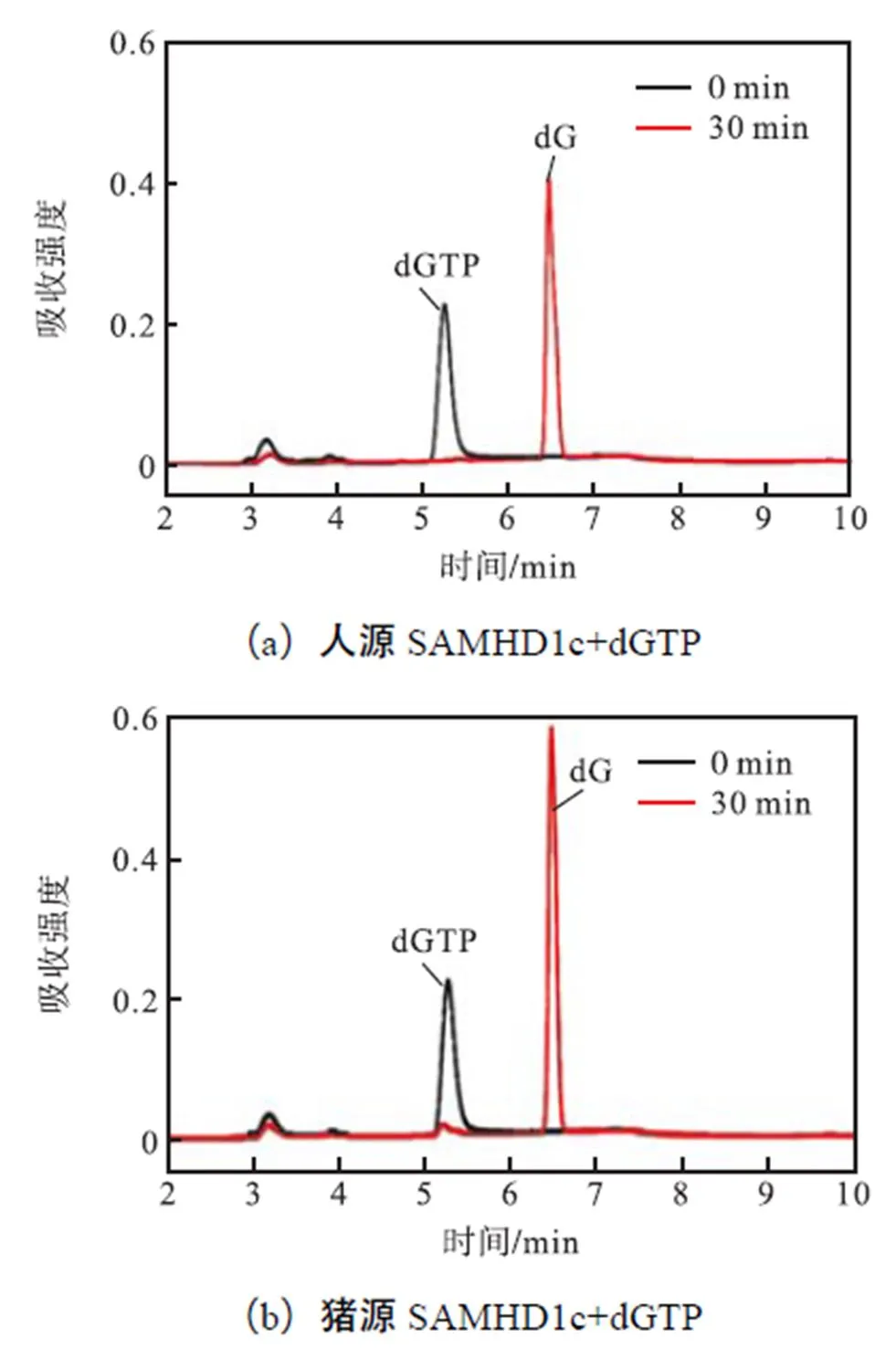
SAMHD1蛋白具有dNTP酶活性,通过GTP/ dGTP分子诱导蛋白发生变构,调节其dNTP水解酶活性[24-25].其中,dGTP分子既可以作为SAMHD1蛋白的变构剂,将SAMHD1蛋白诱导为四聚体的酶活状态[26-27],也可以作为酶催化的底物.笔者检测了人、猪、鸡三物种SAMHD1对dGTP的水解活性.首先将上述目的蛋白浓缩至2,mg/mL,以500,μmol/L的dGTP为底物,利用HPLC对SAMHD1c的dNTP酶活性进行检测(见图6).结果显示,3种来源的SAMHD1c蛋白均具有较高的dNTP酶活性,能够在短时间内将高浓度dGTP分解(见图6(a)~(c)).人源SAMHD1c蛋白具有相对较高的dNTP酶活性,猪源SAMHD1c dNTP酶活性略高于鸡源蛋白,但活性相差不大(见图6(d)).
笔者通过米氏方程的双倒数形式来计算三物种SAMHD1c的酶动力学常数.以dNTP酶活性为例,SAMHD1c蛋白在25,℃和0.8,μmol/L的条件下具有较高的酶活力,笔者固定反应中的SAMHD1c的质量浓度为50,μg/mL,测试该酶促反应在不同底物浓度下的起始速度,借助双倒数法得到三物种SAMHD1c蛋白的m值和cat值.m反映了酶与底物分子特异性结合能力,m值越小,说明该酶与dGTP的亲和力越大.如表2所示,在三物种中,人源SAMHD1蛋白m最大,猪源蛋白与鸡源蛋白m相近.cat反映了SAMHD1c分子对底物的催化反应速率,结果显示,人源SAMHD1的cat最高,猪源蛋白和鸡源蛋白的cat相近.
表2 三物种SAMHD1c dNTP酶活性动力学参数
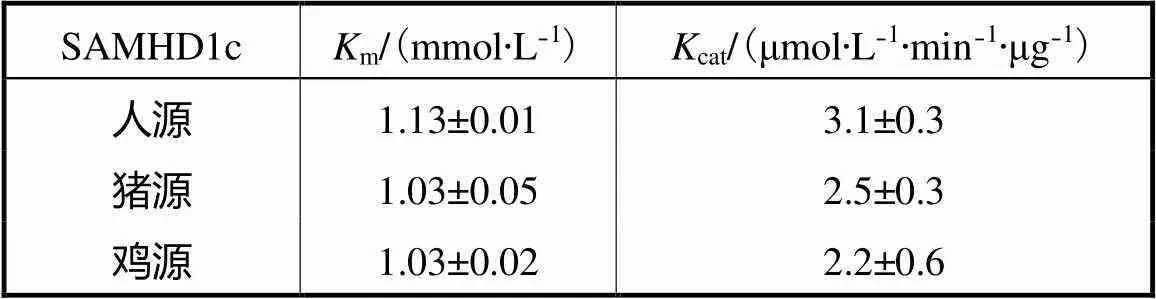
Tab.2 Kinetic parameters of dNTPase activities of three SAMHD1c proteins
2.5 三物种SAMHD1c蛋白核酸酶活性分析
人源SAMHD1蛋白具有核酸酶活性,可以对单链RNA、DNA及双链RNA、DNA进行剪切,该核酸酶活性被认为是除dNTP酶活性之外的抗病毒基 础[12-15].但这种抗病毒机制至今不明,为了探究多物种SAMHD1蛋白是否均具有核酸酶活性,这里分别运用两种方法对其进行探究.首先,以单链DNA为底物,利用HPLC检测SAMHD1c蛋白对核酸进行水解后的产物,见图7.如图7所示,人、猪与鸡源SAMHD1c蛋白均具有核酸酶活性,可以将单链DNA降解.同时,笔者还利用酶标仪对不同物种SAMHD1c蛋白核酸酶活性进行了检测.实验中,底物核酸两端分别进行5’-FAM荧光基因和3’-BHQ1淬灭基因修饰,当SAMHD1c蛋白降解核酸底物时,3’-BHQ1淬灭基团与5’-FAM荧光基团分离,从而显现出FAM荧光信号.与HPLC检测结果一致,3种SAMHD1c均显示出核酸酶活性.并且猪源SAMHD1c蛋白的核酸酶活性较低于人源与鸡源SAMHD1c(见图8).
综合以上实验结果,3个物种SAMHD1c蛋白均具有dNTP酶活性及核酸酶活性,但酶活性高低存在明显差异,猪源SAMHD1c蛋白表现出低核酸酶活性,而人源SAMHD1c蛋白则表现出高dNTP酶活性.
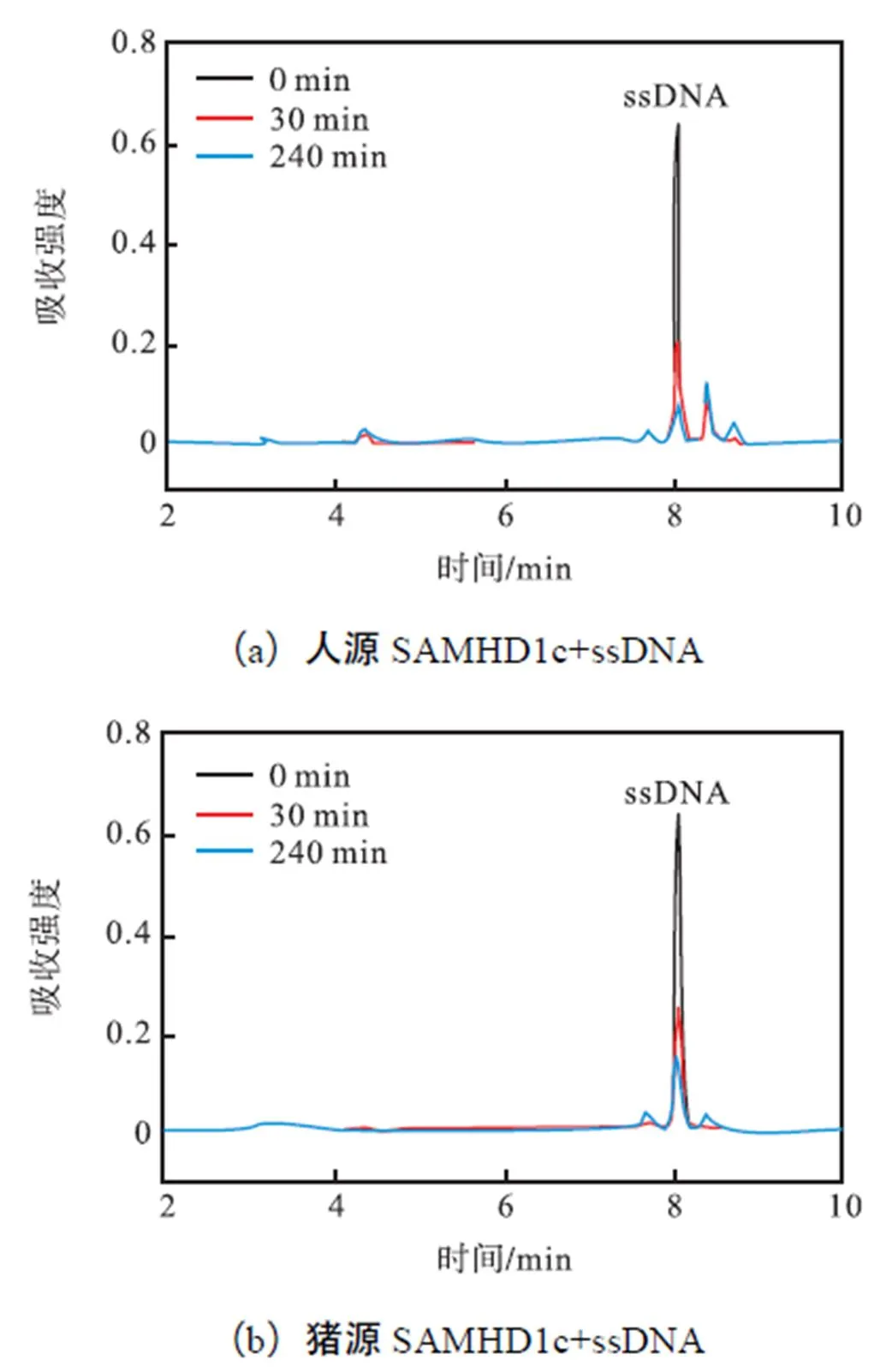
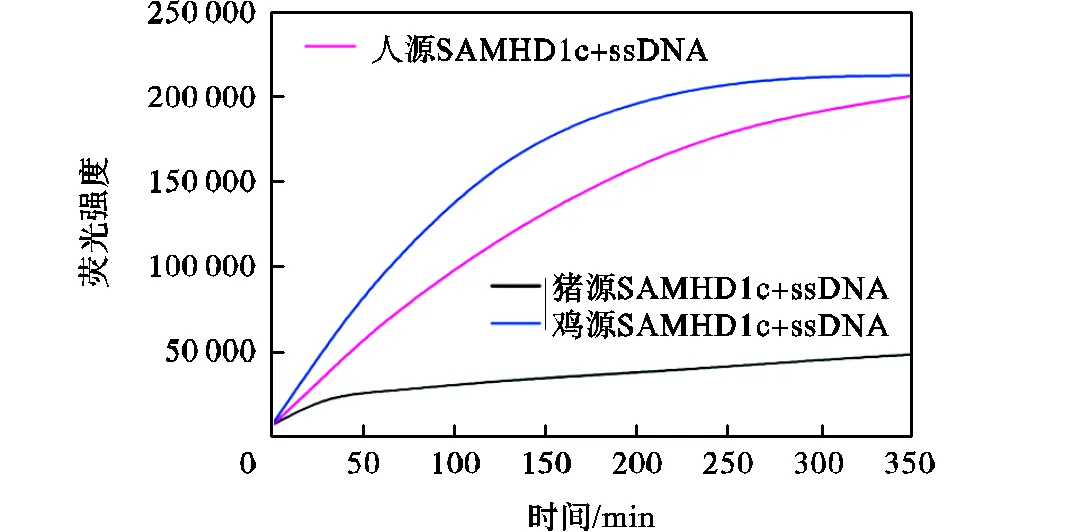
图8荧光检测法测定三物种SAMHD1c蛋白核酸酶活性
3 讨 论
SAMHD1蛋白是一种天然免疫限制因子,由美国的Hrecka和法国的Laguette于2011年几乎同时鉴定出[28-29]其抗病毒活性,迅速成为国际艾滋病病毒领域研究的热点.大量关于人源SAMHD1的研究阐明了SAMHD1在细胞增殖、免疫应答和病毒抑制方面的作用[9,,30].迄今为止,已有关于SAMHD1蛋白的研究主要集中在人源蛋白上,而关于猪源、鸡源SAMHD1蛋白的研究却很少.鉴于禽类病毒和猪繁殖和呼吸障碍综合症病毒(PRRSV)已经给相关产业带来了巨大的损失[7,,31-32],且SAMHD1蛋白在抵抗病毒的侵染上起到重要作用,笔者将目光转向猪源、鸡源SAMHD1蛋白与人源SAMHD1的共性与差异的研究,希望能更好理解SAMHD1蛋白家族抗病毒机制,并为转化应用提供依据.
本研究以人、猪和鸡源SAMHD1c蛋白为研究对象,对上述三物种SAMHD1蛋白序列进行了比对分析,发现SAMHD1蛋白在变构位点、活性位点、磷酸化位点和核酸结合等位点处具有很高的保守性.构建了三物种SAMHD1c的原核表达系统,并成功纯化出具有酶活性的高纯度SAMHD1c蛋白.通过HPLC、酶标仪等检测方法分别比较了三物种SAMHD1蛋白的dNTP酶活性和核酸酶活性.首先,dNTP酶活性检测实验显示,3种来源的SAMHD1c蛋白都具有较高的dNTP酶活性,暗示三者皆可以通过降低细胞内的dNTP水平来抑制侵入病毒的复制,且人源SAMHD1c的dNTP酶活性明显高于其他物种的SAMHD1.其次,利用HPLC和酶标仪进行核酸酶活性检测.结果显示,三物种SAMHD1c蛋白都具有核酸酶活性,即均具有降解所入侵病毒核酸的功能.但猪源SAMHD1c蛋白核酸酶活性却明显低于其他物种,因3个物种SAMHD1蛋白在构成dNTP酶与核酸酶活性位点的氨基酸序列上具有高度的保守性,所以造成3个物种SAMHD1蛋白活性差异的原因可能来源于该蛋白其他不保守氨基酸的化学性质的差别和相应蛋白整体或局部三维结构的改变.具体分子机制的阐明则有赖于后续相关蛋白质分子三维精细结构的解析与分析.
SAMHD1家族蛋白的抗病毒功能依赖于其dNTP酶活性及核酸酶活性已成为业界共识.笔者的研究显示,这3个物种SAMHD1蛋白均保留了dNTP酶活性与核酸酶活性,因此,SAMHD1在3个物种中可能以相似的方式抵抗相应物种病毒入侵.随着人源SAMHD1蛋白的抗病毒机制研究的深入,相关研究将有助于理解其他物种SAMHD1蛋白的抗病毒机制.通过比较物种之间SAMHD1蛋白序列及酶活性的共性与差异,有助于该领域抗病毒机制的研究与畜牧业优良品种的开发.
4 结 语
笔者借助序列比对,发现人源、猪源和鸡源三物种SAMHD1蛋白活性位点在序列上的共性与差异,利用HPLC、荧光检测等技术,发现猪源、鸡源SAMHD1蛋白同样具有dNTP酶和核酸酶活性,人源蛋白dNTP酶活性最高,而猪源蛋白核酸酶活性最低.本研究有助于理解SAMHD1的结构与功能关系和该蛋白的抗病毒机制,为畜牧业优良品种的开发提供了启示.
[1] Kim C A,Gingery M,Pilpa R M,et al. The SAM domain of polyhomeotic forms a helical polymer[J].,2002,9(6):453-457.
[2] Green J B,Gardner C D,Wharton R P,et al. RNA recognition via the SAM domain of Smaug[J].,2003,11(6):1537-1548.
[3] Qiao F,Bowie J U. The many faces of SAM[J].,2005,3(1):286-295.
[4] Oussenko I A,Sanchez R,Bechhofer D H. Bacillus subtilis YhaM,a member of a new family of 3'-to-5' exonucleases in gram-positive bacteria[J].,2002,184(22):6250-6259.
[5] Sinkunas T,Gasiunas G,Fremaux C,et al. Cas3 is a single-stranded DNA nuclease and ATP-dependent helicase in the CRISPR/Cas immune system[J].,2011,30(7):1335-1342.
[6] VorontsovII,Minasov G,Kiryukhina O,et al. Characterization of the deoxynucleotide triphosphate triphosphohydrolase(dNTPase)activity of the EF1143 protein from Enterococcus faecalis and crystal structure of the activator-substrate complex[J].,2011,286(38):33158-33166.
[7] Yang S,Shan T,Zhou Y,et al. Molecular cloning and characterizations of porcine SAMHD1 and its roles in replication of highly pathogenic porcine reproductive and respiratory syndrome virus[J].,2014,47(2):234-246.
[8] Baldauf H M,Pan X,Erikson E,et al. SAMHD1 restricts HIV-1 infection in resting CD4(+)T cells[J].,2012,18(11):1682-1687.
[9] Sommer A F,Riviere L,Qu B,et al. Restrictive influence of SAMHD1 on Hepatitis B virus life cycle[J].,2016,6(1):26616-26629.
[10] Jermy A. Viral infection:SAMHD1 cuts the power to HIV-1[J].,2012,10(4):237-245.
[11] Yan J,Kaur S,Delucia M,et al. Tetramerization of SAMHD1 is required for biological activity and inhibition of HIV infection[J].,2013,288(15):10406-10417.
[12] Beloglazova N,Flick R,Tchigvintsev A,et al. Nuclease activity of the human SAMHD1 protein implicated in the Aicardi-Goutieres syndrome and HIV-1 restriction[J].,2013,288(12):8101-8110.
[13] Ryoo J,Choi J,Oh C,et al. The ribonuclease activity of SAMHD1 is required for HIV-1 restriction[J].,2014,20(8):936-941.
[14] Tungler V,Staroske W,Kind B,et al. Single-stranded nucleic acids promote SAMHD1 complex formation[J].(),2013,91(6):759-770.
[15] Choi J,Ryoo J,Oh C,et al. SAMHD1 specifically restricts retroviruses through its RNase activity[J].,2015,12(1):46-57.
[16] Arnold L H,Groom H C,Kunzelmann S,et al. Phospho-dependent regulation of SAMHD1 oligomerisation couples catalysis and restriction[J].,2015,11(10):1-30.
[17] Tang C,Ji X,Wu L,et al. Impaired dNTPase activity of SAMHD1 by phosphomimetic mutation of Thr-592[J].,2015,290(44):26352-26359.
[18] Yan J,Hao C,Delucia M,et al. CyclinA2-cyclin-dependent kinase regulates SAMHD1 protein phosphohydrolase domain[J].,2015,290(21):13279-13292.
[19] Garner M G,Whan I F,Gard G P,et al. The expected economic impact of selected exotic diseases on the pig industry of Australia[J].,2001,20(3):671-685.
[20] Nieuwenhuis N,Duinhof T F,van Nes A. Economic analysis of outbreaks of porcine reproductive and respiratory syndrome virus in nine sow herds[J].,2012,170(9):225.
[21] Neumann E J,Kliebenstein J B,Johnson C D,et al. Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States[J].,2005,227(3):385-392.
[22] Cribier A,Descours B,Valadao A L,et al. Phosphorylation of SAMHD1 by cyclin A2/CDK1 regulates its restriction activity toward HIV-1[J].,2013,3(4):1036-1043.
[23] Pauls E,Ruiz A,Badia R,et al. Cell cycle control and HIV-1 susceptibility are linked by CDK6-dependent CDK2 phosphorylation of SAMHD1 in myeloid and lymphoid cells[J].,2014,193(4):1988-1997.
[24] Goldstone D C,Ennis-Adeniran V,Hedden J J,et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase[J].,2011,480(7377):379-382.
[25] Li Y,Peng X,Qin X. Recombinant expression,purification,and crystallization of the sterile alpha-motif/histidine-aspartate domain-containing protein from chicken[J].,2017,133(1):96-101.
[26] Ji X,Wu Y,Yan J,et al. Mechanism of allosteric activation of SAMHD1 by dGTP[J].,2013,20(11):1304-1309.
[27] Zhu C,Gao W,Zhao K,et al. Structural insight into dGTP-dependent activation of tetrameric SAMHD1 deoxynucleoside triphosphate triphosphohydrolase[J].,2013,4(1):2722-2730.
[28] Hrecka K,Hao C,Gierszewska M,et al. Vpx relieves inhibition of HIV-1 infection of macrophages mediated by the SAMHD1 protein[J].,2011,474(7353):658-661.
[29] Laguette N,Sobhian B,Casartelli N,et al. SAMHD1 is the dendritic-and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx[J].,2011,474(7353):654-657.
[30] Oberstrass F C,Lee A,Stefl R,et al. Shape-specific recognition in the structure of the Vts1p SAM domain with RNA[J].,2006,13(2):160-167.
[31] Davis A S,Taubenberger J K,Bray M. The use of nonhuman primates in research on seasonal,pandemic and avian influenza,1893-2014[J].,2015,117(1):75-98.
[32] Kapgate S S,Barbuddhe S B,Kumanan K. Next generation sequencing technologies:Tool to study avian virus diversity[J].,2015,59(1):3-13.
(责任编辑:田 军)
Enzymatic Activities of SAMHD1s from Human,Pig,and Chicken
He Shuangyi1,Kong Jia1, 2,Wang Meimei1,Mi Lizhi1,Qin Xiaohong1, 3
(1. School of Life Science,Tianjin University,Tianjin 300072,China;2. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300350,China;3. State Key Laboratory of Medicinal Chemical Biology,Nankai University,Tianjin 300071,China)
Sterile α-motif/histidine-aspartate domain-containing protein 1(SAMHD1),an innate immunological factor,can restrict viral replication by using its deoxynucleotide triphosphohydrolase(dNTPase)or nuclease activities,thus having a broad spectrum of antiviral functions. The sequence conservativeness of human,porcine,and chicken SAMHD1s was analyzed by bioinformatics,and their enzymatic activities were compared by using high performance liquid chromatography(HPLC) and a fluorescent-based enzymatic assay. It is found that the allosteric,nucleotide binding,and phosphorylation sites of SAMHD1 were highly conservative in sequence. Although all the SAMHD1s from the three different species had dNTPase and nuclease activities,they did show difference in the measured activities. Among them,human SAMHD1 had the highest dNTPase activity,and the porcine SAMHD1 had the lowest nuclease activity. This study provides information for understanding SAMHD1 structure-activity relationships and the development of new breeds in the livestock industry.
SAMHD1;species;protein expression and purification;dNTPase activity;nuclease activity
10.11784/tdxbz201703051
Q71
A
0493-2137(2018)01-0009-09
2017-03-20;
2017-05-19.
贺双意(1990— ),男,硕士研究生,shyhebio@163.com.
秦晓红,qinxiaohong@tju.edu.cn.
2017-06-13.
http://kns.cnki.net/kcms/detail/12.1127.N.20170613.1052.004.html.
国家自然科学基金资助项目(31400465);天津市自然科学基金资助项目(15JCQNJC09800);南开大学药物化学生物学国家重点实验室资助项目(20150629).
the National Natural Science Foundation of China(No.,31400465),the Natural Science Foundation of Tianjin(No.,15JCQNJC09800)and the State Key Laboratory of Medicinal Chemical Biology(Nankai University)(No.,20150629).
