不同高精料耐受时间对泌乳期山羊肝脏糖脂代谢的影响
2018-01-19罗燕文田平华灿枫陶诗煜倪迎冬
罗燕文,田平,华灿枫,陶诗煜,倪迎冬
(南京农业大学农业部动物生理生化重点开放实验室,江苏 南京 210095)
随着人民生活水平的改善,人们对乳制品的需求不断提高。为了满足奶牛高产奶的能量需求,通常在饲料里添加大量易发酵的精饲料,这虽然在一定程度上提高了反刍动物的生产性能,但过量摄入会导致瘤胃代谢异常,最终引发亚急性瘤胃酸中毒(subacute ruminal acidosis, SARA)[1]。该病是集约化奶牛场中的一种多发性代谢疾病,常伴随瘤胃上皮损伤、腹泻、乳房炎、蹄叶炎等临床疾病[2],严重影响奶牛健康和泌乳性能,给奶牛养殖业带来巨大的经济损失[3]。
肝脏是调节糖代谢,维持机体能量平衡的主要组织。肝脏是糖异生的主要场所[4], 而糖异生是反刍动物最重要的糖原合成途径。在反刍动物,90%葡萄糖都是由肝糖异生产生[5]。反刍动物体内的碳水化合物不能被直接利用,只能在瘤胃内经微生物发酵后生成挥发性脂肪酸(乙酸、丙酸、丁酸),其中丙酸作为主要生糖前体物进入肝脏后生成丙酮酸,经丙酮酸羧化酶(pyruvic carboxylase, PC)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)和葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)催化后最终异生成糖[6]。此外,肝脏也是脂肪代谢的重要器官,其脂质代谢作用对乳脂的合成至关重要。肝脏对来自脂肪组织分解产生的游离脂肪酸、瘤胃发酵产生的挥发性脂肪酸、日粮来源的长链脂肪酸等代谢产物进行转化和分配[7],最终决定乳脂的数量与质量[8]。
目前多集中于研究高精料对反刍动物乳腺组织脂肪代谢的影响,而对肝脏糖代谢和脂代谢的研究较少。本研究以泌乳中期奶山羊为实验动物,初步探索长期和短期饲喂高精料日粮对其肝脏糖脂代谢的影响及相关机制。本研究为缓解泌乳奶山羊能量负平衡和实现定向调控乳脂的合成提供参考资料。
1 材料与方法
1.1 试剂与仪器
TRIzol Reagent 购自上海英俊生物技术有限公司;SYBR Premix Ex TaqTM 购自TaKaRa公司;肝糖原、总胆固醇、甘油三酯试剂盒均购自南京建成生物研究所。冷冻离心机(Allegra TM64R,BECKMAN COULTERTM,美国);电动匀浆器;Mx3000P Real-time PCR仪(STRATAGENE,美国);酶标仪(Synergy2,Bio Tek,美国);NanoDrop TM1000(Thermo Scientific,美国); Ysmex-2100全自动血液分析仪(希森美康生物科技有限公司)。
1.2 试验动物与饲养
本实验于2013年5月开始,选取16只健康状况良好的二胎次泌乳中期关中奶山羊(购自陕西西安),饲养于西北农林科技大学实验用动物房。随机分为3组,低精料组(精粗比35∶65,LC,n=5)、短期高精料组(精粗比65∶35,HS,n=4),饲喂期为4周,长期高精料组(精粗比65∶35,HL,n=7),饲喂期为19周。日粮营养成分含量同参考文献[9]。实验结束后宰杀采集血液和肝脏组织样。整个实验期间,动物自由饮水,每日挤奶时间为早晨8:00和下午6:00。
1.3 样品采集
1.3.1血液的采集 实验结束后,用采血针、肝素钠真空离心管经颈静脉采血,4 ℃,3000 r·min-1离心15 min,收集血浆,-20 ℃保存。
1.3.2肝脏的采集 采集肝脏组织,立即放入液氮,-80 ℃保存。
1.4 甘油三脂和总胆固醇的测定
用Ysmex-2100全自动血液分析仪(希森美康生物科技有限公司)检测血浆中葡萄糖、甘油三酯(TG)、总胆固醇(TCH)等指标。
按南京建成生物工程研究所生产的试剂盒说明书测定肝糖原(蒽酮法)[10]、肝脏甘油三酯和总胆固醇等指标。
1.5 样品处理与分析测定
1.5.1样品总RNA提取和cDNA的制备 称取50 mg左右的肝脏组织,用Trizol一步法提取总RNA, NanoDrop分光光度计检测RNA浓度和纯度,2%琼脂糖凝胶电泳验证RNA质量,-70 ℃保存备用。反转录酶体系及Tap酶为 Promega 产品。引物采用Primer 6.0软件设计目的基因引物序列,由南京金唯智生物工程有限公司合成,引物见表1。PCR的反应条件为95 ℃预变性3 min,95 ℃变性30 s,64 ℃退火20 s,72 ℃延伸20 s,共40个循环。实时荧光定量分析采用2-ΔΔCT法[11],以GAPDH为内标基因,计算目的基因转录的相对量,通过以下公式计算出每一个样本的ΔΔCT值,最后每一个样本值以2-ΔΔCT表示,x表示任意一个样本,公式如下:ΔΔCT=(CT.目的基因-CT.内参基因)x-(CT.目的基因-CT.内参基因)control。
1.5.2组织总蛋白提取 蛋白酶抑制剂混合片(Roche,4693132001)购于上海罗氏制药有限公司;BCA蛋白测定试剂盒(Thermo,23225)购于南京生兴生物技术有限公司,硝酸纤维素膜(PALL,T91375)购于巴傲得生物科技有限公司;Pierce发光检测试剂盒(Thermo,NC15080或34076)购于南京生兴生物技术有限公司。
称取50 mg左右的肝脏组织,加入10倍体积冰浴的RIPA(radio immuno precipitation assay buffer)总蛋白裂解液;充分匀浆后冰上静置10 min,4 ℃,12000 r·min-1离心20 min,取上清。用BCA试剂盒测定蛋白浓度,将蛋白统一用蛋白裂解液稀释至合适的浓度,变性,-80 ℃冰箱储存。上样量10 g,分离胶10%,浓缩胶4%,电泳,转印至硝酸纤维素膜上,之后室温封闭2 h,接着一抗4 ℃摇床孵育过夜,1×TBST洗膜10 min 3次,再用二抗室温孵育2 h,1×TBST洗膜10 min 3次,最后,采用凝胶成像系统Versa DocTM Imaging System进行发光检测,并用Quantity One Software软件进行数据统计分析。
1.6 数据统计与分析
采用SPSS 20.0软件进行单变量双因素分析;用ANOVA进行方差分析。
2 结果与分析
2.1 不同精料比日粮对血糖和肝糖原的影响
如图1所示,HS组和HL组山羊的血糖和肝糖原浓度显著高于LC组(P<0.05)。
2.2 不同精料比日粮对血液肝脏中胆固醇、甘油三酯的影响
由表2可知,与LC组相比,HS和HL组奶山羊血浆甘油三酯水平显著降低(P<0.05),胆固醇水平无显著变化(P>0.05)。HS组肝脏中胆固醇和甘油三酯含量显著增高(P<0.05),而HL组胆固醇和甘油三酯含量没有发生显著变化(P>0.05)。
2.3 不同精粗比日粮对肝脏糖代谢相关基因和蛋白表达的影响
如图2所示,与LC组相比,HS组奶山羊肝脏组织中PC基因水平和PCK2蛋白水平显著升高(P<0.05);HL组奶山羊PC和GLUT2基因表达水平显著升高(P<0.05), 但3个糖异生关键酶的蛋白表达水平均无显著变化(P>0.05)。

表1 目的基因引物序列Table 1 Primer sequences of the target gene
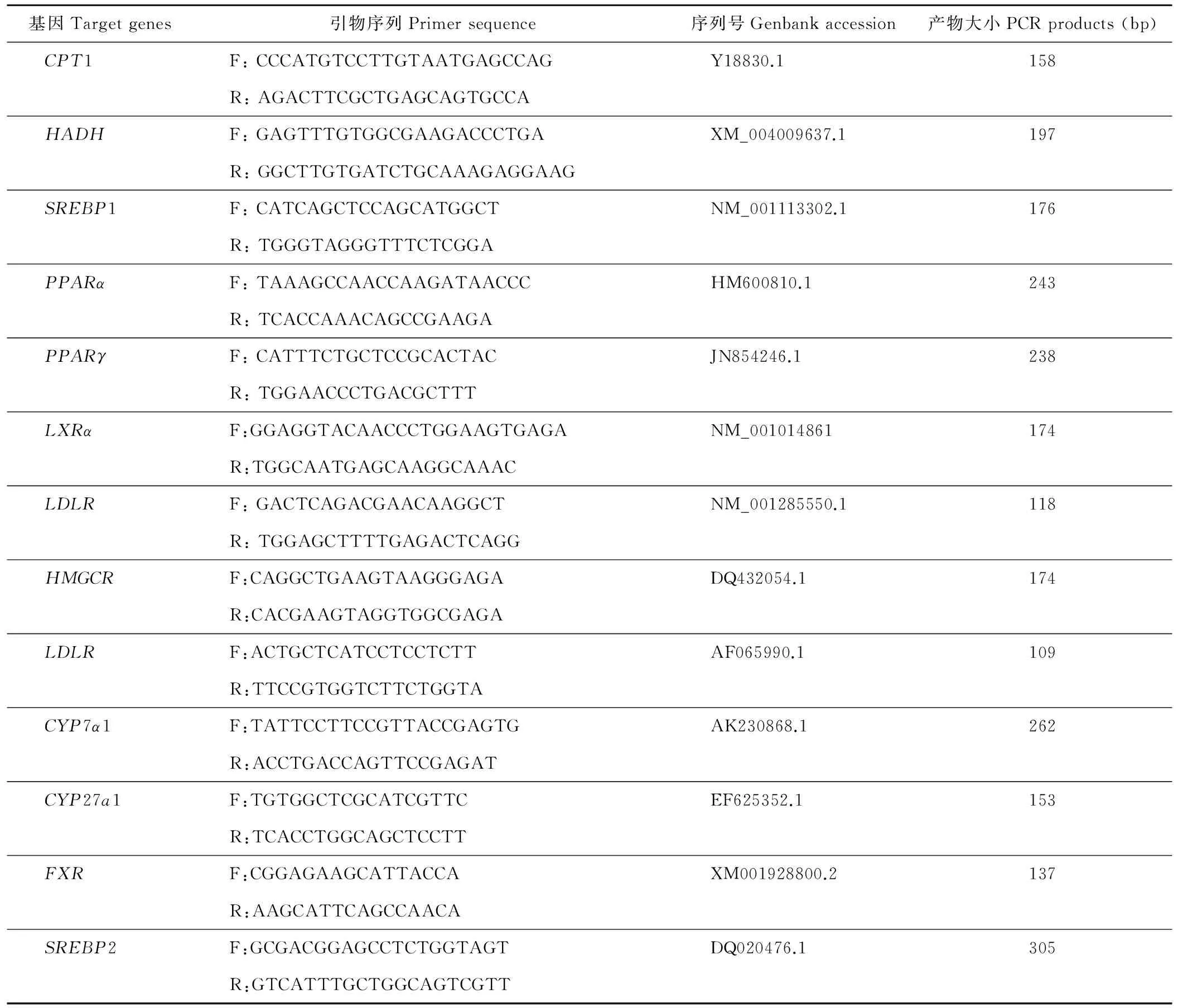
续表1 Continued Table 1
F:上游引物 Forward primer; R:下游引物 Reverse primer. GAPDH:甘油醛-3-磷酸脱氢酶Glyceraldehyde-3-phosphate dehydrogenase; PC:丙酮酸羧化酶Pyruvic carboxylase;PCK1:胞浆型磷酸烯醇式丙酮酸羧激酶 Cytosolic phosphoenolpyruvate carboxylase; PCK2:线粒体型磷酸烯醇式丙酮酸羧激酶 Mitochondrional phosphoenolpyruvate carboxykinsae; G6Pase:葡萄糖-6-磷酸酶 Glucose-6-phosphatase; HK:己糖激酶 Hexokinase; GLUT2:葡萄糖转运蛋白2 Glucose transporter 2; GLUT4:葡萄糖转运蛋白4 Glucose transporter 4; LXRβ: 肝X受体β Liver X receptor β; ACC:乙酰辅酶A羧化酶Acetyl CoA carboxylase; CD36:分化抗原簇36 Cluster of differentiation 36;SCD:硬脂酰辅酶A去饱和酶 Stearoyl-CoA desaturase;DGAT:二酰基甘油酰基转移酶Diacylgycerol acyltransferase; FAS:脂肪酸合酶Fatty acid synthase; FADS1:脂肪酸去饱和酶1 Fatty acid desaturases 1; FADS2:脂肪酸去饱和酶2 Fatty acid desaturases 2; ACSL1:长链脂酰CoA合成酶 Long-chain acyl-CoA synthetase; ACSS1:脂酰辅酶A合成酶1 Acyl-CoA synthetase1; ACSS2:脂酰辅酶A合成酶2 Acyl-CoA synthetase 2; LPL:脂蛋白脂肪酶Lipoprotein lipase; CPT1:肉碱棕榈酰转移酶-1 Carnitine palmitoyltransferase-1; HADH:3-羟脂酰辅酶A脱氢酶3-hydroxyacyl-CoA dehydrogenase; SREBP1:固醇调节元件结合蛋白1 Sterol regulatory element-binding protein 1; PPARα:过氧化物酶增殖物激活受体-α Peroxisome proliferator-activated receptor alpha; PPARγ:过氧化物酶增殖物激活受体-γ Peroxisome proliferator-activated receptor gamma; LXRα:肝X受体α Liver X receptor α; LDLR:低密度脂蛋白受体Low density lipoprotein receptor; HMGCR: 3-羟基-3-甲基戊二酰辅酶A还原酶3-hydroxy-3-methyl glutaryl coenzyme A reductase; LDLR:低密度脂蛋白Low density lipoprotein receptor; CYP7α1:胆固醇7α-羟化酶Cholesterol 7α-hydroxylase; CYP27A1:胆固醇27α羟化酶 Sterol 27-hydroxylase; FXR:法尼酯X受体Farnesoid X receptor; SREBP2:固醇调节元件结合蛋白2 Sterol regulatory element binding protein 2.
2.4 不同精粗比日粮对肝脏脂代谢相关基因的影响
如图3所示,与LC组相比,HS组奶山羊肝脏中SCD、DGAT和SREBP1基因表达水平显著升高(P<0.05),其他脂合成相关基因的表达无显著变化(P>0.05)。而HL组脂代谢相关基因的表达均无显著变化(P>0.05)。

图1 不同精粗比日粮对血糖(A)和肝糖原(B)的影响Fig.1 The effect of different concentrate ratio diet on the level of plasma glucose (A) and hepatic glycogen(B) LC:低精料组 Low concentrate; HS:短期高精料组 High concentrate for short term; HL:长期高精料组 High concentrate for long term. 不同字母代表差异显著(P<0.05)Values with different letters mean significant difference (P<0.05).

部位Part指标ParametersLCHSHL血Blood胆固醇CHOL(mmol·L-1)2.22±0.082.31±0.332.35±0.16甘油三酯TG(mmol·L-10.25±0.03a0.16±0.02b0.17±0.01b肝脏Liver胆固醇CHOL(μmol·g-1)0.57±0.03b1.00±0.20a0.69±0.07ab甘油三酯TG(mmol·L-1)0.12±0.02b0.26±0.04a0.20±0.05ab
LC:低精料组 Low concentrate; HS:短期高精料组 High concentrate for short term; HL:长期高精料组 High concentrate for long term. 同行不同字母表示差异显著(P<0.05)In the same row, the different letters mean significant difference atP<0.05.
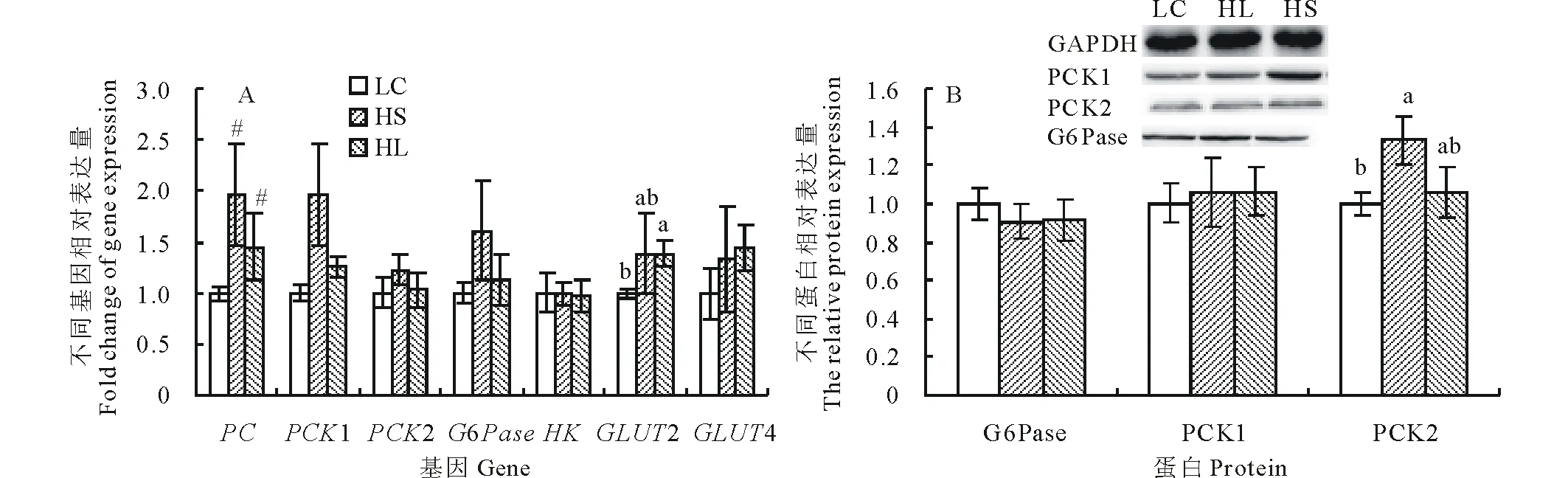
图2 不同精粗比日粮对肝脏糖代谢相关基因(A)和蛋白(B)表达的影响Fig.2 Effect of different concentrate ratio diet on mRNA (A) and protein (B) expression of glucose metabolic genes in liver 不同字母代表差异显著(P<0.05),#表示组间有差异趋势 (0.05 如图4所示,与LC组相比,HS组奶山羊肝脏胆固醇合成的关键酶HMGCR mRNA表达水平显著升高,SREBP2基因表达水平呈现升高趋势(P=0.76),而与胆固醇分解相关的基因CYP7α1显著降低(P<0.05);HL组胆固醇代谢相关基因的表达均无显著变化(P>0.05)。 图3 不同精粗比日粮对肝脏脂代谢相关基因表达的影响Fig.3 Effect of different concentrate diet on genes expression involved in lipid metabolism 图4 不同精粗比日粮对肝脏胆固醇代谢相关基因表达的影响Fig.4 Effect of different concentrate diet on genes expression involved in cholesterol metabolism 血糖浓度的变化反映了机体糖代谢的动态平衡状态,血糖的水平亦体现了机体的能量代谢水平[12]。肝糖原是葡萄糖的储存形式之一,对维持血糖稳定非常重要。张树坤[13]用高精料日粮饲喂泌乳期奶山羊两周后,血糖浓度显著上升。周传朋[14]用碳水化合物日粮饲喂淡水鱼,其肝糖原含量随日粮碳水化合物水平的增加而升高。本实验结果显示,短期或长期饲喂高精料日粮均能使血糖和肝糖原水平显著增高,与以往研究报道结果相一致。 体内甘油三酯和胆固醇水平是反映脂代谢状态最常见的指标[15]。郭勇庆等[16]用含有20%细粉碎小麦的全混合日粮诱导奶牛发生SARA后,肝脏甘油三酯合成作用增强,含量显著增加,血液甘油三酯显著降低。本研究也发现,短期高精料组肝脏甘油三酯增加,血液甘油三酯降低。但是,Van等[17]的研究结果表明,长期高精料组肝脏甘油三酯无显著变化,但血液甘油三酯显著降低,这可能与较低的瘤胃pH减弱了脂解作用和瘤胃中不饱和脂肪酸的氢化作用有关。 肝脏是机体糖异生的重要位点。反刍动物所需的葡萄糖90%来自于肝脏糖异生作用。丙酮酸羧化酶(PC)、磷酸烯醇式丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)是糖异生途径的关键酶[6],这些酶的mRNA表达水平直接决定着糖异生的速度[18-19]。PEPCK存在两个亚型,一个是位于细胞质的PCK1,另一个是位于线粒体的PCK2[20],PCK1 主要参与以氨基酸为底物的糖异生,而PCK2负责以乳酸为底物的糖异生[21];此外,提高PC的表达可增加内源性葡萄糖的产生。在本试验中,短期饲喂高精料日粮后肝脏中PCK2的蛋白水平显著提高,提示以乳酸为底物的糖异生加强;长期或短期饲喂高精料日粮后,丙酮酸羧化酶基因表达水平显著升高,提示肝脏糖异生作用增强。此外,葡萄糖转运蛋白2(GLUT2)主要存在于肝脏、肾脏和胰岛β细胞[22]。肝细胞中的葡萄糖载体蛋白97%都是GLUT2[23],主要负责肝脏上皮细胞基膜侧的葡萄糖转运,促进肝脏对葡萄糖的摄取和利用。GLUT2表达升高促进葡萄糖转运,为肝糖原合成增加提供条件。本实验结果显示,长期饲喂高精料日粮奶山羊肝脏GLUT2 mRNA水平显著升高,这可能是肝糖原含量升高的原因之一。 肝脏是脂肪合成与代谢的主要器官之一。硬脂酰 CoA 去饱和酶(SCD)是调节肝脏脂肪合成的关键酶之一,有SCD1和SCD2两种亚型,其中SCD1是表达于肝脏的主要亚型[24],催化肝细胞中饱和脂肪酸脱氢形成棕榈油酸CoA和油酸CoA,这两种产物是甘油三酯合成的底物。Miyazaki等[25]的研究发现,小鼠摄入高碳水化合物食物后显著提高其肝脏内SCD1蛋白的表达和活性。Listenberger等[26]的研究表明,小鼠肝细胞过表达SCD1,可增强甘油三脂的合成作用,调节脂肪酸的再合成。二酰甘油酰基转移酶(diacylgycerol acyltransferase,DGAT) 是甘油三酯合成中唯一的核心限速酶,其作用是催化二酰甘油加上脂肪酸酰基形成三酰甘油[27]。此外,固醇调节元件结合蛋白1(SREBP1)是一种重要的核转录因子,主要参与脂肪生成基因的调节[28]。本试验结果得出,HS组山羊肝脏中SCD、DGAT 和SREBP-1 mRNA表达水平显著增高,从而促进甘油三酯的合成,但长期饲喂高精料对奶山羊肝脏甘油三酯的合成没有明显影响。 脂肪酸β氧化能影响肝脏内脂肪酸的含量。肉毒碱棕榈酰转移酶-1(carnitinepalmitoyl transterase-1, CPT-1)是参与脂肪酸分解代谢的关键基因[29],负责调控长链脂肪酸进入线粒体进行β氧化。短期饲喂高精料组奶山羊CPT1转录水平下调,而长期组无变化,提示短期组山羊肝脏脂肪酸氧化减弱。 肝脏中TG水平由TG合成、分解及脂蛋白分泌等过程决定,反刍动物肝脏内的甘油三酯主要以极低密度脂蛋白(very low density lipoprotein, VLDL)的形式运输出肝脏。短期高精料组肝脏甘油三酯的合成作用增强,脂肪酸氧化减弱,脂肪合成大于分解,因此肝输出的VLDL浓度降低,血液中甘油三酯浓度下降。而长期饲喂高精料对脂肪合成与分解无显著影响,这可能是因为短期饲喂高精料日粮能增加血液皮质醇浓度,皮质醇具有促进肝脏脂合成的作用,而长期饲喂高精料日粮可导致慢性应激[30],降低皮质醇浓度[31],从而削弱了皮质醇促进脂合成的作用,最终导致长期高精料日粮组肝脏中TG水平没有显著变化。但血液中的甘油三酯却显著下降,这可能是因为较低的瘤胃pH减弱了脂解作用和瘤胃中不饱和脂肪酸的氢化作用[17]。 体内胆固醇的平衡是由胆固醇的合成、吸收和异化协调控制[32]。3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)是胆固醇合成的关键酶[33],其表达和活性直接影响胆固醇合成。固醇调节元件结合蛋白2(SREBP2)是胆固醇合成通路的主要调控元件[34],SREBP2过表达会加重肝细胞胆固醇积累[35]。胆固醇7a-羟化酶(CYP7α1)是肝脏胆汁酸合成途径中的关键限速酶,催化肝脏中胆固醇转化成胆汁酸排出体外[36]。Jones等[37]的研究发现,缺乏CYP7α1的小鼠其肝脏内胆固醇升高。本研究结果表明,短期高精料组奶山羊肝脏内HMGCR基因表达显著上调,SREBP2有升高的趋势,CYP7α1表达显著下降,说明肝脏胆固醇合成增加,分解减弱,造成肝脏胆固醇也显著增加。而长期高精料日粮则无此效应,这可能是因为应激会激活下丘脑-垂体-肾上腺轴,使肾上腺皮质激素增加,进而引起体内胆固醇水平升高[38],而长期饲喂高精料日粮导致的应激可使下丘脑-垂体-肾上腺轴活性逐渐降低[31],最终导致长期高精料日粮组胆固醇水平没有显著变化。 短期饲喂高精料日粮可上调肝脏中糖异生相关基因和蛋白的表达,增强肝脏糖异生能力,并能改变肝脏脂代谢和胆固醇代谢相关基因的表达,促进甘油三酯和胆固醇的合成;长期饲喂高精料日粮也可通过上调肝脏中糖异生相关基因的表达,增强肝脏糖异生能力,但对肝脏脂代谢没有显著影响。 References: [1] Plaizier J C, Krause D O, Gozho G N,etal. Subacute ruminal acidosis in dairy cows: The physiological causes, incidence and consequences. Veterinary Journal, 2008, 176(1): 21-31. [2] Alzahal O, Rustomo B, Odongo N E,etal. Technical note: A system for continuous recording of ruminal pH in cattle. Journal of Animal Science, 2007, 85(1): 213-217. [3] Kleen J L, Hooijer G A, Rehage J,etal. Subacute ruminal acidosis in Dutch dairy herds. Veterinary Record, 2009, 164(22): 681-684. [4] Aschenbach J R, Kristensen N B, Donkin S S,etal. Gluconeogenesis in dairy cows: The secret of making sweet milk from sour dough. Iubmb Life, 2010, 62(12): 869-877. [5] Li H M. The Effect of Different Energy Intake During the Dry Period on Glyconeogenesis in Periparturient Dairy Cows. Harbin: Northeast Agricultural University, 2014. 李红梅. 干奶期不同能量摄食对奶牛糖异生的影响. 哈尔滨: 东北农业大学, 2006. [6] Hurtaud C, Lemosquet S, Rulquin H. Effect of graded duodenal infusions of glucose on yield and composition of milk from dairy cows. 2. Diets based on grass silage. Journal of Dairy Science, 2000, 83(12): 2952. [7] Kristensen N B. Splanchnic metabolism of volatile fatty acids in the dairy cow. Animal Science An International Journal of Fundamental & Applied Research, 2005, 80(80): 3-10. [8] Tagari H, Jr W K, Theurer B,etal. Mammary uptake, portal-drained visceral flux, and hepatic metabolism of free and peptide-bound amino acids in cows fed steam-flaked or dry-rolled sorghum grain diets. Journal of Dairy Science, 2008, 91(2): 679-697. [9] Dong H B, Wang S Q, Jia Y Y,etal. Effect of long-term feeding of high concentrate diet on plasma biochemical parameters and expression of genes involved in glucose metabolism in lactating goats. Acta Prataculturae Sinica, 2014, 23(5): 295-302. 董海波, 王绍庆, 贾媛媛, 等. 长期饲喂高精料日粮对泌乳期山羊血液生化参数及组织中糖代谢相关基因表达的影响. 草业学报, 2014, 23(5): 295-302. [10] Seifter S, Dayton S S, Seifter S,etal. The estimation of glycogen with the anthrone reagent. Archives of Biochemistry and Biophysics, 1950, 25: 191-200. [11] Dong J I, Xin S J. Development and data analysis of real-time fluorescent quantitative PCR. Letters in Biotechnology, 2009, 20(4): 598-600. [12] Ai X J, Wu X L, Zhu Y Q,etal. Characteristics of some plasma biochemical parameter during perinatal period in cow. China Dairy Cattle, 2004, (1): 23-25. 艾晓杰, 吴晓林, 朱勇琪, 等. 初胎奶牛围产期某些血液生化成分的特点.中国奶牛, 2004, (1): 23-25. [13] Zhang S K. Effect of Different Forage Ratio Diets on Milk Fat/milk Protein and Its Mechanism in Lactating Goats. Nanjing: Nanjing Agricultural University, 2012. 张树坤. 不同精粗比日粮对泌乳奶山羊乳脂肪/乳蛋白的影响及其机制. 南京: 南京农业大学, 2012. [14] Zhou C P. Effect of Different Dietary Carbohydrate Levels on Growth Performance, Immunity and Carbohydrate Metabolic Enzymes in Wuchang Bream (Megalobramaamblycephala). Nanjing: Nanjing Agricultural University, 2012. 周传朋. 不同水平碳水化合物日粮对团头鲂的生长、免疫及相关糖代谢酶的影响. 南京: 南京农业大学, 2012. [15] Dy N M, Gostout C J, Balm R K. Bleeding from the endoscopically-identified Dieulafoy lesion of the proximal small intestine and colon. The American Journal of Gastroenterology, 1995, 90(1): 108-111. [16] Guo Y Q, Zhou Y, Xu X F,etal. Effect of finely ground wheat induced subacute ruminal acidosis on milk fat synthesis and expression of key lipogenic enzyme genes in liver tissue in dairy cows. Acta Veterinaria et Zootechnica Sinica, 2014, 45(7): 1120-1128. 郭勇庆, 邹杨, 徐晓锋, 等. 细粉碎小麦诱导亚急性瘤胃酸中毒对奶牛乳脂合成和肝脂肪合成关键酶基因表达量的影响. 畜牧兽医学报, 2014, 45(7): 1120-1128. [17] Van Nevel C J, Demeyer D I. Influence of pH on lipolysis and biohydrogenation of soybean oil by rumen contentsinvitro. Reproduction, Nutrition, Development, 1996, 36(1): 53-63. [18] Goto M, Yoshioka T, Battelino T,etal. TNF|[agr]|decreases gluconeogenesis in hepatocytes isolated from 10-day-old rats. Pediatric Research, 2001, 49(4): 552. [19] Lu D X. Regulatory theory system of glucose nutrition and its application in ruminant. Animal Husbandry and Feed Science, 2010, 31(6): 402-409. 卢德勋. 反刍动物葡萄糖营养调控理论体系及其应用. 畜牧与饲料科学, 2010, 31(6): 402-409. [20] Nijland M J, Mitsuya K, Li C,etal. Epigenetic modification of fetal baboon hepatic phosphoenolpyruvate carboxykinase following exposure to moderately reduced nutrient availability. Journal of Physiology, 2010, 588(8): 1349-1359. [21] Modaressi S, Brechtel K, Christ B,etal. Human mitochondrial phosphoenolpyruvate carboxykinase 2 gene. Structure, chromosomal localization and tissue-specific expression. The Biochemical Journal, 1998, 333(Pt 2): 359-366. [22] Wood I S, Trayhurn P. Glucose transporters (GLUT and SGLT): expanded families of sugar transport proteins. The British Journal of Nutrition, 2003, 89(1): 3-9. [23] Leturque A, Brot-Laroche E, Gall M L,etal. The role of GLUT2 in dietary sugar handling. Journal of Physiology and Biochemistry, 2005, 61(4): 529-537. [24] Chung M, Ha S, Jeong S,etal. Cloning and characterization of bovine stearoyl CoA desaturasel cDNA from adipose tissues. Bioscience Biotechnology & Biochemistry, 2000, 64(7): 1526-1530. [25] Miyazaki M, Kim Y C, Ntambi J M. A lipogenic diet in mice with a disruption of the stearoyl-CoA desaturase 1 gene reveals a stringent requirement of endogenous monounsaturated fatty acids for triglyceride synthesis. Journal of Lipid Research, 2001, 42(7): 1018-1024. [26] Listenberger L L, Han X, Lewis S E,etal. Triglyceride accumulation protects against fatty acid-induced lipotoxicity. Proceedings of The National Academy of Sciences of the United States of America, 2003, 100(6): 3077-3082. [27] Yu Y H, Ginsberg H N. The role of acyl-CoA: diacylglycerol acyltransferase (DGAT) in energy metabolism. Annals of Medicine, 2004, 36(4): 252-261. [28] Yokoyama C, Wang X, Briggs M R,etal. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell, 1993, 75(1): 187-197. [29] Mascaró C, Acosta E, Ortiz J A,etal. Control of human muscle-type carnitine palmitoyltransferase I gene transcription by peroxisome proliferator-activated receptor. Journal of Biological Chemistry, 1998, 273(15): 8560-8563. [30] Jia Y Y. Effect of Subacute Ruminal Acidosis on Cortisol Concentration and Hepatie Lipid Metabolism and Its Mechanism in Dairy Goats. Nanjing: Nanjing Agricultural University, 2013. 贾媛媛. 亚急性瘤胃酸中毒对山羊血液皮质醇浓度和肝脏脂代谢的影响及其机制研究. 南京: 南京农业大学, 2013. [31] Liu J M. Effect of long-term phychological stress on plasma corticosterone, catecholamine level and immunological function in rats. Acta Academiae Medicinae Qingdao, 2005, 41(3): 226-228. 刘继民. 长期心理应激对大鼠血浆皮质酮、儿茶酚胺水平及免疫功能的影响.青岛大学医学院学报, 2005, 41(3): 226-228. [32] Sen S, Makkar H P, Becker K. Alfalfa saponins and their implication in animal nutrition. Journal of Agricultural and Food Chemistry, 1998, 46(1): 131-140. [33] Jurevics H, Hostettler J, Barrett C,etal. Diurnal and dietary-induced changes in cholesterol synthesis correlate with levels of mRNA for HMG-CoA reductase. Journal of Lipid Research, 2000, 41(7): 1048-1054. [34] Liu H. Changes in Expression of Genes Involved in Liver Cholesterol Metabolism of Insulin Resistance and Diabetic Rats. Shijiazhuang: Hebei Medical University, 2010. 刘赫. 单纯胰岛素抵抗及糖尿病大鼠肝胆固醇代谢相关基因mRNA表达变化. 石家庄: 河北医科大学, 2010. [35] Qiang Y, Chen Y, Han L,etal. Inflammatory stress increases unmodified LDL uptake via LDL receptor: an alternative pathway for macrophage foam-cell formation. Inflammation Research, 2009, 58(11): 809-818. [36] Joo K M, Lee J H, Jeon H Y,etal. Pharmacokinetic study of ginsenoside Re with pure ginsenoside Re and ginseng berry extracts in mouse using ultra performance liquid chromatography/mass spectrometric method. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(1): 278-283. [37] Jones R D, Repa J J, Russell D W,etal. Delineation of biochemical, molecular, and physiological changes accompanying bile acid pool size restoration in Cyp7a1(-/-) mice fed low levels of cholic acid. The American Journal of Physiology Gastrointestinal and Liver Physiology, 2012, 303(2): 263-274. [38] Wu L, Zhao Y, Gong J B,etal. Effect of chronic restraint stress of serum glucose and lipid in healthy rats. International Journal of Endocrinology and Metabolism, 2010, 30(2): 80-82. 武磊, 赵云, 弓景波, 等. 慢性束缚应激对健康大鼠血糖及血脂的影响. 国际内分泌代谢杂志, 2010, 30(2): 80-82.2.5 不同精粗比日粮对肝脏胆固醇代谢相关基因的影响


3 讨论
3.1 不同精粗比对血糖及肝糖原的影响
3.2 不同精粗比日粮对肝脏糖代谢相关基因和蛋白表达的影响
3.3 不同精粗比日粮对肝脏脂代谢的影响
3.4 不同精粗比日粮对肝脏胆固醇代谢的影响
4 小结
