呼伦贝尔人工栽培草地土壤微生物对无芒雀麦不同播种密度的响应
2018-01-19李达王笛陈金强辛晓平徐丽君杨桂霞唐雪娟郭明英
李达,王笛,陈金强,辛晓平,徐丽君*,杨桂霞,唐雪娟,郭明英
(1.中国农业科学院农业资源与农业区划研究所,呼伦贝尔国家野外站,北京100081;2.呼伦贝尔市草原工作站,内蒙古 海拉尔021200)
土壤微生物(soil microorganism)是土壤中物质转化和养分循环的驱动力,参与土壤有机质的分解、腐殖质的形成,促进土壤养分的转化和循环各个生化过程[1-4],在土壤活动中起着重要作用。土壤微生物一直被用于评价土壤肥力的重要指标,包括微生物量碳(microbial biomass-C,MBC)、微生物量氮(microbial biomass-N,MBN)等[5-6]。土壤微生物量对植物有效养料起着储备库和源的作用,对植物体能否做到有效利用,能否保持陆地生态系统循环起到深刻影响[3]。土壤碳(C)、氮(N)的化学计量会显著影响微生物的生长、群落结构、生物量C∶N化学计量及其代谢活动[7],其中土壤微生物量碳占土壤有机碳的1.92%[8]、土壤微生物量氮占土壤全氮的1%~5%[3],虽然所占含量均不高,但对生态系统循环的重要作用不容忽视。
土壤酶(soil enzyme)也是参与土壤有机质转化的重要组成部分。包括腐殖质的分解与合成;动植物残体和微生物残体的分解,参与某些无机化合物的氧化、还原反应等生化过程。土壤酶活性(soil enzyme activity)的高低能够反映土壤中物质生长代谢的强弱,是代表土壤肥力的潜在指标[7-9]。
呼伦贝尔草原是我国目前保存最完整的草原生态系统之一,是我国北方草原的代表,也是我国北方乃至东亚地区的重要生态屏障[10-12]。目前为满足呼伦贝尔地区畜牧业需求,减少对草原的过度利用,人工栽培草地的地位变得极为重要,在需要苜蓿等豆科牧草进行饲草蛋白补充之外,同时也需要禾本科牧草提供足够日粮,无芒雀麦(Bromusinermis)是一种根茎型多年生禾草,有“禾草饲料之王”的美称,具有耐寒、抗旱,优质、高产的优点[13],适宜在呼伦贝尔这一高寒干旱地区推广种植。本试验旨在研究不同播种密度对无芒雀麦土壤微生物特性及酶活性的影响,以明确呼伦贝尔地区人工栽培草地无芒雀麦的适宜播种密度,并为呼伦贝尔地区无芒雀麦生产种植技术提供理论参考。
1 材料与方法
1.1 试验区概况
试验地选在呼伦贝尔草原生态系统国家野外试验站(内蒙古海拉尔市谢尔塔拉镇),N 49°06′-49°32′,E 119°32′-120°35′,年降水量多为350~400 mm,主要集中在7-9月,无霜期一般为110 d左右,年平均气温-2 ℃,极端最高、最低气温可达到36.17 ℃、-48.5 ℃,大于10 ℃的年积温为1780~1820 ℃,年日照时效平均为2807 h,太阳辐射年总量平均为5161 MJ·m-2。土壤为黑钙土,肥力中等,土壤含水量在13%~15%,有机质含量5.1%左右。属温带大陆性草原气候,植被群落有苜蓿(Medicagosativa)、无芒雀麦、草木樨状黄芪(Astragalusmelilotoides)、羊草(Leymuschinensis)、老芒麦(Elymussibiricus)、披碱草(Elymusdahuricus)、寸草苔(Carexduriuscula)、日阴菅(Carespediformis)等[14]。
1.2 研究方法
1.2.1试验设计 选择人工栽培无芒雀麦播量控制平台,按照播种密度由低到高设置5个处理组,分别为W1(7.5 kg·hm-2)、W2(15.0 kg·hm-2)、W3(22.5 kg·hm-2)、W4(30.0 kg·hm-2)、W5(37.5 kg·hm-2),每个处理组设置3个重复,重复为一个3 m×5 m试验小区,随机排列,共15个小区。
1.2.2地上、地下生物量及根冠比的测定 地上生物量:15个小区中随机设置3个0.5 m×0.5 m的样方,将样方中的植株均匀剪齐并收集至信封袋中,称取鲜重,之后将其放入80 ℃烘箱烘至恒重,称其干重;地下生物量:在土层深度0~20 cm采集地下生物量,将植株与根系上粘附的土壤洗净后放入80 ℃烘箱烘至恒重,称其干重;根冠比:地下生物量(干重)与地上生物量(干重)的比值。
1.2.3土壤微生物量碳、氮的测定 土壤样品于2015年两次刈割(7月26日与9月25日)后分别采集,各小区随机均匀选取5个取样点,每个取样点分两层用土钻取样,即0~10 cm、10~20 cm土层,分别混合作为一个样品约200 g,过2 mm筛,从土壤中取相当于干土重10 g土样3份进行预培养,做熏蒸处理,称取同样质量的土样3份做不熏蒸对照。微生物量碳(microbial biomass-C)采用熏蒸提取—容量分析法,微生物量氮(microbial biomass-N)采用熏蒸提取—茚三酮比色法进行测定[15-17],所用熏蒸剂均为氯仿。
1.2.4土壤酶活性的测定 蔗糖酶活性(sucrase, Suc)采用比色法,以24 h后1 g土壤中葡萄糖的质量(mg)表示蔗糖酶活性;脲酶活性(urease, Ure)采用比色法,以24 h后1 g土壤中NH3-N的质量(mg)表示脲酶活性;磷酸酶活性(phosphatase, Pho)采用比色法,以24 h后1 g土壤中释出的酚的质量(mg)表示磷酸酶活性;过氧化氢酶(catalase, CAT)活性采用容量法,用滴定土壤滤液所消耗的高锰酸钾量(mL)与滴定25 mL原始的过氧化氢混合液所消耗的高锰酸钾量(mL)的差值为过氧化氢酶活性[18]。
1.2.5土壤微生物呼吸与呼吸熵的测定 本研究采用直接吸收法(密闭法)滴定测定。土壤呼吸熵(respiration entropy, RQ)是微生物呼吸(microbial respiration, MR)与微生物量碳间比率,即每单位微生物生物量碳的具体呼吸速率[19-20]。
1.3 数据处理
采用Excel 2016软件进行绘图,利用SPSS 20.0软件进行数据的统计分析,采用单因素方差(One-Way ANOVA)分析,Duncan多重对比与多重线性回归分析。
2 结果与分析
2.1 不同时期无芒雀麦生物量随播种密度的变化
7月第1次刈割期,随着播种密度的增加,无芒雀麦地上生物量整体呈先增加后减少的趋势(图1),播量30.0 kg·hm-2的W4为最大值,显著高于W2和W5(P<0.05);地下生物量之间差异不显著(P>0.05),且整体数值偏低,通过图2可以看出根冠比数值高低与地上生物量数值呈反比,其原因可能是第1次刈割期前水热条件适宜无芒雀麦地上部分的生长发育。
9月第2次刈割期,随着播种密度的增加,无芒雀麦地上生物量随播种密度整体变化趋势与第1次刈割期相同,但相比之减少了28.04%~63.18%(图3),播量30.0 kg·hm-2的W4仍为最大值,但与其他播量差异不显著(P>0.05);地下生物量之间差异不显著(P>0.05),但整体数值较高,相比第1次刈割期的地下生物量提高了0.93~2.07倍;根冠比中W2与W5为峰值与第1次刈割期基本相似;第2次刈割期与第1次刈割期的生物量差异表明,经过刈割后无芒雀麦地上生物量发育减缓,在外界条件的促使下根系生长发达有利于无芒雀麦的越冬。

图1 第1次刈割期不同播量下生物量的比较Fig.1 Comparison of biomass under different sowing rates during the first mowing period

图2 两次刈割期不同播量下根冠比的比较Fig.2 Comparison of root shoot ratio under different sowing rates at two cutting stages
不同小写字母表示处理间差异显著(P<0.05),下同。Different small letters mean significant difference at 0.05 level among treatments. The same below.
2.2 不同土层深度下土壤微生物量碳、氮的变化

图3 第2次刈割期不同播量下生物量的比较Fig.3 Comparison of biomass under different sowing rates during the second mowing period
土壤微生物量碳在土壤浅层0~10 cm下,第1次刈割期在数值上除W2外均高于第2次刈割期,平均高出26.81%;第1次刈割期的土壤微生物量碳随播种密度在二项式回归曲线中(图4)呈现先降低后升高的趋势,由最高点W1下降至W2后上升至W5;第2次刈割期的土壤微生物量碳随播种密度在二项式回归曲线中(图4)呈现缓慢下降的趋势,从微生物量碳最高的W1稳步下降至微生物量碳最低的W5。
土壤微生物量碳在土壤深层10~20 cm下,第1次刈割期在数值上除W1外均高于第2次刈割期,平均高出68.58%;第1次刈割期的土壤微生物量碳随播种密度在二项式回归曲线中(图5)呈现缓慢升高逐渐平稳的趋势但拟合度较低(R2=0.1522),说明其不符合二项式分布,峰值分别出现在W2和W4;第2次刈割期的土壤微生物量碳随播种密度在二项式回归曲线中(图5)呈现先降低后升高的趋势,由微生物量碳最高的W1下降至微生物量碳最低的W3后缓慢上升至W5。

图4 土层0~10 cm不同播量下土壤微生物量碳变化Fig.4 Changes of soil MBC under different sowing rates in soil layer 0-10 cm

图5 土层10~20 cm不同播量下土壤微生物量碳变化Fig.5 Changes of soil MBC under different sowing rates in soil layer 10-20 cm
土壤微生物量氮在土壤浅层0~10 cm下,第1次刈割期的土壤微生物量氮随播种密度在二项式回归曲线中(图6)虽然拟合度不高,但其平均值的标准差仅为5.76,说明第1次刈割期的土壤微生物量氮变化平稳;第2次刈割期的土壤微生物量氮随播种密度在二项式回归曲线中(图6)呈现缓慢上升逐渐平稳的趋势,从微生物量氮最低的W1稳步上升在W3处趋于稳定。
土壤微生物量氮在土壤深层10~20 cm下,第1次和第2次刈割期随播种密度在数值上整体呈下降趋势;第1次刈割期的土壤微生物量氮随播种密度在二项式回归曲线中(图7)呈现稳定下降趋势;第2次刈割期的土壤微生物量氮随播种密度在二项式回归曲线中(图7)呈现先迅速降低后逐渐平稳的趋势。
2.3 不同土层深度下土壤微生物呼吸熵的变化
土壤微生物呼吸熵在土壤浅层0~10 cm下,第1次刈割期各处理组之间差异不显著(P>0.05),而第2次刈割期W1显著高于其余各组(P<0.05),达到其余各组两倍以上(图8);土壤微生物呼吸熵在土壤深层10~20 cm下,W1最高,W2其次,W1显著高于W3、W4和W5(P<0.05),第2次刈割期与其变化趋势基本一致,处理组W1最高,W2次之且相差很小,显著高于其余3组(P<0.05),高于1倍以上(图9);两个土层的微生物呼吸熵变化趋势说明播种密度在W1(7.5 kg·hm-2)和W2(15.0 kg·hm-2)时的土壤扰动较大,而播种密度W3(22.5 kg·hm-2)、W4(30.0 kg·hm-2)和W5(37.5 kg·hm-2)土壤环境较为成熟。

图6 土层0~10 cm不同播量下土壤微生物量氮变化Fig.6 Changes of soil MBN under different sowing rates in soil layer 0-10 cm
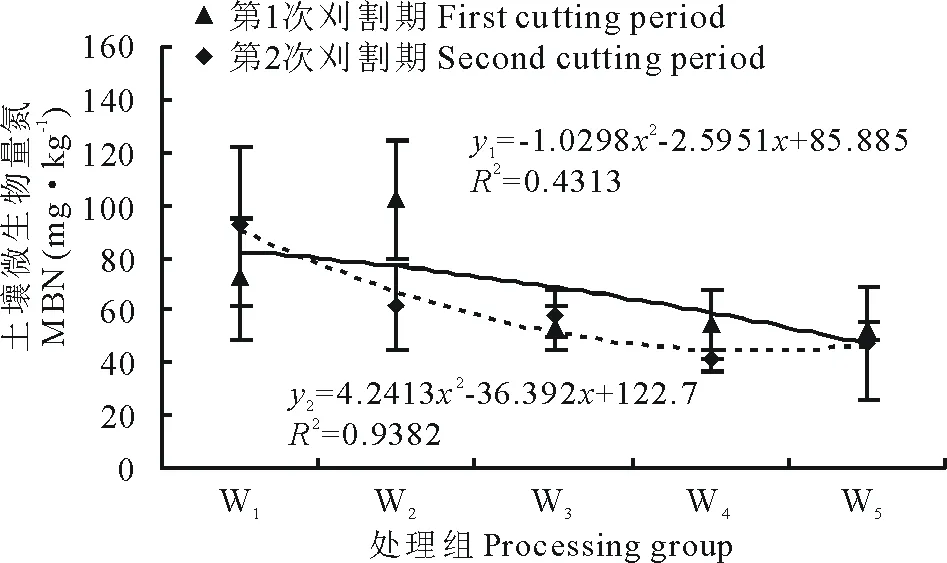
图7 土层10~20 cm不同播量下土壤微生物量氮变化Fig.7 Changes of soil MBN under different sowing rates in soil layer 10-20 cm

图8 土层0~10 cm不同播量下土壤微生物呼吸熵变化Fig.8 Changes of soil microbial respiratory entropy under different sowing rates in soil layer 0-10 cm

图9 土层10~20 cm不同播量下土壤微生物呼吸熵变化Fig.9 Changes of soil microbial respiratory entropy under different sowing rates in soil layer 10-20 cm
2.4 不同土层深度土壤酶活性变化
本试验对不同土层深度土壤酶活性进行分析,结果如表1所列,蔗糖酶、脲酶、碱性磷酸酶、过氧化氢酶4种酶活性在相同土层深度的不同时期变化规律一致,第1次刈割期的土壤酶活性均高于第2次刈割期,其中脲酶活性在两个时期存在显著差异(P<0.05);针对不同土层深度除蔗糖酶活性表现土壤深层(10~20 cm)大于土壤浅层(0~10 cm)外,其余各组没有明显趋势且均未达到显著水平。
2.5 呼吸熵影响因素的多重线性回归分析
本研究以呼吸熵为因变量,微生物呼吸、微生物量氮、微生物量碳、蔗糖酶活性、脲酶活性、碱性磷酸酶活性、过氧化氢酶活性为预测变量进行多重线性回归分析(强制引入法,Enter)构建了呼吸熵影响因素的回归模型。
根据表2可知模型多重判定系数r=0.985,R2=0.970;修正的判定系数Ra2=0.946,估计标准误差=1.45491;显著性检验的F统计值为41.433,对应P值为0.000,D.W统计量=2.243,说明残差服从正态分布,模型整体显著,构建合理。
根据表3可得,微生物呼吸,微生物量氮,蔗糖酶活性与呼吸熵呈正相关关系,回归系数B值分别为0.180、0.042和42.724,其中微生物呼吸,微生物量氮达到显著水平(P<0.05);微生物量碳,过氧化氢酶活性,脲酶活性,碱性磷酸酶活性与呼吸熵呈负相关关系,B值分别为-0.009、-45.521、-77.769和-0.584,其中脲酶活性达到显著水平(P<0.05)。由于呼吸熵是微生物呼吸与微生物量碳的比值,微生物呼吸与微生物量碳同呼吸熵分别具有正负相关关系,而属于转化酶类的蔗糖酶活性与呼吸熵呈正相关,氧化还原酶类的过氧化氢酶活性,脲酶活性,碱性磷酸酶活性与呼吸熵呈负相关,具体作用机理有待之后的实验中继续探究。
注:同列不同小写字母表示处理间差异显著(P<0.05),下同。
Note:Different small letters in the same column mean significant difference at 0.05 level among treatments. The same below.
a. 预测变量(常量): 微生物呼吸, 微生物量氮,微生物量碳,蔗糖酶活性,脲酶活性,碱性磷酸酶活性,过氧化氢酶活性 Predictor variable (constant): MR, MBN, MBC, Suc, Ure, Pho, CAT;b. 因变量: 呼吸熵 Dependent variable: Respiration entropy.
3 讨论
生物量是人工栽培草地重要指标,地上生物量直接反映草地生产力,地下生物量与根冠比是草地持续性的体现[21]。本试验中第1次刈割的地上生物量整体高于第2次刈割,且都在W4(30.0 kg·hm-2)时达到最高,其次是播量W3(22.5 kg·hm-2),说明合理的播种密度显著影响着地上生物量,即密度较低时差异不显著,当密度增加时生物量随之增加,过高的播种密度又会使植物生长受到抑制,这与以往学者研究结果[22]相同。通过地上、地下生物量的对比可以得出无芒雀麦在经过第1次刈割前营养物质主要向地上部分积累,而刈割后营养物质转向地下部分积累,促使根冠比整体上升,有利于增强无芒雀麦的越冬能力。
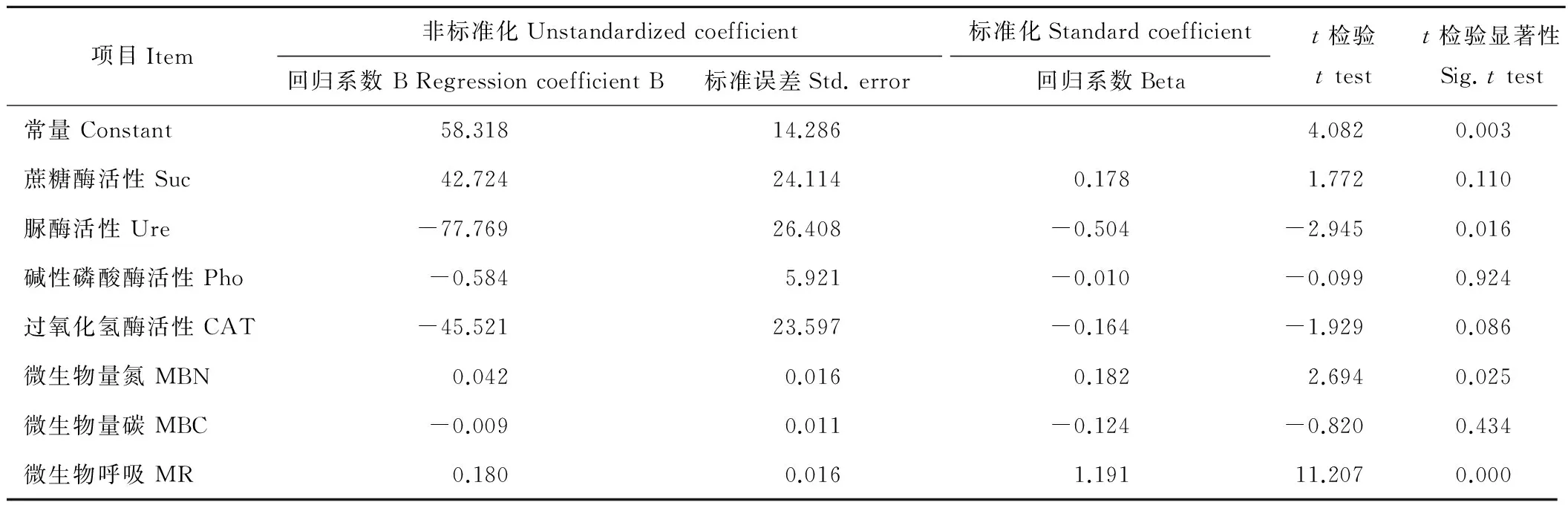
表3 多重线性模型参数估计与系数校正Table 3 Parameter estimation and coefficient correction of multiple linear model
a. 因变量: 呼吸熵 Dependent variable: Respiration entropy.
微生物生物量碳、氮分别是有机氮和有机质中最活跃、最易变化的部分,虽然所占比例很小,却是整个生态系统养分和能源循环的关键和动力[23]。本研究中,不同土层深度的土壤微生物量碳第1次刈割期明显高于第2次刈割期,与地上生物量变化较为一致,可能是经过两次的生长期土壤中的肥力被消耗所致[24],但此时外界环境因子两个时期间差异较大,前人研究[25]中温度、湿度和其他的干扰方式都会对其产生巨大影响,所以影响生物量碳的主要因素有待进一步研究。
微生物生物量氮随着播种密度的增加在土壤浅层0~10 cm中呈上升趋势,与禾本科植物逐渐生长,有利于土壤氮素累积的结果基本一致[26],在土壤深层10~20 cm中呈下降趋势,有文献表明土壤微生物生物量氮随土层深度增加而降低[27],但不同深度之间变化趋势是否相关暂时未有明确记载,土壤浅层微生物生物量氮在生长季内的波动幅度较大[28],给研究带来了困难,需要再进一步的探讨。
土壤酶活性是评价土壤肥力重要指标之一[18],酶活性与土壤呼吸强度和土壤微生物活动相关,在一定程度上反映了土壤微生物学过程的强度。本研究中的土壤酶活性在不同土层中表现出了均一性规律,即第1次刈割期的土壤酶活性高于第2次刈割期,结论与宋日等[29]的作物生育旺盛时期土壤酶活性最强和朱海强等[30]在植物不同的生长期,土壤酶活性具有明显的季节变化特征,芦苇(Phragmitesaustralis)群落土壤过氧化氢酶、磷酸酶和脲酶峰值均出现在生长旺盛期的结论相似,说明土壤酶活性受季节变化产生的环境因子、水热条件影响较大;在有机物质的转化中,土壤酶起着至关重要的作用,是土壤腐殖质腐殖化程度的标志,与土壤腐殖质含量呈正相关[29]的结论也与微生物生物量碳两个时期的差异相一致。
土壤呼吸熵为某一时刻CO2释放速率与MBC的比,反映了单位生物量的微生物在单位时间里的呼吸强度,它可以同时表示微生物量的大小和活性[6]。试验结果表明,微生物呼吸,微生物量氮,蔗糖酶活性与呼吸熵正相关,其中微生物呼吸,微生物量氮显著正相关;微生物量碳,过氧化氢酶活性,脲酶活性,碱性磷酸酶活性与呼吸熵负相关,其中脲酶活性显著负相关,与李晓莎等[31]的微生物活性和微生物量碳的提高能够降低呼吸熵的结论基本一致;呼吸熵能够很好地反映出土壤生态系统的变化,与土壤呼吸相比具有更好的稳定性,受植物生长状况影响较小[32],因此不同的播种密度依靠影响土壤生物特性和酶活性来间接影响呼吸熵,由试验结果可以得出脲酶活性越高,微生物量氮越低的播种密度其土壤受胁迫程度越低,说明土壤环境越成熟[32],综合考量显著影响土壤呼吸熵的微生物呼吸、生物量氮和土壤脲酶活性以及其他各项指标可以得出无芒雀麦30.0 kg·hm-2播种密度各方面表现较为优秀。
4 结论
综合研究结果可知,随着播种密度的增加,不同时期下无芒雀麦地上生物量呈先升高后降低的趋势,W4(30.0 kg·hm-2)达到最大值,W3(22.5 kg·hm-2)其次,地下生物量间差异不显著;微生物量碳主要呈现先降低后升高的趋势;微生物量氮土壤浅层0~10 cm总体变化平稳,土壤深层10~20 cm呈下降趋势;酶活性第1次刈割期显著高于第2次刈割期,但同时期之间差异不显著;通过探求呼吸熵的主要影响因素结合其影响系数,结果表明土壤微生物特性及酶活性对无芒雀麦W4(30.0 kg·hm-2)播种密度具有最佳响应。
References:
[1] Zhao J, Geng Z C, Shang J,etal. Effects of biochar and biochar-based ammonium nitrate feitilizers on soil microbial biomass carbon and nitrogen and enzyme activities. Acta Ecologica Sinica, 2016, 36(8): 2355-2362.
赵军, 耿增超, 尚杰, 等. 生物炭及炭基硝酸铵对土壤微生物量碳、氮及酶活性的影响. 生态学报, 2016, 36(8): 2355-2362.
[2] Zhao X L, Cheng H T, Lü G H,etal. Advances in soil microbial biomass. Journal of Meteorology and Environment, 2006, 22(4): 68-72.
赵先丽, 程海涛, 吕国红, 等. 土壤微生物生物量研究进展. 气象与环境学报, 2006, 22(4): 68-72.
[3] Yu S, Li Z G. Advances in the determination of soil microbial biomass by fumigation extraction. Progress in Soil Science, 1994, (6): 42-50.
俞慎, 李振高. 薰蒸提取法测定土壤微生物量研究进展. 土壤学进展, 1994, (6): 42-50.
[4] Cao H, Yang H, Sun B,etal. Characteristics of microbial biomass and enzyme activities in vegetable garden soil at different planting times. Soil, 2002, 34(4): 197-200.
曹慧, 杨浩, 孙波, 等. 不同种植时间菜园土壤微生物生物量和酶活性变化特征. 土壤, 2002, 34(4): 197-200.
[5] Fierer N, Strickland M S, Liptzin D,etal. Global patterns in belowground communities. Ecology Letters, 2009, 12(11): 1238-1249.
[6] Anderson T H, Domsch K H. Application of cophysiological quotients (qCO2and qD) on microbial biomasses from soils of different cropping histories. Soil Biology & Biochemistry, 1990, 22(2): 251-255.
[7] Zhou Z H, Wang C K. Changes of the relationships between soil and microbes in carbon, nitrogen and phosphorus stoichiometry during ecosystem succession. Chinese Journal of Plant Ecology, 2016, 40(12): 1257-1266.
周正虎, 王传宽. 生态系统演替过程中土壤与微生物碳氮磷化学计量关系的变化. 植物生态学报, 2016, 40(12): 1257-1266.
[8] Zhou Z H, Wang C K. Soil resources and climate jointly drive variations in microbial biomass carbon and nitrogen in China’s forest ecosystems. Biogeosciences Discussions, 2015, 12(14): 11191-11216.
[9] Wang Y, Han B, Shi Z Q,etal. Effects of conservation tillage on soil microbial characters and soil enzyme activities. Soil and Water Conservation, 2006, 20(4): 120-122.
王芸, 韩宾, 史忠强, 等. 保护性耕作对土壤微生物特性及酶活性的影响. 水土保持学报, 2006, 20(4): 120-122.
[10] Xu L J, Tang H J, Yang G X,etal. Variation of net ecosystem carbon flux and its impact factors onSpitabaicalensissteppe in the growing season. Acta Prataculturae Sinica, 2011, 20(6): 287-292.
徐丽君, 唐华俊, 杨桂霞, 等. 贝加尔针茅草原生态系统生长季碳通量及其影响因素分析. 草业学报, 2011, 20(6): 287-292.
[11] Yang D L. Relationship between Productivity and Species Diversity of Plant Community in Hulunber Grassland. Huhhot: Inner Mongolia Agricultural University, 2005.
杨殿林. 呼伦贝尔草原群落植物多样性与生产力关系的研究. 呼和浩特: 内蒙古农业大学, 2005.
[12] Cui X Y, Wang Y F, Du Z C. Primary study on soil respiration of main plant communities in typical grasslands in Inner Mongolia. Acta Agrestia Sinica, 1999, 7(3): 245-250.
崔骁勇, 王艳芬, 杜占池. 内蒙古典型草原主要植物群落土壤呼吸的初步研究. 草地学报, 1999, 7(3): 245-250.
[13] Ogola J B O, Wheeler T R, Harris P M. Effects of nitrogen and irrigation on water use of maize crops. Field Crops Research, 2002, 78(2): 105-117.
[14] Guo M Y, Xu L J, Yang G X,etal. Effects of different cutting intervals on soil respiration in mowing grassland inLeymuschinensismeadow steppe. Grassland and Turf, 2010, 30(6): 10-14.
郭明英, 徐丽君, 杨桂霞, 等. 不同刈割间隔对羊草草甸草原割草地土壤呼吸的影响. 草原与草坪, 2010, 30(6): 10-14.
[15] Yao H Y, Huang C Y. Soil Microbial Ecology and Its Experimental Technique. Beijing: Science Press, 2006: 55-93.
姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术. 北京: 科学出版社, 2006: 55-93.
[16] Chen G, Liu Y Y, Yao H Y,etal. A method for measuring microbial biomass C in waterlogged soil chloroform fumigation extraction—water bath method. Chinese Journal of Soil Science, 2006, 43(6): 981-988.
陈果, 刘岳燕, 姚槐应, 等. 一种测定淹水土壤中微生物生物量碳的方法: 液氯熏蒸浸提—水浴法. 土壤学报, 2006, 43(6): 981-988.
[17] He Z L. Method for determination of microbial biomass of soil slopes: Present situation and prospect. Progress in Soil Science, 1994, 22(4): 36-44.
何振立. 土坡微生物量的测定方法: 现状和展望. 土壤学进展, 1994, 22(4): 36-44.
[18] Guan S Y. Soil Enzymes and Their Research Methods. Beijing: Agricultural Press, 1986.
关松荫. 土壤酶及其研究方法. 北京: 农业出版社, 1986.
[19] Wang Y, Li Z J, Han B,etal. Effects of conservation tillage on soil microbial characters and soil enzyme activities. Acta Ecologica Sinica, 2007, 27(8): 3384-3390.
王芸, 李增嘉, 韩宾, 等. 保护性耕作对土壤微生物量及活性的影响. 生态学报, 2007, 27(8): 3384-3390.
[20] Hu Y L, Wang S L, Huang Y,etal. Effects of litter chemistry on soil biological property and enzymatic activity. Acta Ecologica Sinica, 2005, 25(10): 2662-2668.
胡亚林, 汪思龙, 黄宇, 等. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响. 生态学报, 2005, 25(10): 2662-2668.
[21] Li Y J, Sun C C, Cao G M,etal. Study on plant biomass and soil nutrients under different land use patterns in three-river headwater area. Grassland and Turf, 2016, (4): 48-53.
李亚娟, 孙灿灿, 曹广民, 等. 三江源区不同利用方式草地生物量及土壤养分特征. 草原与草坪, 2016, (4): 48-53.
[22] Cui X X, Tian X M, Wang J,etal. Introduction ofBromusstamineusDesv and it’s performance in cultivation trial. Resources and Environment in Arid Area, 2008, 22(6): 194-199.
崔向新, 田秀民, 汪季, 等. 引进美国无芒雀麦栽培技术的研究. 干旱区资源与环境, 2008, 22(6): 194-199.
[23] Li Y M, Hu J C, Wang S L,etal. Function and application of soil microorganisms in forest ecosystem. Chinese Journal of Applied Ecology, 2004, 15(10): 1943-1946.
李延茂, 胡江春, 汪思龙, 等. 森林生态系统中土壤微生物的作用与应用. 应用生态学报, 2004, 15(10): 1943-1946.
[24] Powlson D S, Brookes P C, Christensen B T. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation. Soil Biology & Biochemistry, 1987, 19(2): 159-164.
[25] Bárcenas-Moreno G, Rousk J, Bååth E. Fungal and bacterial recolonisation of acid and alkaline forest soils following artificial heat treatments. Soil Biology & Biochemistry, 2011, 43(5): 1023-1033.
[26] Min C J, Wan H E, Ming H X,etal. Accumulation and decomposition of litter in the semiarid enclosed grassland. Acta Ecologica Sinica, 2006, 26(4): 1207-1212.
[27] Wang L D, Yao T, Wang F L,etal. Soil microbial soil enzyme activity in a discontinued farmland by the lower Shiyang river. Acta Ecologica Sinica, 2016, 36(15): 4769-4779.
王理德, 姚拓, 王方琳, 等. 石羊河下游退耕地土壤微生物变化及土壤酶活性. 生态学报, 2016, 36(15): 4769-4779.
[28] Wang N, Wang M J, Li S L,etal. Effects of precipitation variation on growing seasonal dynamics of soil microbial biomass in broadleaved Korean pine mixed forest. Chinese Journal of Applied Ecology, 2015, 26(5): 1297-1305.
王宁, 王美菊, 李世兰, 等. 降水变化对红松阔叶林土壤微生物生物量生长季动态的影响. 应用生态学报, 2015, 26(5): 1297-1305.
[29] Song R, Wu C S, Mu J M,etal. Effects of maize stubble remaining in field on dynamics of soil microbial biomass C and soil enzyme activities. Chinese Journal of Applied Ecology, 2002, 13(3): 303-306.
宋日, 吴春胜, 牟金明, 等. 玉米根茬留田对土壤微生物量碳和酶活性动态变化特征的影响. 应用生态学报, 2002, 13(3): 303-306.
[30] Zhu H Q, Li Y H, Li F D. Seasonal variations of soil enzyme activities in typical plant communities in the Ebinur Lake wetland. Chinese Journal of Applied Ecology, 2017, 28(4): 1145-1154.
朱海强, 李艳红, 李发东. 艾比湖湿地典型植物群落土壤酶活性季节变化特征. 应用生态学报, 2017, 28(4): 1145-1154.
[31] Li X S, Wu N, Liu L,etal. Effects of different straw recycling and tillage methods on soil respiration and microbial activity. Chinese Journal of Applied Ecology, 2015, 26(6): 1765-1771.
李晓莎, 武宁, 刘玲, 等. 不同秸秆还田和耕作方式对夏玉米农田土壤呼吸及微生物活性的影响. 应用生态学报, 2015, 26(6): 1765-1771.
[32] Huang Y M, An S S, Xue H. Responses of soil microbial biomass C and N and respiratory quotient (qCO2)to revegetation on the Loess Hilly-Gully region. Acta Ecologica Sinica, 2009, 29(6): 2811-2818.
黄懿梅, 安韶山, 薛虹. 黄土丘陵区草地土壤微生物C、N及呼吸熵对植被恢复的响应. 生态学报, 2009, 29(6): 2811-2818.
