草地早熟禾叶表皮蜡质及其对海拔变化的响应
2018-01-19姚露花倪郁郭娜和玉吉高建花郭彦军
姚露花,倪郁,郭娜,和玉吉,高建花,郭彦军
(西南大学农学与生物科技学院,重庆400716)
草地早熟禾(Poapratensis)是一种多年生草本植物,具有耐践踏、绿期长等优良特性,常作为牧草和草坪绿化植物。它广泛适应各种潮湿环境、温带高山环境,甚至是南极等极端气候环境[1-2]。草地早熟禾由于其快速的繁殖能力在北美地区常被视为牧场的入侵杂草之一,极大程度地破坏草原生境[3]。研究发现,合理利用草地早熟禾对各种非生物胁迫,如干旱胁迫[4],盐胁迫[5]和渍水胁迫[6]的生理生态适应性,调节自身生理机制,使其适当扮演各种角色。然而,关于自然条件下草地早熟禾叶表皮蜡质方面的研究报道却比较少见[7]。
植物的表皮蜡质是植物与外界环境的第一接触面,是由初级醇、醛类、脂肪酸和烷烃等化合物组成的特殊复合物[8]。在一些植物表皮蜡质中还发现了次级醇、酮类、支链醇、支链烷烃、酯类、三萜醇、双酮、烯烃、二醇和酮醇等物质的存在[9]。植物表皮蜡质的化学组分在其不同的发育阶段和器官形成过程中一直处于变化状态。比如,蕨类植物的主要蜡质成分是酯类[10],大麦(Hordeumvulgare)叶片的主要蜡质成分是初级醇[11],拟南芥(Arabidopsisthaliana)的组分主要是烷烃[12]。Pilon等[13]调查了在控制生长条件下,高山早熟禾物种(P.fawcettiae与P.costiniana)、亚高山早熟禾物种(P.alpina与P.pratensis)和温带低地早熟禾物种(P.compressa与P.trivialis)的蜡质组分。结果发现高山和低地的早熟禾属物种的表皮蜡质组分存在本质差异。然而,表皮蜡质对非生物胁迫的响应较敏感[14-15]。例如,拟南芥在遭受缺水和盐胁迫或者进行脱落酸处理时,其表皮蜡质含量显著增加,主要表现为蜡质烷烃含量从29%增加到98%[16]。干旱胁迫下燕麦(Avenasativa)幼苗的初级醇含量较对照有所增加[17]。通过增加紫外线辐射,挪威云杉(Piceaabies)二十九烷二醇烷基酯比例增加,而烷基酯比例却减少[18]。以上结果表明表皮蜡质对胁迫的响应因植物物种的不同存在差异。生长在高山环境的早熟禾物种,其表皮蜡质组分与低地环境物种的表皮蜡质不同。
蜡质组分烷烃主要由一系列碳链链长在C20到C39的超长链烷烃组成。烷烃作为地质年代的生物标志物,稳定存在于生物体内,用于古生物学、古生态学和生化分类学[19]。野外植物具有较多短碳链复合物,而室内植物则具有更多比例的长碳链复合物[7]。Dodd 等[20]发现年降水量是短链碳复合物形成的重要影响因素,而年平均温度则是长碳链复合物形成的重要影响因素。收集车前(Plantagoasiatica)物种的烷烃分布特征进行聚类分析可知其生长环境的年平均气温导致物种差异[21]。然而,在青藏高原东部沿纬度梯度采集的草地植物,其叶表皮蜡质的烷烃分布与年平均气温(温度变化范围-7.7到3.2 ℃)没有显著相关关系[22]。这表明,其他环境因素可能会抵消温度对烷烃链长分布的影响。或者说, 在不同纬度分布的高山草甸,其环境因素的差异可能仍不足以引起植物烷烃的适应性变化。
因此,在本研究中,选择海拔2600 m到4200 m的样地,采集草地早熟禾叶片,分析蜡质组成成分及含量并计算烷烃的链长分布。地面植物是土壤烷烃的一个重要来源[23]。分析土壤烷烃可以代表地面整个植被特定阶段的烷烃特征。本试验针对以下3个问题进行研究:1)高山环境的草地早熟禾叶表皮蜡质的化学组分及含量变化;2)随海拔梯度变化的叶表皮蜡质成分的变化;3)不同海拔梯度下,植物和土壤烷烃的链长分布变化。
1 材料与方法
1.1 试验地概况
试验地位于青藏高原东缘的贵德县,黄河自西向东横贯县境中北部,北接拉鸡山(最高海拔4524 m,N 36°,E 101°),南接阿尼直海山(最高海拔5011 m, N 35°,E 101°)。该地区优势物种是金露梅(Potentillafruticosa)、紫花针茅(Stipapurpurea)、弯囊苔草(Carexdispalata),矮嵩草(Kobresiapygmaea)、扁平云(K.humilis)、垂穗披碱草(Elymusnutans)、蓼属(Polygonum)植物、光颖芨芨草(Achnatherumsibiricum)、羊茅(Festucaovina)、锦鸡儿(Caraganasinica)、矮火绒草(Leontopodiumnanum)和草地早熟禾(Poapratensis)。植物种群调查结果表明,草地早熟禾在海拔2600 m到4200 m均有分布。海拔3400 m以上的植被类型是高寒草甸,海拔3000 m是高山草原,海拔2600 m是半荒漠草原。生长季节为3~4个月。
拉鸡山海拔2600,3000,3400,3800和4200 m的地上部生物量分别是(160±25)、(176±23)、(265±30)、(54±8)和(42±7) g·m-2(每个海拔均设置5个1 m×1 m的样方)。阿尼直海山对应海拔的地上部生物量分别是(158±30)、(204±33)、(367±29)、(120±24)和(79±11) g·m-2。该地区为典型高原大陆性气候,气候寒冷干燥。最近气象站的资料显示该地区年平均气温和年降水量分别为7.2 ℃和254 mm (贵德县, 海拔2200 m)。有60%~70%的降水量集中在植物生长季。
1.2 叶片与土壤样品
2014年7月5—10日,在每个采样高度,设置4个10 m×10 m的大样方,作为4个重复,样方间距至少1000 m。每个采样地采集20到30片完全展开、健康的草地早熟禾叶片。所采集叶片为第2、第3位叶(自植株顶端计算)。叶片用自来水轻轻冲洗表面粉尘并置于标本夹保存。标本夹的吸水纸每隔1 d更换一次,直到叶片充分干燥。每个采样地,随机选取20个点,采集0~20 cm土层土壤,混合,带回实验室分析。
1.3 土壤蜡质提取
称取土壤样本10 g,在索氏抽提器中加入二氯甲烷和甲醇(V∶V=9∶1)作为提取液,50 ℃提取 24 h[24]。将提取液旋转蒸发至完全干燥,再将干燥物溶于分析纯二氯甲烷∶异丙醇=2∶1的混合溶液中,过柱层析,氮气干燥。之后加入衍生剂BSTFA [N,O(三甲基硅烷)三氟乙酰胺,bis (trimethylsilyl) trifluoroacetamide] 50 μL,70 ℃水浴加热1 h。再次将溶液用氮吹仪吹干,最后把所得物用500 μL正己烷溶解,进行色谱和质谱分析[25]。
1.4 叶表皮蜡质提取
取大约20片干叶片,室温条件下在含25 μg内标(十六烷)的氯仿(50 mL)溶液中浸泡提取1 min。提取液40 ℃下氮气吹干,加入50 μL BSTFA[N,O-Bis(三甲基硅烷基)三氟乙酰胺]衍生剂,70 ℃反应1 h,多余BSTFA利用氮吹仪再次吹干。将所得物用1 mL正己烷溶解进行气相色谱和质谱分析。叶片提蜡后,利用WinFOLIA专业叶片图像分析系统(Regent Instrument Inc, Canada)和数字化扫描仪(EPSON V750, Japan)测定叶表面积。
1.5 气相色谱(GC-FID)与色质谱(GC-MS)分析
蜡质含量分析采用福立9790Ⅱ系列气相色谱仪。气相色谱仪程序:GC毛细管柱长30 m,直径0.32 mm,液膜厚度0.25 μm;氮气作为载气;进样量为2 μL。柱膜和FID检测器的温度分别为300和320 ℃。分流比为3∶1。程序升温方式:初始温度为80 ℃,以每分钟15 ℃的速度升温至260 ℃,并保持10 min,之后以每分钟2 ℃升温至290 ℃,保持1 min,再以每分钟5 ℃的速度升温至320 ℃,并保持10 min。利用气相色谱—质谱联用仪(GCMS-QP2010 Ultra)鉴定蜡质组分,程序升温方式同色谱分析。用内标计算植物单位面积的蜡质含量,单位为μg·cm-2。土壤样品只计算烷烃的碳链长度分布。
1.6 碳优势指数(CPI)和平均碳链长度(ACL)计算
用Mazurek等[26]的方程计算碳优势指数(carbon preference index,CPI):
CPItotal=1/2(∑oddCn(17-31)/∑evenCn(18-32)+∑oddCn(19-33)/∑evenCn(18-32))
式中:C是正构烷烃的相对含量;n是碳原子数;odd表示奇数;even表示偶数。
用Poynter等[27]的方程计算平均碳链长度(average chain length, ACL)[27]:
ACLtotal=(∑Cn×n)/∑Cn
式中:n表示正构烷烃的同一碳原子数,取值范围:20≤n≤34。
CPI<1代表偶数优势,CPI>1代表奇数优势。
1.7 数据分析
由于此类野外试验难以建立一个合适的重复性实验设计,将每个采样地作为一个重复进行了方差分析(SPSS 17.0,USA),比较了蜡质总含量、蜡质各组分含量及烷烃链长分布。蜡质组分相对含量为各组分实际含量占蜡质总量的百分比。各蜡质组分同系物相对含量为各同系物实际含量占总蜡质组分的百分比。显著水平为P<0.05(l.s.d检验)。
2 结果与分析
2.1 蜡质总含量和蜡质组分
早熟禾叶表皮蜡质总量随两座高山海拔的变化而变化(图1)。阿尼直海山草地早熟禾的蜡质总量较高,平均为19.89 μg·cm-2, 而拉鸡山平均含量为11.65μg·cm-2。两座高山草地早熟禾的蜡质总含量均在海拔4200 m时最大,拉鸡山为15.67 μg·cm-2,阿尼直海山为30.67 μg·cm-2。随着海拔的降低,拉鸡山的蜡质总量呈先下降后上升的趋势,且含量最低在海拔3400 m时;而阿尼直海山的蜡质总含量则一直呈现下降趋势。

图1 不同海拔对草地早熟禾叶片蜡质总含量的影响Fig.1 Effects of altitudes on wax amounts on leaves of P. pratensis 不同小写字母表示差异显著(P<0.05) Different lowercase letters represent significant difference at P<0.05 level. 下同 The same below.
草地早熟禾叶片中发现6种蜡质成分,包括脂肪酸、初级醇、烷基酯、烷烃、α-香树脂醇和羽扇豆醇(图2)。初级醇是草地早熟禾蜡质的主要成分,在拉鸡山的总蜡质中占65.89%,阿尼直海山占73.49%。其次是烷烃,拉鸡山为17.39%,阿尼直海山为11.37%。第3是烷基酯,分别达到了4.36%和2.68%。脂肪酸、α-香树脂醇和羽扇豆醇比例都低于1.33%。有大约11%的化合物成分不能确定。除阿尼直海山海拔3400 m时所占比例最低之外,初级醇的比例随着海拔降低一直减少,而烷基酯和烷烃的比例增加,脂肪酸比例基本不变。

图2 不同海拔草地早熟禾叶片表皮蜡质成分的相对含量Fig.2 Relative abundance of compound classes within the wax mixtures on leaves of P. pratensis as influenced by altitudes
2.2 脂肪酸、初级醇和烷基酯比例变化
脂肪酸以C22、C24和C26脂肪酸同系物的形式存在,其中C24脂肪酸占脂肪酸总量的46.13%~81.87%(图3)。两座高山脂肪酸比例对海拔的响应不同。例如,拉鸡山海拔4200 m的C24脂肪酸比例最高,海拔3000 m时最低。而阿尼直海山海拔4200和3400 m的C24脂肪酸比例高于海拔3800和2600 m。初级醇以C22~C30的醇同系物形式存在,其中C26醇为优势成分,其比例在拉鸡山为42.22%~84.89%,阿尼直海山为74.88%~86.40%(图4)。总之,随着海拔的降低,C26醇的比例减少而C28醇的比例却增加。烷基酯类以同系物C38、C40和C42形式存在,C40酯类同系物比例占总烷基酯比例的40.02%~84.66%(图5)。在阿尼直海山,随着海拔的降低,C38和C42烷基酯同系物比例呈减少的趋势而C40呈增加趋势。拉鸡山,C38酯类同系物在海拔4200 m比例最高,海拔3400 m最低。C40烷基酯同系物在海拔4200和3800 m的比例均低于其他海拔,而海拔3800 m时C42烷基酯同系物的比例高于其他海拔。

图3 不同海拔草地早熟禾叶片脂肪酸同系物相对含量Fig.3 Quantification of homologs within the fatty acids on leaves of P. pratensis at different altitudes
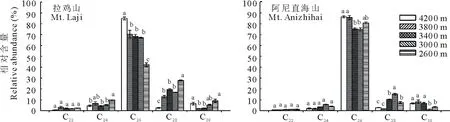
图4 不同海拔草地早熟禾叶片初级醇的相对含量Fig.4 Quantification of homologs within the primary alcohols on leaves of P. pratensis at different altitudes

图5 不同海拔草地早熟禾叶片烷基酯类的相对含量Fig.5 Quantification of homologs within the alkyl esters on leaves of P. pratensis at different altitudes
2.3 植物和土壤中的烷烃类化合物成分
植物的烷烃碳链长度变化范围是C24~C35,土壤的烷烃碳链长度是C25~C35,并且都具有显著的奇偶数优势(图6、7)。在植物和土壤中烷烃C29的比例均占据优势地位,拉鸡山和阿尼直海山的早熟禾中的比例分别是37.31%和42.71%,土壤中的比例分别为26.49%和27.63%。不管是植物还是土壤,海拔不同,烷烃的比例也随之变化。就植物而言,海拔4200 m时的烷烃C27比例高于其他海拔,海拔4200和2600 m时的烷烃C29比例高于海拔3400 m;海拔4200和3800 m的烷烃C31比例低于其他海拔,海拔3400 m的C35比例低于海拔4200, 3400, 3800和3000 m。就土壤而言,海拔4200和3400 m处的C27比例低于其他海拔,海拔4200和3800 m处的C29比例高于3000和2600 m;海拔4200 m的C35比例低于3400, 3000和2600 m。

图6 不同海拔早熟禾叶表皮蜡质烷烃的相对含量Fig.6 Quantification of homologs within the alkanes on leaves of P. pratensis at different altitudes

图7 不同海拔土壤烷烃的相对含量Fig.7 Quantification of homologs within the alkanes in soils at different altitudes

图8 不同海拔草地早熟禾与土壤的碳优势指数及平均碳链长度Fig.8 Carbon preference index and average chain length of alkanes in P. pratensis and soils at different altitudes
本试验通过计算烷烃的碳优势指数(CPI)和平均碳链长度(ACL),分析其在土壤和植物中的链长分布特征。植物的CPI都大于5,且总体显著高于土壤中的CPI值(除拉鸡山海拔4200 m的土壤CPI)(图8)。随着海拔的降低,拉鸡山从海拔2600 m开始,CPI指数先增加后降低(海拔4200 m的CPI指数高于3800 m),而阿尼直海山从海拔3000 m开始先增加后降低。土壤的CPI值随海拔的变化没有显著差异。另外,ACL值在植物和土壤的变化范围同样差异不显著,其中植物的ACL变化范围是29.22~30.69,土壤ACL值范围是28.69~30.65。阿尼直海山植物与土壤的ACL值随海拔的降低呈增加的趋势。拉鸡山植物在海拔4200 m的ACL值显著低于其他海拔,而土壤的ACL值没有显著差异。
3 讨论
青藏高原地区分布的草地早熟禾,其叶表皮蜡质中鉴定出6类蜡质组分,包括脂肪酸、初级醇、烷基酯、烷烃、α-香树脂醇和羽扇豆醇。这些组分与低地草地早熟禾中报道的一致[13]。不同之处在于,本研究结果中初级醇占优势,占蜡质总量的65%左右;而Pilon等[13]的研究表明,低地草地早熟禾蜡质的主要组分是烷烃。究其原因发现植物的生长阶段不同。Pilon等[13]仅分析了生长36 d的幼苗叶片,而本研究采集了完全成熟的植物叶片,蜡质成分相对稳定。Jetter 等[28]研究发现,生长18 d的桂樱(Prunuslaurocerasus),其叶片蜡质中占优势的成分是醇类,之后烷烃积累逐渐增加,成为优势组分。此外,如果低地草地早熟禾的主要成分是烷烃,生长环境变为高山,烷烃由于生境的不同可能改变为初级醇。这种情况下,高山环境和低地环境的草地早熟禾可能存在不同的蜡质沉积机制。
拉鸡山和阿尼直海山的蜡质总量随海拔变化产生差异。两座高山的蜡质总量均在海拔4200 m时最高,随着海拔的降低,阿尼直海山的蜡质总量一直减少,而拉鸡山的蜡质含量则是先减少后增加。这表明海拔4200 m的高蜡质含量可能是草地早熟禾在严酷高山环境中生存的适应机制之一。研究表明,叶表皮蜡质含量的增加与紫花苜蓿(Medicagosativa)的抗旱性[29],拟南芥[30]以及甘蓝(Brassicaoleracea)[31]的抗寒性有关。蜡质含量随海拔的变化规律,表明高山复杂的环境因素如温度、湿度、土壤水分和紫外线辐射等可能导致高山植物更复杂的蜡沉积机制。比如,气候因子对蜡沉积的影响可能会被其他因子的影响所中和。Guo等[22]也发现,在不同高寒草甸采集的矮嵩草、雪白委陵菜(Potentillanivea)、乳白香青(Anaphalislactea)和矮火绒草(Leontopodiumnanum),其叶表皮蜡质含量沿纬度梯度变化但与年平均气温、平均降水量并无显著关系。
草地早熟禾叶片蜡质组分的比例在不同海拔产生差异。随海拔的降低,初级醇比例总体减少,而烷烃比例增加。海拔变化引起的环境差异改变草地早熟禾表皮蜡的生物合成途径,即高海拔相对增加了醇合成途径产生的化合物。4 ℃低温处理小麦(Triticumaestivum)时,与初级醇生物合成途径相关的3个TaFAR基因的转录水平相应增加[32]。另外,有研究发现海拔降低的同时烷基酯的含量增加,表明低海拔较高气温可能相对增加了与烷基酯生物合成相关的基因WSD1的转录水平[33]。总的来说,醇合成途径产生的初级醇和烷基酯的比例随海拔的降低有下降的趋势。
脂肪酸主要的同系物是C24脂肪酸,而初级醇主要的同系物为C26醇。在高山环境中随海拔的降低,初级醇C26含量减少而C28含量增加,说明草地早熟禾含有不同的CER4同源基因,使合成的初级醇的链长发生改变[34]。同时,在草地早熟禾中发现了链长大于C30的蜡质组分,这意味着草地早熟禾可能含有CER2-LIKEs基因,用于合成链长大于C28的脂肪酸[35]。烷烃同系物的比例在不同海拔也存在差异的现象表明参与烷烃合成的CER1同源基因在应对不同环境条件时发生的反应可能不同[36]。
植物和土壤的蜡质烷烃链长均有明显的奇数优势。植物与土壤烷烃相比有更高的CPI值,这主要归因于植物含有较高的C29和C31烷烃。烷烃在植物和土壤之间的分布差异表明,土壤烷烃源自植物,但不是源于当前生长的植物物种。Schellekens等[37]也发现,即使在水藓占优势地位的泥炭中,烷烃分布也不是由泥炭藓决定的,而是与岩高兰(Empetrumrubrum)和南极洲假山毛榉(Nothofagusantarctica)的落叶有关。尽管没有分析这一地区的植被演化,但气候变化引起的植被变更可能影响了土壤烷烃的分布[38]。高山生态系统不同海拔的气候条件 (如温度、降水、UVB辐射等)与植物物种的分布、物候期、植被类型和土壤化学性质有关。除沿海拔梯度的植被差异外,土壤微生物的不同也可能导致CPI值发生变化[39-41]。通过利用微生物增加长链烷烃含量或利用潮湿气候增强生物降解的方式均可导致土壤CPI值的下降[42]。由海拔变化所引起的地下生物量的变化[43],影响了土壤蜡质的植物来源[44],从而引起CPI值的变化。
CPI值越高,奇数烷烃的比例越大。植物CPI值随海拔降低呈先减少后增加的趋势,说明随着环境的变化奇数和偶数烷烃同系物的生物合成也在发生变化[19],即参与奇数烷烃生物合成的同源基因可能不同于偶数烷烃。CPI值与海拔之间不存在一般线性关系,原因可能是海拔变化引起了较为复杂的环境变化。CPI、ACL值在植物和土壤之间无明显的差异。虽然叶表皮蜡质烷烃的ACL已被证实与年平均温度[20,45]或纬度[46]有关,但是植物ACL与海拔之间并无显著相关关系。Guo等[22]也发现,在青藏高原沿纬度梯度采集的4种植物的烷烃ACL与年平均气温之间无显著关系。这意味着利用高山植物烷烃的ACL变化预测高寒地区的气候变化是不可行的。
References:
[1] Pertierra L R, Lara F, Benayas J,etal.PoapratensisL., current status of the longest-established non-native vascular plant in the Antarctic. Polar Biology, 2013, 36(10): 1473-1481.
[2] Reader R J, Wilson S D, Belcher J W,etal. Plant competition in relation to neighbor biomass-an intercontinental study withPoapratensis. Ecology, 1994, 75(6): 1753-1760.
[3] Dennhardt L A, DeKeyser E S, Tennefos S A,etal. There is no evidence of geographical patterning among invasive Kentucky bluegrass (Poapratensis) populations in the northern great plains. Weed Science, 2016, 64(3): 409-420.
[4] Da Costa M, Wang Z, Huang B. Physiological adaptation of Kentucky bluegrass to localized soil drying. Crop Science, 2004, 44(4): 1307.
[5] Hu L, Zhang P, Jiang Y,etal. Metabolomic analysis revealed differential adaptation to salinity and alkalinity stress in Kentucky bluegrass (Poapratensis). Plant Molecular Biology Reporter, 2015, 33(1): 56-68.
[6] Puyang X, An M, Xu L,etal. Antioxidant responses to waterlogging stress and subsequent recovery in two Kentucky bluegrass (PoapratensisL.) cultivars. Acta Physiologiae Plantarum, 2015, 37(10): 1-12.
[7] Shepherd T, Griffiths D W. The effects of stress on plant cuticular waxes. New Phytologist, 2006, 171(3): 469-499.
[8] Yeats T H, Rose J K C. The formation and function of plant cuticles. Plant Physiology, 2013, 163(1): 5-20.
[9] Jetter R, Kunst L, Samuels A L. Composition of plant cuticular waxes//Riederer M, Muller C. Biology of the Plant Cuticle. Oxford UK: Blackwell Publishing Ltd, 2006: 145-181.
[10] Jetter R, Riederer M. Composition of cuticular waxes onOsmundaregalisFronds. Journal of Chemical Ecology, 2000, 26(2): 399-412.
[11] Richardson A, Franke R, Kerstiens G,etal. Cuticular wax deposition in growing barley (Hordeumvulgare) leaves commences in relation to the point of emergence of epidermal cells from the sheaths of older leaves. Planta, 2005, 222(3): 472-483.
[12] Bernard A, Joubès J.Arabidopsiscuticular waxes: Advances in synthesis, export and regulation. Progress in Lipid Research, 2013, 52(1): 110-129.
[13] Pilon J J, Lambers H, Baa W,etal. Leaf waxes of slow-growing alpine and fast-growing lowlandPoaspecies: inherent differences and responses to UV-B radiation. Phytochemistry, 1999, 50(4): 571-580.
[14] Gao J H, He Y J, Guo N,etal. Seasonal variations of leaf cuticular wax in herbs widely distributed in Chongqing. Acta Prataculturae Sinica, 2016, 25(1): 134-143.
高建花, 和玉吉, 郭娜, 等. 重庆地区野生草本植物叶表皮蜡质的季节性变化. 草业学报, 2016, 25(1): 134-143.
[15] Mackova J, Vaskova M, Macek P,etal. Plant response to drought stress simulated by ABA application: Changes in chemical composition of cuticular waxes. Environmental and Experimental Botany, 2013, 86: 70-75.
[16] Kosma D K, Bourdenx B, Bernard A,etal. The impact of water deficiency on leaf cuticle lipids ofArabidopsis. Plant Physiology, 2009, 151(4): 1918-1929.
[17] Bengston C, Larsson C S, Liljenberg C. Effect of water stress on cuticular transpiration rate and amount and composition of epicuticular wax in seedlings of six oat varieties. Physiologia Plantarum, 1978, 44: 319-324.
[18] Gordon D C, Percy K E, Riding R T. Effects of UV-B radiation on epicuticular wax production and chemical composition of fourPiceaspecies. New Phytologist, 1998, 138(3): 441-449.
[19] Bush R T, McInerney F A. Leaf wax n-alkane distributions in and across modern plants: Implications for paleoecology and chemotaxonomy. Geochimica Et Cosmochimica Acta, 2013, 117: 161-179.
[20] Dodd R S, Rafii Z A, Power A B. Ecotypic adaptation inAustrocedruschilensisin cuticular hydrocarbon composition. New Phytologist, 1998, 138(4): 699-708.
[21] Guo Y, He Y, Guo N,etal. Variations of the composition of the leaf cuticular wax among Chinese populations ofPlantagomajor. Chemistry & Biodiversity, 2015, 12(4): 627-636.
[22] Guo Y, Guo N, He Y,etal. Cuticular waxes in alpine meadow plants: climate effect inferred from latitude gradient in Qinghai-Tibetan Plateau. Ecology and Evolution, 2015, 5(18): 3954-3968.
[23] Kuhn T K, Krull E S, Bowater A,etal. The occurrence of short chain n-alkanes with an even over odd predominance in higher plants and soils. Organic Geochemistry, 2010, 41(2): 88-95.
[24] Nierop K G J, Naafs D F W, Van Bergen P F. Origin, occurrence and fate of extractable lipids in Dutch coastal dune soils along a pH gradient. Organic Geochemistry, 2005, 36(4): 555-566.
[25] D’Anjou R M, Bradley R S, Balascio N L,etal. Climate impacts on human settlement and agricultural activities in northern Norway revealed through sediment biogeochemistry. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(50): 20332-20337.
[26] Mazurek M A, Simoneit B R T. Higher molecular weight terpenoids as indicators of organic emissions from terrestrial vegetation//Eganhouse R. Molecular Markers in Environmental Geochemistry. American Chemical Society, 1997.
[27] Poynter J, Eglinton G. Molecular composition of three sediments from Hole 717C: the Bengal Fan//Cochran J R, Stow D A V. Proceedings of the Ocean Drilling Program Scientific Results. Texas: Texas A & M University, 1990: 155-161.
[28] Jetter R, Schäffer S. Chemical composition of thePrunuslaurocerasusleaf surface. Dynamic changes of the epicuticular wax film during leaf development. Plant Physiology, 2001, 126(4): 1725-1737.
[29] Zhang J Y, Broeckling C D, Blancaflor E B,etal. Overexpression of WXP1, a putativeMedicagotruncatulaAP2 domain-containing transcription factor gene, increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa (Medicagosativa). Plant Journal, 2005, 42(5): 689-707.
[30] Ni Y, Song C, Wang X Q. Investigation on response mechanism of epicuticular wax onArabidopsisthalianaunder cold stress. Scientia Agricultura Sinica, 2014, 47(2): 252-261.
倪郁, 宋超, 王小清. 低温胁迫下拟南芥表皮蜡质的响应机制. 中国农业科学, 2014, 47(2): 252-261.
[31] Baker E A. Influence of environment on leaf wax development inBrassicaoleraceavar gemmifera. New Phytologist, 1974, 73(5): 955-966.
[32] Wang M, Wang Y, Wu H,etal. Three TaFAR genes function in the biosynthesis of primary alcohols and the response to abiotic stresses inTriticumaestivum. Scientific Reports, 2016, 6: 25008.
[33] Li F, Wu X, Lam P,etal. Identification of the wax ester synthase/acyl-coenzyme A: diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis inArabidopsis. Plant Physiology, 2008, 148(1): 97-107.
[34] Rowland O, Zheng H, Hepworth S R,etal. CER4 encodes an alcohol-forming fatty acyl-coenzyme a reductase involved in cuticular wax production inArabidopsis. Plant Physiology, 2006, 142(3): 866-877.
[35] Haslam T M, Haslam R, Thoraval D,etal. ECERIFERUM2-LIKE proteins have unique biochemical and physiological functions in very-long-chain fatty acid elongation. Plant Physiology, 2015, 167(3): 682-692.
[36] Sakuradani E, Zhao L, Haslam T M,etal. The CER22 gene required for the synthesis of cuticular wax alkanes inArabidopsisthalianais allelic to CER1. Planta, 2013, 237(3): 731-738.
[37] Schellekens J, Buurman P. n-Alkane distributions as palaeoclimatic proxies in ombrotrophic peat: The role of decomposition and dominant vegetation. Geoderma, 2011, 164(3/4): 112-121.
[38] Herzschuh U, Birks H J B, Liu X,etal. What caused the mid-Holocene forest decline on the eastern Tibet-Qinghai Plateau. Global Ecology and Biogeography, 2010, 19(2): 278-286.
[39] Beniston M. Climatic change in mountain regions: A review of possible impacts. Climatic Change, 2003, 59(1/2): 5-31.
[40] Frei E R, Ghazoul J, Matter P,etal. Plant population differentiation and climate change: responses of grassland species along an elevational gradient. Global Change Biology, 2014, 20(2): 441-455.
[41] Wang G X, Wang Y B, Li Y S,etal. Influences of alpine ecosystem responses to climatic change on soil properties on the Qinghai-Tibet Plateau, China. Catena, 2007, 70(3): 506-514.
[42] Luo P, Peng P A, Lu H Y,etal. Latitudinal variations of CPI values of long-chain n-alkanes in surface soils: Evidence for CPI as a proxy of aridity. Science China-Earth Sciences, 2012, 55(7): 1134-1146.
[43] Wang C, Cao G, Wang Q,etal. Changes in plant biomass and species composition of alpineKobresiameadows along altitudinal gradient on the Qinghai-Tibetan Plateau. Science in China Series C-Life Sciences, 2008, 51(1): 86-94.
[44] Wiesenberg G L B, Schneckenberger K, Schwark L,etal. Use of molecular ratios to identify changes in fatty acid composition ofMiscanthus×giganteusplant tissue, rhizosphere and root-free soil during a laboratory experiment. Organic Geochemistry, 2012, 46: 1.
[45] Tipple B J, Pagani M. Environmental control on eastern broadleaf forest species’ leaf wax distributions and D/H ratios. Geochimica Et Cosmochimica Acta, 2013, 111: 64-77.
[46] Sachse D, Radke J, Gleixner G. δD values of individual n-alkanes from terrestrial plants along a climatic gradient-Implications for the sedimentary biomarker record. Organic Geochemistry, 2006, 37(4): 469-483.
