促凝剂及小分子表面活性剂对大豆分离蛋白乳状液凝胶性质的影响
2018-01-18王革新何志勇曾茂茂
王革新 , 徐 捷 , 何志勇 , 曾茂茂 , 秦 昉 , 陈 洁 *,
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
大豆分离蛋白 (Soybean Protein Isolate,SPI)由于其具有良好的乳化性、填充性以及凝胶性等性质,在食品中应用广泛。SPI在肉制品中一般以乳状液性质添加,其凝胶能力和持水性能对肉制品品质影响巨大[1]。在豆制品等其他制品中,SPI凝胶性也是最受重视的性质之一[2]。
SPI的凝胶影响因素已经有相当充分的研究,SPI可以通过热诱导、加促凝剂、酶法凝胶和利用交联剂凝胶等[3],影响因素包括蛋白质组成、温度、pH、离子强度等[4-6]。然而关于SPI乳状液的凝胶,相对研究较少。Chuan-He Tang等[7]研究显示,在乳化后对SPI乳状液进行预热处理,导致葡萄糖酸内脂(GDL)和CaCl2诱导的凝胶强度增加,TGase诱导的凝胶强度减弱。而Xingyun Peng等[8]研究发现,对乳状液进行预热处理会导致凝胶强度减弱。Fu Liu等[5]研究发现,乳状液稳定性好的凝胶强度也要高于稳定性差的。上述研究显示,促凝剂、SPI乳状液的稳定性、乳状液中小分子表明活性剂的种类和用量、大豆蛋白质本身的蛋白质结构与性质等都对SPI乳状液凝胶性质有影响,但影响SPI乳状液凝胶的因素和机制尚未透彻。
作者以SPI乳状液的凝胶性为主要研究对象,通过测定凝胶强度、持水性、弹性模量(G′)和粘性模量(G")以及乳状液凝胶的微观结构等,来确定促凝剂、乳状液稳定性以及小分子表面活性剂对SPI乳状液凝胶性质的影响,以期为大豆蛋白在豆制品、肉制品以及其他相关体系中的应用提供一定的理论依据和实验基础。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白:南通光合生物技术有限公司;金龙鱼大豆油;蔗糖、硫酸钙、大豆卵磷脂、吐温20、二甲基硅油:均为分析纯,购于国药集团化学试剂有限公司(中国,上海);葡萄糖酸-δ-内酯(GDL):Sigma公司。
TA-XT plus质构仪:美国Beckman公司;MARAⅢ流变仪:Haaker公司;NS1001 L2K高压均质机:意大利尼鲁索尔维公司;KMO-2basic磁力搅拌器:广州仪科实验室技术有限公司;S3500激光粒度分析仪:美国Microtrac公司;3K15离心机:Sigma公司;601循环水浴锅:金坛市新航仪器厂;AL系列分析天平:梅特勒-托利多仪器有限公司;JB5374-91电子天平:梅特勒-托利多仪器有限公司;pH计:梅特勒-托利多仪器有限公司。
1.2 方法
1.2.1 SPI乳状液制备 将SPI溶于水,制成8 g/dL的溶液,pH 7.0,加入4 g/dL的蔗糖,使用循环水浴锅将大豆蛋白溶液加热至90℃,保温10 min后加入体积分数4%的大豆油,经过乳化、均质(二步均质 40~10 MPa),制作成 SPI乳状液。
1.2.2 SPI乳状液凝胶的制备 将样品放入相同规格的容器(4.3 cm×4.3 cm×4.2 cm)中,在 80℃加热30 min,之后将凝胶置于冰水浴,迅速冷却至室温,并在4℃冰箱放置过夜,用于凝胶性质的测定。
1.2.3 不同促凝剂对SPI乳状液凝胶性影响 取40 mL SPI乳状液,加入0.175 g/dL CaSO4与0.25 g/dL GDL或者 0.35 g/dL CaSO4或者 0.5 g/dL GDL,按1.2.2制成凝胶,用于凝胶性质测定。
1.2.4 SPI乳状液稳定性对凝胶性质的影响 取1.2.1 乳化后的溶液分别进行 20、30、40、50 MPa 均质,分别测定0 h和24 h后的乳状液粒径。SPI乳状液的粒径分布使用激光粒度分析仪进行表征,测量其体积平均粒径(d43),每组样品平行测定3次。
取40 mL SPI乳状液,加入0.175 g/dL CaSO4与0.25 g/dL GDL,按1.2.2制成凝胶,用于凝胶性质测定。
1.2.5 大豆卵磷脂、吐温20对SPI乳状液凝胶性质影响 分别取体积分数0.2%、0.4%、0.6%(v/v)的吐温20,加入SPI溶液中,按1.2.1的方法制成SPI乳状液。
分别取 0.2、0.3、0.4、0.5 g/dL 的大豆软磷脂溶于4%、10%的大豆油中,再加入SPI溶液中,按1.2.1的方法制成SPI乳状液。
取40 mL SPI乳状液,加入0.175 g/dL CaSO4与0.25 g/dL GDL,按1.2.2制成凝胶,用于凝胶性质测定。
1.2.6 SPI乳状液凝胶强度测定 凝胶强度的测定参考王婵秋[9]的方法。将制备好的凝胶取出,室温下平衡30 min,其凝胶强度通过质构仪进行测定。测试条件为:探头类型P/0.5,测前和测试速度均为1 mm/s,测后速度10 mm/s,触发力5 g,触发类型为自动,下压距离为10 cm,数据采集速率220 pps。凝胶强度用探头下压过程中的最大感应力(单位g)来表示。每组样品平行测定3次。
1.2.7 SPI乳状液凝胶持水性测定 测定方法依据Xiong等[10],略有改动。将凝胶样品放置到50 mL的离心管中,4℃、10 000 r/min离心10 min。每组样品平行测定3次。持水性(WHC)公式如下:
WHC(%)=(Wt-Wr)/Wt×100%
式中,Wt为离心前凝胶体质量 (g),Wr为离心后凝胶溢出水的质量(g)。
1.2.8 SPI乳状液凝胶的弹性模量(G′)与粘性模量(G")测定 利用流变仪,对大豆分离蛋白乳状液凝胶进行温度扫描。主要参数为:平板夹具直径35 mm,最大应变力为0.01,单频频率为0.1 Hz,间隙1 mm,以5℃/min的速率从25℃升至80℃,80℃保温30 min,再以5℃/min的速率从80℃下降到25℃。测量过程中G′和G"随温度变化而变化。
1.2.9 SPI乳状液凝胶的激光共聚焦测定 测定方法依据Chuan-He Tang等[7],略有改动。取5 mL的SPI乳状液,加入体积分数0.1%的罗兰明B和体积分数0.1%的尼罗红,分别染蛋白质和油相,混合均匀。加入促凝剂后取20 uL于单凹载玻片上,按1.2.2方法制成凝胶,用于测定。
激光共聚焦具体参数:使用40倍镜,扫描模式像素:1 024×1 024,扫描速度:200 Hz,尼罗红的激发波长为488 nm,罗兰明B的激发波长为552 nm。
1.2.10 统计分析 所用数据均为3次重复试验的平均值;采用Statistix软件中LSD方法进行数据显著性差异分析,图中标有相同字母表示数据间存在不显著差异(P>0.05),标有不同字母表示有显著性差异(P<0.05)。
2 结果与分析
2.1 SPI乳状液稳定性对凝胶性质的影响
从表1可以看出,随着均质的压力增加,乳状液粒径逐渐减小。K.R.Kuhn等[11]研究高压均质压力与均质次数对乳清蛋白乳状液稳定性的影响,结果表明,在少于3次均质时,乳状液粒径随着压力的增加而减小,然而在较高压力与多次均质下,乳状液会形成高相对分子质量聚集,使得乳化能力、稳定性下降。本研究结论与其一致,而40 MPa均质的乳状液稳定性最好。
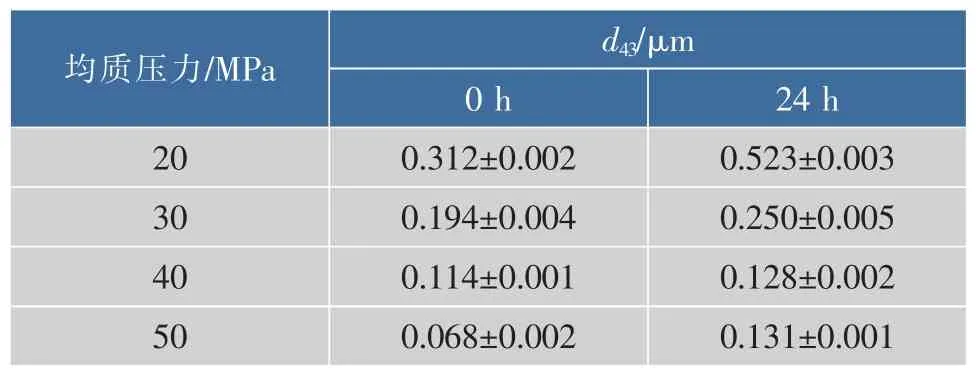
表1 不同高压均质SPI乳状液的平均粒径Table 1 Average particle sizes of SPI emulsionsunder different high-pressure homogenization
从图1-2可知,40 MPa均质的乳状液凝胶强度与持水性要优于其他均质条件的凝胶,这一结果与Fu Liu等[5]的研究结果一致,即乳状液稳定性好的其凝胶强度、持水性都要优于稳定性弱的。
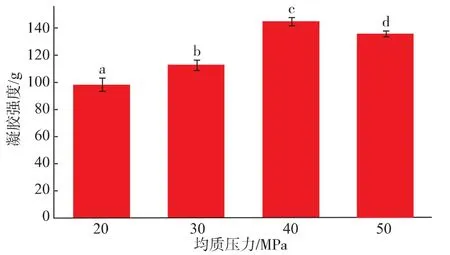
图1 均质压力对SPI乳状液凝胶强度的影响Fig.1 Effect of high-pressure homogenization on gel hardness of SPI emulsion gels
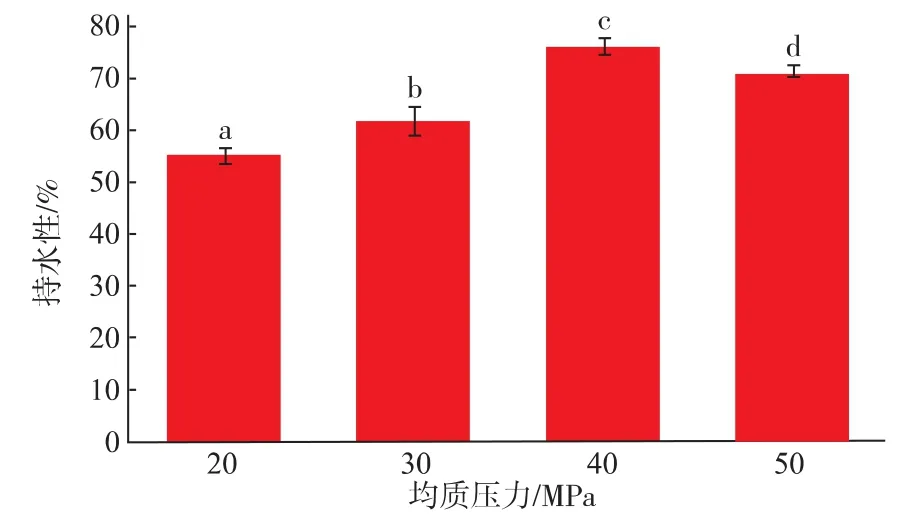
图2 均质压力对SPI乳状液凝胶持水性的影响Fig.2 Effect of high-pressure homogenization on waterholding capacity of SPI emulsion gels
2.2 不同促凝剂对SPI乳状液凝胶性质的影响
由图3-4可知,混合诱导的凝胶强度要明显高于GDL和CaSO4凝胶强度。混合凝胶的持水性要高于CaSO4凝胶,GDL的持水性介于两者之间,并没有显著差别。可能是由于CaSO4诱导凝胶的主导作用力是疏水作用和静电作用,氢键起辅助作用[12],而GDL诱导凝胶促使体系pH降低,在酸化凝胶过程形成共价二硫键,使得三维凝胶网络结构更加稳定[13]。但是也有文章报道过高浓度的GDL会引起过度酸化[14],同时也会对风味产生不好的影响。
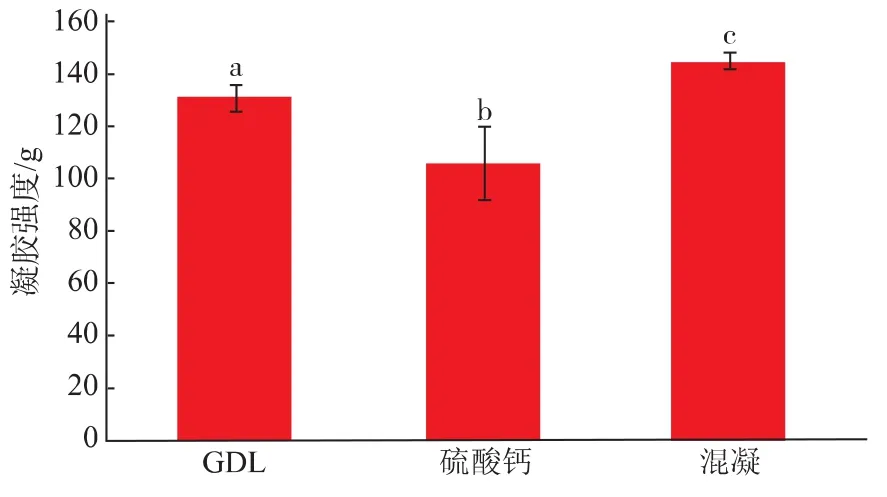
图3 促凝剂对SPI乳状液凝胶强度的影响Fig.3 Effect of different coagulants on gelhardness of SPI emulsion gels

图4 促凝剂对SPI乳状液凝胶持水性的影响Fig.4 Effect of different coagulants on water-holding capacity of SPI emulsion gels
图5为3种不同促凝方式的弹性模量(G′)(G"趋势与G′一致,故未列出)。由图5可知,混合凝胶的G′要略高于GDL的,与CaSO4促凝的有显著的差异。一般定义G′值上升速率大于0.5 Pa/℃或者G′和G"值相交叉时的温度为蛋白质的凝胶形成温度[15]。根据定义GDL、硫酸钙、混合凝胶3种凝胶形成温度分别为56、69、43℃,混合凝胶相对其他两者降低了凝胶温度。
3种不同凝胶方式的激光共聚焦图见图6(绿色为油滴)。可以看出,CaSO4成胶体系的网络结构相对于GDL诱导和混合诱导的凝胶结构而言,有较大的空隙,这也有与凝胶强度、持水性相对较弱符合。
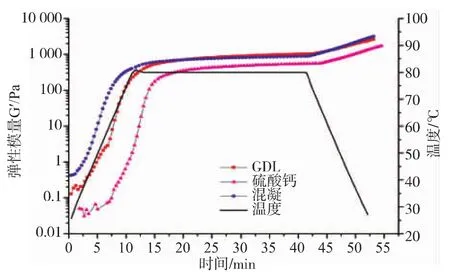
图5 促凝剂对SPI乳状液凝胶弹性模量G′的影响Fig.5 Effect of different coagulants on storage modulus(G′) of SPI emulsion gels
2.3 小分子表面活性剂对SPI乳状液凝胶性质的影响
2.3.1 吐温20对SPI乳状液凝胶性质的影响Ring等人[16]认为乳状液的凝胶取决于凝胶基质和填充粒子的性质,并且将填充粒子分为活性和非活性粒子两大类。Dickinson等人[17]研究发现,活性填充粒子(乳清蛋白乳状液)能增强凝胶的网络结构,而非活性填充粒子(吐温20)会弱化凝胶网络结构。如图7所示,SPI乳状液的凝胶强度随着吐温20浓度的增加而增大,但是与空白组 (不添加吐温20)相比,在添加量小于0.4%时,吐温20的添加使得凝胶强度减弱,这与Dickinson等人研究结果一致,但在添加量大于0.4%后,吐温对SPI乳状液凝胶强度有增强的作用,这与Dickinson等人结果相反,可能原因是Dickinson研究时,吐温20添加量始终保持在R=15(R为表面活性剂与蛋白质的摩尔比)。

图6 不同促凝剂诱导的SPI乳状液凝胶的激光共聚焦图Fig.6 CLSM images of SPI emulsion gels induced by different coagulants
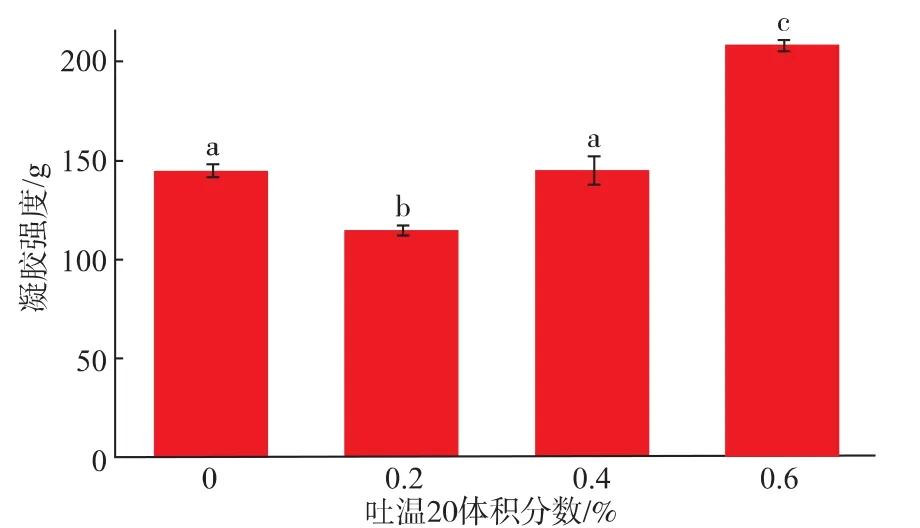
图7 吐温20对SPI乳状液凝胶强度的影响Fig.7 Effect of Tween 20 on gel hardness of SPI emulsion gels
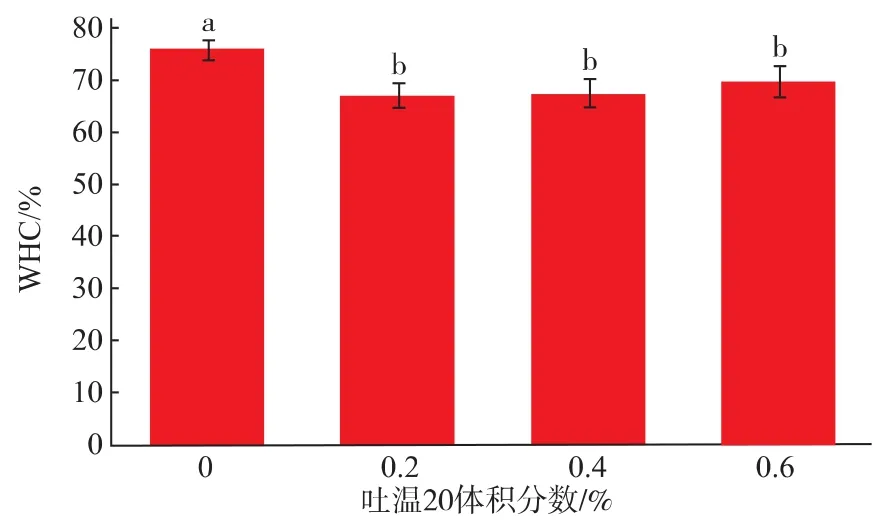
图8 吐温20对SPI乳状液凝胶持水率的影响Fig.8 Effect of Tween 20 on water-holding capacity of SPI emulsion gels
图8为不同吐温20添加量对SPI乳状液凝胶持水性的影响,由图可知,添加吐温20导致持水性下降,且与体积分数无关。Sven Kerstens等[18]研究吐温20对β乳球蛋白热凝胶时,发现吐温20的添加导致凝胶结构变得更粗糙。
2.3.2 大豆卵磷脂对SPI乳状液凝胶性质的影响如图9所示,在不添加大豆软磷脂时,SPI乳状液凝胶强度随着油体积分数的增加而增加。Xin Gu等[19]研究不同种类油对SPI乳状液凝胶的影响,无论是固态油还是液态油,凝胶强度都随着油体积分数的增加而增加。
在大豆油体积分数较低(4%)的情况下,大豆卵磷脂对于SPI乳状液凝胶强度没有明显作用,且与体积分数也无关。但是在大豆油体积分数相对高(10%)的情况下,大豆卵磷脂会降低SPI乳状液的凝胶强度,也与体积分数无关。根据Dickinson等[17]研究表明,可能是因为在油体积分数比较低时,并没有起活性填充作用,但是在油体积分数较高时,大豆油增强凝胶网络结构,而大豆软磷脂的添加会促使部分油与大豆软磷脂结合,减弱填充作用,因此在油体积分数为10%时,添加大豆软磷脂导致凝胶强度降低。
大豆卵磷脂对SPI乳状液凝胶的持水性有增强的作用。但是在低油(4%)时,大豆卵磷脂的添加量高于0.4 g/dL才会有作用,在高油(10%)时,0.2 g/dL的大豆卵磷脂就有增强持水性的作用,见图10。可能是由于大豆卵磷脂使得大豆分离蛋白与大豆油形成的凝胶网络结构更加紧致,增强了对水分的保持作用。
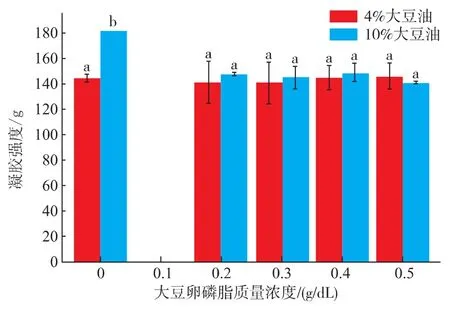
图9 大豆卵磷脂对SPI乳状液凝胶强度的影响Fig.9 Effect of soybean lecithin on gel hardness of SPI emulsion gels
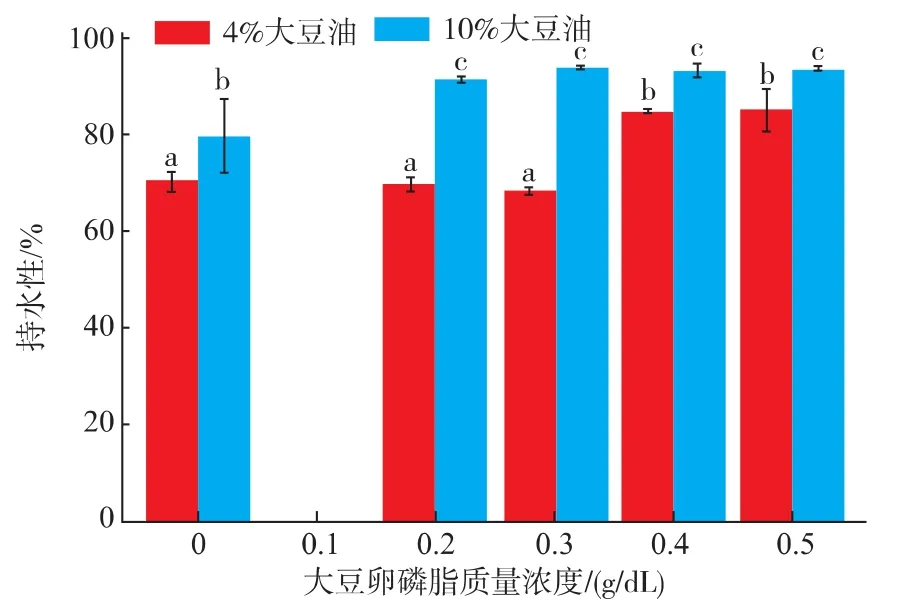
图10 大豆卵磷脂对SPI乳状液凝胶持水性的影响Fig.10 Effect of soybean lecithin on water-holding capacity of SPI emulsion gels

图11 大豆卵磷脂对SPI乳状液凝胶的弹性模量(G′)的影响Fig.11 Effect of soybean lecithin on storage modulus(G′)changes of SPI emulsion gels
图11为不同油-大豆卵磷脂含量对大豆分离蛋白弹性模量(G′)的影响。在不添加大豆软磷脂的时,G′随着油体积分数的增加而增加。在低油(4%)时,大豆卵磷脂的添加能提高G′,但是与添加的质量浓度无关。在高油(10%)时,大豆软磷脂的添加使得G′有所降低,同样与添加质量浓度无关,这与凝胶强度的结果相符。根据凝胶形成温度定义,含有大豆卵磷脂的大豆分离蛋白乳状液成胶温度都在30℃左右,相对于不含大豆卵磷脂而言,降低了成胶温度。
由此可知,大豆分离蛋白凝胶强度与大豆油-大豆卵磷脂比例无关,无论是4%还是10%大豆油,只要体系中含有大豆卵磷脂,其凝胶强度基本无差异。 从激光共聚焦图(图 10)可得到证实,图 b、c、e、f结构相似(4%油与0.2、0.5 g/dL大豆卵磷脂,10%油与0.3、0.4 g/dL大豆卵磷脂与其他图相似,故文中未列出)。K.H.Kim等[20]研究油滴粒径对水包油乳状液凝胶脆性的影响,结果表明凝胶脆性随着油滴粒径的增加而减小。而图a能看到较大的油滴存在,而图d油滴最小,这与凝胶强度结果相符。

图12 不同大豆卵磷脂质量浓度的SPI乳状液凝胶的激光共聚焦图Fig.12 CLSM images of SPI emulsion gel
3 结 语
SPI乳状液稳定性对凝胶强度有促进作用,稳定性好的乳状液其凝胶强度、持水性都要高于稳定性弱的。GDL和CaSO4混合促凝的SPI乳状液的凝胶性质要优于CaSO4促凝的,与GDL促凝没有显著的差别,但是混合凝胶所需的成胶温度为三者最低。在没有添加小分子表面活性剂时,SPI乳状液的凝胶强度、持水性都随着油相比例的增加而增加。吐温20在低添加量(体积分数小于0.4%)时,凝胶强度减弱,在高添加量(体积分数大于0.4%)时,增强其凝胶强度,但是无论添加量多少,都使得持水性下降。大豆卵磷脂在低油体积分数(4%)时,对凝胶强度没有显著影响,在高油体积分数(10%)时,使得凝胶强度降低。但是无论低油还是高油,大豆卵磷脂对于凝胶持水性有促进作用。
[1]WANG Dan,LI Zhuowei,LIU Junmei,et al.Advances in preparation methods of soybean protein gel and its influencing factors[J].Farm Machinery,2013,29:68-73.
[2]LIVNEY Y D,CORREDIG M,DALGLEISH D G.Influence of thermal processing on the properties of dairy colloids[J].Current Opinion in Colloid&Interface Science,2003,8(4):359-364.
[3]YANG M,LIU F,TANG C H.Properties and microstructure of transglutaminase-set soy protein-stabilized emulsion gels[J].Food Research International,2013,52(1):409-418.
[4]LINEVLS,REMONDETTOGE,SUBIRADEM.Coldgelationofβ-lactoglobulinoil-in-wateremulsions[J].Food Hydrocolloids,2005,19(2):269-278.
[5]LIU F,TANG C H.Cold,gel-like whey protein emulsions by microfluidisation emulsification:rheological properties and microstructures[J].Food Chemistry,2011,127(4):1641-1647.
[6]KERSTENS S,MURRAY B S,DICKINSON E.Microstructure of β-lactoglobulin-stabilized emulsions containing non-ionic surfactant and excess free protein:influence of heating[J].Journal of Colloid and Interface Science,2006,296(1):332-341.
[7]TANG C H,LUO L J,LIU F,et al.Transglutaminase-set soy globulin-stabilized emulsion gels:Influence of soy β-conglycinin/glycinin ratio on properties,microstructure and gelling mechanism[J].Food Research International,2013,51(2):804-812.
[8]PENG X,GUOS.Texture characteristics of soymilk gels formed by lactic fermentation:a comparison of soymilk prepared by blanching soybeans under different temperatures[J].Food Hydrocolloids,2015,43:58-65.
[9]WANG Chanqiu,CHI Yujie.Influence of different chemical factors on gelatin property of soybean protein isolate[J].Journal of the Chinese Cereals and Oils Association,2010(7):39-42.(in Chinese)
[10]XIONGYL,BLANCHARDSP,MEANSWJ.Propertiesofbroilermyofibrilgelscontainingemulsified lipids[J].Poultry Science,1992,71(9):1548-1555.
[11]KUHN K R,CUNHA R L.Flaxseed oil-whey protein isolate emulsions:Effect of high pressure homogenization[J].Journal of Food Engineering,2012,111(2):449-457.
[12]孟旭.方便豆腐粉微结构及其蛋白质溶解、凝胶机理的研究[D].无锡:江南大学,2006.
[13]ALTING A C,HAMER R J,DE Kruif C G,et al.Formation of disulfide bonds in acid-induced gels of preheated whey protein isolate[J].Journal of Agricultural and Food Chemistry,2000,48(10):5001-5007.
[14]HORNE D S.Aggregation and gelation-factors influencing acid-induced gelation of skim milk[J].Special Publications of the Royal Society of Chemistry,2001,258:345-351.
[15]RENKEMA J M S,KNABBEN J H M,VAN Vliet T.Gel formation by β-conglycinin and glycinin and their mixtures[J].Food Hydrocolloids,2001,15(4):407-414.
[16]RING S,STAINSBY G.Filler reinforcement of gels[J].Progress in Food and Nutrition Science,1982,6:323-329.
[17]DICKINSON E,CHEN J.Heat-setwheyprotein emulsion gels:Role ofactive and inactive filler particles[J].Journal of Dispersion Science and Technology,1999,20(1-2):197-213.
[18]KERSTENS S,MURRAY B S,DICKINSON E.Confocal microscopy of heat-induced aggregation and gelation of βlactoglobulin in presence of non-ionic surfactant[J].Food Hydrocolloids,2005,19(3):625-633.
[19]GU X,CAMPBELL L J,EUSTON S R.Effects of different oils on the properties of soy protein isolate emulsions and gels[J].Food Research International,2009,42(8):925-932.
[20]KIM K H,GOHTANI S,YAMANO Y.Effect of oil droplets on brittleness of o/w emulsion gel[J].Journal of Dispersion Science and Technology,1997,18(2):199-210.
