姜黄素衍生物L6H4对2型糖尿病大鼠肝组织的保护作用
2018-01-18董细丹陈晓湖缪成锋徐菲菲陈三妹蔡国平
董细丹,陈晓湖,缪成锋,徐菲菲,陈三妹,蔡国平
(1.温州医科大学附属第一医院 病理科,浙江 温州 325015;2.绍兴文理学院医学院 护理系,浙江绍兴 312000)
2型糖尿病肝脏病变是2型糖尿病的一大并发症,临床上以非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)最为常见,后者发病率在2型糖尿病患者中高达50%,在糖尿病伴肥胖患者中几乎可达100%[1]。NAFLD的发病机制尚不明确,目前较多学者支持“二次打击”学说:“第一次打击”主要为脂肪的肝内蓄积,这个过程同胰岛素抵抗密切相关;“第二次打击”为氧化应激反应,氧化应激产生的活性氧将诱导肝实质炎症,而各种炎症介质及细胞因子又将活化肝星状细胞(hepatic stellate cells,HSC),导致肝脏细胞外基质(extracellular matrix,ECM)合成和降解失衡,最终促使肝纤维化发生。研究表明,姜黄素具有抗炎、抗氧化、抗肿瘤等极其广泛的药理活性,能抑制脂质过氧化及转化生长因子(transferming grawth factor β1,TGF-β1)表达,从而抑制HSC活化,具有保护肝脏及抗纤维化的作用[2]。本实验以L6H4治疗糖尿病及高脂大鼠,探讨L6H4对高脂及高糖引起的肝脏损伤的保护作用及机制,为糖尿病肝脏病变的防治提供理论依据。
1 材料和方法
1.1 实验动物及模型建立 雄性SPF级SD大鼠40只(购于温州医科大学实验动物中心,批准文号:wydw2014-0052),体质量180~220 g,适应性喂养1周后,随机均分为正常对照组、高脂组、高脂治疗组、糖尿病组及糖尿病治疗组。正常对照组正常饮食,其余各组高糖高脂喂养,糖尿病组及糖尿病治疗组喂养4周后加单次30 mg/kg腹腔注射链脲佐菌素(STZ,厦门星隆达化学试剂有限公司产品)诱导2型糖尿病模型,检测尾静脉空腹血糖(fasting blood glucose,FBG)水平,以FBG>16.7 mmol/L为造模成功,成模后高脂治疗组和糖尿病治疗组L6H4+1%羧甲基纤维素钠(L6H4由温州医科大学药学院梁广教授惠赠,1%羧甲基纤维素钠购自美国Sigma公司)连续灌胃治疗8周,其余3组以等剂量1%羧甲基纤维素钠灌胃。12周末,处死大鼠[3]。
1.2 血生化指标检测 收集各组大鼠血清,以日立7600全自动生化分析仪检测血总甘油三脂(total triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low-density lipoprotein cholesterol,LDL-c)、高密度脂蛋白(high-density lipoprotein cholesterol,HDL-c)水平以及血谷丙转氨酶(alanine amino transferase,ALT)、谷草转氨酶(aspartate amino transferase AST)、血浆白蛋白(albumin,ALB)等肝功能指标;微量血糖仪测FBG,放射免疫法(试剂盒购自上海瑞齐生物科技有限公司)测空腹胰岛素(free blood insulin,FINs)并计算胰岛素抵抗指数(blood indexes of insulin resistance homeostasis model assessmentestimated insulin resistance,HOMAIR)。
1.3 HE染色标本制备[4]大鼠处死后分离肝脏,0.9%氯化钠溶液清洗称重后,取部分肝组织置于4%中性甲醛溶液中固定,经梯度乙醇脱水,石蜡包埋后,制成厚约3 μm的石蜡切片,行HE染色,中性树脂固封。在光学显微镜下观察各组肝脏组织的形态结构改变。
1.4 油红O染色标本制备 肝脏组织经OTC包埋,冰冻切片机(机箱温度约-20 ℃)制作冰冻切片(厚度约6 μm),置于油红O染液(油红0.05 g+异丙醇1 000 mL加热至95 ℃溶解后过滤)中1 h,水洗,置于Harris苏木素液中进行核复染约10 s,水洗,用甘油明胶(明胶10 g+蒸馏水60 mL+甘油70 mL+石碳酸0.25 g)封固。
1.5 Masson染色标本制备 石蜡切片常规脱蜡,经苏木素染色5 min,1%盐酸乙醇分化2 s,流水冲洗10 min,置于Masson液(变色酸2R 0.25 g+磷钨酸0.5 g+冰醋酸0.5 mL+蒸馏水50 mL)中染色5 min,冲洗数秒,1%亮绿液染色1 min(观察颜色并控制时间),梯度乙醇脱水各1 min,置于石碳酸二甲苯中3 s,二甲苯透明,树胶封片。光镜下对染色结果进行判读,胶原纤维呈蓝绿色,肝细胞呈红色。
1.6 肝组织电镜标本制备 切取小块肝组织(大小约0.1 cm×0.1 cm×0.1 cm),2.5%戊二醛4 ℃固定1 h,锇酸后固定,PBS漂洗,丙酮酸梯度脱水,Epon812包埋机包埋,半薄切片定位,RMC-XL型超薄切片机切片,在H-7500型透射电镜下观察肝细胞的超微结构。
1.7 免疫组织化学染色(EnVision二步法) 常规石蜡切片经烤片、二甲苯脱蜡及梯度乙醇脱水,3%过氧化氢液中阻断、高温高压抗原修复后,滴加一抗[抗TGF-β1抗体(武汉博士德生物工程有限公司产品,稀释浓度1∶150)、抗基质金属蛋白酶抑制剂2(tissue inhibitor metallo protemase 2,TIMP-2)抗体(美国Santa cruz公司产品,稀释浓度1∶50)及抗基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)抗体(美国abcam公司产品,稀释浓度1∶200)],4 ℃孵育过夜,室温下复温5 min,PBS液冲洗5 min后滴加兔二抗,37 ℃烤箱孵育30 min,DAB显色2 min,苏木素复染,中性树胶封固,PBS代替一抗作阴性对照。用Image-Pro Plus 6.0图像处理软件计算5个随机选择的显微镜领域的光密度(OD)。结果判定:胞浆内含有棕黄色颗粒者为阳性表达。
1.8 统计学处理方法 应用SPSS19.0统计分析软件进行统计分析。计量资料数据为正态分布,结果均用 ±s表示。组间差异用单因素方差分析,组间两两比较方差齐用LSD法检验,方差不齐用秩和检验。统计和制图使用Graph Pad Prism 5软件。P<0.05为差异有统计学意义。
2 结果
2.1 血生化检测结果
2.1.1 血糖血脂相关指标:高脂组与糖尿病组大鼠的FBG、FINs、HOMA-IR、TG、TC、LDL-c浓度以及LDL-c/HDL-c值均较正常对照组明显增高(P<0.01),糖尿病组大鼠的HDL-c浓度较正常对照组降低(P<0.01);高脂治疗组与高脂组比、糖尿病治疗组与糖尿病组比,FBG、HOMA-IR、TG、TC、LDL-c浓度以及LDL-c/HDL-c值均显著下降(P<0.01),糖尿病治疗组大鼠与糖尿病组比HDL-c浓度显著升高(P<0.01),FINs浓度显著降低(P<0.01),见表1。
2.1.2 大鼠血清肝功能指标:与正常对照组比较,高脂组、糖尿病组大鼠血清ATL、AST明显升高(P<0.01),ALB水平显著下降(P<0.01);高脂治疗组与高脂组比、糖尿病治疗组与糖尿病组比,ATL、AST水平明显降低(P<0.01),ALB水平明显升高(P<0.05,P<0.01),见表2。
2.2 大鼠肝组织光镜下形态学改变 正常对照组大鼠肝小叶结构清晰,肝细胞呈立方形,排列整齐,油红O染色未见明显脂滴,Masson染色示仅在门静脉及汇管区周围见少量绿色胶原纤维;高脂组肝细胞有明显脂肪变性,细胞核被挤向一侧,伴有炎症细胞浸润,肝索结构紊乱,油红O染色示胞浆内大小不等的橘红色脂滴,Masson染色未见明显胶原增生;糖尿病组肝细胞脂肪变性更加明显,可见气球样变,肝索结构破坏,纤维间隔增宽,油红O染色示胞浆内橘红色脂滴较高脂组更加密集,Masson染色示粗大的绿色胶原行走于汇管区,肝细胞间亦可见胶原纤维相互连接。高脂治疗组、糖尿病治疗组大鼠肝脏病变有所减轻,油红O染色示胞浆内脂滴减少,Masson染色示胶原纤维沉积减轻,纤维间隔变窄。见图1-3。
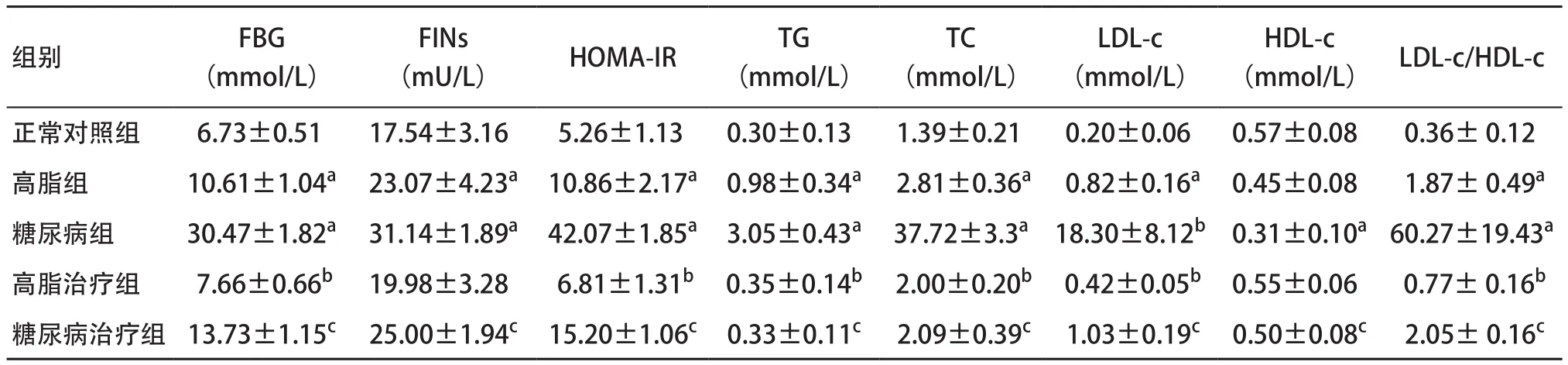
表1 各组大鼠血糖血脂相关指标比较(n=8, ±s)
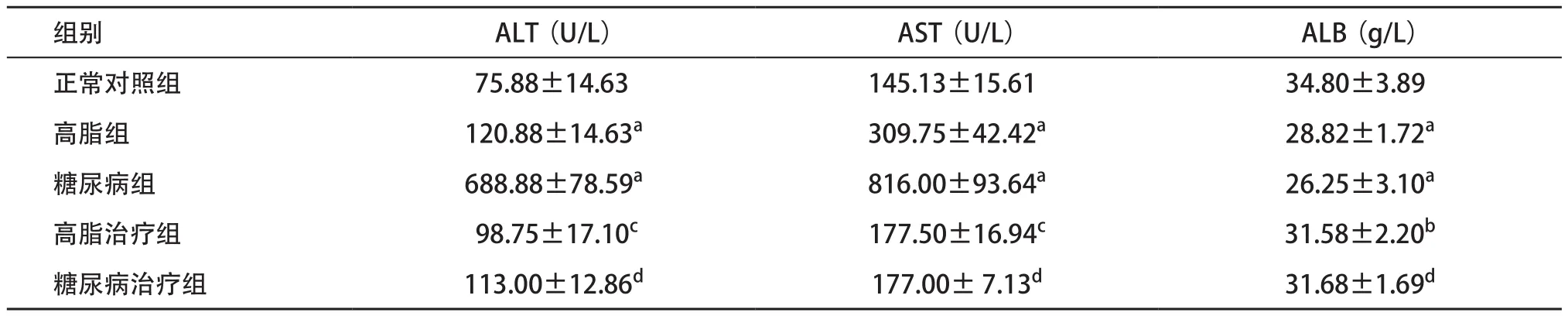
表2 各组ALT、AST及ALB水平比较(n=8, ±s)
2.3 大鼠肝组织透射电镜下形态学改变 正常对照组大鼠肝细胞核为椭圆形,线粒体为椭圆形,嵴丰富,数量较多,内质网呈层状排列;高脂组大鼠肝细胞内含大小不等的脂质颗粒,部分融合形成大的脂滴,粗面内质网增多,线粒体肿胀,内室扩张;糖尿病组大鼠肝细胞脂质颗粒数量较高脂组增多,核固缩,染色质加深,线粒体肿胀,嵴排列紊乱、模糊、中断;L6H4干预后,高脂治疗组大鼠肝细胞内脂质颗粒数量减少,线粒体增多,肿胀明显减轻,板状嵴清晰,糖尿病治疗组核固缩减轻,线粒体增多,见图4。
2.4 免疫组织化学检测结果 正常对照组大鼠肝组织中TGF-β1仅在血管周围少量表达,TIMP-2仅在血管壁和胆管壁少量表达,MMP-2在汇管区少量阳性表达;TGF-β1在高脂组、糖尿病组肝组织的中央静脉周围及增厚的纤维间隔内表达明显增加(P<0.01),TIMP-2在高脂组肝组织中较正常对照组表达稍增加,在糖尿病组中表达明显增加(P<0.01),MMP-2在高脂组及糖尿病组中表达均明显降低(P<0.01);L6H4干预后,高脂治疗组与高脂组比、糖尿病治疗组与糖尿病组比,TGF-β1及TIMP-2表达量明显减少(P<0.01),MMP-2表达量明显增加(P<0.01),见表3。
3 讨论
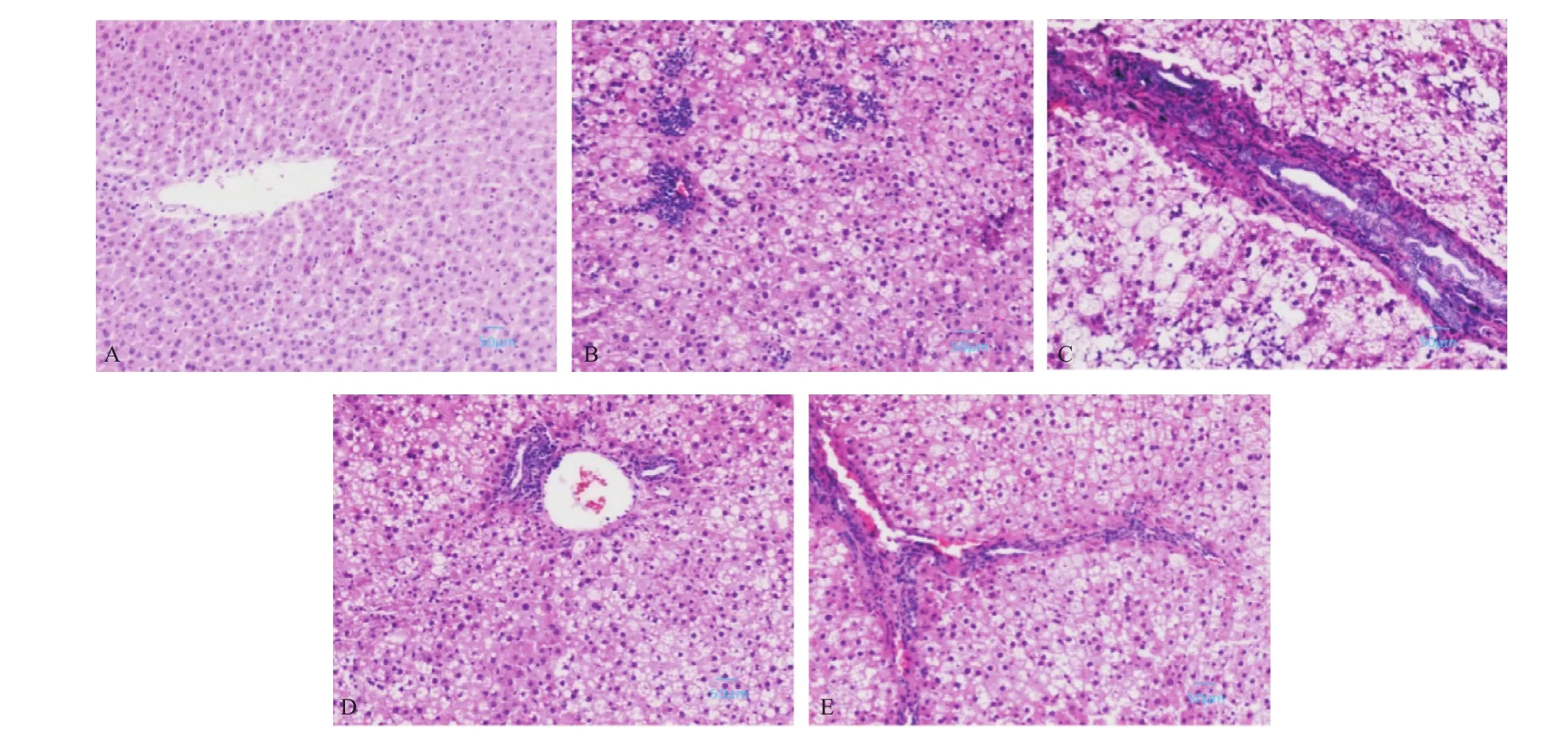
图1 各组大鼠肝组织HE染色观察(×100)
糖尿病性肝疾病是糖尿病的主要并发症之一,有20%~30%的患者存在肝内炎症、纤维组织增生,若无及时的干预,可发展为肝纤维化,最终导致肝功能衰竭[5]。研究发现,高血糖环境是肝脏受损的始动因素,胰岛素抵抗使机体对糖利用障碍,大量脂肪被动员,致使游离脂肪酸在肝细胞线粒体内蓄积,并通过多种途径触发氧化应激反应和脂质过氧化[6],此过程不仅可以诱导炎症介质和细胞因子的释放,直接损害肝细胞,又可以激活HSC,使其基因表达和表型发生改变,合成ECM增多,释放细胞因子、胶原酶及其抑制物等,最终导致肝纤维化的发生[7]。
TGF-β1为目前已知最强的致肝纤维化因子,与肝脏纤维化病理分期正相关[8],由活化的窦内皮细胞及损伤的肝细胞等多种细胞分泌,通过多种信号转导途径激活HSC;而活化的HSC可旁分泌活化及自分泌TGF-β1,持续激活HSC,最终导致肝纤维化的形成[9]。此外,TGF-β1还可以促进基质金属蛋白酶抑制剂(tissue inhibitor metalloprotemases,TIMPs)表达和或抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达,减少ECM的降解,同时可通过跨膜受体,参与并起始TbRI I-ALK5-Smad2/3信号传导通路,直接调节胶原蛋白、ECM基因的转录及表达,致使ECM生成和降解失衡,进一步加重肝纤维化[10-11]。本实验发现,高脂组及糖尿病组大鼠TGF-β1表达增多,L6H4治疗后,高脂治疗组、糖尿病治疗组大鼠肝内TGF-β1表达显著降低,提示L6H4可能通过抑制TGF-β1,抑制HSC活化和分泌ECM,进而减轻肝纤维化。
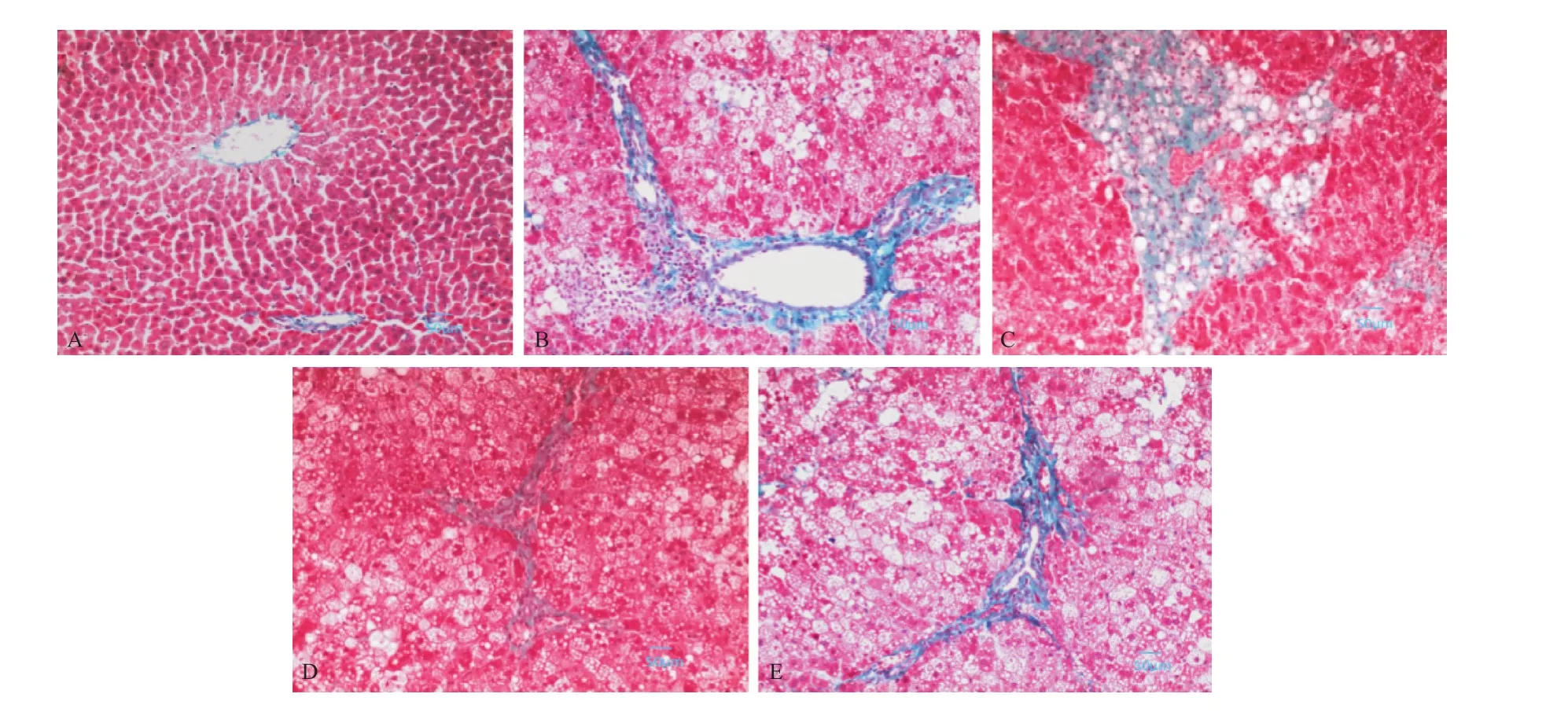
图3 各组大鼠肝脏组织Masson染色观察(×100)
TIMPs/MMPs失衡是导致肝纤维化的一个重要机制[12],而TIMP-2在肝内表达且对MMPs具有较强的抑制活性[13],是抗肝纤维化研究的一个热点。NIE等[14]及HU等[15]分别通过反义核苷酸及合成的特异siRNA靶向抑制TIMP-2基因,发现抑制TIMP-2表达可以显著减少ECM中I型及IV型胶原的沉积。IV型胶原沉积是肝血窦毛细血管化的关键因素,在纤维化早期,以Col IV为主的功能性基底膜破坏,Col IV与LN沉积共同构成连续的基底膜致使肝血窦毛细血管化,影响肝窦血流和肝内外物质交换,加重肝功能损害,是肝纤维化的分子病理学基础[16]。本实验发现,L6H4干预后,高脂治疗组及糖尿病治疗组大鼠肝组织TIMP-2表达显著下降,MMP-2蛋白表达显著上升,Masson染色也显示治疗组大鼠肝组织的胶原纤维沉积较高脂组及糖尿病组明显减少,且TIMP-2的表达变化趋势同TGF-β1一致。CHENG等[17]体外实验研究发现姜黄素可抑制HSC的增殖活化,提高MMP-2、MMP-9等的活性,抑制TGF-β1表达,结合本研究发现提示L6H4可能通过抑制TGF-β1表达,直接或通过抑制HSC的活化,下调TIMP-2,减少对MMP-2等MMPs的抑制作用来抑制高脂及糖尿病大鼠肝的纤维化。
临床和动物实验证明,姜黄素有明显降脂、降血糖的药理作用[18]。本研究发现,高脂治疗组及糖尿病治疗组的血TG、TC、LDL-c水平明显下降,糖尿病治疗组HDL-c明显升高,差异有统计学意义(P<0.01),高脂治疗组HDL-c稍有上升,但差异无统计学意义(P>0.05),可能与姜黄素上调载脂蛋白A1和胆固醇流出调节蛋白,促进HDL的合成,同时上调肝内的清道夫受体B I,增加肝细胞对HDL的选择性摄取[19]相关。脂肪组织是胰岛素抵抗的源头,其慢性炎症产生的一些炎症因子将影响到胰岛素作用通路促使胰岛素抵抗,导致高血糖和高脂血症,而后两者则进一步刺激胰岛,增加胰岛素分泌导致高胰岛素血症,本实验示L6H4可明显下调高脂组及糖尿病组大鼠FBG、HOMA-IR水平,并明显下调糖尿病组FINs水平,这可能同L6H4下调血糖及血脂,减少对胰岛刺激有关。此外本实验发现L6H4可明显改善模型组大鼠的肝功能及肝组织炎症、变性坏死等病理改变,同王玲等[20]以姜黄素衍生物B06治疗联合高糖高脂喂养与STZ诱导的2型糖尿病大鼠研究结果一致。
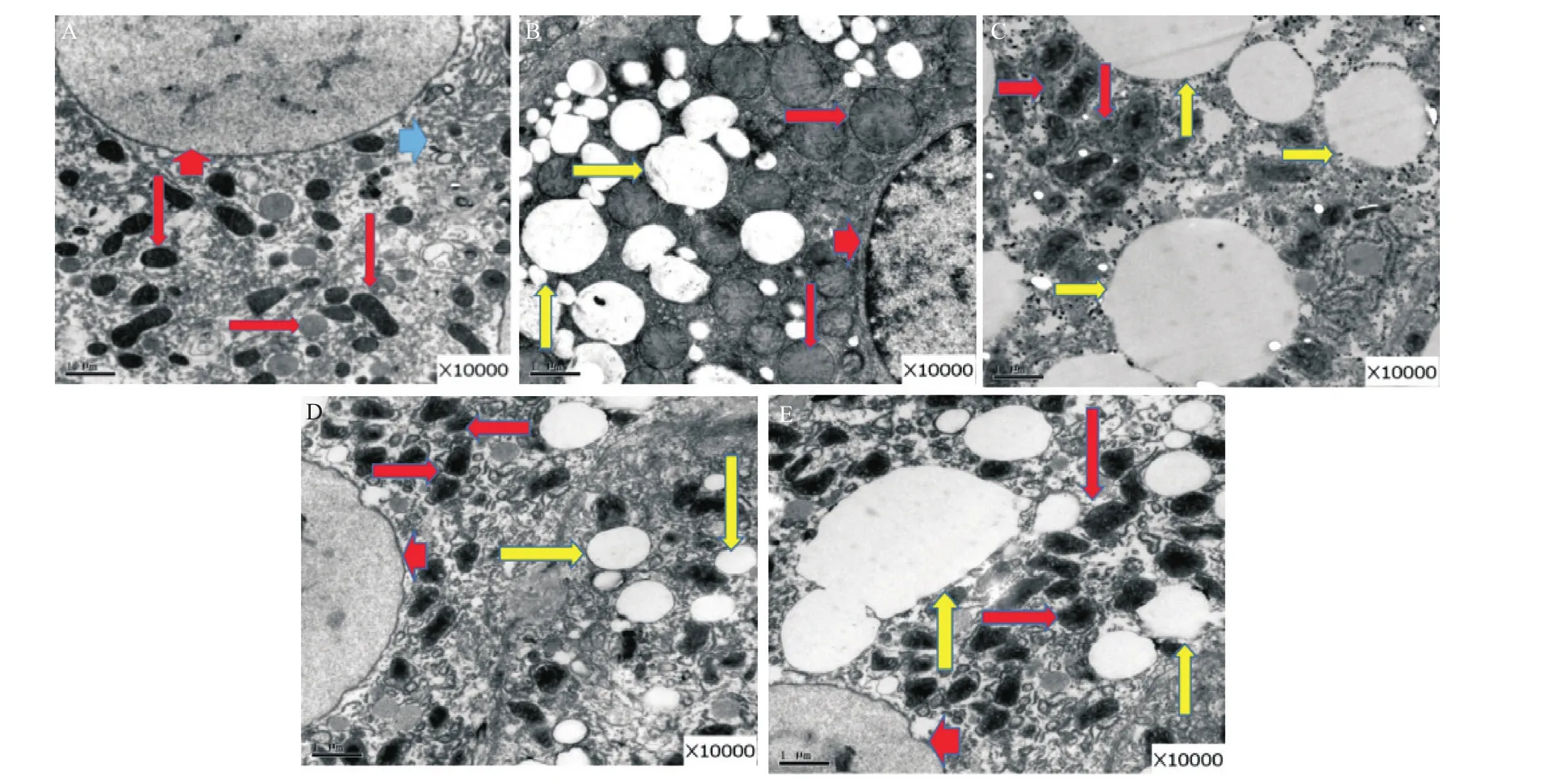
图4 各组大鼠肝细胞透射电镜观察(×10 000)
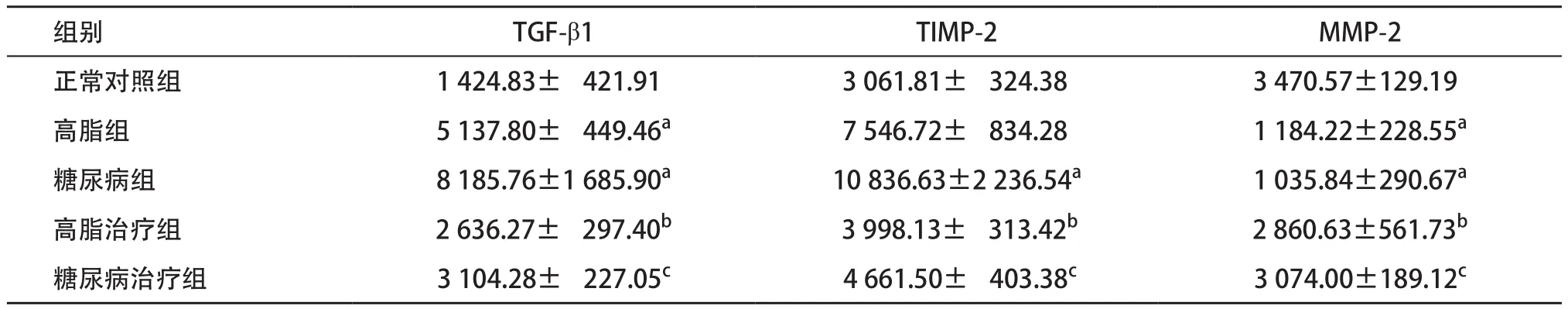
表3 各组大鼠肝组织TGF-β1、TIMP-2和MMP-2的表达比较(n=8, ±s)
综上所述,L6H4能调节2型糖尿病大鼠的胰岛素抵抗及糖脂代谢,对高脂及糖尿病大鼠的肝脏具有保护作用,能明显减轻2型糖尿病大鼠肝脏纤维化,抑制TGF-β1及TIMP-2的表达,上调MMP-2的表达可能是其主要作用机制之一。
[1] BRIL F, CUSI K. Management of nonalcoholic fatty liver disease in patients with type 2 diabetes: A call to action[J].Diabetes Care, 2017, 40(3): 419-430.
[2] TANG Y. Curcumin targets multiple pathways to halt hepatic stellate cell activation: Updated mechanisms in vitro and in vivo[J]. Dig Dis Sci, 2015, 60(6): 1554-1564.
[3] 应丽丽, 倪瑾瑶, 李慧敏, 等. 姜黄素类似物L6H4对2型糖尿病大鼠心肌的保护作用[J]. 中国病理生理杂志, 2016,32(1): 27-32.
[4] 刘曦, 马骏, 胡茂通, 等. 姜黄素类似物L6H4对2型糖尿病大鼠肾脏的保护作用[J]. 中国应用生理学杂志, 2017, 33(1): 11-15.
[5] SUMIDA Y, SEKO Y, YONEDA M. Novel antidiabetic medications for non-alcoholic fatty liver disease with type 2 diabetes mellitus[J]. Hepatol Res, 2017, 47(4): 266-280.
[6] CHITURI S, ABEYGUNASEKERA S, FARRELL G C, et al.Nash and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome[J].Hepatology, 2002, 35(2): 373-379.
[7] CHIANG D J, PRITCHARD M T, NAGY L E. Obesity, diabetes mellitus, and liver fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 300(5): G697-702.
[8] GRESSNER A M, WEISKIRCHEN R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets[J]. J Cell Mol Med, 2006, 10(1): 76-99.
[9] 党双锁, 李亚萍. TGF-β1在肝纤维化研究中的新进展[J].世界华人消化杂志, 2010, 18(16): 1631-1636.
[10] XU F, LIU C, ZHOU D, et al. TGF-beta/SMAD pathway and its regulation in hepatic fibrosis[J]. J Histochem Cytochem, 2016, 64(3): 157-167.
[11] LIU X, HU H, YIN J Q. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis[J]. Liver Int, 2006,26(1): 8-22.
[12] HEMMANN S, GRAF J, RODERFELD M, et al. Expression of MMPs and TIMPs in liver fibrosis: a systematic review with special emphasis on anti-fibrotic strategies[J]. J Hepatol, 2007, 46(5): 955-975.
[13] ARPINO V, BROCK M, GILL S E. The role of TIMPs in regulation of extracellular matrix proteolysis[J]. Matrix Biol, 2015, 44-46: 247-254.
[14] NIE Q H, ZHU C L, ZHANG Y F, et al. Inhibitory effect of antisense oligonucleotide targeting TIMP-2 on immune-induced liver fibrosis[J]. Dig Dis Sci, 2010, 55(5): 1286-1295.
[15] HU Y B, LI D G, LU H M. Modified synthetic siRNA targeting tissue inhibitor of metalloproteinase-2 inhibits hepatic fibrogenesis in rats[J]. J Gene Med, 2007, 9(3): 217-229.
[16] 黄月红, 郭杞兰, 陈治新, 等. 四氯化碳诱导肝纤维化早期大鼠肝窦内皮细胞及基底膜形态改变的动态研究[J]. 中国病理生理杂志, 2014, 30(8): 1501-1505.
[17] CHENG Y, PING J, XU L M. Effects of curcumin on peroxisome proliferator-activated receptor gamma expression and nuclear translocation/redistribution in culture-activated rat hepatic stellate cells[J]. Chin Med J (Engl), 2007, 120(9):794-801.
[18] HUSSAIN Z, THU H E, AMJAD M W, et al. Exploring recent developments to improve antioxidant, anti-inflammatory and antimicrobial efficacy of curcumin: A review of new trends and future perspectives[J]. Mater Sci Eng C Mater Biol Appl, 2017, 77: 1316-1326.
[19] PANASHI Y, AHMADI Y, TEYMOURI M, et al. Curcumin as a potential candidate for treating hyperlipidemia: A review of cellular and metabolic mechanisms[J]. J Cell Physiol, 2018, 233(1): 141-152.
[20] 王玲, 徐梦菲, 刘曦, 等. 姜黄素衍生物b06对2型糖尿病大鼠肝脏的保护作用[J]. 中国病理生理杂志, 2014, 30(2):328-332.
