冬凌草甲素对人脐静脉内皮细胞的抑制作用
2018-01-18田丽莉朱国福盛东来
田丽莉,朱国福,盛东来
(1.浙江医院 中药房,浙江 杭州 310013;2.上海中医药大学 中药学院,上海 201203;3.杭州师范大学 发育与再生研究所,浙江 杭州 310036)
冬凌草[Rabdosia rubescens(Hemsl.)Hara],唇形科香茶菜属植物,主要分布于中国黄河流域和黄河流域以南的区域,具有清热解毒、健胃活血、消炎止痛及抗肿瘤等功效。冬凌草甲素为冬凌草抗肿瘤的主要活性成分[1]。本课题组前期研究证明,冬凌草甲素可明显抑制斑马鱼血管生成[2]。但冬凌草甲素在血管内皮细胞方面的研究较少,本研究选择人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),研究冬凌草甲素对HUVEC增殖、凋亡、迁移、侵袭和成管的影响,为血管内皮细胞相关的研究提供依据。
1 材料和方法
1.1 主要材料 冬凌草甲素(Oridonin,上海源叶生物科技有限公司),经高效液相色谱鉴定,纯度≥98%;HUVEC(中国科学院上海生命科学院细胞库);RPMI1640培养液(美国Invitrogen公司),MTT试剂盒(美国Sigma公司),Annexin V-FITC试剂盒(美国BD Pharmingen公司),Matrigel试剂盒(美国BD Pharmingen公司),Calcein-AM试剂盒(美国Sigma公司),结晶紫染色液(上海碧云天生物科技有限公司),二甲基亚砜(上海展云化工有限公司);Trizol试剂(美国Invitrogen公司);RT试剂盒(大连Takara公司),DRR041A SYBR试剂盒(大连Takara公司),引物由大连TaKaRa公司设计合成,引物序列见表1。
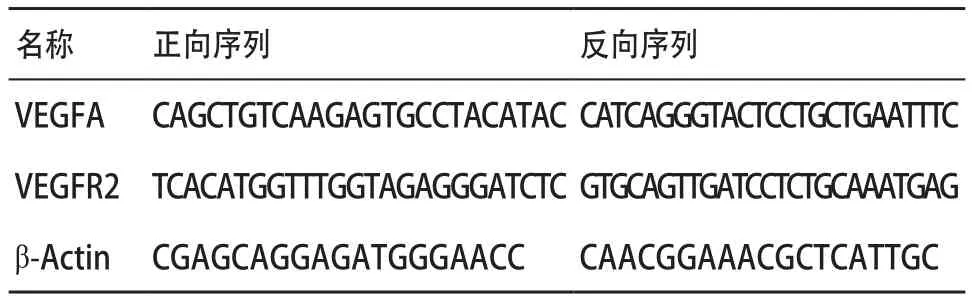
表1 引物序列
1.2 方法
1.2.1 MTT法检测细胞活力:培养HUVEC,培养的具体条件为:RPMI1640(含10%胎牛血清、100 U青霉素和100 U链霉素),于37 ℃、5% CO2培养箱中,培养细胞至对数生长期;细胞消化计数,调整细胞密度为6×104个/mL,96孔板中每孔加入90 μL细胞悬液;次日,每孔加入10 μL低、中、高浓度的冬凌草甲素(浓度分别为156、312、625 mg/L),并于37 ℃、5% CO2培养箱中继续培养;此后在24 h时检测,每孔加入5 g/L的MTT 10 μL,于37 ℃、5%CO2培养箱培养;4 h后,将上清吸出,加入DMSO,于570 nm波长处检测吸光值(OD570)。
1.2.2 流式细胞荧光分选法(FACS)检测细胞凋亡:培养HUVEC,培养的具体条件为:RPMI1640(含10%胎牛血清、100 U青霉素和100 U链霉素),于37 ℃、5% CO2培养箱中,至细胞对数生长期;细胞消化计数,调整细胞密度为2.5×105个/mL,6孔板中每孔铺2 mL细胞悬液;次日,加入低、中、高浓度的冬凌草甲素(浓度分别为39、156、625 mg/L);24 h后,消化细胞;收集悬浮细胞:离心5 min;贴壁细胞:用不含EDTA的胰酶消化收集后,于室温2 000 r/min离心6 min,收集细胞;细胞洗涤:用预冷1×PBS(4 ℃)重悬细胞1次,2 000 r/min离心6 min,洗涤细胞;加入300 μL的1×Binding Buffer悬浮细胞;Annexin V-FITC标记:加入5 μL的Annexin V-FITC混匀后,避光,室温孵育15 min;PI标记:上机前5 min再加入5 μL的PI染色;上机前,补加100 μL的1×Binding Buffer,用流式细胞仪进行检测。
1.2.3 穿透小室法(Transwell)检测细胞迁移和侵袭:细胞迁移实验:HUVEC撤去血清,培养过夜;次日,消化细胞,用PBS洗2次;用含0.1% BSA的无血清培养液重悬,调整细胞密度为4×105个/mL;取细胞悬液200 μL加入24孔板配套小室中,下室加入500 μL含10% FBS的培养液或低、中、高浓度的冬凌草甲素(浓度分别为39、78、156 mg/L),尽量避免气泡产生,于37 ℃培养过夜;用棉签擦去小室底部多聚碳酸脂膜上未穿膜的细胞,0.1%结晶紫染色;显微镜镜下观察并拍照;33%醋酸脱色,将结晶紫洗涤收集,测OD570。细胞侵袭实验:构建Transwell小室,底部均匀包被50 μL matrigel,超净台风干过夜;次日,每孔加入2% BSA 50 μL,37 ℃烘2 h,PBS冲洗2遍;HUVEC消化后PBS洗2次,用含0.1% BSA的无血清培养液重悬,调整细胞密度为4×105个/mL;取细胞悬液200 μL加入24孔板配套小室中,下室加入500 μL含10% FBS的培养液或低、中、高浓度的冬凌草甲素(浓度分别为39、78、156 mg/L),尽量避免有气泡,于37 ℃培养24 h;棉签擦去小室底部多聚碳酸脂膜上未穿膜的细胞,0.1%结晶紫染色,显微镜镜下观察并拍照;33%醋酸脱色,将结晶紫洗涤收集,测OD570。
1.2.4 管腔形成实验法检测血管生成:培养HUVEC,培养的具体条件为:RPMI1640(含10%胎牛血清、100 U青霉素和100 U链霉素),于37 ℃,5% CO2培养箱中,常规培养至对数生长期;铺6孔板,加入低、中、高浓度的冬凌草甲素(浓度分别为25、100、400 mg/L)培养24 h;次日,实验前用预冷的Matrigel包被15孔板,每孔10 μL,于37 ℃培养箱放置1 h;将HUVEC计数后种入Matrigel包被的小孔中,每孔约1万个细胞;于37 ℃培养箱培养6 h以形成网状血管结构;用10 μmol/L Calcein-AM染料避光染色30 min,置荧光显微镜下观察并拍照,利用imagepro plus计数以比较结果。
1.2.5 相对荧光定量PCR检测VEGFA和VEGFR2基因的表达量:样本来源为1.2.1中各实验组中的HUVEC,加1 mL Trizol研磨均匀,转移至1.5 mL EP管中,室温静置5 min;加入0.2 mL氯仿,震摇15 s,室温静置3 min,离心15 min(4 ℃,12 000 r/min);取上层水相0.4 mL,加入等量异丙醇,室温静置10 min,离心10 min(4 ℃,12 000 r/min);弃去上清液,加75%预冷乙醇,涡旋,离心5 min(4 ℃,7 500 r/min);弃去上清液,晾干沉淀,加DEPC水20 μL溶解。采用紫外分光光度计测定并计数得浓度,并用1%琼脂糖凝聚电泳辅助检测。cDNA的合成:取上述合格的RNA样品,根据浓度计算体积配比用量使各取样量均为0.5 μg,按照RT试剂盒和DRR041 SYBR荧光定量试剂盒的说明书具体操作,选用ABI PCR仪,并用相应软件设置反应程序和进行数据分析处理。
1.3 统计学处理方法 采用SPSS16.0软件进行统计分析。数据均以 ±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD法检验。P<0.05为差异具有统计学意义。
2 结果
2.1 冬凌草甲素抑制HUVEC增殖 通过MTT法检测HUVEC的活力,结果显示冬凌草甲具有抑制HUVEC增殖的作用,根据预试验,选择在24 h时检测各实验组的细胞活性,结果显示:与空白对照组比较,冬凌草甲素具有明显的抑制HUVEC增殖的作用,且在低浓度到高浓度的实验组范围内,具有浓度依赖性,冬凌草甲素的浓度越高,其抑制作用越强(P<0.05)。见图1。见图5。

图1 冬凌草甲素抑制HUVEC的增殖作用
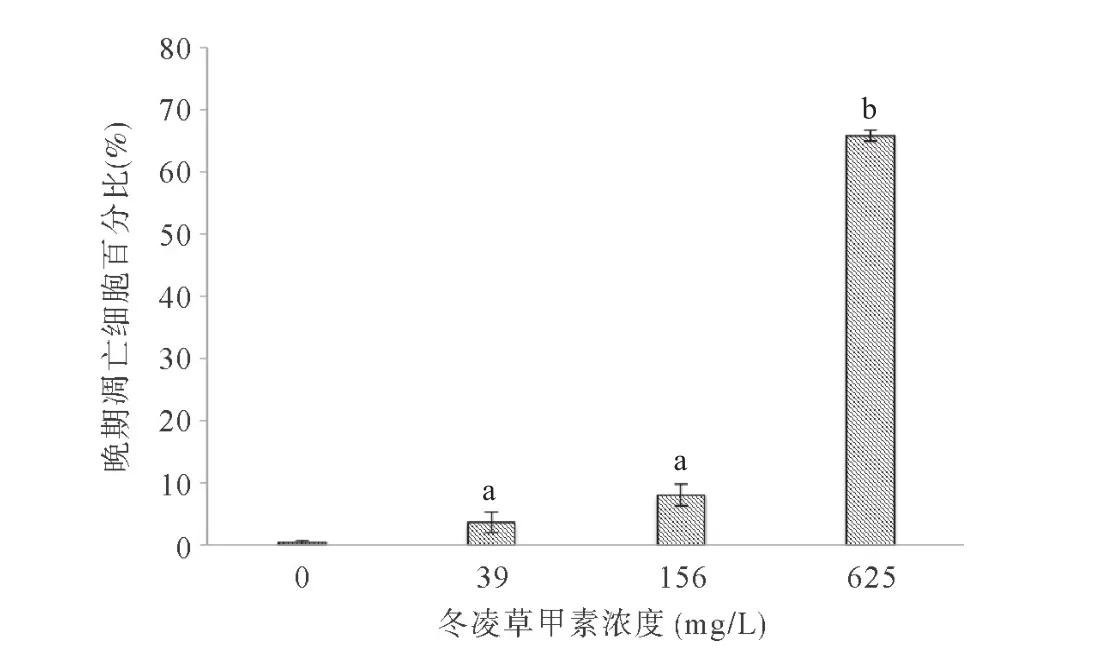
图2 冬凌草甲素诱导HUVEC的晚期凋亡作用

图3 冬凌草甲素诱导HUVEC的早期凋亡作用
2.2 冬凌草甲素诱导HUVEC凋亡 通过FACS法检测HUVEC的凋亡,结果显示:冬凌草甲素具有明显诱导HUVEC凋亡的作用(P<0.01),并且HUVEC的凋亡期主要表现为晚期凋亡细胞和早期凋亡细胞。且在低浓度到高浓度的实验组范围内,具有浓度依赖性,随着冬凌草甲素的浓度升高,其诱导HUVEC凋亡的效果越强。见图2-3。
2.3 冬凌草甲素抑制HUVEC迁移 通过Transwell法检测HUVEC的迁移,结果显示:冬凌草甲素具有明显抑制HUVEC迁移的活性(P<0.05),且在低浓度到高浓度的实验组范围内,具有浓度依赖性,随着冬凌草甲素的浓度升高,抑制效果增强。见图4。
2.4 冬凌草甲素抑制HUVEC侵袭 通过Transwell法检测HUVEC的侵袭,结果显示:冬凌草甲素具有明显的抑制HUVEC侵袭的活性,与空白对照组比较,高浓度组的冬凌草甲素抑制效果显著(P<0.01)。

图4 冬凌草甲素抑制HUVEC的迁移作用
2.5 冬凌草甲素抑制HUVEC成管 通过管腔形成实验法检测HUVEC的血管生成,结果显示:100、400 mg/L的冬凌草甲素具有明显抑制HUVEC的管腔形成作用(P<0.01),且在低浓度到高浓度的实验组范围内,随着冬凌草甲素的浓度升高,其抑制管腔形成的效果越强。见图6。
2.6 冬凌草甲素降低HUVEC中VEGFA和VEGFR2基因的表达量 相对荧光定量PCR结果显示:冬凌草甲素可降低VEGFA和VEGFR2基因的表达量(P<0.05),且在低浓度到高浓度的实验组范围内,随着冬凌草甲素的浓度升高,VEGFA和VEGFR2基因的表达量逐渐降低。见图7。

图5 冬凌草甲素抑制HUVEC的侵袭作用

图6 冬凌草甲素抑制HUVEC管腔形成的作用
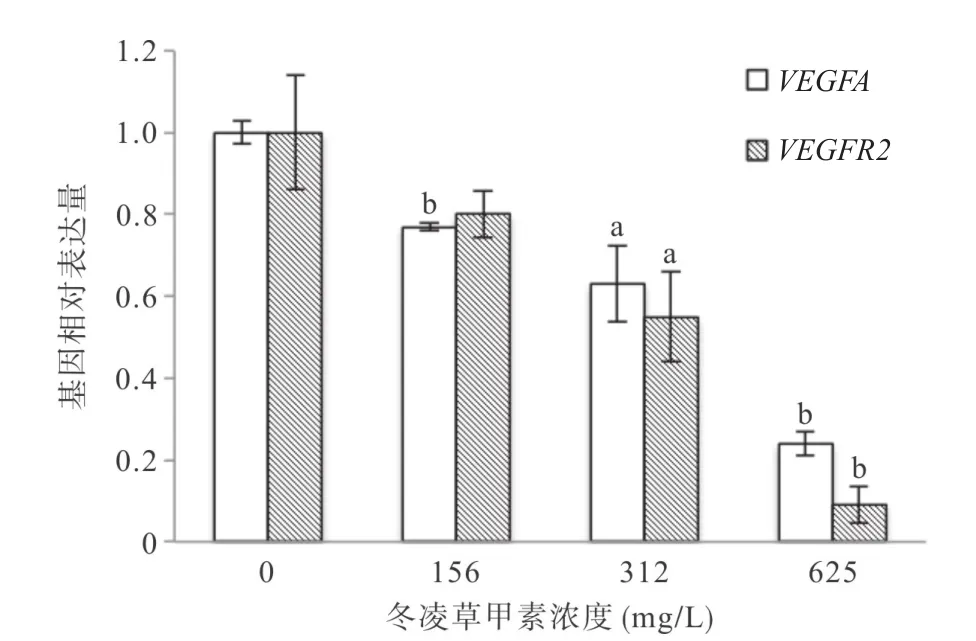
图7 冬凌草甲素抑制HUVEC中VEGFA和VEGFR2基因的表达
3 讨论
研究表明冬凌草甲素具有很好的抗肿瘤作用,其机制主要是抑制肿瘤细胞增殖、迁移和侵袭,诱导肿瘤细胞凋亡,诱导细胞自噬,与治疗药物的协同作用等[1]。但是,冬凌草甲素是否具有抑制血管生成作用,国内外相关研究报道很少。
目前,抑制血管生成药物的筛选模型主要有血管内皮细胞增殖、移行、成管分析、鸡胚血管生成、大鼠动脉环微血管模型等,其中血管内皮细胞是比较经典的体外研究模型[3]。血管内皮细胞实验常选用的细胞类型为HUVEC,因其具有干细胞的潜能,理论上可以传代50~60次;内皮细胞直接接触血液,在血管形成的生理或病理过程中作用重大[4]。因此,本研究选择HUVEC模型,并且证明冬凌草甲素具有明显诱导HUVEC凋亡,抑制HUVEC增殖、迁移和侵袭,以及抑制HUVEC的管腔形成的作用。
VEGF是血管内皮细胞生长及分化的首要因子,在血管生成过程中具有关键的作用,VEGFR通过胞外区与VEGF结合,形成同源二聚体,从而激活细胞内的酪氨酸激酶,因此VEGF-VEGFR信号通路为抗血管生成机制方面研究的主要方向之一[5]。VEGF家族成员主要有VEGFA、VEGFB、VEGFC等,其中VEGFA是最主要的促血管生成因子,在生理性或病理性血管调节中发挥重要的作用[6];VEGFR2是首要调节血管生成活性的受体,VEGFR2可与VEGFA、VEGFC、VEGFD相结合,通过VEGF通路调节内皮细胞的生成、迁移、分化及成管[7];沉默VEGFR2可明显抑制血管生成活性[8]。本研究证明,冬凌草甲素可降低HUVEC中VEGFA和VEGFR2基因的表达量,这可能与冬凌草甲素抑制HUVEC的活性有关。与前期研究结果[2]相一致。
冬凌草甲素抑制血管生成方面的活性可能与c-Met、Notch信号通路有关[9-10]。调节血管生成的重要信号通路是VEGF-VEGFR、Ang-Tie2和Dll4-Notch信号通路,它们各自作用又相互影响,从而共同促进、协调血管生成[11]。研究表明:VEGF-VEGFR信号通路是抗肿瘤转移的主要治疗方向[5,12]。但冬凌草甲素抑制血管生成活性方面整体模型上的作用机制仍有待深入研究。《中医药健康服务发展规划(2015—2020年)》中指出:“中医药是我国独具特色的健康服务资源”。中医药兼顾整体观和个体化,疗效缓和而持久,不良反应相对较小,受到研究者的青睐,在坚持中医药基本理论的前提下,从中药中筛选和开发具有血管抑制活性的抗肿瘤药物潜力很大[13-14]。
∶
[1] 冯耀荣,陈红淑. 冬凌草甲素抗肿瘤活性研究进展[J]. 中
国中医药科技, 2016, 23(1): 125-126.
[2] 田丽莉, 盛东来, 朱国福. 冬凌草甲素抑制血管生成活性及作用机制[J]. 中国实验方剂学杂志, 2016, 22(5): 166-171.
[3] 魏仙, 姚于勤, 杨金亮. 新生血管生成模型及应用[J]. 生物技术通讯, 2015, 26(3): 421-425.
[4] BOUÏS D, HOSPERS G A, MEIJER C, et al. Endothelium in vitro: a review of human vascular endothelial cell lines for blood vessel-related research[J]. Angiogenesis, 2001, 4(2): 91-102.
[5] SHIBUYA M. Vascular endothelial growth factor (VEGF)and its receptor (VEGFR) signaling in angiogenesis: A crucial target for anti-and pro-angiogenic therapies[J]. Genes Cancer, 2011, 2(12): 1097-1105.
[6] HOLMES D I, ZACHARY I. The vascular endothelial growth factor (VEGF) family: angiogenic factors in health and disease[J]. Genome Biol, 2005, 6(2): 209.
[7] OLSSON A K, DIMBERG A, KREUGER J, et al. VEGF receptor signalling-in control of vascular function[J]. Nat Rev Mol Cell Biol, 2006, 7(5): 359-371.
[8] SHIBUYA M. Differential roles of vascular endothelial growth factor receptor-1 and receptor-2 in angiogenesis[J]. J Biochem Mol Biol, 2006, 39(5): 469-478.
[9] MEADE-TOLLIN L C, WIJERATNE E M, COOPER D,et al. Ponicidin and oridonin are responsible for the antiangiogenic activity of Rabdosia rubescens, a constituent of the herbal supplement PC SPES[J]. J Nat Prod, 2004, 67(1):2-4.
[10] DONG Y, ZHANG T, LI J, et al. Oridonin inhibits tumor growth and metastasis through anti-angiogenesis by blocking the Notch signaling[J]. PLoS One, 2014, 9(12): e113830.
[11] 孙晓佳, 张月英. 血管生成主要信号通路[J]. 国际肿瘤学杂志, 2010, 37(2): 95-97.
[12] LI Y L, ZHAO H, REN X B. Relationship of VEGF/VEGFR with immune and cancer cells: staggering or forward?[J].Cancer Biol Med, 2016, 13(2): 206-214.
[13] KUMAR M, DHATWALIA S K, DHAWAN D K. Role of angiogenic factors of herbal origin in regulation of molecular pathways that control tumor angiogenesis[J]. Tumour Biol, 2016, 37(11): 14341-14354.
[14] LU K, BHAT M, BASU S. Plants and their active compounds: natural molecules to target angiogenesis[J]. Angiogenesis, 2016, 19(3): 287-295.
