葛根素对2型糖尿病大鼠胰腺β细胞损伤的影响
2018-01-18陈秀芳雷康福董敏郑巧敏
陈秀芳,雷康福,董敏,郑巧敏
(温州医科大学,浙江 温州 325035,1.基础医学院 生物化学教研室;2.生物学实验教学中心)
我国糖尿病的患病率高达9.7%,其中90%以上为2型糖尿病(type 2 diabetes mellitus,T2DM)[1]。糖尿病不断进展的本质是胰岛素分泌功能的持续减退,初发患者诊断为糖尿病时β细胞功能已降低50%[2]。与正常人群相比,T2DM患者胰岛β细胞数目明显减少,凋亡明显增加[3]。因此保护胰岛β细胞功能,抑制其凋亡成为预防和治疗T2DM的重要措施。葛根素(puerarin,Pue)是从传统中药葛根中提取的异黄酮化合物,被证实有降低血糖、保护心肌等作用[4-7]。本研究采用高脂饮食联合小剂量链脲佐菌素(streptozocin,STZ)腹腔注射建立T2DM大鼠模型,观察胰腺组织氧化应激指标、端粒长度、沉默信息调节因子1(sirtuin 1,SIRT1)、解偶联蛋白2(uncoupling protein 2,UCP2)及凋亡相关蛋白的表达变化,探讨葛根素对胰腺β细胞的保护作用及其可能机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠30只,体质量160~180 g,购自浙江省实验动物中心,许可证号:SCXK(浙)2008-0033。
1.1.2 饲料:高脂饲料(60%脂肪,D12492)、普通饲料(10%脂肪,D12450J)购自美国Research Diets公司。
1.1.3 主要药物和试剂:STZ由美国Sigma公司提供;葛根素注射液(批号130902)由广州白云山天心制药股份有限公司提供;血糖测试纸、定量PCR试剂盒购自瑞士Roche公司;糖化血红蛋白(HbA1c)测定试剂盒购自南京建成生物工程研究所;胰岛素ELISA试剂盒购自瑞典Mercodia公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、丙二醛(malondialdehyde,MDA)检测试剂盒,RIPA裂解液由上海碧云天生物技术研究所提供;蛋白酶/磷酸酶抑制剂、BCA蛋白含量检测试剂盒购自美国Thermo Scientific公司;DNA提取试剂盒购自德国Qiagen公司;相关抗体包括caspase-3、cleaved caspase-3(Asp175)、Bim、Bax、Bcl-2、SIRT1、腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)、p-AMPK(Thr172)、UCP2、β-actin购自美国CST公司。
1.2 方法
1.2.1 动物模型复制、分组及给药:大鼠常规饲料喂养1周后,随机分为正常对照组(NC组,8只)和造模组(22只)。NC组大鼠在整个实验周期中喂以普通饲料,造模组大鼠在整个实验周期中喂以高脂饲料。5周后,造模组大鼠在禁食12 h后一次性腹腔注射STZ 35 mg·kg-1(STZ临用前用0.1 mol/L枸橼酸钠缓冲液配成2%、pH 4.2的溶液),NC组大鼠腹腔注射等体积枸橼酸钠缓冲液。72 h后取尾血测血糖,血糖≥16.7 mmol/L表示T2DM胰岛素抵抗大鼠模型复制成功。将成模大鼠随机分为糖尿病模型(DM)组和葛根素治疗(DM+Pue)组,DM+Pue组腹腔注射葛根素(100 mg·kg-1),DM组及NC组大鼠腹腔注射等体积赋形剂(5%丙二醇)。各组大鼠每天在规定时间内用药,每天1次,连续4周。
1.2.2 样品收集:末次给药1 d后,用2%戊巴比妥钠溶液(30 mg·kg-1)腹腔注射麻醉大鼠,腹主动脉采血处死动物。留取血液,在4 ℃静置4 h后,4 ℃1 500 r/min离心15 min分离血清备用。迅速分离胰腺组织,置液氮速冻后转至-80 ℃冰箱保存备用。
1.2.3 生化指标检测:血糖浓度采用快速血糖仪测定,HbA1c用比色分析法、胰岛素含量用ELISA法、SOD活性用WST-8法、CAT活性用过氧化物酶法、MDA含量用硫代巴比妥酸法、蛋白质含量用BCA法测定,均按试剂盒说明书操作。
1.2.4 胰腺组织端粒长度测定:采用基因组提取试剂盒提取胰腺组织DNA,NanoDrop 2000检测DNA的纯度和浓度。用端粒长度比值,即样本中端粒重复拷贝数和单拷贝基因拷贝数的比值来评估端粒长度,应用real-time PCR技术检测[8]。端粒(Telomere)基因的上游引物序列为5’-CGGTTTGTTTGGGTTTGGGTT TGGGTTTGGGTTTGGGTT-3’,下游引物序列为5’-GGCTTGC CTTACCCTTACCCTTACCCTTACCCTTACCCT-3’;内参照基因(36b4)上游引物序列为5’-ACTGGTCTAGGACCCGAG AG-3’,下游引物序列为5’-TCAATGGTGCCTCTGGAGAT T-3’;上述引物均由南京金斯瑞生物科技有限公司合成。PCR反应体系总体积20 μL,其中2×SYBR Green qPCR Master Mix 10 μL,上、下游引物各1 μL(浓度为10 μmoL/L),模板DNA 2 μL(浓度为7.5 ng/μL),超纯水6 μL。PCR反应条件为95 ℃15 s,62 ℃ 1 min,共40个循环;首循环95 ℃5 min,扩增反应的特异性用熔解曲线检验。
1.2.5 Western blot检测蛋白表达:用RIPA裂解液提取大鼠胰腺组织蛋白,BCA法测定蛋白浓度。经10% SDS-PAGE分离,PVDF膜印迹,5%牛血清白蛋白室温封闭2 h后,加入一抗4 ℃孵育过夜,TBST震摇洗涤10 min×3次;用封闭液稀释辣根过氧化物酶标记的二抗,室温下摇床孵育1 h,再次TBST震摇洗涤10 min×3次;用ECL试剂盒显色,凝胶成像仪拍照,Image J软件分析条带灰度值,确定样品中目的蛋白相对含量。
1.3 统计学处理方法 采用SPSS19.0软件进行分析。数据用 ±s表示,各组间比较采用单因素方差分析,组间行LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 葛根素对T2DM大鼠空腹血糖、HbA1c、血清胰岛素含量的影响 与NC组比较,DM组大鼠空腹血糖、HbA1c含量明显升高(均P<0.01),血清胰岛素水平显著降低(P<0.01);与DM组比,DM+Pue组大鼠血糖、HbA1c含量显著降低(均P<0.01),胰岛素含量明显升高(P<0.01),见图1。
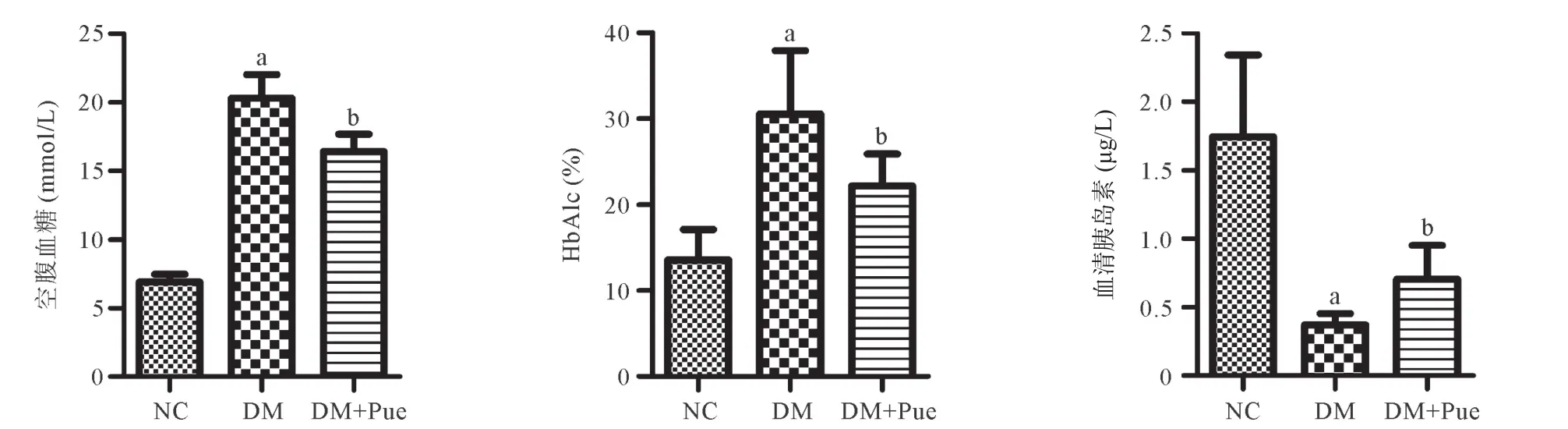
图1 各组大鼠空腹血糖、HbA1c和血清胰岛素含量比较(n=8)
2.2 葛根素对T2DM大鼠胰腺组织氧化应激的影响 DM组大鼠胰腺组织SOD、CAT活性明显低于NC组(均P<0.01),MDA含量明显高于NC组(P<0.01);予以葛根素干预后,SOD、CAT活性显著升高(均P<0.01),而MDA含量显著降低(P<0.01),见图2。

图2 各组大鼠胰腺组织氧化应激相关指标比较(n=8)
2.3 葛根素对T2DM大鼠胰腺组织端粒长度的影响 与NC组相比,DM组大鼠胰腺组织端粒长度明显缩短(P<0.01),给予葛根素干预后,端粒长度显著增加(P<0.01),见图3。
2.4 葛根素对T2DM大鼠胰腺组织凋亡相关蛋白表达的影响 与NC组比较,DM组大鼠胰腺组织中促凋亡蛋白Bax、Bim和cleaved caspase 3/caspase 3的表达明显增加(均P<0.01),而抗凋亡蛋白Bcl-2的表达显著降低(P<0.01);DM+Pue组Bax、Bim、cleaved caspase 3/caspase 3表达显著降低(均P<0.01),Bcl-2表达明显增加(P<0.01),见图4。
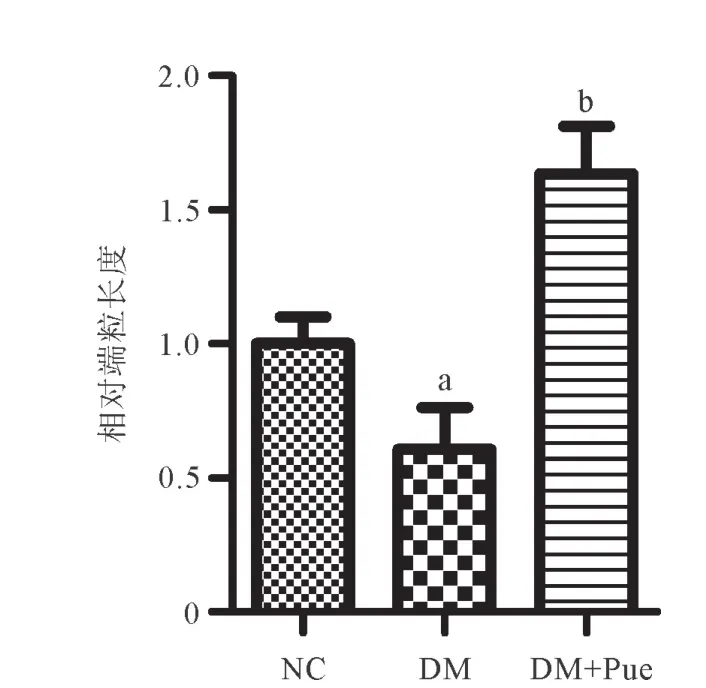
图3 各组大鼠胰腺组织端粒长度变化(n=6)
2.5 葛根素对T2DM大鼠胰腺组织UCP2、SIRT1、p-AMPK/AMPK蛋白表达的影响 如图5所示,与NC组比较,DM组大鼠胰腺组织中UCP2表达明显增加(P<0.01),p-AMPK/AMPK、SIRT1表达显著降低(均P<0.01);葛根素显著下调UCP2表达(P<0.01),上调p-AMPK/AMPK、SIRT1蛋白表达(均P<0.01)。
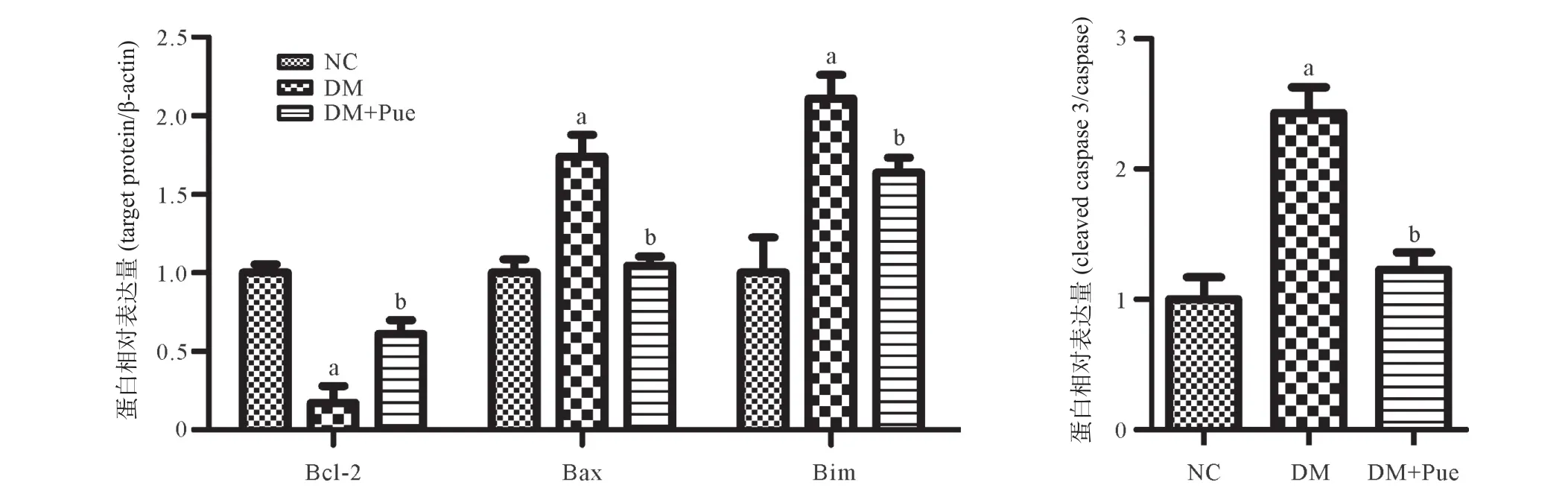
图4 各组大鼠胰腺组织凋亡相关蛋白表达水平比较(n=4)
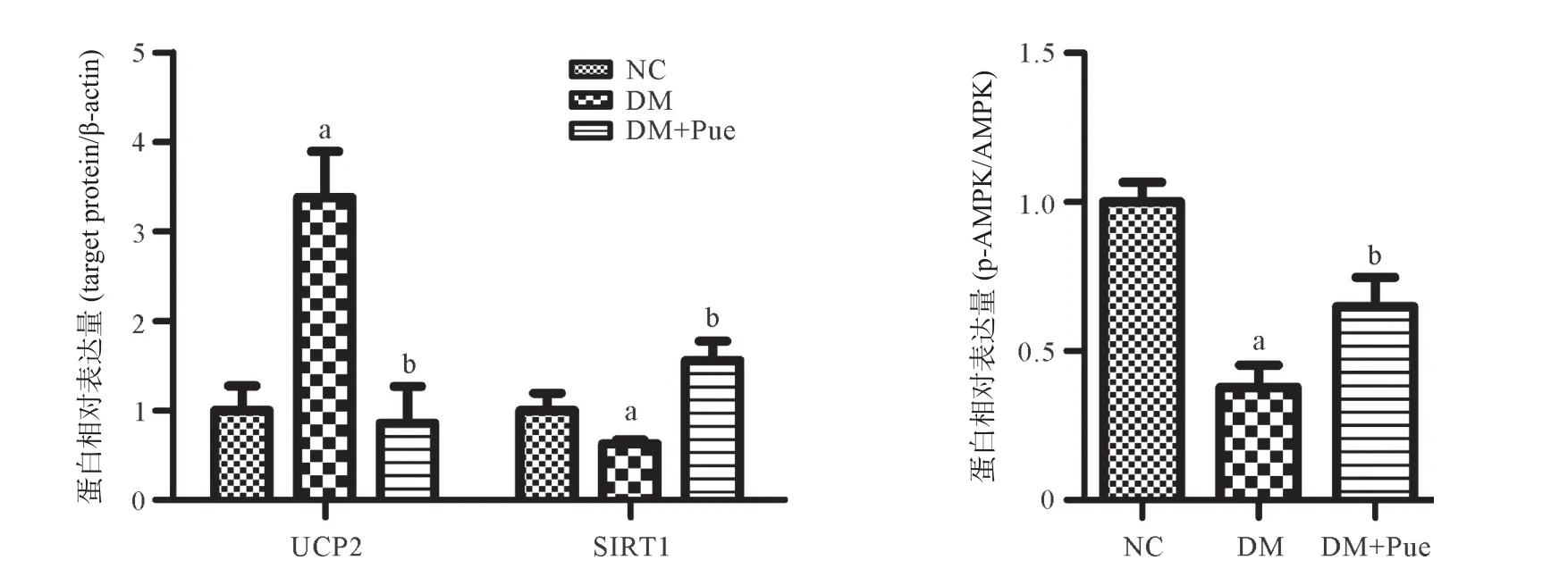
图5 各组大鼠胰腺组织UCP2、SIRT1和p-AMPK/AMPK蛋白表达水平比较(n=4)
3 讨论
研究表明,糖尿病及其并发症的发生发展与氧化应激密切相关[9]。胰岛是人体中抗氧化能力较弱的器官,对活性氧自由基(reactive oxygen species,ROS)含量的变化尤为敏感,容易受氧化应激攻击而损伤[9]。糖尿病长期高糖状态导致胰腺组织中抗氧化酶SOD、CAT活性降低,脂质过氧化产物MDA含量增加,提示ROS生成增多,氧化应激增强。而ROS上调线粒体内膜解偶联蛋白UCP2的表达[10],使线粒体氧化和磷酸化过程脱离,ATP生成减少,导致胰腺β细胞分泌胰岛素减少,血糖进一步升高,形成恶性循环。糖尿病大鼠予以葛根素干预后,胰腺组织SOD、CAT活性增加,ROS生成减少,UCP2表达降低,胰岛素分泌增加而血糖和HbA1c含量降低。有研究[11]报道,UCP2负性调节胰岛素分泌,UCP2基因敲除的小鼠胰岛,避免了高糖诱导的损伤。
端粒长度是β细胞功能和糖尿病发病机制的一个决定因素[12]。在一项纳入了9项研究(包括5 759例患者和6 518例对照)的关于T2DM的Meta分析中指出,端粒长度的缩短与T2DM的发病风险密切相关[13]。1型和2型糖尿病患者均有端粒的缩短,且与氧化应激程度呈正相关[14]。本研究发现,糖尿病大鼠胰腺组织端粒长度明显缩短,可能与胰腺中增多的ROS诱导端粒酶从细胞核向线粒体转位[15],使端粒酶修复端粒的功能丧失有关。而端粒缩短会导致胰岛β细胞复制能力降低,当端粒缩短到一定程度,细胞停止分裂并启动凋亡。而且,高浓度ROS导致凋亡相关基因的表达失调,抗凋亡基因Bcl-2表达减少,促凋亡基因Bax、Bim表达增加,加速细胞凋亡连锁反应,引起caspase级联激活,诱发细胞凋亡[16]。葛根素显著抑制糖尿病大鼠胰岛β细胞端粒长度的缩短,同时抑制促凋亡蛋白的表达,保护β细胞功能,与文献[17-18]报道一致。
SIRT1是哺乳动物中第一个被发现的Sirtuin蛋白家族成员,作为NAD+依赖的蛋白去乙酰化酶,在胰腺、肝脏、骨骼肌等与能量代谢密切相关的组织中参与调节糖脂稳态[19]。SIRT1可以通过减缓胰腺β细胞衰老和抑制凋亡保护β细胞功能[19]。SIRT1缺失,葡萄糖刺激的胰岛素分泌受到抑制[20]。AMPK可通过增加细胞内NAD+水平来增强SIRT1的活性[21]。本研究发现,糖尿病大鼠胰腺组织中AMPK磷酸化减少,SIRT1表达降低;葛根素明显上调SIRT1的表达,增加AMPK磷酸化水平,使细胞内NAD+含量增加,SIRT1活性增强。而SIRT1可通过与UCP2基因启动子区结合,抑制UCP2基因的表达[22]。胰腺β细胞过表达SIRT1的转基因小鼠,UCP2表达减少,胰岛素分泌增加[23]。本研究予以糖尿病大鼠葛根素治疗后血清胰岛素含量增加,也可能与其增强SIRT1活性进而减少UCP2表达有关。
综上所述,本研究表明葛根素对T2DM大鼠胰腺β细胞具有一定的保护作用,其机制可能一方面与减轻氧化应激损伤,保护端粒长度进而抑制β细胞凋亡有关,另一方面与增强SIRT1活性,减少UCP2表达有关。
[1] YANG S H, DOU K F, SONG W J. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010,362(25): 2425-2426.
[2] UK Prospective Diabetes Study (UKPDs) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34)[J]. Lancet, 1998, 352(9131): 854-865.
[3] BUTLER A E, JANSON J, BONNER-WEIR S, et al. Betacell deficit and increased beta-cell apoptosis in humans with type 2 diabetes[J]. Diabetes, 2003, 52(1): 102-110.
[4] 陈秀芳, 董敏, 雷康福, 等. 葛根素对高血糖模型大鼠降糖作用的机制研究[J]. 中国药学杂志, 2010(16): 1242-1246.
[5] 陈秀芳, 雷康福, 董敏, 等. 葛根素对糖尿病大鼠心肌损伤的影响[J]. 中国病理生理杂志, 2010(4): 650-655.
[6] ZHOU Y X, ZHANG H, PENG C. Puerarin: a review of pharmacological effects[J]. Phytother Res, 2014, 28(7): 961-975.
[7] 陈秀芳, 董敏, 雷康福, 等. 葛根素对糖尿病大鼠坐骨神经损伤的影响[J]. 温州医学院学报, 2010, 40(5): 441-444.
[8] CAWTHON R M. Telomere measurement by quantitative PCR[J]. Nucleic Acids Res, 2002, 30(10): e47.
[9] DREWS G, KRIPPEIT-DREWS P, DUFER M. Oxidative stress and beta-cell dysfunction[J]. Pflugers Arch, 2010,460(4): 703-718.
[10] KRAUSS S, ZHANG C Y, SCORRANO L, et al. Superoxide-mediated activation of uncoupling protein 2 causes pancreatic beta cell dysfunction[J]. J Clin Invest, 2003, 112(12):1831-1842.
[11] ZHANG D, SHEN M, MIKITA A, et al. Targeting uncoupling protein-2 improves islet graft function[J]. Cell Transplant, 2011, 20(3): 421-429.
[12] TAMURA Y, TAKUBO K, AIDA J, et al. Telomere attrition and diabetes mellitus[J]. Geriatr Gerontol Int, 2016, 16 Suppl 1: 66-74.
[13] ZHAO J, MIAO K, WANG H, et al. Association between telomere length and type 2 diabetes mellitus: a meta-analysis[J]. PLoS One, 2013, 8(11): e79993.
[14] MAD, ZHU W, HU S, et al. Association between oxidative stress and telomere length in Type 1 and Type 2 diabetic patients[J]. J Endocrinol Invest, 2013, 36(11): 1032-1037.
[15] LI P, TONG Y, YANG H, et al. Mitochondrial translocation of human telomerase reverse transcriptase in cord blood mononuclear cells of newborns with gestational diabetes mellitus mothers[J]. Diabetes Res Clin Pract, 2014, 103(2):310-318.
[16] WANG X. The expanding role of mitochondria in apoptosis[J]. Genes Dev,2001,15(22):2922-2933.
[17] LI Z, SHANGGUAN Z, LIU Y, et al. Puerarin protects pancreatic beta-cell survival via PI3K/Akt signaling pathway[J].J Mol Endocrinol,2014,53(1):71-79.
[18] YANG L, YAO D, YANG H, et al. Puerarin protects pancreatic beta-cells in obese diabetic mice via activation of GLP-1R signaling[J]. Mol Endocrinol, 2016, 30(3): 361-371.
[19] YU J, AUWERX J. The role of sirtuins in the control of metabolic homeostasis[J]. Ann N Y Acad Sci, 2009, 1173 Suppl 1: E10-E19.
[20] LUU L, DAI F F, PRENTICE K J, et al. The loss of Sirt1 in mouse pancreatic beta cells impairs insulin secretion by disrupting glucose sensing[J]. Diabetologia, 2013, 56(9): 2010-2020.
[21] CANTO C, GERHART-HINES Z, FEIGE J N, et al. AMPK regulates energy expenditure by modulating NAD+metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-1060.
[22] BORDONE L, MOTTA M C, PICARD F, et al. Sirt1 regulates insulin secretion by repressing UCP2 in pancreatic beta cells[J]. PLoS Biol, 2006, 4(2): e31.
[23] MOYNIHAN K A, GRIMM A A, PLUEGER M M, et al.Increased dosage of mammalian Sir2 in pancreatic beta cells enhances glucose-stimulated insulin secretion in mice[J].Cell Metab, 2005, 2(2): 105-117.
