羟考酮复合右美托咪定抑制芬太尼诱发的咳嗽反射
2018-01-18杨洋方丽萍卞清明
杨洋,方丽萍,卞清明
(1.南京市溧水区人民医院麻醉科,江苏南京211200;2.江苏省肿瘤医院麻醉科,江苏南京210009)
全麻诱导期间静脉注射芬太尼可诱发不同程度的咳嗽反射,其发生率因不同的给药剂量、速度和途径而不尽相同[1-4]。对于术前伴有高血压、冠心病、脑动脉瘤、颅内压增高、开放性眼外伤、饱胃的患者,剧烈的咳嗽(加之气管插管引起的心血管反应)可引起机体血流动力学急剧变化,并可能导致严重的并发症。Tweed等[5]报道1例儿童静脉注射芬太尼后诱发剧烈咳嗽反射导致结膜和眶周瘀斑。Lim等[6]报道1例行腹腔镜肾切除患者全麻诱导期间注射芬太尼诱发咳嗽反射引起呕吐、误吸导致吸入性肺炎。Li等[7]研究发现芬太尼诱发的咳嗽反射仍是患者术后恶心、呕吐的危险因素。因此,对芬太尼诱发咳嗽反射进行有效的干预,可增强围麻醉期安全性,降低麻醉并发症的发生。近期有文献报道羟考酮、右美托咪定均能有效抑制芬太尼诱发的咳嗽反射[8-9],但单独使用这些药物各有利弊。本研究拟评价麻醉诱导前联合应用小剂量羟考酮和右美托咪定预防芬太尼诱发咳嗽反射以及减轻气管插管引起心血管反应的效果及安全性。
1 资料与方法
1.1 一般资料
本研究经江苏省肿瘤医院伦理委员会批准,纳入患者均签署知情同意书。选择2016年1月至12月200例择期手术并行全身麻醉的患者,性别不限,年龄21~64岁,体质量48~78 kg,ASAⅠ~Ⅱ级,采用随机数字表法均分为4组:羟考酮组、右美托咪定组、复合组和对照组,每组50例。排除标准:近期有上呼吸道感染和咳嗽;有哮喘、高血压、冠心病等病史;肝、肾功能严重异常;对阿片类药物过敏;术前使用转化酶抑制剂、皮质类固醇激素;麻醉诱导期间使用麻黄素、阿托品;气管插管时间大于30 s或插管2次以上成功者。
1.2 方法
所有患者入手术室后均持续监测心电图、无创血压(NBP)、SpO2,开放右上肢静脉。羟考酮组于麻醉诱导前静脉注射羟考酮0.1 mg·kg-1;右美托咪定组于麻醉诱导前静脉泵注右美托咪定0.5 μg·kg-1(10 min泵注完毕);复合组于麻醉诱导前经静脉泵注右美托咪定0.25μg·kg-1(10 min泵注完毕),右美托咪定泵注结束后经静脉注射羟考酮0.05 mg·kg-1;对照组经静脉泵注与右美托咪定组等容量的生理盐水。各组于预给药结束5 min后静脉注射3μg·kg-1剂量的芬太尼(5 s注射完毕),2 min后依次静脉注射咪达唑仑(0.04 mg·kg-1),丙泊酚(1 mg·kg-1),顺式阿曲库铵(0.2 mg·kg-1),3 min后经气管内插管,连接麻醉机行机械通气,呼吸参数:VT为8 mL·kg-1,呼吸频率为12次/min,吸呼比(I∶E)为1∶2,氧流量为1.5 L·min-1。麻醉诱导期未使用阿托品、麻黄素等药物。
1.3 观察指标
记录静脉注射芬太尼后各组患者咳嗽反射发生的例数,并参考文献[2]进行咳嗽强度评分:咳嗽1~2次为轻度,咳嗽3~4次为中度,咳嗽≥5次为重度;监测并记录麻醉诱导前(T0)、预给药结束5 min后(T1)、气管插管前即刻(T2)、气管插管后即刻(T3)、气管插管后 1 min(T4)、气管插管后 3 min(T5)各组患者收缩压、舒张压、心率;观察并记录各组患者诱导期(预给药5 min后)低氧血症(SpO2<90%)、低血压(收缩压<80 mmHg)、严重心动过缓(心率<50次/min)的发生率。
1.4 统计学方法
数据采用SPSS 13.0软件进行统计。计量资料以均数±标准差(±s)表示,采用单因素方差分析进行4组资料的组间比较,采用重复测量设计的方差分析进行组内比较,采用χ2检验或Fisher确切概率法比较4组间咳嗽的发生率。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
4组患者性别、年龄、体质量以及ASA分级等一般资料的比较差异均无统计学意义(P均>0.05),具有可比性。见表1。
2.2 各组患者咳嗽发生的例数及强度
与对照组相比,其余3组咳嗽发生率显著降低(P<0.05或P<0.01);复合组虽然完全抑制了芬太尼诱发的咳嗽反射,但与羟考酮组、右美托咪定组相比,差异无统计学意义(P=0.242,0.117)。见表2。
表1 各组患者一般资料的比较 n=50
2.3 各组患者不同时间点收缩压、舒张压和心率的变化
与 T0时间点相比较,对照组 T3、T4、T5时间点收缩压、舒张压明显增高,心率显著增快(P<0.05);其余3组T1~T5时间点收缩压、舒张压、心率均明显降低(P<0.05)。与对照组T3~T5时间点相比,其他3组收缩压、舒张压、心率则均明显降低(P<0.05)。见表 3。
2.4 各组患者诱导期低氧血症、低血压、严重心动过缓发生情况
羟考酮组有4例T1时间点SpO2低于90%,经面罩吸氧后回升,其余3组 T1时间点SpO2均高于90%,均未经面罩吸氧。4组T2时间点均有患者收缩压低于80 mmHg,但总体差异无统计学意义;羟考酮组、右美托咪定组和复合组分别有1例、4例、1例T2时间点心率低于50次/min,但均未用麻黄素或阿托品,气管插管后收缩压、心率均回升。见表4。
3 讨论
芬太尼诱发咳嗽反射的现象近年来受到国内外学者的重视,相关研究结果认为其发生可能与多种机制相关[4,10-11]。国内外学者采用不同的药物预防芬太尼诱发的咳嗽反射,均取得了一定的效果,这些药物单独使用各有利弊。可能是由于芬太尼诱发咳嗽反射的这些机制之间存在关联,相互影响,单独使用某种药物可能只针对其中某种或部分机制,并不能完全有效地抑制芬太尼诱发的咳嗽反射;加大药物剂量并不一定增强抑制咳嗽反射的效果,还可能增加不良反应。
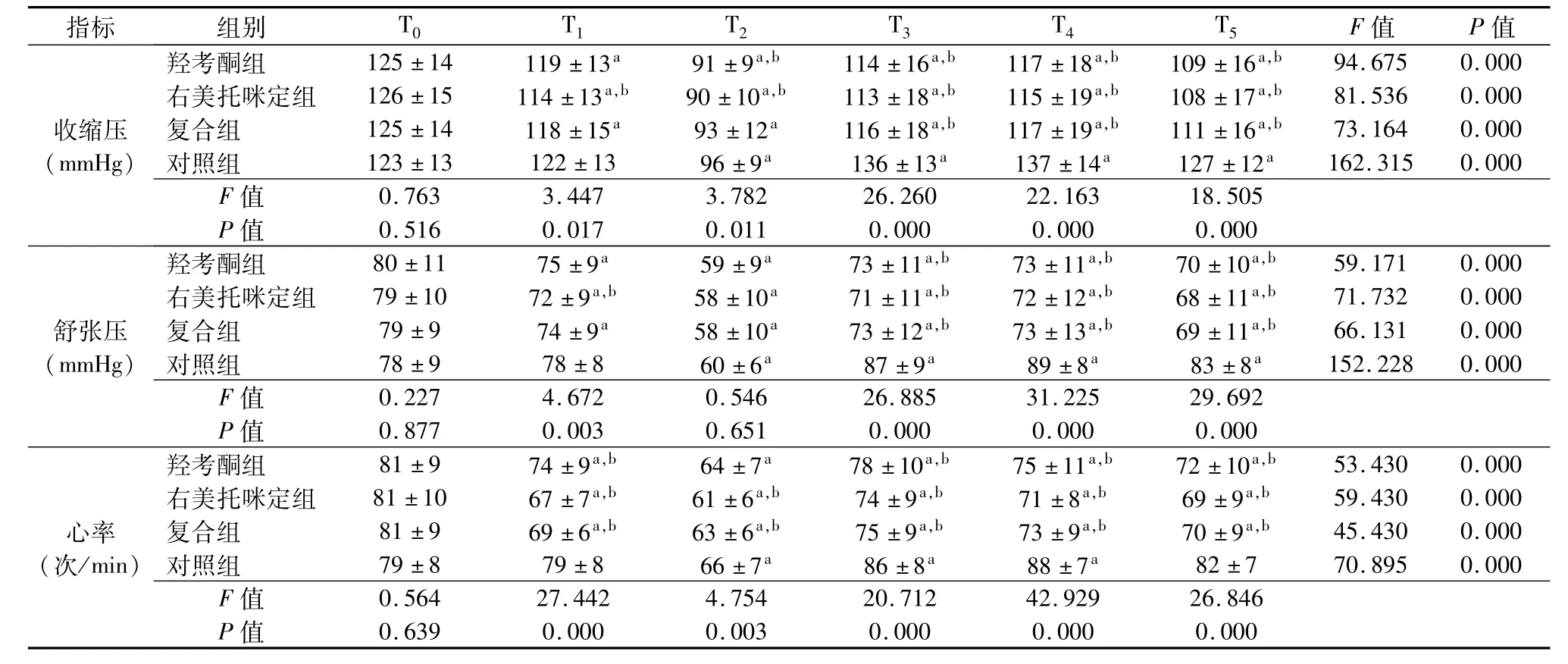
表3 各组患者不同时间点收缩压、舒张压和心率的比较¯x±s,n=50
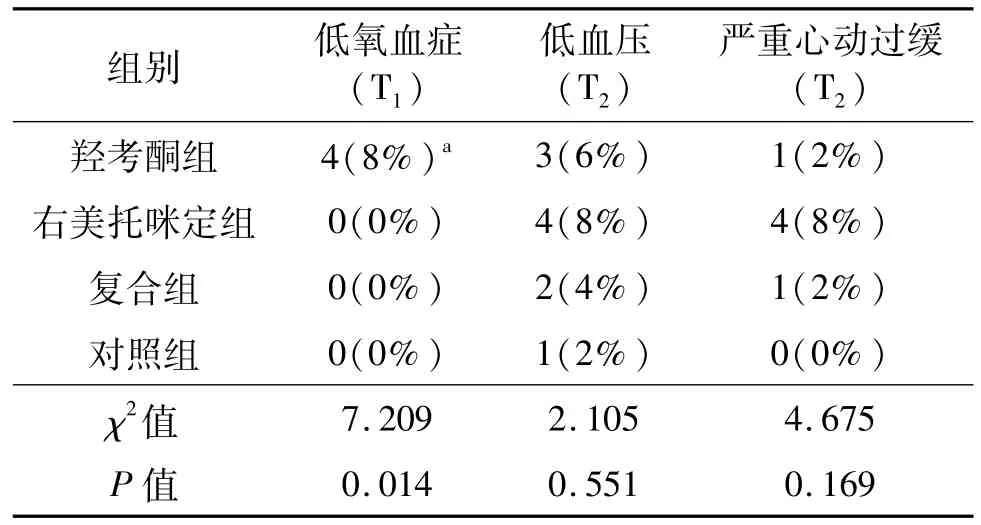
表4 各组患者诱导期低氧血症、低血压、严重心动过缓发生率n=50,例(%)
新型α2受体激动剂右美托咪啶具有显著的镇静、镇痛及抗交感作用,已广泛用于临床麻醉以及ICU镇静。近来研究发现右美托咪定还能有效抑制阿片类药物诱发的咳嗽反射[12]。研究发现,α2肾上腺素能受体激动剂可乐定能抑制兔的咳嗽反射,激活α2肾上腺素能受体可能通过中枢机制调节咳嗽反射[13]。有研究发现右美托咪定呈剂量依赖性抑制阿芬太尼诱发的大鼠肌强直,而阿替美唑(一种α2肾上腺素能受体拮抗剂)则能显著增强阿芬太尼诱发的大鼠肌强直[14-15]。另一项研究发现,右美托咪定静脉注射能显著抑制组胺诱发的狗支气管收缩[16]。因此可推测,右美托咪定一方面可能通过抑制阿片类药物诱发的肌强直以及支气管收缩等从而抑制芬太尼诱发的咳嗽反射,另一方面也可能通过中枢来调节咳嗽反射。本研究结果显示,预先静脉泵注0.5μg·kg-1右美托咪定不仅能有效抑制芬太尼诱发的咳嗽反射,而且能有效减轻气管插管引起的心血管反应;但同时还发现,右美托咪定组患者麻醉诱导期严重心动过缓的发生率高于对照组,对术前心电图检查有窦性心动过缓或房室传导阻滞的患者应慎用。
羟考酮是一种新型的纯阿片μ、κ受体双重激动剂,起效迅速(2~3 min),镇痛作用较强(尤其是内脏痛),已广泛应用于麻醉诱导及术后镇痛。近来研究[8]发现羟考酮能有效地抑制芬太尼诱发咳嗽的发生,一方面可能与其直接作用于延髓的咳嗽中枢而起镇咳作用有关,另一方面可能与其激动κ受体有关。本研究中预先静脉注射羟考酮(0.1 mg·kg-1)不仅能有效抑制气管插管反应,而且能有效抑制芬太尼诱发的咳嗽反射;但同时发现,羟考酮组有4例患者T1时间点SpO2低于90%,经面罩吸氧后SpO2均回升,提示羟考酮预给药后仍需加强SpO2监测,以防不测。
鉴于应用单一药物预防芬太尼诱发的咳嗽反射可能会产生不良反应,本研究于麻醉诱导前将小剂量羟考酮和右美托咪定联合应用,评价其预防芬太尼诱发咳嗽反射以及减轻气管插管引起心血管反应的效果及安全性。复合组将羟考酮与右美托咪定联合使用,并将二者剂量均减半,结果显示不仅能够完全抑制芬太尼诱发的咳嗽反射,同时也减少了麻醉诱导期间低氧血症和严重心动过缓的发生率。由此提示,在临床预防芬太尼诱发咳嗽反射时可以联合不同药物,通过多种机制和环节,达到更好的效果,尽量减少可能的不良反应发生。
综上所述,全麻诱导前采用0.1 mg·kg-1羟考酮静脉注射或0.5μg·kg-1右美托咪定静脉泵注均可有效抑制芬太尼诱发咳嗽反射的发生及气管插管引起的心血管反应。羟考酮0.05 mg·kg-1静脉注射联合右美托咪定0.25μg·kg-1静脉泵注不仅能显著减轻气管插管反应,而且能更有效地抑制芬太尼诱发的咳嗽反射,并能减少各自的不良反应,值得临床推广。
[1]Agarwal A,Azim A,Ambesh S,et al.Salbutamol,beclomethasone or sodium chromoglycate suppress coughing induced by iv fentanyl[J].Can JAnaesth,2003,50(3):297-300.
[2]Horng HC,Wong CS,Hsiao KN,et al.Pre-medication with intravenous clonidine suppresses fentanyl-induced cough[J].Acta Anaesthesiol Scand,2007,51(7):862-865.
[3]Lin CS,Sun WZ,Chan WH,et al.Intravenous lidocaine and ephedrine,but not propofol,suppress fentanyl-induced cough[J].Can JAnaesth,2004,51(7):654-659.
[4]Pandey CK,Raza M,Ranjan R,et al.Intravenous lidocaine suppresses fentanyl-induced coughing:a doubleblind,prospective,randomized placebo-controlled study[J].Anesth Analg,2004,99(6):1696-1698.
[5]Tweed WA,Dakin D.Explosive coughing after bolus fentanyl injection[J].Anesth Analg,2001,92(6):1442-1443.
[6]Lim KJ,Lee SK,Lee HM,et al.Aspiration pneumonia caused by fentanyl-induced cough-a case report-[J].Korean JAnesthesiol,2013,65(3):251-253.
[7]Li CC,Chen SS,Huang CH,et al.Fentanyl-induced cough is a risk factor for postoperative nausea and vomiting[J].Br JAnaesth,2015,115(3):444-448.
[8]唐作垒,吴畏.盐酸羟考酮预防麻醉诱导中芬太尼诱发患者咳嗽的效果[J].中华麻醉学杂志,2014,34(6):668-669.
[9]Shuying L,Ping L,Juan N,et al.Different interventions in preventing opioid-induced cough:ameta-analysis[J].JClin Anesth,2016,34:440-447.
[10]Ricciardolo FL.Mechanisms of citric acid-induced bronchoconstriction[J].Am JMed,2001,111(8 suppl 1):18S-24S.
[11]Kim JE,Min SK,Chae YJ,et al.Pharmacological and nonpharmacological prevention of fentanyl-induced cough:a meta-analysis[J].JAnesth,2014,28(2):257-266.
[12]Sun S,Huang SQ.Effects of pretreatment with a small dose of dexmedetomidine on sufentanil-induced cough during anesthetic induction[J].J Anesth,2013,27(1):25-28.
[13]Cinelli E,Bongianni F,Pantaleo T,et al.Suppression of the cough reflex byα2-adrenergic receptor agonists in the rabbit[J].Physiol Rep,2013,1(6):e00122.
[14]Weinger MB,Chen DY,Lin T,et al.A role for CNS α-2 adrenergic receptors in opiate-inducedmuscle rigidity in the rat[J].Brain Res,1995,669(1):10-18.
[15]Weinger MB,Bednarczyk JM.Atipamezole,anα2 antagonist,augments opiate-induced muscle rigidity in the rat[J].Pharmacol Biochem Behav,1994,49(3):523-529.
[16]Groeben H,Mitzner W,Brown RH.Effects of theα2-adrenoceptor agonist dexmedetomidine on bronchoconstriction in dogs[J].Anesthesiology,2004,100(2):359-363.
