小RNA SbfR增强伤寒沙门菌动力和侵袭力
2018-01-18孙嘉遥陆仁飞赵昕黄新祥
孙嘉遥,陆仁飞,赵昕,黄新祥
(江苏大学医学院,江苏镇江212013)
伤寒沙门菌(Salmonella entericaserovar Typhi,S.Typhi)是沙门菌属中一种人类肠道致病菌,通常通过污染的食物由消化道进入人体。S.Typhi可侵袭进入小肠黏膜,并克服人体免疫吞噬细胞的杀伤作用,再经血液进入肝脾等全身组织,造成严重的系统性感染——伤寒热[1-2]。
细菌中存在大量的非编码RNA(non-coding RNA,ncRNA),它们活跃参与细菌各个方面的基因表达调控[3-4]。根据作用方式可将ncRNA分为顺式编码RNA和反式作用RNA。其中,反式作用RNA大多<200 nt,又称为小RNA(sRNA)。sRNA往往在远处有多个靶基因,且常在伴侣分子Hfq的协助下与靶mRNA形成不完全碱基互补配对发挥作用[5-6]。
本实验室前期利用Solexa高通量测序技术进行了S.Typhi转录组分析,发现了一个新的长为138 nt的 sRNA,命名为SbfR(原名称为T64)[7],其基因序列位于yegD与一假定蛋白St00898基因之间。目前已对该sRNA进行了表达特性分析和相关菌株构建[8],但对其在S.Typhi中发挥的作用尚未深入研究。
本研究对已构建的SbfR相关菌株进行表型和基因芯片分析,以查找表达差异基因,为后续寻找SbfR的靶基因提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 H:z66阳性S.Typhi野生株GIFU 10007(WT)为日本岐阜大学医学院微生物学教研室馈赠。质粒pBAD/Myc-HisA为 Promega公司产品。S.Typhi空载体株(WT+pBAD/Myc-HisA)、S.Typhi SbfR缺陷株(△SbfR+pBAD/Myc-HisA)、S.Typhi SbfR回补株(△SbfR+pBAD/Myc-HisA-SbfR)由本实验室制备及保存[8]。HeLa细胞购自上海生科院细胞库。
1.1.2 主要材料与试剂 胰蛋白胨、酵母提取物、氨苄西林、DMEM培养基、胰蛋白酶、胎牛血清(Oxoid公司);NaCl、NaOH、盐酸、无水乙醇、异丙醇(上海国药集团化学试剂有限公司);Trizol试剂(Invitrogen公司);L-阿拉伯糖、SYBR荧光定量试剂盒、反转录试剂盒、DNA酶Ⅰ快速DNA消化试剂盒(TaKaRa公司);基因特异性引物合成(苏州泓讯生物科技有限公司);荧光染料 Cy3-dCTP、Cy5-dCTP(Amersham公司);总RNA提取试剂盒(Qiagen公司);检测S.Typhi基因组的基因芯片(本实验室制备保存)。
1.1.3 主要仪器 PCR仪(美国 ABI公司,型号2720);NanoDrop ND-1000核酸紫外检测仪(美国赛默飞世尔科技公司);荧光定量PCR仪(美国Bio-Rad公司);高速冷冻离心机(美国赛默飞世尔科技公司,型号HERAEUSMegafuge);核酸杂交仪(英国Roller-Blot公司,型号 hybridiser HB-3D);基因芯片扫描分析系统(美国 Axon Instruments公司,型号Genepix personal 4100A)。
1.2 细菌培养
将S.Typhi空载体株、SbfR缺陷株和SbfR回补株的单菌落分别接种于2 mL LB培养基(含0.1 mg/mL氨苄西林),37℃、250 r/min振荡过夜。第2天,1∶100转接后以相同条件培养至对数生长期[D(600 nm)≈0.4],加入 0.2%(W/V)L-阿拉伯糖,继续培养30 min诱导SbfR表达。
1.3 细菌动力实验
取培养的空载体株、SbfR缺陷株和SbfR回补株菌液各0.5μL,点种于含0.3%琼脂的LB半固体平板,37℃静置培养过夜,检测动力圈直径。实验重复3次后进行数据分析。
1.4 HeLa细胞侵袭实验
用含10%胎牛血清的DMEM培养液在37℃、5%CO2培养箱内培养HeLa细胞。实验前1 d将24×105个细胞按密度为1×105个/mL接种于24孔细胞培养板中,于培养箱内培养24 h。按照MOI为20∶1的比例向每孔细胞中加入培养的空载体株、SbfR缺陷株和SbfR回补株菌液,继续将培养板在培养箱内孵育90 min;弃上清液,用PBS将每孔轻缓吹洗3次。一半孔内加入1 mL 0.5%(V/V)TritonX-100裂解细胞,孵育10 min后涂于LB平板,培养过夜后其克隆数代表黏附水平(以T0表示);余下一半孔内加入100 mg/L庆大霉素杀死胞外菌,继续培养90 min后同样以1 mL 0.5%(V/V)TritonX-100裂解细胞,过夜培养后计算单克隆数代表侵袭水平(以T90表示)。重复3次后进行数据分析。
1.5 基因芯片检测S.Typhi全基因组表达水平
为进一步研究sRNA SbfR增强S.Typhi动力和侵袭力的机制,利用本实验室前期制备的基因芯片筛查SbfR缺陷株和SbfR回补株基因表达谱差异,Log2R的绝对值>1为判断差异显著的标准。采用4 000 r/min离心收集SbfR缺陷株和回补株。使用总RNA提取试剂盒提取总RNA,加入Cy3-dCTP、Cy5-dCTP进行逆转录,cDNA产物与基因芯片于核酸杂交仪中杂交18 h,次日下午洗片、扫描,进行数据分析[9]。
1.6 qRT-PCR检测有表达差异的4种基因的mRNA表达
挑选基因芯片中4种表达差异的基因fliA、fljB、sopE和prgJ进行qRT-PCR分析。将培养的SbfR缺陷株和回补株以4 000 r/min离心收集细菌。Trizol法提取细菌总RNA。取1μg总RNA,以下游引物为反转录引物,用反转录试剂盒进行反转录。以cDNA为模板,用上下游引物进行扩增,采用两步法qRT-PCR(95℃ 150 s预变性,95℃ 10 s,65℃ 30 s,40个循环),其中5s为内参基因,观察相关基因在各菌株中的转录水平。所用qRT-PCR引物:5s上游 5′-TTGTCTGGCGGCAGTAGC-3′,下 游 5′-TTTGATGCCTGGCAGTTC-3′;fliA上游 5′-GCGATGCTGGATGAATTACG-3′,下游 5′-TCGGTTTCCGTCGCATTAC-3′;fljB上游 5′-CAACCGCTAGTGATTTAGTTT-3′,下 游 5′-CTGTCCCTGTAGTAGCCGTAC-3′;sopE上游 5′-GCAACACACTTTCACCGAGG-3′,下 游 5′-CGGGGTCTTTACTCGCACTA-3′;prgJ上游 5′-GACATTGTCTCGCTGGATGA-3′,下游 5′-TCTTGCGAAATAGCCAGCTC-3′。实验重复3次后进行数据分析。
1.7 统计学分析
2 结果
2.1 sRNA SbfR对 S.Typhi动力的影响
细菌动力实验结果显示,与空载体株相比,SbfR缺陷株的动力圈明显减小(t=17.44,P<0.01),而回补株与对照株的动力圈大小基本一致。此结果表明sRNA SbfR可增强S.Typhi的动力。
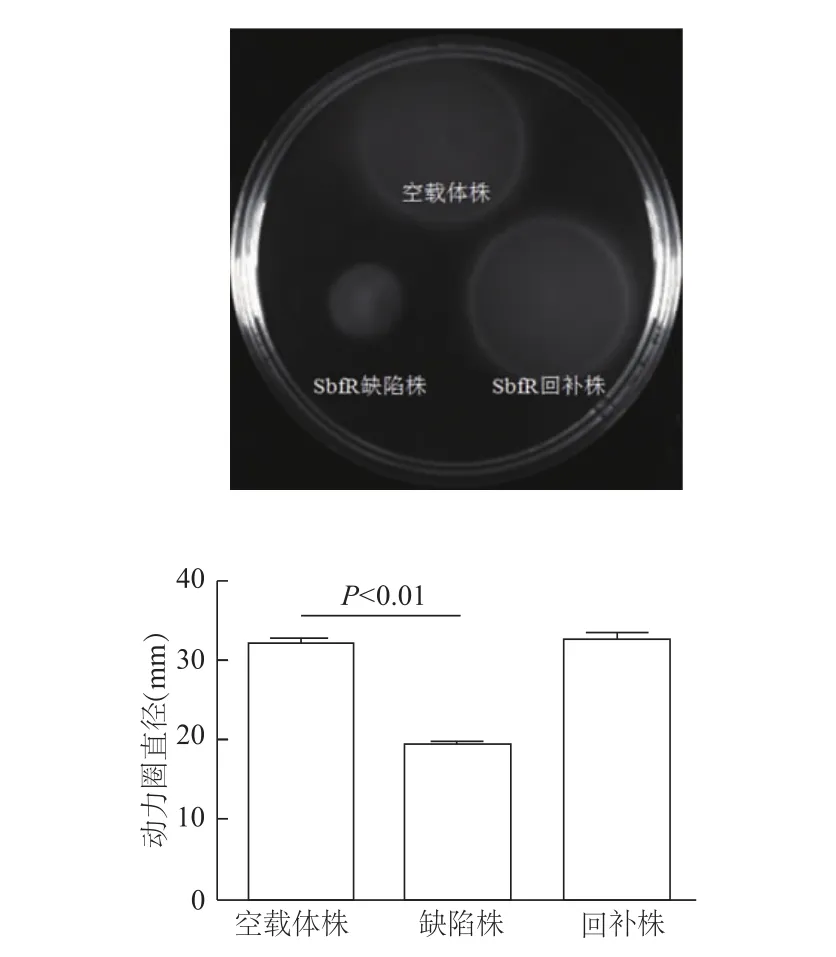
图1 3种菌株动力圈比较
2.2 sRNA SbfR对 S.Typhi侵袭力的影响
细胞侵袭实验结果显示,与空载体株比较,缺陷株对HeLa细胞的侵袭能力显著下降(t=30.18,P<0.01),而回补株与对照株侵袭力基本一致,说明sRNA SbfR可以促进S.Typhi对上皮细胞的侵袭。
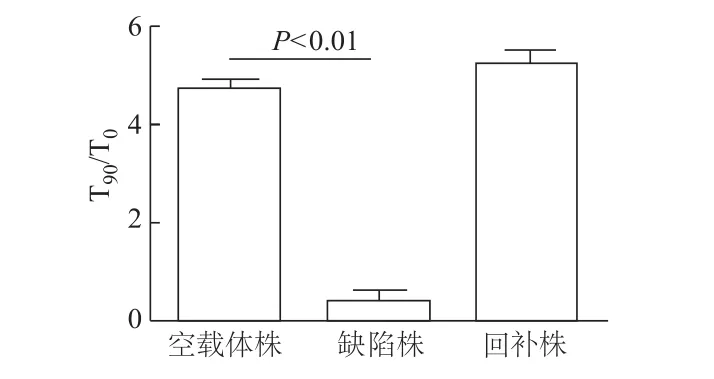
图2 3种菌株对HeLa细胞的侵袭力
2.3 基因芯片分析sRNA SbfR对S.Typhi转录组的影响
基因芯片筛查结果显示,缺陷株与回补株的表达差异基因共有85个,主要为鞭毛、热休克、酶等相关基因。其中与鞭毛相关基因10种,侵袭相关基因2种。具体下调的基因功能及表达差异见表1。
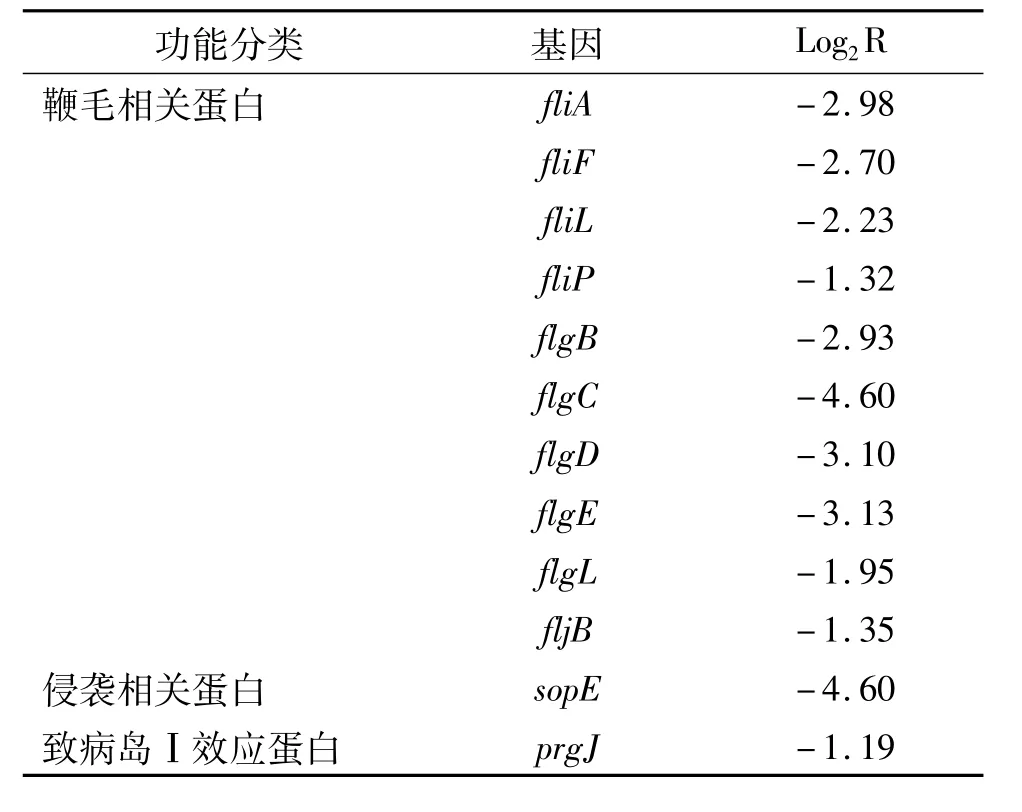
表1 SbfR缺陷株中下调的12种基因
2.4 4种差异表达基因的qRT-PCR验证
qRT-PCR结果显示,回补SbfR后fliA、fljB、sopE基因表达均上调(P均<0.05),而prgJ表达水平不变(图3)。qRT-PCR结果与基因芯片结果基本一致,表明SbfR可以促进S.Typhi鞭毛和侵袭相关基因的转录表达。
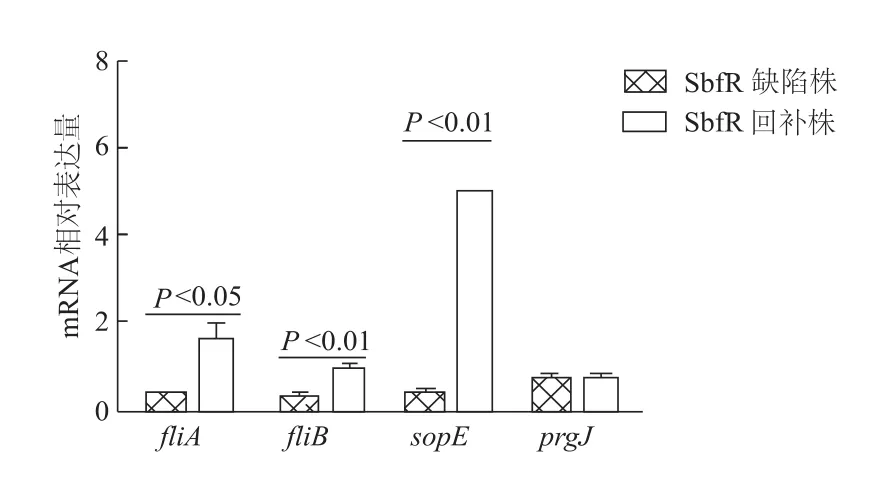
图3 qRT-PCR验证基因芯片结果
3 讨论
sRNA在S.Typhi基因表达调控中发挥重要作用。sRNA主要通过与靶mRNA形成不完全碱基互补配对发挥作用,其与靶基因的作用方式主要有两种:①与靶mRNA局部结合形成双链,干扰RNA酶E的降解作用,影响靶mRNA的稳定性;②与靶mRNA的5′端结合,影响靶mRNA SD序列的二级结构,从而影响靶基因的翻译效率[10]。
鞭毛是细菌重要的动力结构,在细菌致病过程中发挥重要作用。大约50个基因与鞭毛的结构和功能相关,并根据转录调节关系可将这些基因分为三级。其中,flhDC为一级基因,调节下游所有二、三级鞭毛基因;fliA为二级基因,调节如fljB、fliC等三级鞭毛基因[11]。本研究中基因芯片和qRT-PCR检测结果均显示,SbfR通过上调二、三级鞭毛基因fliA、fljB等的表达,增强S.Typhi的运动能力。
S.Typhi穿过上皮层的过程中,首先黏附于肠上皮细胞表面,随后侵袭进入靶细胞。这一过程需要多种侵袭、菌毛、鞭毛基因以及调节因子等参与[12]。sopE和prgJ分别编码胍基交换因子和Ⅲ型分泌系统内部棒状蛋白,均可增强细菌对细胞的侵袭力[13-14]。本研究中sopE的 qRT-PCR结果与芯片结果一致,而prgJ则存在矛盾,推测可能是由于实验方法和阈值差异引起。基因芯片和qRT-PCR结果表明,sopE表达水平下调与鞭毛相关基因水平下降引起的动力减弱可能共同降低了S.Typhi对HeLa细胞的侵袭能力。
综上,本研究通过S.Typhi动力和细胞侵袭表型实验,发现sRNA SbfR可增强S.Typhi的动力和侵袭力;并分析了基因芯片和qRT-PCR结果,发现sRNA SbfR可促进S.Typhi鞭毛相关基因(fliA、fljB)和侵袭相关基因(sopE)的转录。然而,研究结果虽表明SbfR对鞭毛和侵袭相关基因存在调控作用,但并未确定它们是否为SbfR的靶基因。因此SbfR靶基因的确定及其与靶基因的结合位点仍需进一步的研究确定。
[1]Akullian A,Ng′eno E,Matheson AI,et al.Environmental transmission of typhoid fever in an urban slum[J].PLoSNegl Trop Dis,2015,9(12):e0004212.
[2]Douqan G,Baker S.Salmonella enterica Serovar Typhi and the pathogenesis of typhoid fever[J].Annu Rev Microbiol,2014,68:317-336.
[3]Lalaouna D,Simoneau-Roy M,Lafontaine D,et al.Regulatory RNAs and targetmRNA decay in prokaryotes[J].Biochim Biophys Acta,2013,1829(6/7):742-747.
[4]Sedlyarova N,Shamovsky I,Bharati BK,et al.sRNA-mediated control of transcription termination in E.coli[J].Cell,2016,167(1):111-121.
[5]Lee HJ,Gottesman S.sRNA roles in regulating transcriptional regulators:Lrp and SoxS regulation by sRNAs[J].Nucleic Acids Res,2016,44(14):6907-6923.
[6]Smirnov A,Wang C,Drewry LL,et al.Molecular mechanism ofmRNA repression in trans by a ProQ-dependent small RNA[J].EMBO J,2017,36(8):1029-1045.
[7]王哲鑫,吉滢,赵昕,等.非编码小RNA T64对伤寒沙门菌基因表达的影响[J].江苏大学学报(医学版),2014,24(4):298-301.
[8]徐慧,袁一航,陆仁飞,等.伤寒沙门菌小RNA T64的功能[J].江苏大学学报(医学版),2016,26(4):320-323.
[9]Sheng X,Huang X,Li J,etal.Regulation of sulfur assimilation pathways in Salmonella enterica serovar Typhi upon up-shift high osmotic treatment:the role of UhpA revealed through transcriptome profiling[J].Curr Microbiol,2009,59(6):628-635.
[10]Le Pabic H,Germain-Amiot N,Bordeau V,et al.A bacterial regulatory RNA attenuates virulence,spread and human host cell phagocytosis[J].Nucleic Acids Res,2015,43(19):9232-9248.
[11]Du H,Sheng X,Zhang H,et al.RpoE may promote flagellar gene expression in Salmonella enterica serovar Typhi under hyperosmotic stress[J].Curr Microbiol,2011,62(2):492-500.
[12]Chaban B,Hughes HV,Beeby M,et al.The flagellum in bacterial pathogens:Formotility and awhole lotmore[J].Semin Cell Dev Biol,2015,46:91-103.
[13]Vonaesch P,Sellin ME,Cardini S,et al.The Salmonella Typhimurium effector protein SopE transiently localizes to the early SCV and contributes to intracellular replication[J].Cell Microbiol,2014,16(12):1723-1235.
[14]Zhong D,Lefebre M,Kaur K,et al.The Salmonella type IIIsecretion system inner rod protein PrgJis partially folded[J].J Biol Chem,2012,287(30):25303-25311.
