姜黄素抑制BV2细胞RAGE/NF-κB通路发挥对多巴胺能神经细胞的保护作用
2018-01-18李梦楠马振凯白宏英
李梦楠, 马振凯, 白宏英
帕金森病(Parkinson’s disease,PD)是目前最常见的神经退行性疾病,严重影响中老年人运动功能。线粒体功能障碍、氧化应激、神经兴奋性改变、神经炎性反应和蛋白异常聚集等多种因素推动着PD的发生与发展。其中,神经炎性反应已经逐渐成为研究热点。小胶质细胞是存在于中枢神经系统中自身免疫调节细胞,占整个胶质细胞总数的20%,对维持神经元的生存起着重要作用。抑制小胶质细胞的过度激活及炎症反应从而减弱神经元变性是一种新的治疗方向。RO是一种强烈的神经毒性剂,已被广泛用于制作PD疾病动物和细胞模型。RO可通过加重线粒体损伤,促进氧化应激、凋亡以及活化小胶质细胞等方面造成神经毒性反应[1],而Cur是一种从姜黄的根茎中提取出来的一种脂溶性酚类色素,具有抗炎、抗氧化、抗斑块及清除氧自由基等多种药理反应。前期研究主要集中在Cur对神经元细胞的保护作用,发现它可通过清除细胞内ROS,诱导细胞内蛋白酶体水解酶活性以及过表达热休克蛋白Hsp70等方面拮抗RO诱导的神经元细胞损伤。而本研究主要集中探索Cur能否减弱RO诱导的小胶质细胞激活和细胞损伤。
研究证实小鼠小胶质细胞系BV2细胞与原代小胶质细胞具有相类似的生物学功能,并已经广泛用于体外小胶质细胞模型[2,3]。SH-SY5Y细胞具有多巴胺神经元的诸多特征,被广泛用于体外神经元样细胞模型。本实验在观察Cur是否减弱RO介导的BV2细胞晚期终末糖基化受体/核转录因子-κB(RAGE/NF-κB)反应的基础上,并收集不同组的BV2条件培养液(conditioned media,CM)培养SH-SY5Y细胞,评估姜黄素对于神经细胞活力的影响。
1 材料与方法
1.1 主要试剂与仪器 胎牛血清购自美国Gibco公司;胰蛋白酶、DMEM高糖培养基、磷酸盐缓冲液PBS购自美国HyClone公司;姜黄素、鱼藤酮购自北京鼎国昌盛生物技术公司;兔抗小鼠RAGE、NF-κB单克隆抗体购自美国Sigma公司;HRP标记羊抗兔二抗购自美国Zymed公司;MPO、ICAM、TNF-α、iNOS的ELISA检测试剂盒购于美国R&D公司;二氧化碳培养箱(美国Forma Scientific公司;-80 ℃冰箱(美国Thermo公司);多波长酶标仪(美国Bio-TEK公司)。
1.2 细胞培养 小鼠小胶质细胞BV2细胞株和SH-SY5Y细胞株均购自中国医学科学院基础医学细胞中心。用10%胎牛血清的完全培养基,将细胞置于5%CO2,37 ℃恒温培养箱中孵育,2~3 d后传代。至细胞铺满底部70%~80%时消化处理并接受不同干预处理。SH-SY5Y细胞用含10%胎牛血清的完全培养基,隔天换液一次,并取处于对数生长期的细胞消化处理。
1.3 药物处理和细胞分组 Cur溶解于二甲基亚砜(DMSO)中,并配制成20 mmol/L的储存液,-20 ℃储存,待用时用完全培养基进行稀释成工作液;RO溶解于DMSO,配制成1 mmol/L的储存液,-20 ℃储存,并同样用完全培养基稀释成工作液。分组为:空白对照组:不施加干预因素;RO组:处理浓度为10 nmol/L,作用时间6 h;Cur干预组:预先用RO处理后,加入浓度1、5、10 μmol/L Cur共同孵育4 h。收集各组细胞。每组实验重复3次。CM处理SH-SY5Y细胞:收集上述各培养组的上清液,作为SH-SY5Y细胞的CM。每次实验前需重新更换SH-SY5Y细胞的培养基,将CM加入SH-SY5Y细胞继续培养,24 h后收集细胞观察其存活率。
1.4 Western blot检测各组细胞RAGE/NF-κB表达 收集各组细胞并用裂解液于冰上收集总蛋白,BCA蛋白浓度试剂盒测定蛋白浓度后调整每孔浓度为50 μg。上样缓冲液按相应比例与总蛋白液混匀后100 ℃,5 min煮沸变性。先后按照80 V 40 min和120 V 90 min的条件进行SDS-PAGE凝胶电泳和PVDF转膜。封闭洗脱后,兔抗RAGE抗体1∶1000,兔抗NF-κB抗体1∶2000,兔多克隆GAPDH 抗体1∶1000 4 ℃孵育过夜,洗膜后二抗(稀释比例1∶5000)室温下孵育2 h。洗膜后在暗室进行ECL显影,用图像分析软件Quantity One分析条带的目的蛋白和内参蛋白的积分光密度值。
1.5 ELISA法测定上清液炎症反应性介质含量 收集各组上清液200 μl,按照细胞间粘附分子-1 (ICAM)、肿瘤坏死因子-α(TNF-α)和诱导型一氧化氮合酶(iNOS)的ELISA检测试剂盒说明书处理。空白孔调零后测定450 nm波长处各孔的吸光度,并绘制标准曲线。根据样品孔中的吸光光度值计算出相应的细胞因子的含量。
1.6 MTT比色法检测细胞活力 取对数生长期的细胞,胰酶消化后离心,并用培养基重悬细胞沉淀,反复吹打制成单个细胞悬液,计数后将细胞浓度调整为1×108~1×109/L,按1×104~1×105个/孔(90 μl/孔)接种于96孔培养基,每组设置6个复孔。调零孔中只加入同体积的培养基,并不接种细胞。向每孔中加入10 μl MTT (5 mg/ml),37 ℃继续孵育4 h,加入100 μl DMSO,震荡10 min至甲臜颗粒完全溶解,酶标仪570 nm波长处测定各孔OD值。
2 结 果
2.1 Cur对BV2细胞活力的影响 首先检测各组细胞在不同浓度Cur干预下的活力的变化以研究它对BV2细胞的毒性作用。结果显示不同浓度Cur(0~10 μmol/L)干预后并未对细胞活力造成影响,各组间并无显著性差异(见图1)。
2.2 Cur对RO刺激的BV2细胞的RAGE/NF-κB表达 采用Western blot分析BV2细胞中RAGE/NF-κB 的表达情况。与空白对照组相比,RO组RAGE和NF-κB的蛋白表达水平明显升高(P<0.01);与RO组相比,Cur干预组(1、5、10 μmol/L)能够明显降低细胞内RAGE和NF-κB的含量(P<0.05)。其中,对于NF-κB的抑制作用是随着Cur浓度升高而更加显著。具体的灰度值数据(见表1),条带图(见图2)。
2.3 Cur对RO刺激的BV2细胞分泌ICAM、TNF-α和iNOS的影响 细胞经过RO(10 nmol/L)及Cur(1、5、10 μmol/L)处理后,收集各培养组上清液进行ELISA检测各个细胞因子。结果发现,与空白对照组相比,RO组ICAM、TNF-α和iNOS的表达明显升高,ICAM、TNF-α和iNOS分别是其的3.13倍、20倍和4倍。与RO组相比,Cur干预组能明显减弱ICAM、TNF-α和iNOS的分泌量,且抑制效应随着Cur浓度的增加更加增强。具体的数据(见表2)。
2.4 CM对SH-SY5Y细胞增殖活力的影响 收集BV2细胞各处理组的上清液,作为SH-SY5Y细胞的CM。作用24 h测定细胞活力。结果提示,与空白对照组相比,RO组细胞活力显著降低(P<0.01);与鱼藤组相比,Cur处理组细胞活力明显升高,且随着Cur剂量的升高细胞活力呈明显升高趋势(P<0.05)。具体数据(见图3)。
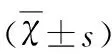
表1 Cur对RO刺激的BV2细胞RAGE/NF-κB蛋白表达的影响
与空白对照组相比#P<0.01;与RO组相比*P<0.05,**P<0.01

表2 Cur对RO刺激BV2细胞ICAM、TNF-α和iNOS的影响
与空白对照组相比#P<0.01;与RO组相比*P<0.05,**P<0.01

图1 MTT法检测不同浓度Cur对BV2细胞活力的影响
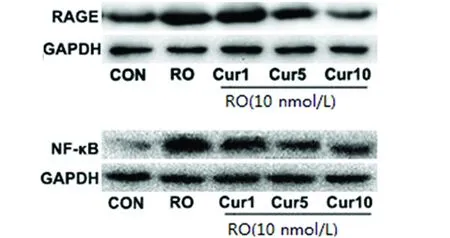
Cur1:1.0 μmol/L Cur干预组;Cur5:5 μmol/LCur干预组;Cur10:10 μmol/L Cur干预组。与空白对照组相比#P<0.01;与RO组相比*P<0.05,**P<0.01
图2 RAGE/NF-κB的蛋白条带图

与空白对照组相比#P<0.01;与RO组相比*P<0.05,**P<0.01
图3 MTT法检测不同处理组CM对SH-SY5Y细胞活力的影响
3 讨 论
作为一种神经变性疾病,PD以中脑黑质多巴胺能神经元丢失为特征,炎症反应是神经系统变性疾病的重要特征。其中,小胶质细胞在调节中枢系统免疫反应中起着重要作用。PD患者病理尸检中就发现神经元周围聚集的大量活化的小胶质细胞[4],而对原发性和家族性PD患者的脑组织切片病理也发现大量反应性小胶质细胞[5]。它在静息状态下起着免疫监视作用;适度活化后,通过吞噬病原体,有害颗粒以及死亡神经细胞并分泌神经营养因子和基质分子等功能来修复受损神经元;但持续活化会释放一系列潜在的神经毒性分子和炎症介质如:NO、O2-、IL-1β和TNF-α,加重细胞毒性反应导致继发性脑组织损伤[6,7]。
RAGE受体广泛表达于多种细胞,其中包括神经元细胞,并能感知包括晚期糖基化产物(AGEs)在内的多种信号分子。实际上,大多数RAGE的配体都参与免疫炎症和细胞迁移过程,而在炎症反应中RAGE的表达也是上调的。但异常过度的RAGE表达和活化会导致细胞产生过强的免疫反应,这种病理过程参与了人类很多疾病的发生与发展,如:缺血性损伤、阿尔兹海默病等。因此,阻断RAGE相关信号通路具有极大的治疗潜力。越来越多的证据表明,PD患者脑内路易斯小体中存在积聚的AGEs是导致患者呈现亚临床状态的主要原因。
多项研究表明RAGE的内源性信号通路控制着与很多疾病相关的病理生理过程。已证明作为核转录因子的NF-κB是第一个发现由AGEs活化并产生的信号转导分子,而且NF-κB锚定在细胞核上可以进一步正反馈升高RAGE mRNA的转录[8]。作为一种炎症反应过程中关键的转录调节因子,NF-κB刺激多种炎症介质的释放,例如:环加氧化酶-2(COX-2)、TNF-α、白介素-6/1β(IL-6、IL-1β)[9]等。此外,由iNOS介导生成的NO和由此形成的ROS也被RAGE/NF-κB操控[10]。体外实验表明RO能增加大鼠NF-κB的表达[11],类似的RO能通过降解小胶质细胞中抑制蛋白κB(IκB)来活化NF-κB[12]。
前期研究已经表明0~20 nmol/L的RO并未影响BV2细胞的活力,因此本实验将RO浓度设定为10 nmol/L,即在不影响细胞活力的前提下探索RO对小胶质细胞的炎性反应及Cur的保护作用。首先我们的研究涉及探索设定的Cur浓度范围(1~10 μmol/L)是否对BV2细胞造成毒性,MTT结果显示,在此浓度范围内BV2细胞活力并未受到影响。于是,我们采用Western blot分析BV2细胞内RAGE/NF-κB表达,发现RO能明显升高细胞体内RAGE和NF-κB的蛋白表达,但是这种升高作用能被Cur所减弱,且随着浓度的升高这种减弱作用也逐渐增强。紧接着,我们开始检测NF-κB下游的各种炎症因子的变化。同样的,这些炎症介质在RO的刺激下过量表达,但Cur也能抑制这些下游信号分子的分泌,并且也呈现浓度依赖性。PD疾病模型中过强且紊乱的炎症反应会导致神经元细胞的损伤,如果Cur能在一定程度上清除RO介导的炎症介质,那收集BV2细胞的上清液作为CM培养神经细胞,观察是否Cur降低炎症介质后同样会减弱RO所致的细胞损伤 。MTT结果显示,Cur同样能在一定程度上扭转RO介导的神经元损伤并增强细胞活力。RAGE活化刺激下游信号分子MAPK瀑布增强炎症反应的主要转录调节因子NF-κB的表达[13],从而加重RO介导的中枢神经元损伤。此外,Hernandez-Romero[14]的研究证实,NF-κB和下游信号分子TNF-α,ICAM和iNOS能在RO刺激下明显升高,这进一步验证我们的研究。
总之,本研究证实Cur可通过抑制RAGE/NF-κB和下游炎症反应发挥对多巴胺能神经细胞的保护效应。
[1]韩 威,孙立忠,胡林森.鱼藤酮与帕金森病[J].中国老年学杂志,2011,31(12):2376-2378.
[2]Song JH,Marszalec W,Kai L,et al.Antidepressants inhibit proton currents and tumor necrosis factor-α production in BV2 microglial cells[J].Brain Research,2012,1435(1435):15-23.
[3]Jin M,Kim B W,Koppula S,et al.Molecular effects of activated BV-2 microglia by mitochondrial toxin 1-methyl-4-phenylpyridinium[J].Neurotoxicology,2012,33(2):147-155.
[4]Mcgeer PL,Itagaki S,Tago H,et al.Reactive microglia in patients with senile dementia of the Alzheimer type are positive for the histocompatibility glycoprotein HLA-DR[J].Neuroscience Letters,1987,79(1/2):195.
[5]Chen X,Zhang N,Li C,et al.Parallel relationship between microglial activation and substantial nigra damage in rotenone-induced Parkinson's disease rat model[J].Neural Regen Res,2010,5(4):245-250.
[6]Heales SJR,Lam AAJ,Duncan AJ,et al.Neurodegeneration or neuroprotection:the pivotal role of astrocytes[J].Neurochemical Research,2004,29(3):513.
[7]Davalos D,Grutzendler J,Yang G,et al.ATP mediates rapid microglial response to local brain injury in vivo[J].Nature Neuroscience,2005,8(6):752.
[8]Li J,Schmidt AM.Characterization and functional analysis of the promoter of RAGE,the receptor for advanced glycation end products[J].Journal of Biological Chemistry,1997,272(26):16498-506.
[9]Wegener E,Krappmann D.Dynamic protein complexes regulate NF-κB signaling[M]//Protein-protein interactions as new drug targets.Springer berlin heidelberg,2008.237-259.
[10]Vallance P,Leiper J.Blocking NO synthesis:how,where and why[J].Nature Reviews Drug Discovery,2002,1(12):939.
[11]Thakur P,Nehru B.Inhibition of neuroinflammation and mitochondrial dysfunctions by carbenoxolone in the rotenone model of Parkinson’s disease[J].Molecular Neurobiology,2015,51(1):209-219.
[12]Wilms H,Zecca L,Rosenstiel P,et al.Inflammation in Parkinson's diseases and other neurodegenerative diseases:cause and therapeutic implications[J].Current Pharmaceutical Design,2007,13(18):1925-1928.
[13]Lander HM,Tauras JM,Ogiste JS,et al.Activation of the receptor for advanced glycation end products triggers a p21(ras)-dependent mitogen-activated protein kinase pathway regulated by oxidant stress[J].Journal of Biological Chemistry,1997,272(28):17810.
[14]Hernandez-Romero MC,Delgado-Cortes MJ,Sarmiento M,et al.Peripheral inflammation increases the deleterious effect of CNS inflammation on the nigrostriatal dopaminergic system[J].Neurotoxicology,2012,33(3):347-360.
