不同培养方式对大鼠原代神经干细胞自噬的影响
2018-01-18王梦影黄国伟董志萍张绪梅
王梦影, 黄国伟, 程 曼, 董志萍, 张绪梅
自噬(autophagy)是一种通过隔离膜包裹细胞质和细胞器来形成自噬体,再与溶酶体、微管系统等融合形成自噬溶酶体来降解包裹物质的一种高度保守的细胞降解途径[1]。因其与多种生理病理过程相关联,现已成为生命科学领域的热点之一。自噬是一个自我消化的过程,在能量调控和营养物质刺激的反应调控扮演重要角色[2]。一般正常生理条件下,自噬维持基础水平,在营养缺乏、氧化应激、缺氧等状况下,自噬水平会提高[3]。神经干细胞(neural stem cells,NSCs)是指一类具有自我更新能力和高增殖、多分化潜能,可分化为神经元、胶质细胞的细胞群[4]。目前NSCs的体外培养方法主要有细胞球悬浮法(悬浮培养)和单层贴壁培养法(贴壁培养),以悬浮培养最为常见,其操作简单且可获得大量NSCs,但却存在一定缺陷,如细胞球内部的细胞会因接触不到营养因子而死亡。而单层贴壁培养大大增加了细胞的暴露面积,有利于神经干细胞充分获取细胞因子刺激长期稳定增殖[5],但却存在易导致NSCs分化的缺陷。国内外已有文献报道神经干细胞体外培养存在自噬现象[6]。但大多是对NSCs单一培养方式的自噬观察,而对进行不同培养方式之间自噬水平的对比研究鲜有报道。本实验拟采用悬浮培养和贴壁培养来检测NSCs体外培养过程中自噬的发生情况,并比较两组自噬相关蛋白LC3Ⅱ/LC3Ⅰ、Beclin-1的表达水平,同时,希望能在培养方式的选择上提供进一步的实验依据。
1 材料与方法
1.1 实验动物 出生24 h内的SD大鼠,由中国医学科学院放射医学研究所实验动物中心提供。
1.2 药品与试剂 DMEM/F-12(1∶1)培养基(康宁公司,货号:10-092-CVR),B27(GIBCO公司,货号:17504-044),碱性成纤维生长因子和表皮生长因子(PEPROTECH公司,货号:106096-93-9、102400-25-20),鼠抗大鼠巢蛋白抗体(Nestin)(Abcam公司,货号:ab6142),兔抗大鼠Beclin-1和兔抗大鼠LC3B抗体(CST公司,货号:#3495、#3868),山羊抗鼠H&L IgG(Abcam公司,货号:ab150115),辣根过氧化物酶标记的山羊抗兔(CST公司,货号:#7074),40×柠檬酸钠-依地酸(乙二胺四乙酸, ethylene diamine tetraacetic acid,EDTA)抗原修复液及抗荧光淬灭封片剂(碧云天生物),即用型山羊血清和二喹啉甲酸(bicinchoninic acid,BCA) 蛋白定量试剂盒(博士德生物),其他常用试剂均为国产分析纯。
1.3 NSCs原代培养
1.3.1 细胞球悬浮培养 新生24 h以内的SD大鼠,无菌条件下取SD大鼠海马与纹状体组织,放入预冷的磷酸盐缓冲液(phosphate buffer saline,PBS),再用培养液洗两次替换PBS,将组织块剪溶成约1 mm3的小块,用1000 ml枪头吹打数次,获得细胞悬液,过细胞筛(0.76 μm)。将细胞悬液离心800 r/min×5 min,去除上清液,加入培养基(DMDM/F12、EGF20 ng/ml、 bFGF10 ng/ml、L-谷氨酰胺2 mol/L、2%B27、青霉素和链霉素100 U/ml、叶酸10 μmol/L),吹打混匀,以台盼蓝法进行细胞计数,按 1~2×106个/ml 接种于培养瓶。置 37 ℃、5% CO2孵育箱中培养,3 d后神经球形成。
1.3.2 单层贴壁培养 单层贴壁培养的SD大鼠的分离方法同悬浮培养分离方法,其不同是需提前4 h用0.01 g/L多聚鸟氨酸和2 g/L明胶包被25 cm2的培养瓶,以2×106个/ml接种,隔天换液一次,显微镜下观察及拍照。
1.4 NSCs的鉴定 悬浮培养的神经球机械吹打后,以1~2×106个/ ml接种在包被laminin的圆玻片上,单层贴壁培养的细胞经0.125%胰酶消化后计数,以1~2×106个/ml接种在laminin包被的圆玻片上,放入24孔板,加入无血清培养基继续培养12 h后进行免疫荧光染色。4%多聚甲醛固定,PBS洗3次,山羊血清室温封闭1 h,加入一抗Nestin(1∶100)4 ℃过夜,分别加二抗(1∶200),室温孵育1 h,滴加DAPI覆盖过玻片后,避光静置10 min,0.01 mol/L的PBS洗一次,抗荧光淬灭剂封片,荧光倒置显微镜下观察及拍照。
1.5 电镜切片制备与观察 取原代培养5 d的NSCs,置于1.5 ml离心管中1000 r/min,离心5 min后弃上清,加入2.5%戊二醛4 ℃固定过夜。再用1%锇酸固定1 h。PBS漂洗两次后,常规梯度乙醇及100%丙酮逐级脱水。环氧树脂浸透、包埋。超薄切片后经铅铀双染,在透射电子显微镜(HT-7700;Hitachi)下观察并拍照。
1.6 Western blotting 将原代培养5 d的NSCs中加入RIPA裂解液置于冰盒上进行裂解,4 ℃高速离心机去除细胞碎片,并用BCA蛋白检测试剂盒检测总蛋白浓度。用上样缓冲液调整每组样品浓度,使各组样品浓度保持一致,煮沸10 min。配制15%的分离胶和5%的浓缩胶,加样10 μg每孔。在140 V条件下,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)100 min后,从胶上转移到PVDF膜上,转膜后的PVDF膜用5%的脱脂奶粉室温封闭120 min,分别加入一抗LC3B(1∶1000),Beclin1(1∶800),β-actin(1∶2000),4 ℃孵育14 h,TBST漂洗后加入辣根过氧化物酶标记的二抗(1∶2000),室温孵育1 h,TBST充分漂洗后显影,拍照保存图片,蛋白条带用Image J 2.0软件进行定量分析。

2 结 果
2.1 显微镜下大鼠原代NSCs形态学特征及鉴定 原代培养开始阶段,悬浮培养的细胞多成单个或十几个细胞聚集成球,为具有良好折光性的圆形小球,随培养天数的增加细胞球的直径逐渐增大,中心部细胞因营养不良而呈棕褐色(见图1A)。贴壁培养的细胞呈单层生长无坏死棕褐色存在(见图1B),形态多成两极或三极,随着培养天数的增多及时添加新的培养液细胞数量明显增多。悬浮培养原代神经干细胞标记物Nestin免疫荧光染色结果(见图2A),DAPI染核(见图2B),细胞阳性率(呈红色)约为95%(见图2C)。贴壁培养培养原代神经干细胞标记物Nestin免疫荧光染色结果(见图2D),DAPI染核(见图2E),细胞阳性率接近100%(见图2F)。
2.2 透射电镜下两组NSCs中自噬小体的观察比较 单层贴壁培养的神经干细胞核膜清晰完整,染色质呈细颗粒状,线粒体脊发达,粗面内质网散在分布,可见大量游离核糖体(见图3A)。细胞球悬浮培养的神经干细胞,染色质呈团块状分布在核膜周围,线粒体肿胀,脊断裂,球形线粒体较多,游离核糖体减少明显,可见由双层膜或多层膜结构(即自噬小体),包裹的吞噬物为降解的细胞质或细胞器,或与溶酶体融合形成自噬溶酶体(见图3B)。
2.3 Western blotting检测两组NSCs中LC3Ⅱ、Beclin-1蛋白表达变化 LC3、Beclin-1分别作为酵母菌(Atg7/Atg8、Atg6)在哺乳动物的同源物,参与自噬体的形成。且在自噬体形成时LC3Ⅰ与磷酸酰乙醇胺共轭转化为LC3Ⅱ,因此常用LC3Ⅱ/LC3Ⅰ比值、Beclin-1作为自噬标记物。LC3蛋白结果显示,与贴壁培养相比,悬浮培养LC3的蛋白表达量显著增多(见图4A),且LC3Ⅱ/LC3Ⅰ比值差异具有统计学意义(P<0.05,见图4B)。Beclin-1蛋白结果显示,与贴壁培养相比,悬浮培养Beclin-1的蛋白表达量显著增多(见图4C),且差异具有统计学意义(P<0.05,见图4D)。
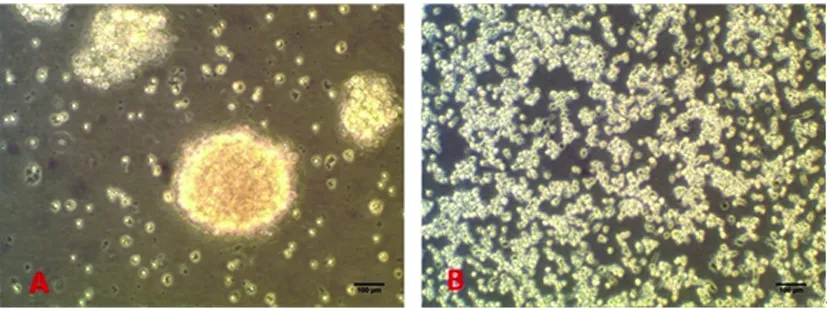
A:悬浮培养;B:贴壁培养;标尺=100 μm

红色:Nestin;蓝色:DAPI;蓝粉色:DAPI与Nestin共标;A~C:悬浮培养;D~F:贴壁培养;标尺=50 μm
图2 大鼠原代NSCs的Nestin鉴定

→自噬小体;▲自噬溶酶体;A:贴壁培养;B:悬浮培养;标尺=1 μm
图3 透射电镜下两组自噬小体的比较

a:LC3Ⅱ的蛋白表达; B:LC3Ⅱ/LC3Ⅰ的统计分析; C:Beclin-1的蛋白表达; D:Beclin-1的统计分析(与贴壁培养比较*P<0.05,**P<0.05,n=3)
图4 Western blotting检测LC3Ⅱ、Beclin-1蛋白在两组NSCs中的表达
3 讨 论
自20世纪90年代初,Reynolds等在胚胎鼠脑组织和成年鼠分离出了NSCs,经过二十几年的探索,使体外培养NSCs移植入机体,恢复受损的神经功能有望成为治疗神经系统疾病的新方法。现已有较为成熟的悬浮培养大鼠海马原代NSCs的方法,近来又发现贴壁培养神经干细胞的方法有着悬浮培养不可替代的优点[7,8]。本实验采用悬浮培养和贴壁培养两种方法,通过悬浮细胞球直径的变大,贴壁细胞密度的增加均可以说明神经干细胞的增殖特性,与此同时,所培养的细胞均表达神经干细胞的特异性标记物Nestin(即神经上皮干细胞样蛋白,是一种第Ⅵ类中间丝蛋白),代表我们分离得到的是具有自我更新能力的神经干细胞。
自噬是一种程序化降解自身大分子物质及受损细胞器的过程,其对细胞内环境的稳定、机体的生长发育、对外界环境的刺激应答等具有重要作用。有研究表明,NSCs在缺氧、营养匮乏和炎性反应等应激条件下,NSCs微环境将产生活性氧簇、活性氮等,从而产生氧化应激损伤,导致细胞器,如内质网和线粒体功能损伤[9]。也有研究显示,自噬在及时清除损伤的细胞器,维持细胞功能正常、细胞结构完整,延缓衰老和死亡等具有重要作用[10]。而自噬作为一种适应性降解途径,可以应答生长因子缺乏、缺氧和营养匮乏等代谢应激,通过分解释放代谢产物,保证其顺利进入三羧酸循环进行能量的供应[9]。由此可见,自噬是一把双刃剑。检测自噬的金标准就是电镜下观察到自噬体的存在,激活自噬的同时,ULK复合物与PI3K(the phosphatidylinositol 3-kinase)复合物形成双层隔膜包裹待吞噬物,形成自噬小体[11]。自噬小体的形成与多种蛋白的表达水平的改变有关,如LC3、Beclin-1、P62蛋白等。LC3作为自噬相关基因受自噬相关基因(autophagy-related gene)家族调控,其为酵母自噬基因(Atg7/Atg8)在哺乳动物的同源物。LC3Ⅰ是自噬体膜上的一种标志物,在自噬形成时,LC3Ⅰ与磷酸酰乙醇胺共轭转化为LC3Ⅱ,且LC3Ⅱ/LC3Ⅰ的比值、LC3Ⅱ均与自噬小体形成程度直接相关,因此常作为自噬形成的标记物。Beclin-1作为酵母菌Atg6的同源物,参与自噬前体和自噬小体的形成过程。本实验应用Western blotting方法检测了LC3Ⅱ、Beclin-1蛋白表达,且在电镜下观察到了悬浮培养组中有自噬小体的存在,且有自噬小体与溶酶体结合降解包裹物,即自噬溶酶体(晚期自噬体)的存在。至此,我们分别在分子水平和超微结构水平验证了悬浮培养与贴壁培养相比,前者的自噬发生水平显著高于后者,推测其可能原因为细胞球内部与培养基营养成分、氧气接触不良而激活自噬,本实验已证实与贴壁培养相比,悬浮培养的细胞可提高LC3Ⅱ、Beclin-1蛋白表达,激活细胞内自噬,但悬浮细胞球内是如何调控LC3Ⅱ、Beclin-1蛋白表达差异及自噬是否处于保护水平仍需进一步研究。
NSCs因为细胞球内存在细胞死亡的现象[12]。同时,悬浮培养不易于NSCs的形态学观察和生物特性的分析,如流式细胞仪、电生理等[13]。在进行细胞传代时,为将其分成单个细胞而对其进行机械吹打和胰酶消化等刺激使细胞活力下降。即使如此悬浮培养仍然作为NSCs的主要培养方式,因为此法操作简单,易获得大量NSCs,且同时保持良好的增殖特性。也有部分学者尝试用贴壁培养的方法来获得纯度较高的NSCs,此举解决了NSCs与培养基接触不充分而造成营养物质交换困难的问题,同时贴壁培养的细胞可以细致的观察单个细胞的生物学特性,不容忽视的是贴壁培养存在不易控制的缺陷,容易造成NSCs的贴壁分化[14]。因此本研究希望通过对不同培养方式中自噬的比较,在NSCs培养方式的选择上提供参考。
[1]王海杰,谭玉珍.细胞自噬机制开启疾病治疗新途径 [J].解剖学报,2017,48(1):103-105.
[2]马海龙,刘万林.细胞自噬分子机制研究进展 [J].内蒙古医科大学学报,2015,37(1):87-92.
[3]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313-326.
[4]Lee JM,Bae JS,Jin HK.Intracerebellar transplantation of neural stem cells into mice with neurodegeneration improves neuronal networks with functional synaptic transmission[J].J Vet Med Sci,2010,72(8):999-1009.
[5]陈 凯,康现江,张 平,等.大鼠海马神经干细胞的分离培养与免疫荧光鉴定[J].医学研究与教育,2010,27(2):1-16.
[6]董富兴,张振中,刘亚萍,等.离体培养海马神经干细胞中自噬现象的观察[J].神经解剖学杂志,2016,32(1):56-60.
[7]Walker TL,Kempermann G.One mouse,two cultures:isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice[J].J Vis Exp,2014,84(e51225):1-9.
[8]高 峰,田玉科,安 珂,等.大鼠脑室膜管下区神经干细胞的贴壁培养及其分化特征[J].中国临床康复,2005,9(30):56-57.
[9]焦 倩,杜希恂,谢俊霞,等.自噬在神经干细胞中作用的研究进展[J].生理学报,2016,68(5):649-654.
[10]Wang HJ,Zhang D,Tan YZ,et al.Autophagy in endothelial progenitor cells is cytoprotective in hypoxic conditions[J].Am J Physiol Cell Physiol,2013,304(7):C617-626.
[11]Yang Z,Klionsky DJ.Mammalian autophagy:core molecular machinery and signaling regulation[J].Curr Opin Cell Biol,2010,22(2):124-131.
[12]贺菊芳,余资江,朱晓瓞,等.SD大鼠胚胎神经干细胞悬浮培养与鉴定[J].贵州医科大学学报,2016,10(41):1128-1132.
[13]李 梅,王湘臻,徐铁军.海马神经干细胞不同传代方法的比较[J].中国组织工程研究与临床康复,2011,6(15):985-989.
[14]郝军荣,张 丽,秦正红.神经干细胞球和单层贴壁神经干细胞的培养及鉴定[J].神经药理学报,2011,1(1):51-55.
