注射用水温度对腺苷钴胺中维生素B12含量的影响探析
2018-01-16査文勇
査文勇
(上海上药第一生化药业有限公司,上海200240)
0 引言
长期以来注射用腺苷钴胺中原料腺苷辅酶维生素B12含量的不稳定性一直限制着产品质量的提升,不仅影响生产进度,而且产品的合格率低。因此,解决腺苷钴胺中维生素B12含量不稳定的问题成了首要任务。我们在长期的注射用腺苷钴胺生产与小样试验过程中,逐渐发现了问题的症结所在,并进行了不断的改进研究,通过改良生产工艺,采用避光、控制水温、通入氮气等方法,改善了影响维生素B12含量稳定性的因素,其中水温控制尤为关键。
本文针对腺苷钴胺注射用水的水温控制这个重要因素进行了一系列试验并记录了相关数据,根据试验结果改良了生产工艺,使得产品的合格率及成品率都得到了一定的提高。
1 材料与方法
1.1 材料
1.1.1 处方组成
注射用腺苷钴胺的处方组成如表1所示。
1.1.2 器具
试验用器具包括:不锈钢桶、搅拌棒、不锈钢勺、玻璃棒、不锈钢杯子、剪刀、不锈钢棒、高效液相色谱仪、色谱柱。

表1 处方组成
1.2 方法
1.2.1 配制注射用腺苷钴胺
先取配制总量一半的注射用水于不锈钢桶内,然后称取一定配制量的氯化钠加入上述不锈钢桶内,用玻璃棒搅拌溶解均匀后,精确称取腺苷,加入上述溶液中,用玻璃棒搅拌溶解均匀;再称取一定配制量的腺苷辅酶维生素B12原料,置于塑料容器内,用注射用水溶解后,加入上述溶液中,用玻璃棒搅拌溶解均匀;最后,将一定配制量的甘露醇溶液加入上述溶液中,用注射用水稀释至总量,并用玻璃棒搅拌溶解均匀。取样分析所配制注射用腺苷钴胺的pH值,应控制在5.5~7.0。
1.2.2 分析项目及标准
中间体分析项目及标准如表2所示。
(4)精确度,从重复性、中间精密度、重现性三个层次考察,一般用偏差、标准偏差或相对标准偏差表示;
(5)稳定性考察;
(6)检测限,从样品中检测待测物质的最小浓度或最小量,一般以基质空白所产生的仪器背景信号3倍值的相应量,或者以基质空白产生的背景信号平均值加上3倍的均数标准差为检测限;
(7)定量限,样品中被测物能被定量测定的最低量,其测定结果应具有一定的准确度,常用信噪比法确定定量限。

表2 中间体分析项目及标准
1.2.2.1 腺苷钴胺片中腺苷钴胺含量的HPLC测定方法
建立产品定量分析色谱方法首先需要查阅文献等相关资料,了解产品的物理、化学性质及其预处理方法,确定仪器配置(包括使用的HPLC型号、色谱柱类型、检测器类型、流动相等),再确定初始试验条件,进一步优化试验条件。
在优化试验条件时,一般用相邻峰的分离度作为考察指标之一,分离度R大于1.5作为相邻两组峰已完全分离的标志。
当确定好试验条件后,需要进一步作方法验证,包括:
(1)专属性试验,确定被测组分色谱峰的一致性;
(2)线性关系考察,证明产品在某质量浓度范围内,浓度与峰面积的线性关系良好;
(3)准确度,一般用回收率表示,指用该方法测定的结果与真实值或参考值接近的程度;
刘红莉等在建立腺苷钴胺片腺苷钴胺含量的HPLC测定方法时,提出采用Inertsil的ODS-3色谱柱(250 mm×4.6 mm,5μm),以乙腈-0.05 mol/L磷酸二氢钾溶液(15∶85,用磷酸调节pH值至3.2)为流动相,检测波长260 nm,流速1.0 mL/min。测定结果:腺苷钴胺质量浓度在20~500μg/mL范围内,与峰面积的线性关系良好,得到的回归方程为:A=8.797 36C+4.202 2(r=0.999 9)。结论:HPLC测定法操作简单,测定结果准确,可用于腺苷钴胺片腺苷钴胺的含量和含量均匀度的测定。
1.2.2.2 测定原理
高效液相色谱仪系统由储液器、泵、进样器、色谱柱、检测器、记录仪等几部分组成。储液器中的流动相被高压泵打入系统,样品溶液经进样器进入流动相,被流动相载入色谱柱(固定相)内,由于样品溶液中的各组分在两相中具有不同的分配系数,在两相中作相对运动时,经过反复多次吸附-解吸的分配过程,各组分在移动速度上产生较大的差别,被分离成单个组分依次从柱内流出,通过检测器时,样品浓度被转换成电信号传送到记录仪,数据以图谱形式打印出来。
本试验所用高效液相色谱仪系统由1个LC-10ATvp溶剂输送泵、Rheodyne 7725i手动进样阀、SPD-10Avp紫外-可见检测器、色谱数据工作站和电脑等组成,另外还包括打印机、不间断电源等辅助设备。
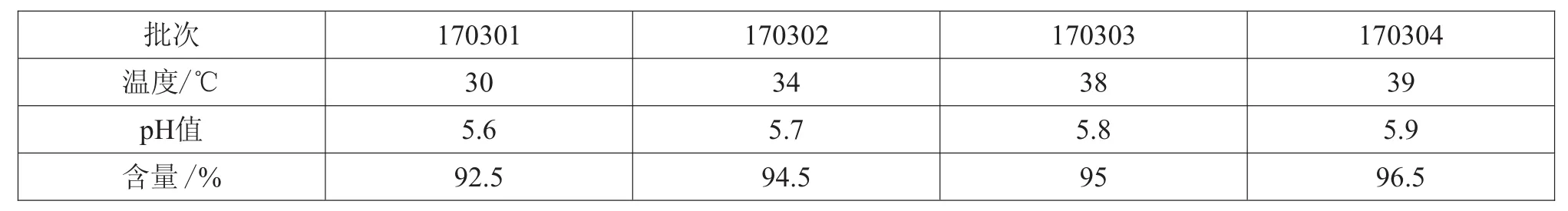
表3 30~39℃水温下维生素B12的pH值及含量
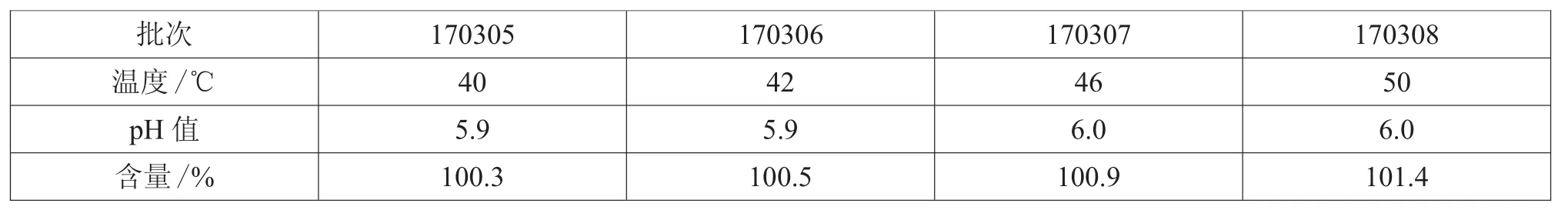
表4 40~50℃水温下维生素B12的pH值及含量
2 试验结果
2.1 不同水温小样试验(规格:0.5 mg/瓶)
现用同一批号的原料辅酶腺苷维生素B12(02140906)进行不同配制水温对腺苷钴胺中维生素B12含量影响的小样试验。
2.1.1 30~39℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇,因为过早加赋形剂会导致水温快速下降,使得大桶中的B12得不到充分溶解。取样测药液中维生素B12的pH值及含量,结果如表3所示。
由表3可知,170301批、170302批的维生素B12含量均不符合工艺要求,观察配液桶中药液发现,配液桶中有少量B12未能充分溶解,沉淀于桶底,继续搅拌仍未能溶解。
2.1.2 40~50℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表4所示。
由表4可知,四批小样中的维生素B12均充分溶解,并且pH值及含量均符合标准。
2.1.3 51~60℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表5所示。
由表5可知,170310批、170311批、170312批的维生素B12含量均低于控制下限,观察药液溶解情况发现,维生素B12并无沉淀,药液已得到充分溶解。
2.1.4 61~70℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表6所示。
由表6可知,四批小样中的维生素B12均彻底溶解,但含量均不符合标准。

表5 51~60℃水温下维生素B12的pH值及含量

表6 61~70℃水温下维生素B12的pH值及含量

表7 30~39℃水温下维生素B12的pH值及含量
2.2 不同水温小样试验(规格:1.5 mg/瓶)
现用同一批号的原料辅酶腺苷维生素B12(02160904)进行不同配制水温对腺苷钴胺中维生素B12含量影响的小样试验。
2.2.1 30~39℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表7所示。
由表7可知,由于水温不高且维生素B12量多,导致B12溶解不充分,桶底有较多的原料未溶解,维生素B12含量均不符合标准。
2.2.2 40~50℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表8所示。
由表8可知,四批小样中的维生素B12均充分溶解,且桶底未见未溶解的维生素B12原料,维生素B12的pH值及含量均符合标准。
2.2.3 51~60℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表9所示。
由表9可知,170810批、170811批、170812批,三批小样中维生素B12的含量均低于控制下限,观察药液溶解情况发现,维生素B12并无沉淀,药液已得到充分溶解。

表8 40~50℃水温下维生素B12的pH值及含量
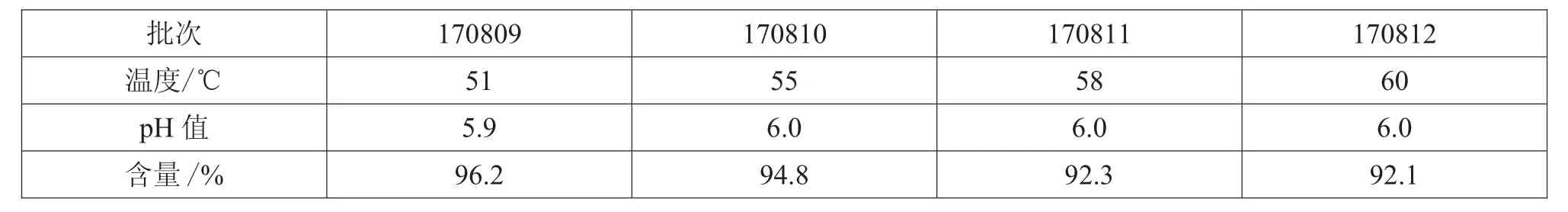
表9 51~60℃水温下维生素B12的pH值及含量

表10 61~70℃水温下维生素B12的pH值及含量
2.2.4 61~70℃水温小样试验
首先,量取一半体积的注射用水至配液桶中,投入辅料氯化钠及腺苷,待其溶解后,避光称取腺苷辅酶维生素B12,放入小勺加入注射用水,用玻璃棒搅拌溶解,由于B12量比较多,一次溶解不彻底,所以待小勺药液沉淀后将上层的已溶解的药液倒入大桶中,小勺继续加入注射用水搅拌溶解,如此重复,直至小勺中的B12充分溶解。最后,倒入赋形剂甘露醇。取样测药液中维生素B12的pH值及含量,结果如表10所示。
由表10可知,四批小样中的维生素B12均彻底溶解,桶底部未见未溶解的原料,但维生素B12的含量均不符合标准。
2.3 小样试验结果
根据以上不同水温、不同规格的小样试验结果,得出结论:在配制注射用腺苷钴胺时,注射用水的温度控制在40~50℃时,注射用腺苷钴胺中的主要原料维生素B12溶解最彻底,用于溶解的不锈钢勺以及配制用的不锈钢桶底部都未见未溶解的维生素B12,并且用该温度配制的药液中维生素B12的含量也均符合工艺要求,在0.5 mg/瓶与1.5 mg/瓶两个规格中都是如此。但是,在其他不同注射用水水温的小样测试中,配制的药液在温度低时,存在维生素B12溶解不彻底的情况,有大量的维生素B12未溶解且粘附于不锈钢桶底部,导致成品率低。而配制的药液在温度高时,虽然维生素B12溶解彻底,但其中间体含量不稳定,达不到标准或仅达到最低限度标准,影响成品率。
3 相关问题讨论
3.1 试验数据分析
根据以上注射用水温度对腺苷钴胺中维生素B12含量的影响试验数据,可以发现:在40~50℃时,两个规格的腺苷钴胺中维生素B12的含量控制都很好,完全符合工艺要求,并且达到了100%以上;在30~39℃时,维生素B12由于水温偏低得不到充分溶解,尤其是在规格为1.5 mg/瓶的腺苷钴胺中,由于维生素B12的量比较多,放在不锈钢勺中由于水温低无法溶解,大量沉积于不锈钢桶底部,最终无法得到充分溶解,使得腺苷钴胺的B12含量不能保证完全控制在工艺范围内;在51~60℃和61~70℃时,注射用水温度偏高,虽然维生素B12得到了充分溶解,但是对维生素B12也造成了一定的破坏,导致含量不稳定。因此,水温控制在40~50℃最为适宜。此外,对药液配制及灌装环境的要求也很严格,全程需避光操作,因为维生素B12不稳定,遇光容易分解。
经过改进,如今腺苷钴胺的B12含量已趋于稳定,这不仅大大提高了生产产量,还提高了产品的合格率、成品率。
3.2 腺苷钴胺的配制问题
3.2.1 配制的特殊性
注射用腺苷钴胺的主要原料为腺苷辅酶维生素B12,它是遇光、遇热极不稳定的维生素品种。在日光下直接照射5 min,可使主药腺苷辅酶维生素B12被完全破坏;在日光灯下直接照射24~48 h,主药含量下降3%~5%。因此,要求在注射用腺苷钴胺的配制过滤、灌封、灯检、印刷包装等过程中及各工序产品放置时必须严密避光,要求用黑布遮盖,尽可能减少与日光灯接触的时间。若长期未生产该品种,则应在再次生产前三批控制好产品中间体含量、pH值(含量控制:90%~110%;pH控制:5.5~7.0),且生产过程中应严格做好避光工作。
维生素B12除在称料、配制、灌装过程中需全程避光操作外,配制的水温、搅拌均匀度等也要严加控制,其中配制药液的水温尤其关键。温度过低,导致维生素B12溶解不彻底,含量不稳定。以往生产过程中,为了能充分、快速溶解维生素B12,常用温度略高的注射用水来溶解B12,经测水温在60℃左右,虽然这个温度的注射用水能迅速溶解维生素B12,但是在一定程度上也破坏了B12,导致成品含量接近下限或者不达标。在配制1.5 mg/瓶规格的注射用腺苷钴胺时,维生素B12的量非常大,导致一次性无法溶解,需多次搅拌并及时将溶解的药液倾倒入大桶中充分溶解;水温稍微低点也会影响其溶解度,导致无法彻底溶解,影响含量。
3.2.2 现场配制注意事项
在配制前,应对注射用水的温度进行严格控制,在放注射用水之前先用温度计测试流动注射用水的温度,使其控制在40~50℃(最好在45℃以上)。然后,将水放在不锈钢桶内用作配制。注射用水的准备时间不宜过早,为了使维生素B12在配制过程中更快溶解,所放的注射用水水温偏高容易蒸发降温,所以只需在配制之前放就可以了。
在溶解维生素B12过程中,先将原料倒在不锈钢勺中,然后加注射用水,为了使维生素B12能充分溶解,注射用水水温可以稍高,但不能超过50℃;再用不锈钢棒按同一个方向搅拌3 min左右;将溶解药液的不锈钢勺沿搅拌棒慢慢倾倒入大不锈钢桶内,继续加注射用水到不锈钢勺中继续溶解未完全溶解的维生素B12,重复多次,直到不锈钢勺中的维生素B12溶解完为止。由于注射用腺苷钴胺有0.5 mg/瓶和1.5 mg/瓶两个规格,在配制1.5 mg/瓶规格时,以上过程应该多重复几次,搅拌时间稍微增加1~2 min,保证维生素B12充分溶解。考虑到辅料中有大量的甘露醇会影响到最后药液的温度,所以最后加注射用水时,注射用水的水温可以稍微高点,但不能超过50℃,使最后的药液温度保持在40~50℃,从而使药品含量保持在规定范围内。
最后,将注射用水加至最终体积后,用不锈钢搅拌棒继续搅拌10 min,使腺苷钴胺中的维生素B12在不锈钢大桶中得到充分溶解,避免B12沉积于不锈钢桶底部,影响药品含量。
除了在药液配制方面需要注意以外,无菌灌装、人员操作等也是需要关注的环节。灌装用瓶子必须为2 mL的棕色管制瓶。在灌装过程中要注意避光操作,应减少照明灯打开的数量、时间,减少灌装时间。药液也需用遮光布盖严实,保证避光到位,确保成品含量。
3.2.3 配制过程中遇到的问题及解决方法
(1)放置注射用水时间过早,水温在40~50℃,但B12含量仍偏低的问题:在溶解维生素B12过程中,适当增加搅拌时间以及溶解次数。如果还是无法彻底溶解,更换溶解用的注射用水。
(2)搅拌时间过长导致体积减少的问题:根据体积的减少程度,如果少于总体积的3%水量,可以补充至所需体积即可。如果体积减少的量大于总体积的3%水量,应根据减少量计算需补充的辅料及水量。
(3)1.5 mg/瓶规格的注射用腺苷钴胺中维生素B12无法一次性溶解的问题:适当提高用于溶解的注射用水水温,但不能超过50℃,增加溶解次数。
(4)称量原料时间过长导致水温变化的问题:由于一些原因导致称量原料的时间增加,要及时测量水温,确保水温在所需范围内,如果水温过低,应及时更换注射用水,更换时也需注意水温控制。
3.3 维生素B12投料量与水温的控制
由于在配制腺苷钴胺中存在两个规格,在配制0.5 mg/瓶规格的腺苷钴胺时,维生素B12的投料量不是特别多,水温控制在40~50℃对溶解维生素B12不存在任何问题。但是,在配制1.5 mg/瓶规格的腺苷钴胺时,由于维生素B12投料量比较大,导致溶解不是非常彻底,有少量B12粘附于不锈钢勺底部,要多次加水搅拌才能使其充分溶解。是否可以通过提高溶解时的水温来使维生素B12彻底溶解呢?通过试验可以看出,提高水温虽然可以提高维生素B12的溶解度,温度越高,效果越明显,但同时发现最后的含量无法完全达到标准或者只是接近最低标准限度。因此,只能适当提高溶解温度,使水温接近但不能超过最佳温度50℃。
在溶解时要注意不锈钢勺中的维生素B12要充分溶解,如果加水一次不能溶解,可以先将溶解的维生素B12沿搅拌棒慢慢倾倒入大桶中,然后继续加水溶解直至不锈钢勺中的维生素B12全部溶解。
结论:投料量的增加不影响对水温的控制,只需适当提高水温即可,但要注意维生素B12应充分溶解。
3.4 赋形剂的加入顺序是否影响水温对含量的控制
在配制腺苷钴胺时,需要加入大量的赋形剂甘露醇,由于甘露醇是液体且温度接近常温注射用水,大量甘露醇的加入会直接影响水温。如果在配制时先加入甘露醇,水温会适当下降,可以通过加入注射用水来调节大桶内的水温,使其水温控制在40~50℃。然后,再将溶解在不锈钢勺中的维生素B12慢慢倾倒入大桶中,边倾倒边搅拌,防止最后大桶底部有残留未溶解的维生素B12,影响含量。如果先在大桶内加入溶解在不锈钢勺中的维生素B12,边倾倒边搅拌,然后再加入赋形剂甘露醇,这时甘露醇的加入会影响大桶中药液的温度,有可能使少量的维生素B12沉积于大桶底部,不能充分溶解,即使始终用不锈钢棒搅拌,温度的降低仍会影响维生素B12的溶解,最后影响其含量。因此,在配制腺苷钴胺时,赋形剂甘露醇必须在维生素B12之前加入,通过重新加入注射用水将甘露醇加入时降低的温度重新调节到最佳温度,再加入维生素B12就可以使其得到充分溶解。
结论:赋形剂的加入顺序会影响水温对腺苷钴胺中维生素B12的含量,在配制中需要时刻注意,必须按照先加赋形剂再加维生素B12的投料顺序操作。
3.5 其他可能影响腺苷钴胺中维生素B12含量的因素
在配制注射用腺苷钴胺过程中,还有一些影响维生素B12含量的因素,比如光照,本药品属于需避光的药品,特别是其中的主要原料维生素B12,遇光易分解,从而影响在腺苷钴胺中的含量。在配制过程中需要注意减少光对药液的照射时间,尽量避免光对药液的照射。配制完成后,应及时将不锈钢桶盖上,避免灯光直接照射。
在搅拌过程中会有适当的药液被蒸发掉,少量的蒸发不会影响药液的含量,但如果搅拌时间过长,蒸发掉的水分将会影响药品的含量,甚至超出标准范围;搅拌时间过短,则会使维生素B12溶解不彻底或者不充分,从而影响最终的含量。因此,在注射用腺苷钴胺配制过程中,搅拌时间一般控制在10 min左右为宜。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2015.
[2]郑筱萸.化学药品和治疗用生物制品研究指导原则(试行)[M].北京:中国医药科技出版社,2002.
[3]王志良,王芳,尹书芳,等.HPLC法测定注射用腺苷钴胺有关物质[J].中国药事,2006,20(8):492-493.
[4]刘新通.腺苷钴胺的临床应用[J].中国处方药,2004(5):20-21.
[5]陈学军,李振东.腺苷钴胺原料药的稳定性研究[J].黑龙江医药,2011,24(1):82-83.
[6]王志良,冷健,崔红燕.腺苷钴胺的临床应用进展[J].中国药事,2006,20(2):122-125.
[7]崔红燕,刘晔.再看腺苷钴胺[J].中国处方药,2004,23(2):80.
[8]罗丽萍,雷嘉川.腺苷钴胺水溶液的光降解动力学研究[J].中国药师,2010,13(8):1104-1106.
[9]MARSH ENG,DRENNAN C L.Adenosylcobalamindependent isomerases: new insights into structure and mechanism[J].Curr.Opin.Chem.Biol,2001,5:499-505.
