腺苷钴胺的光学稳定性研究
2018-01-12宫晓平崔璐璐杨桂英
宫晓平,崔璐璐,董 琨,杨桂英
(张家口市食品药品检验中心,张家口 075000)
腺苷钴胺即腺苷辅酶维生素B12,化学名为5,6-二甲基苯并咪唑基-5-脱氧腺嘌呤核苷基钴胺,是维生素B12的活性辅酶形式之一,据相关文献报道[1-9],腺苷钴胺对B12缺乏引起的贫血、多发性神经炎、三叉神经痛、肝病、长期萎缩性胃炎和急性视神经炎等疾病均具有较好的疗效;也可与其他药物联合使用[10-12],治疗带状疱疹、膝关节骨关节病及糖尿病周围神经病变等疾病。腺苷钴胺的化学性质不稳定,对光敏感[13-14],对酸、碱、热[15]和氧亦不稳定,易分解产生腺苷、羟钴胺素[16-17]等杂质。腺苷钴胺片剂所用辅料、生产工艺[18-19]及其去除包衣的方法[20]等对实验结果也会产生一定的影响。《中国药典》2015年版二部[21]规定腺苷钴胺的实验条件均在避光条件下进行。本文通过在可见光区波长范围内选取7个波段、5个光照强度,参考相关文献方法[22-23],确定光照射时间为40 min,通过所测含量考察对照品溶液的稳定性[24],对腺苷钴胺的降解率进行研究。
1 仪器与试药
1.1仪器 LC-2010A型高效液相色谱仪(包括二元泵、在线脱气机、PDA二极管阵列检测器等),LC-30A型超高效液相色谱仪串联8060型串联质谱仪(日本岛津公司);YMC-Pack ODS-A色谱柱(250 mm×4.6 mm,5 μm;批号0425067794;十八烷基硅烷键合硅胶,YMC股份有限公司);Shim-pack GISS C18色谱柱(50 mm×2.1 mm,1.9 μm;批号227-30048-01;十八烷基硅烷键合硅胶,岛津技迩(上海)商贸有限公司);CPA225D型精密电子天平(赛多利斯集团);超纯水机(Millipore公司);DTC-15型超声波清洗仪(鼎泰生化科技设备制造有限公司,40 kHz);TES-1334A型数位式照度计(泰仕电子工业股份有限公司);LED光灯(宁波良亮灯饰总厂,6 W,DC 5 V);滤光片(飞宇达光电科技有限公司,8 cm×8 cm)。
1.2试药 腺苷钴胺对照品(批号140658-201302,质量分数:98.3%),腺苷对照品(批号110879-200202),肌苷对照品(批号140669-201104),氰钴胺对照品(维生素B12,批号100248-200802,质量分数:95.7%),均为中国食品药品检定研究院生产;甲钴胺对照品(批号L270P20,质量分数:99.0%,北京百灵威科技有限公司);羟钴胺素乙酸盐(批号5KBZO-BK,质量分数:97.0%,东京化成工业株式会社);乙腈(Fisher Scientific试剂公司,色谱纯);磷酸(天津市科密欧化学试剂有限公司,色谱纯);甲酸(Fisher Scientific试剂公司,液质联用级);磷酸二氢钾(天津市大茂化学试剂厂,分析纯);水由Milli-Q纯化系统制备。
2 方法与结果
2.1色谱条件及溶液制备
2.1.1色谱条件 YMC-Pack ODS-A色谱柱(250 mm×4.6 mm,5 μm;批号0425067794)。以乙腈为流动相A,以0.05 mol·L-1磷酸二氢钾(用磷酸调节pH值至3.2)∶乙腈(90∶10)为流动相B,进行线性梯度洗脱(0~7 min,2%A→9%A;7~14 min,9%A;14~30 min,9%A→2%A)。流速:1.0 mL·min-1;检测波长:260 nm;柱温:35 ℃;进样量:20 μL。
2.1.2波长的选取 在400~700 nm范围内,每隔50 nm选取1个波长,采用400±10,450±10,500±10,550±10,600±10,650±10和700±10 nm的滤光片,对可见光光波进行过滤的方式实现。
2.1.3光照强度的选取 选取50,100,200,300,400和500 lx的光照强度对腺苷钴胺对照品溶液进行光照实验,光照强度用照度计进行测定并确认。
2.1.4对照品溶液的制备 精密称取腺苷钴胺对照品适量,加水制成1 mL含100.030 08 μg的溶液,用0.45 μm的微孔滤膜滤过,取续滤液。避光操作。
2.1.5供试品溶液的制备 取腺苷钴胺对照品溶液,分别在所选定的波长与光照强度条件下照射40 min,用0.45 μm的微孔滤膜滤过,取续滤液。
2.2测定结果 取腺苷钴胺对照品溶液与照射后的供试品溶液,按照2.1.1项下的色谱条件进行测定,记录峰面积。在400 nm的波长处、200 lx的光照强度下照射40 min,色谱图见图1。
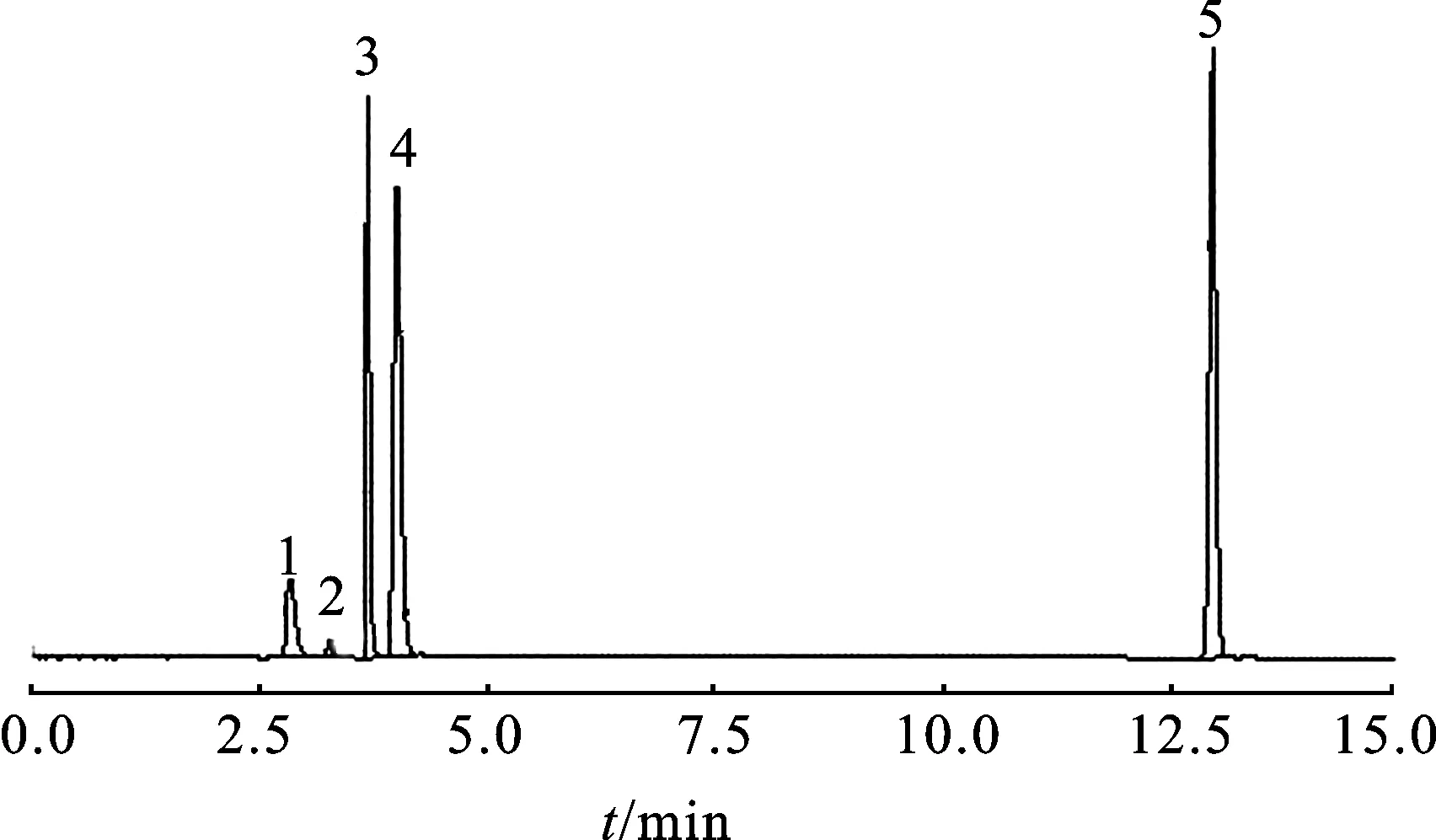
图1样品在400nm波长处、200lx下照射40min的色谱图
1.杂质峰1;2.腺苷;3.腺苷;4.羟钴胺素;5.腺苷钴胺。
Fig.1 Chromatograms of the sample radiated for 40 min under the wavelength of 400 nm and the illumination intensity of 200 lx
1.impurity peak 1;2.adenosine;3.adenosine;4.hydroxocobalamin;5.cobamamide.
由图1可知,腺苷钴胺光降解后出现4个杂质峰,据文献报道,杂质峰1可能为腺苷分子中核糖结合了一个氧原子[16]。经对照品定位及二极管阵列检测器确认,杂质峰2和3与腺苷对照品的保留时间及其紫外光谱图一致,杂质峰4与羟钴胺素对照品的保留时间及其紫外光谱图一致,初步推断腺苷钴胺的主要光降解产物杂质Ⅱ(杂质峰2和3)为腺苷、杂质Ⅲ(杂质峰4)为羟钴胺素,并采用质谱作进一步确认。
根据腺苷钴胺光降解后的峰面积确定腺苷钴胺标准曲线质量浓度范围。精密量取2.1.4项下的腺苷钴胺对照品溶液1.5,5,5,7.5,12.5和20 mL,分别置于100,100,50,25,25和25 mL量瓶中,加水定容,摇匀,用0.45 μm的微孔滤膜滤过,即得腺苷钴胺对照品系列标准溶液。取系列标准溶液各20 μL,按照2.1.1项下的色谱条件进行分析,以对照品溶液的质量浓度 (μg·mL-1)为横坐标x、色谱峰的峰面积为纵坐标y,绘制标准曲线,得回归方程y=26 631x-4 941.4,相关系数r=0.999 7。
由回归方程计算出照射后的各供试品溶液中腺苷钴胺降解后的质量浓度值(μg·mL-1),以光照强度为横坐标x、供试品溶液的质量浓度(μg·mL-1)为纵坐标y绘制不同波长下腺苷钴胺降解后的质量浓度趋势图,见图2。
由图2可知,腺苷钴胺在600 nm的波长处降解率最低,在50 lx的光照强度下降解最少,100 lx的光照强度下降解后的百分含量为96.52%,200 lx的光照强度下降解后的百分含量为93.16%。即在波长600 nm、光照强度50~100 lx的条件下腺苷钴胺降解率最低。
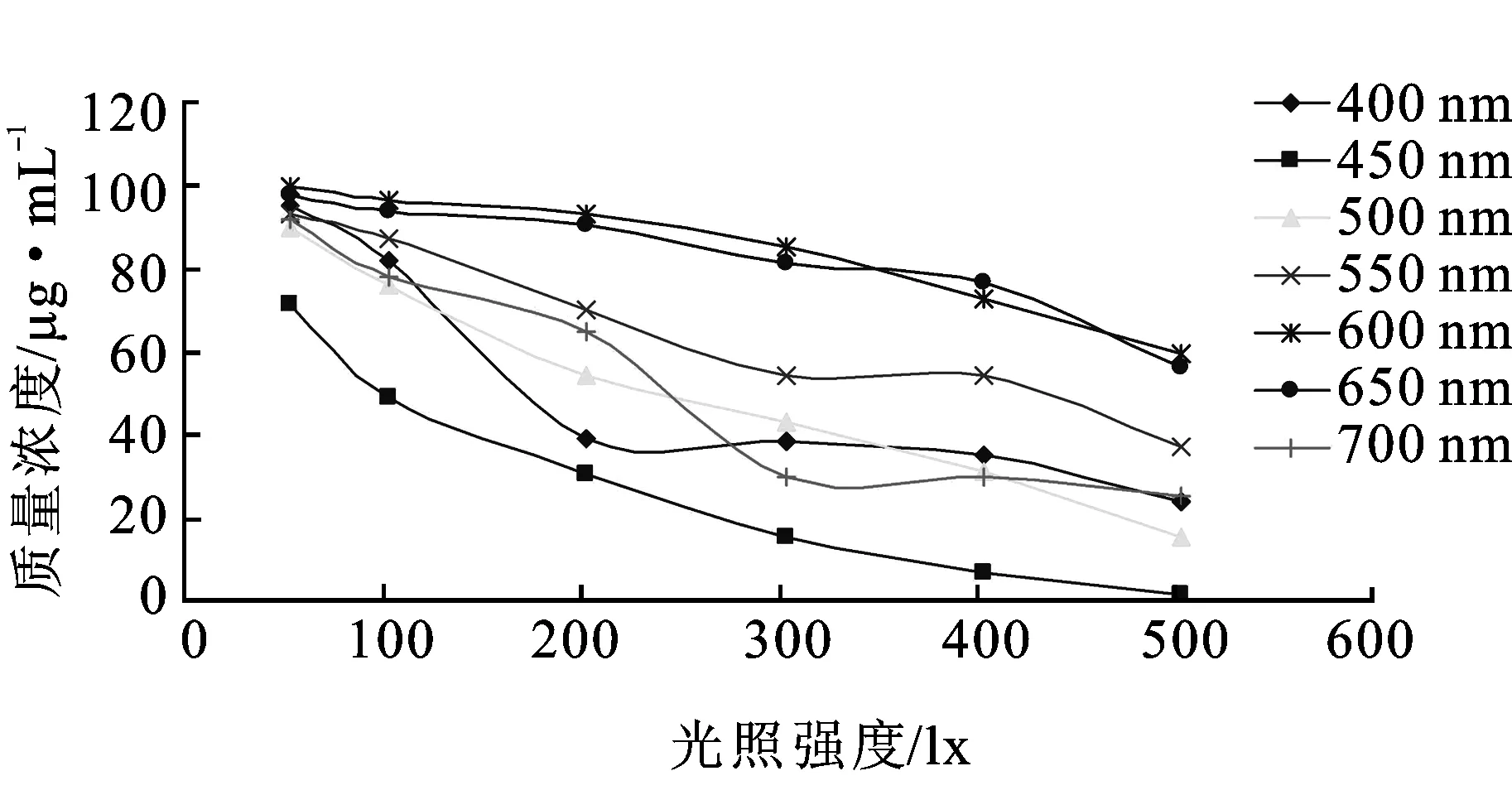
图2不同波长下腺苷钴胺降解后的质量浓度趋势图
Fig.2 Mass concentration trend chart after cobamamide degradation at the different wavelengthes
以本文选取的光照条件(600 nm的波长,50 lx的光照强度)与用传统避光灯在50 lx的光照强度下的避光效果进行比较。选取10,15,20,30和40 min的光照时间,按照2.1.1项下的色谱条件进样分析,由回归方程计算出照射后的各供试品溶液中腺苷钴胺降解后的质量浓度值(μg·mL-1),以照射时间为横坐标x、光照后的供试品溶液的质量浓度(μg·mL-1)为纵坐标y,绘制腺苷钴胺降解后的质量浓度趋势图,见图3。
由图3可知,用避光灯在50 lx下操作,腺苷钴胺降解率均高于在600 nm波长处50 lx光照的降解率。由此可见,以本文选定的实验条件进行避光的效果比用传统避光灯的避光效果更优。
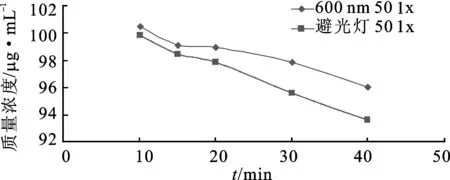
图3选定条件与避光灯条件下腺苷钴胺降解后质量浓度趋势图
Fig.3 Concentration trend chart after cobamamide degradation under the selected condition and avoiding light condition
3 质谱确认
3.1色谱条件 Shim-pack GISS C18色谱柱(50 mm×2.1 mm,1.9 μm;批号227-30048-01)。以0.2 mL·L-1的甲酸水溶液为流动相A,以0.2 mL·L-1的甲酸乙腈溶液为流动相B,进行线性梯度洗脱(0~0.5 min,95% A;0.5~3 min,95% A→5% A;3~4 min,5% A;4~4.1 min,5% A→95% A;4.1~6 min,95% A)。流速:0.3 mL·min-1;柱温:40 ℃;进样量:5 μL。
3.2质谱条件 正离子检测模式;离子源:ESI源;离子源温度:300 ℃;脱溶剂管温度:200 ℃;加热模块温度:400 ℃;雾化气流量:3 L·min-1;加热气流量:15 L·min-1;干燥气流量:5 L·min-1。
3.3对照品溶液的制备 精密称取腺苷钴胺对照品、腺苷对照品和羟钴胺素乙酸盐适量,分别加水制成1 mL含腺苷钴胺10 ng、腺苷10 ng和羟钴胺素1 ng的溶液。避光操作。
3.4供试品溶液的制备 取腺苷钴胺对照品溶液在400 nm波长处,以200 lx的光照强度照射40 min,用0.45 μm的微孔滤膜滤过,取续滤液。
经质谱确认,杂质Ⅱ为腺苷,杂质Ⅲ为羟钴胺素。腺苷钴胺、腺苷和羟钴胺素的LC-MS/MS测定图见图4。

图4腺苷钴胺、腺苷和羟钴胺素的LC-MS/MS色谱图
1.混合对照色谱图;B.样品色谱图;1.腺苷;2.羟钴胺素;3.腺苷钴胺。
Fig.4 LC-MS/MS chromatogram of cobamamide,adenosine and hydroxocobalamin
1.mixed chromatogram;B.sample chromatogram;1.adenosine;2.hydroxocobalamin;3.cobamamide.
4 讨论
4.1腺苷钴胺的光降解产物确认 腺苷钴胺、氰钴氨、甲钴胺及羟钴胺均为维生素B12类物质。经本文验证,腺苷钴胺光降解产物并无氰钴胺及甲钴胺。经质谱确认后,腺苷钴胺的主要光降解产物为腺苷及羟钴胺。
4.2腺苷钴胺避光操作的必要性 腺苷钴胺水溶液对光极为敏感,在日光下(光照强度为1 000 lx)照射10 min,含量剩余20.23%,照射20 min含量剩余4.08%,照射30 min含量仅剩0.73%。因此,腺苷钴胺的相关实验必须严格执行避光操作。
4.3照射时间的选取 《中国药典》2015年版二部中腺苷钴胺片含量测定项下[21]规定:超声20 min,离心15 min;文献[22]中腺苷钴胺片溶出度测定时间为30 min。综上所述,本文选取40 min为光照时间,可有效满足制剂分析的前处理要求。
[1] 王志良,冷健,崔红燕.腺苷钴胺的临床应用进展[J].中国药事,2006,20(2):122-125.
[2] 黄容海,贾哲,蒋力,等.腺苷钴胺治疗肝炎肝硬化贫血84例疗效分析[J].中华实验和临床感染病杂志:电子版,2013,7(4):24-26.
[3] 尚学军,胡卫国,姚福鑫,等.腺苷钴胺的药理及临床作用[J].临床合理用药,2013,6(8):80.
[4] 盖春柳,底煜,徐晓鹤.腺苷钴胺治疗急性视神经炎的临床观察[J].实用药物与临床,2013,16(5):418-419.
[5] 王明远,王成凤,李红燕.腺苷钴胺辅助治疗三叉神经痛60例[J].中国药业,2015,24(17):100-101.
[6] 杨春光.腺苷钴胺治疗多发性神经炎的效果研究[J].中国继续医学教育,2015,7(7):217-218.
[7] 张文,文重远.腺苷钴胺对糖尿病周围神经病变患者血清同型半胱氨酸水平的影响研究[J].湖南师范大学学报:医学版,2016,13(3):52-55.
[8] 倪婷婷,赵德强.腺苷钴胺对大鼠脑缺血的作用及机制[J].广东医学,2016,37(19):2878-2881.
[9] 朱晓,邬晓敏,徐永萍.腺苷钴胺治疗奥沙利铂所致神经毒性的临床观察[J].实用癌症杂志,2014,29(3):355-356.
[10]张晓丹.单磷酸阿糖腺苷联合腺苷钴胺及JUC治疗带状疱疹的疗效观察[J].中国医药指南,2016,14(2):59-60.
[11]张睿,赵英.玻璃酸钠联合腺苷钴胺用于治疗膝关节骨关节病的临床研究[J].中国康复医学杂志,2015,30(8):840-842.
[12]杨静,田应芳,王隽书,等.硫辛酸与腺苷钴胺治疗2型糖尿病周围神经病变的临床效果[J].中国社区医师,2016,32(21):36-37.
[13]封淑华,李力更,王丽萍.腺苷钴胺的光解研究[J].中国药科大学学报,1997,28(3):183-186.
[14]罗丽萍,雷嘉川.腺苷钴胺水溶液的光降解动力学研究[J].中国药师,2010,13(8):1104-1106.
[15]陈学军,李振东.腺苷钴胺原料药的稳定性研究[J].黑龙江医药,2011,24(1):82-83.
[16]杨洪淼,廖海明,任雪,等.腺苷钴胺有关物质分析方法的改进及杂质研究[J].中国生化药物杂志,2015,35(6):157-160.
[17]殷莉莉,廉英,郭妍,等.高效液相色谱法测定腺苷钴胺片中羟钴胺素的含量[J].中南药学,2014,12(7):677-679.
[18]杨桂英,宫晓平,董琨,等.腺苷钴胺片的质量评价[J].中国药房,2014,25(29):2751-2753.
[19]杨桂英,宫晓平,张彦鹏,等.正交设计实验优选腺苷钴胺片处方[J].中国药房,2014,25(37):3502-3504.
[20]王卓,王秀英,黄娜.去除包衣方法对腺苷钴胺片含量的影响[J].煤炭与化工,2014,37(11):48-49.
[21]国家药典委员会.中国药典:2015年版:二部[S].北京:中国医药科技出版社,2015:1484-1485.
[22]杨桂英,董琨,宫晓平,等.腺苷钴胺片溶出度试验方法的建立[J].中国药房,2014,25(25):2376-2378.
[23]佘定平,何英,陈钦榜,等.注射用头孢拉定在25 ℃时的稳定性研究[J].西北药学杂志,2016,31(1):79-82.
[24]朱清丽,谭艳萍,柯红梅,等.HPLC法考察肌苷等4种对照品溶液的稳定性及不确定度分析[J].西北药学杂志,2016,31(6):592-596.
