肺原发性横纹肌肉瘤2例临床病理分析
2018-01-15岳振营
岳振营
横纹肌肉瘤(rhabdomyosarcoma, RMS)是具有骨骼肌分化倾向的原始间叶性恶性肿瘤,WHO(2013)软组织肿瘤分类根据其临床及病理学特点将其分为4个亚型:胚胎性RMS、腺泡状RMS、多形性RMS和梭形细胞/硬化性RMS[1]。肿瘤组织学形态多样,但基本上重演了骨骼肌胚胎发育过程中各个阶段的细胞,其主要由原始小圆形细胞和不同分化程度的横纹肌母细胞以不同比例组成。RMS多发于头颈部、躯干(包括泌尿生殖道)和四肢,也有发生于乳腺、肾脏和胃的相关报道[2-4],而原发于肺的RMS临床极其罕见,国内仅见个案报道[5]。本文现收集2例原发于肺的RMS,对其进行组织学、免疫表型分析并复习相关文献,以提高对该肿瘤的认识。
1 材料与方法
1.1临床资料例1,女性,50岁。因胸闷、咳嗽、咳白色泡沫痰,痰中带少量血丝1个月入院。查体无阳性发现,各实验室检查未见异常。CT示:左肺下叶背段见大小4.0 cm×3.0 cm类圆形软组织肿块,边缘尚光整,轻度分叶,可见短细毛刺,密度不均,肿块背侧胸膜轻度肥厚、凹陷,CT值35 Hu;增强后肿块不均匀强化,CT值50~90 Hu。患者于2001年7月20日入院行手术治疗。例2,女性,24岁,因咳嗽、咯血2天查体发现右肺中叶占位1天,于2017年1月3日入院。体检:胸廓对称,胸式呼吸,双侧呼吸动度相等,呼吸运动正常,语颤正常,双肺叩诊清音,双肺呼吸音清,未闻及干、湿性啰音,无胸膜摩擦音。各项实验室检查未见异常。CT示:胸廓对称,气管纵隔无移位,其内未见明显肿大淋巴结。气管支气管未见明显闭塞。右肺中叶近叶间裂区见一巨大类圆形软组织肿块影,密度不均匀,边界欠清,大小8.8 cm×8.7 cm,CT值约45 Hu,增强扫面后明显不均匀强化,CT值26~82 Hu。余肺野未见明显密度影。双侧胸腔未见积液,心包未见异常。CT诊断右肺中叶软组织肿块,考虑肉瘤可能性大。手术见肿瘤位于右肺中叶肺实质内呈圆形,胸膜皱缩,完整切除右肺上中叶送术中病理诊断为恶性小圆细胞肿瘤,支气管切缘未见明显异常。临床彻底清扫右肺门淋巴结。
1.2方法手术切除标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片及HE染色后,光镜下观察。免疫组化采用EnVision法,抗体选用CKH、CAM5.2、vimentin、desmin、Myoglobin、Myogenin、MyoD1、CD34、CD45、CD99、SMA、H-caldesmon、TFE-3、Fli-1、CR、CEA、CK18、CKL、HMB-45、S-100、MC、Ki-67等染色。一抗和EnVision试剂盒,均购自福州迈新公司。
2 结果
2.1眼观例1左肺下叶切除标本,大小12 cm×9.5 cm×7 cm,表面脏层胸膜光滑,肺表面无皱缩,沿支气管剖开,距支气管切缘1.9 cm处于周围肺内见一肿物,大小5.0 cm×4.8 cm×4.0 cm,肿物切面灰白色,质稍韧,局部可见坏死。例2右肺上叶及中叶切除标本,大小17 cm×15 cm×8.5 cm,表面脏层胸膜光滑,中叶部分区域脏层胸膜呈灰白色,切面于中叶周围肺内见一肿物(图1),大小9.0 cm×8.5 cm×7.0 cm,肿物切面灰白色及棕黄色,质韧,部分区域较细腻,边界不清。
2.2镜检肿瘤与周围肺组织边界不清,呈侵袭性生长(图2)。肿瘤细胞组织学形态多种多样,基本上重演了骨骼肌胚胎发育过程中各个阶段的细胞。分化较为原始的星形细胞和小圆形细胞(胚基间叶细胞)核呈圆形或卵圆形,深染,核分裂象易见,胞质稀少,淡嗜伊红色,与未分化的原始间叶细胞相似,并见较多深嗜伊红色蝌蚪样、网球拍样及大圆形、卵圆形等各种形态的横纹肌母细胞(图3、4)。例2瘤细胞主要呈巢状和片状分布(图5),巢中央瘤细胞因退变和坏死失去黏附性形成腺泡状结构。腺泡之间为纤维血管性分割(图6),部分区域也可见少量散在的胞质嗜伊红色的横纹肌母细胞,位于腺泡腔内的横纹肌母细胞呈圆形或卵圆形,而位于纤维血管间隔的横纹肌母细胞呈带状或梭形。间质内可见散在的核位于胞质周边排列、胞质淡然或弱嗜伊红的多核巨细胞。
2.3免疫表型2例肿瘤细胞均表达vimentin、desmin(图7)、Myogenin(图8)、Myglobin、MyoD1,例1部分肿瘤细胞表达CD99,2例瘤细胞均不表达CKH、CAM5.2、TFE-3、CD45、S-100、HMB-45、H-caldesmon、CR、CD34、CEA、CK18、CKL、Fli-1、SMA、MC,例1的Ki-67增殖指数约60%,例2的Ki-67增殖指数约为65%。
3 讨论
RMS是较为少见的软组织肿瘤之一,WHO(2013)软组织肿瘤分类根据其临床以及病理学特点将其分为4个亚型:胚胎性RMS、腺泡状RMS、多形性RMS和梭形细胞/硬化性RMS[1]。临床可发生于任何年龄,但主要发生于10~25岁青少年,两性均可发生。肿瘤多位于四肢深部软组织,其次为头颈部(包括鼻腔、鼻窦和扁桃体)以及躯干(包括脊柱旁)、会阴、盆腔和腹膜后[6],也有发生于乳腺、肾脏和胃的相关报道[2-4]。发生于胸腔实质脏器的比较罕见,而发生于肺的更为罕见。RMS的临床表现缺乏特异性,其症状及体征因肿瘤原发部位、肿瘤大小、肿瘤压迫及侵犯周围组织和器官的程度不同而各异,主要为肿瘤组织占位、压迫、浸润后引起的症状。位于一些特殊部位者可产生相应的症状,如位于鼻窦者可产生突眼或脑神经受损症状,位于直肠旁会阴者可产生便秘等症状。肿瘤易循淋巴道转移,故可有局部或全身淋巴结转移。临床及影像学检查无特殊性,术前诊断较困难。迅速生长的肺内软组织肿块伴周围组织结构的密集是最常见的放射学表现,该病需组织病理学结合免疫组化明确诊断。组织学显示肿瘤主要由未分化的小圆形及梭形组成,与周围肺组织边界不清,呈浸润性生长。胚胎性RMS典型的形态结构是在疏松黏液背景中见星芒状细胞,细胞密度不定,胞质少,少数细胞胞质粉染或出现带状、蝌蚪样和蜘蛛样横纹肌母细胞。幼稚横纹肌母细胞呈圆形、卵圆形,边界不清,胞质内含有糖原呈透亮空泡,有的瘤细胞较大,胞质丰富。腺泡状RMS是由原始圆形细胞和较小横纹肌母细胞形成的腺泡状结构为特征。瘤细胞被不规则纤维血管间隔分割呈实性巢状或腺泡状,边缘瘤细胞排列密集,中央稀少,呈不规则腔隙,腔内常见漂浮的横纹肌母细胞或退变核固缩细胞,无基膜包饶。间质有时可呈乳头状入腺泡腔内,瘤细胞有时围绕小血管呈放射状或乳头状生长。纤维间质中常有明显胞质红染似肌性分化的细胞,且间质的基质也较红染。肿瘤的部分区域可见带状、梭形、多核巨细胞核偏位,排列成花环状,胞质弱嗜酸性有诊断价值。梭形细胞易见纵纹、偶见横纹,有些腺泡结构不明显。有些区域瘤细胞圆形、细胞密集弥漫呈实性巢状,肿瘤周围区域明显似淋巴瘤。免疫组化特异性对明确诊断有较大帮助,横纹肌特异性标志物如Myogenin、Myglobin,其他肌源性标志如desmin、actin。
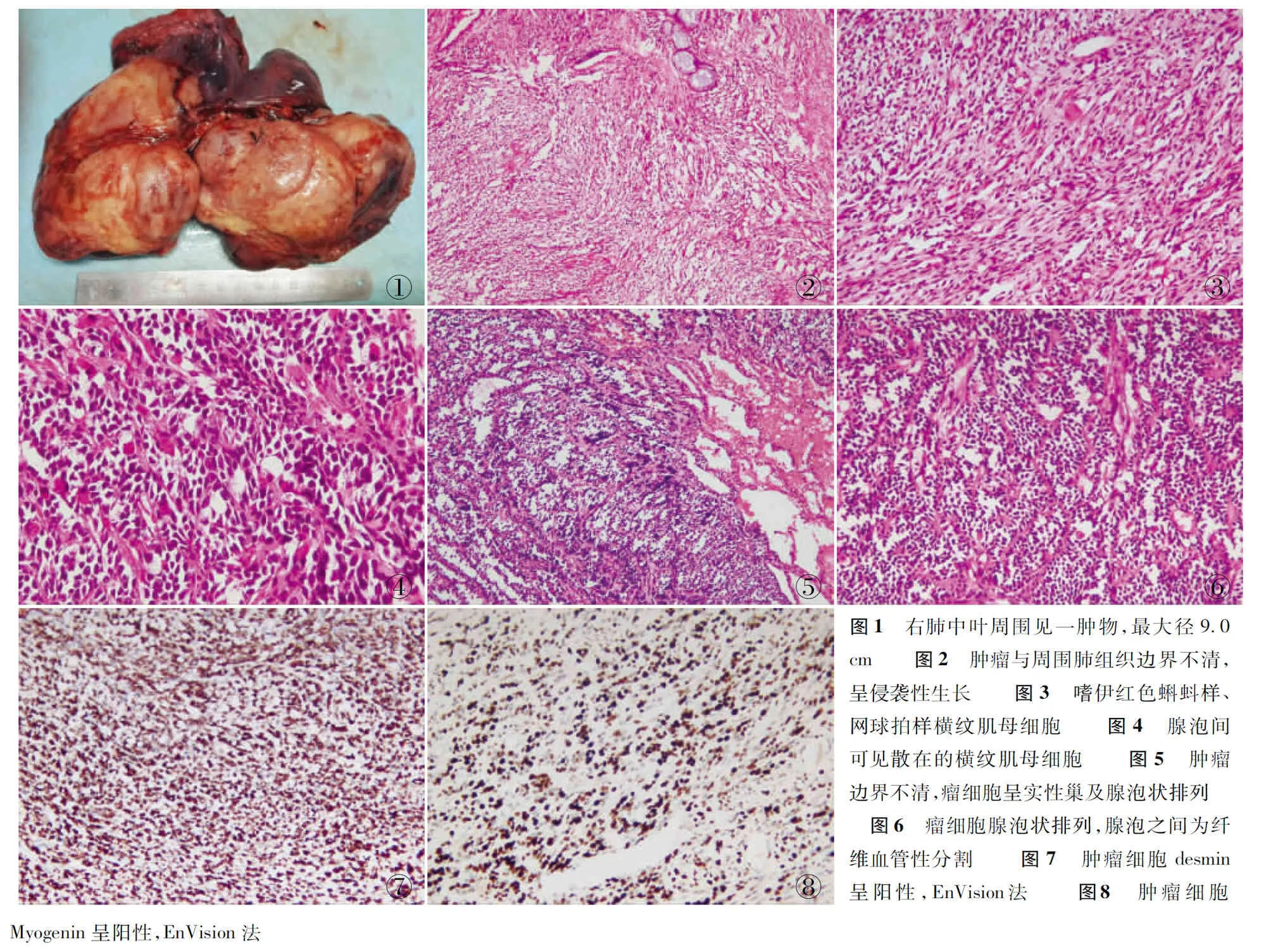
①②③④⑤⑥⑦⑧图1 右肺中叶周围见一肿物,最大径9.0cm 图2 肿瘤与周围肺组织边界不清,呈侵袭性生长 图3 嗜伊红色蝌蚪样、网球拍样横纹肌母细胞 图4 腺泡间可见散在的横纹肌母细胞 图5 肿瘤边界不清,瘤细胞呈实性巢及腺泡状排列 图6 瘤细胞腺泡状排列,腺泡之间为纤维血管性分割 图7 肿瘤细胞desmin呈阳性,EnVision法 图8 肿瘤细胞
鉴别诊断:RMS主要应与以下肿瘤鉴别。(1)转移性RMS:该组病例对患者进行全面体检及影像学等辅助检查,均未发现除肺以外其它软组织及器官的病变。(2)肺分化差的腺癌:一般腺癌结构较规则,腺体周围有基膜,癌内腺腔周围有纤维组织围绕,癌与间质分界较清楚,腺腔上皮排列紧密,游离面较整齐,腔内无游离细胞;无嗜酸性胞质的横纹肌母细胞。免疫组化上皮标记CKH、EMA常阳性,肌源性标记阴性。(3)尤因肉瘤或外周原始神经外胚层肿瘤(primitive neuroectodermaltumor, PNET):主要发生于青少年,组织结构及细胞形态可与RMS相似,特别是一些实体型腺泡状RMS,其腺泡样结构形成不良,细胞呈实性片状分布,极易与尤因肉瘤/PNET混淆,但后者细胞染色质更细腻,肿瘤组织内常可见菊形团结构,免疫组化标记表达CD99以及神经内分泌标志物,不表达desmin、Myogenin和MyoD1。需注意的是少数腺泡状RMS也会出现类似尤因肉瘤/PNET中CD99的核旁点样着色[7]。RT-PCR检测尤因肉瘤或外周PNET常可检测EWS/Fli-1融合性基因。(4)分化差的滑膜肉瘤:肿瘤常有上皮和间叶双向性分化,上皮型瘤细胞和梭形瘤细胞互相移形,瘤细胞胞质染色较淡,且瘤细胞分布较均一,无中央区瘤细胞黏附性差的游离细胞,无胞质嗜酸的横纹肌母细胞。分化差的滑膜肉瘤有时瘤细胞双向分化不显著,但往往具有血管外皮瘤样结构,这有别于腺泡状RMS。滑膜肉瘤免疫组化标记CKH、EMA和vimentin呈双相表达,FISH检测可见特征性SYT基因异位。(5)腺泡状软组织肉瘤:主要发生于青少年,部分患者临床常以肺和脑转移为首发症状。组织学上腺泡形态规则,腺泡间间隔较薄,并为毛细血管包绕;瘤细胞较大、胞质丰富,染色浅;胞质内有呈粉红、大小一致的颗粒,并可见PAS阳性、抗淀粉酶消化的棒状结晶体。电镜显示胞质内特征性长菱形或斜方形结晶小体,为膜状结构的细格子样。免疫组化标记瘤细胞核呈TFE-3阳性。(6)恶性黑色素瘤:以小痣细胞为主的恶性黑色素瘤可排列成腺泡状,易于腺泡状RMS混淆;但免疫组化染色显示瘤细胞表达S-100蛋白和HMB-45,不表达desmin和actin。(7)小细胞癌或未分化癌:多见于中老年患者,瘤细胞常表达上皮性标记如CK(AE1/AE3)和EMA、神经内分泌颗粒(如CgA、Syn和NSE)和CD56,不表达desmin、MSA和Myogenin。其他需与RMS鉴别的肿瘤有肺母细胞瘤和恶性淋巴瘤,结合组织学形态及免疫组化结果不难鉴别。
治疗与预后:RMS是高度恶性的肿瘤,缺乏满意的治疗方案,易出现局部浸润或经淋巴及血行转移,生存率低。可采取手术、化疗和放疗的联合治疗,对肿瘤宜采取广泛性切除,化疗对胚胎性RMS具有一定的疗效。若不治疗,患者多在数月内死亡。同时其预后与发病年龄、肿瘤生长部位、大小、侵犯程度、局部淋巴结有无转移及治疗方案等多种因素有关[8]。目前认为根治性肺叶切除是治疗RMS的首选,但切除范围较肺癌要广泛,力求根治性。对于手术无法完整切除和已有多处转移的患者,应采用手术联合局部放疗和全身化疗的综合治疗模式,能够降低复发率、提高生存率。90%的患者于诊断后4年内因广泛转移而死亡。例1患者术后行6疗程放、化疗,随访8个月出现脑转移死亡。例2患者临床行右肺中上叶切除并广泛清扫周围淋巴结,目前患者正在放、化疗中。
[1] Fletcher C D, Bridge J A, Hogendoorn P C,etal. WHO classification of tumours of soft tissue and bone[M]. Lyon:IARC Press, 2013:130-132.
[2] 岳振营,董艳光,胡营营,等. 乳腺原发性实体型腺泡状横纹肌肉瘤1例[J].临床与实验病理学杂志, 2015,35(3):349-350.
[3] 魏 灿,杨晓亮,席俊华,等. 成人肾脏原发性腺泡型横纹肌肉瘤1例报告并文献复习[J].国际泌尿系统杂志, 2014,34(3):464-466.
[4] 李俊萍,边美玲,董爱华. 胃原发胚胎性横纹肌肉瘤临床诊断学特征及文献复习[J]. 中华诊断学电子杂志, 2016,11(4):245-248.
[5] 田昭俭,杨新国,李新功.肺原发性胚胎型横纹肌肉瘤一例[J]. 临床放射学杂志, 2001,20(10):807.
[6] 韩安家,赖日权.软组织肿瘤病理学[M].北京:科学技术出版社, 2015:207-224.
[7] Huang S H, Wu S Y, Chang K C. Paranuclear dot-like immunostaining of CD99 in rhabdomyosareoma[J]. Histopathology, 2013,62(5):814-816.
[8] Shimizu Y, Kitahara H, Yamaguchi W,etal. Three-dimensional computed tomography combined with hysterosalpingography is useful for both diagnosis and treatment of iatrogenic diverticulum of the uterus[J]. Fertil Steril, 2010,94(3):1084-1085.
