小鼠心肌层注射方法的改进
2018-01-13周学中
王 惠,赵 蓉,周学中
心血管疾病(cardiovascular disease,CVD)严重影响着人类的健康,2013年全球因心血管疾病而死亡的人数达到1 730万,占总死亡人数的31.5%[1].随着社会经济的发展,人们生活方式的变化,心血管疾病患病人数仍在快速增长[2].近年来,随着对心血管疾病致病基因和分子基础的探索,人们已经提出了药物和基因治疗等方法缓解心血管疾病的一些症状[3].由于给药方式的选择为临床治疗和科学研究考虑的主要问题之一[4-5],本研究通过对小鼠进行心肌层注射方法的建立与优化,试图提出一种稳定有效的注射方式.
1 材料与方法
1.1 材料
1.1.1 实验动物
无特定病原体(specif i c pathogen free,SPF)级C57BL/6小鼠,雌雄均可,由常州卡文斯实验动物有限公司提供.操作依照美国国立卫生院(National Institutes of Health)的相关规定.
1.1.2 注射用药物
质量体积分数为1%的Evans Blue(Sigma);带GFP的慢病毒(1×109TU/mL);质量体积分数为1%的戊巴比妥钠.
1.1.3 实验器材
小动物呼吸机、体视显微镜、光源、加热垫、电子天平.
显微外科手术器械:蚊剪、直镊、弯镊、显微尖镊、显微弯镊、高压灭菌锅、4-0手术缝合线、纱布、碘伏棉棒.
胰岛素注射器,由美国BD公司提供;针头规格29 G,透明胶带.
冰冻切片机、OCT包埋剂(optimal cutting temperature compound)、荧光显微镜.
1.2 实验方法
1.2.1 小鼠心肌层注射
手术操作过程如图1所示,具体操作步骤如下.

图1 小鼠心肌层注射的手术过程Fig.1 Surgical procedure of myocardial layer injection in mice
第1步 高压灭菌手术器械,准备手术区域,手术区域用75%的酒精擦拭消毒.
第2步 设置热毯温度恒定为34°C,且在手术期间保持小鼠正常的体温.设置呼吸机频率120次/min,潮气量2.0,确定小动物能够呼吸顺畅.
第3步 对实验小鼠进行称重,然后用质量体积分数为1%的戊巴比妥钠腹腔注射麻醉小鼠.
第4步 将小鼠置于34°C恒温垫,暴露小鼠颈部和胸部,用脱毛膏脱去颈部和左胸口毛发.
第5步 小鼠取仰卧位,用碘伏棉棒消毒手术区域3遍,镊子夹持小鼠尾巴,观察其反射程度确定小鼠是否充分麻醉.
第6步 在显微镜下沿直线分离覆盖气管上的颈部皮肤、肌肉及组织,暴露气管后,在声门下两个气管软骨环之间切一个小孔,插入气管插管,固定,检查胸廓的运动,确保两肺通气良好,呼吸频率为120次/min.
第7步 开胸.在显微镜下使用显微剪将小鼠胸骨左缘第四第五肋间位置做一横形切口,切口长约1.2 cm,逐层分离胸壁肌肉直至肋间肌暴露,使用显微镊钝性分离肋间肌肉,暴露心脏.
第8步 心肌注射.使用1 mL的胰岛素针吸取药物或者慢病毒稀释液一小格,即25µL,针尖垂直向下扎进心脏左心室的心室壁肌肉,扎入深度为刚没过针尖切面为标准;然后缓慢将药物推出,拔出注射器.
第9步 逐层缝合关闭实施手术区域.
第10步 对术后伤口进行碘酒消毒,若小鼠有脱水迹象,及时腹腔注射无菌生理盐水.
第11步 小鼠置于热毯恢复,直到自行爬动,然后拿开热毯,将小鼠放回鼠笼.
在心肌层注射过程中,针头进入的深度较难控制.进针太深会注射入心腔,药物和病毒无法进入心肌,同时心脏出血,死亡率增加;若进针太浅,药物和病毒无法注射进入心肌层,实验失败率增加.另外,注射的深浅不同,对心脏的损伤程度不一致,无法保证稳定性.基于此,采用无菌的透明胶带对针头进行处理,以此控制进针的深度并保证实验的均一性.对于不同种类的动物,比如大鼠,可以统一固定调整进针的深度.注射针头的处理和效果如图2所示.

图2 改进后的小鼠心肌层注射针头Fig.2 Improved syringe of myocardial layer injection in mice
1.2.2 冰冻切片与荧光拍摄
冰冻切片与荧光拍摄的操作步骤如下.
第1步 取心脏组织.腹腔注射质量体积分数为1%的戊巴比妥钠麻醉小鼠,再用显微剪在小鼠腹部做横切口;然后由两侧垂直往上延伸直至膈肌显露,最终露出心脏;弯镊从心脏下方走行,夹住主动脉等大血管将心脏小心上提;用显微剪在弯镊下方离断血管,取出心脏并置于磷酸盐缓冲液(phosphate buあer saline,PBS)中;最后用显微镊轻轻挤压心脏,去除血液.
第2步 OCT包埋剂包埋.将取出的新鲜心脏组织用OCT包埋剂浸润;然后迅速放入液氮中,快速冷却;最后置于−80°C冰箱中保存.
第3步 切片.预冷冰冻切片机至−20°C,然后将样品托涂上OCT包埋剂,并将样品置于其上,冰架上冷却30 min;调整角度、厚度,修片后切片,取10µm;切好的切片置于−80°C冰箱保存.
第4步 荧光采集.将切好的冰冻切片常温复温20 min,PBS清洗,洗净OCT包埋剂后,置于荧光显微镜下采集照片.
2 结果
2.1 注射药物和慢病毒效果
向心肌层分别注射Evans Blue染料和慢病毒,注射完毕后,置于体视镜下观察,结果如图3和4所示.由图可以看出:注射Evans Blue染料后,注射点附近的心肌层被染成蓝色,并且向四周晕开;注射慢病毒后,注射点附近的心肌层出现白色区域.上述结果表明药物和慢病毒均可注射入心肌层,并且小鼠存活率高.

图3 小鼠心肌层注射Evans Blue染料后的效果图Fig.3 Diagram of Evans Blue injection of myocardial layer injection in mice
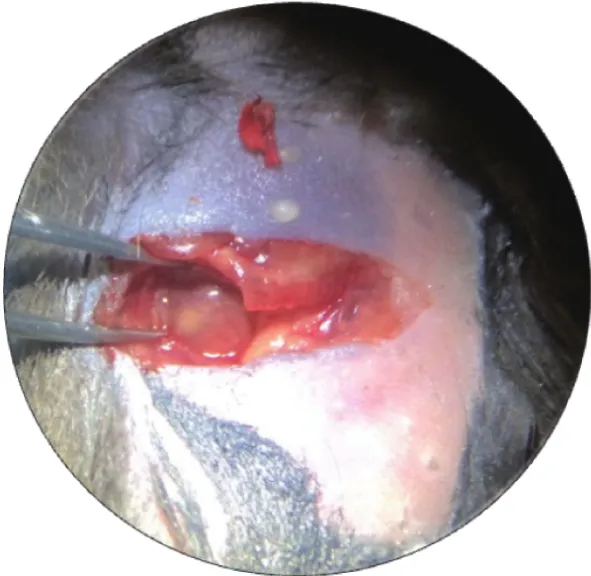
图4 小鼠心肌层注射慢病毒后的效果图Fig.4 Diagram of lentivirus injection of myocardial layer injection in mice
2.2 慢病毒注射后的基因表达
选取带绿色荧光蛋白(green f l uorescent protein,GFP)的慢病毒进行心肌层注射,并在注射一周后检测GFP的表达情况,结果如图5所示,其中1表示注射慢病毒的位置,标尺长度为100µm.由图可以看出,在注射点附近的不同位置均可以检测到GFP的表达,并且在其他组织中无法检测到GFP的表达(数据未显示).
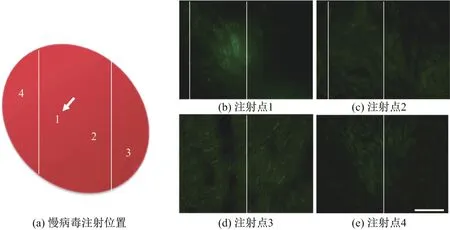
图5 小鼠心肌层注射慢病毒后GFP的检测结果Fig.5 Result of GFP-f l uorescent detection after myocardial layer lentivirus injection in mice
3 讨论
目前,心脏注射方式在一些研究中已经得到了应用,例如心内注射外泌体[6]和miRNA(microRNA)物质[7].但是心内注射会导致注射的物质随着血液进入体循环,而真正停留在心脏中的物质会偏少,影响干预效率.心肌层注射能够使绝大多数注射的物质保留在心脏中,特别是对于一些心梗区域的干预具有比较明显的优势.本研究明显地显示出注射的药物能够停留在心肌层内部.但是,心肌层注射最大的困难在于控制注射针头的深度:若注入较深,注射物质会进入心腔,并且随着血液循环而丧失,容易出现心脏出血,从而影响小鼠的存活率;若注射太浅,注射物质不易进入心脏,无法发挥注射药物的效率.本研究通过对胰岛素注射器进行改良,加入可以控制进针深度的原件,较好地解决了这一问题,提高了手术的稳定性和均一性.
目前,在心血管研究中腺相关病毒(adeno-associated virus,AAV)凭借其比较高的安全性已被大家认可[8].不同的血清型对不同的组织和细胞的转染效率存在差异,例如AAV1,AAV6,AAV8和AAV9对心脏具有很好的亲和性.特别是,AAV9可通过尾静脉等常用的注射方式进行感染心脏组织[9].通过尾静脉注射,AAV9一方面大量进入心脏组织[10],另一方面还会进入脑组织[11]、肺组织[12]、肝脏组织[13]等器官,这不可避免地影响实验或者基因治疗的结果.因此,心肌层注射成为优秀的注射方案之一.本研究表明,心肌层注射可以较好地保证注射的物质停留在心脏组织并且能够长期的表达,而不影响其他器官.这为基因治疗提供了一种比较有效的注射方式.
综上所述,本研究提出的心肌层注射方式为心血管研究和心血管基因治疗方案的选择提供了一定的帮助与借鉴.
[1]BENjAMIN E J,BLAHA M J,CHIUVE S E,et al.Heart disease and stroke statistics-2017 update:a report from the american heart association[J].Circulation,2017,135(10):e634-e1003.
[2]CATUCCI M,PRETE F,BOSTICARDO M,et al.Dendritic cell functional improvement in a preclinical model of lentiviral-mediated gene therapy for Wiskott-Aldrich syndrome[J].Gene Therapy,2012,19(12):1150-1158.
[3]TILEMANN L,ISHIkAWA K,WEBER T,et al.Gene therapy for heart failure[J].Circulation Research,2012,110(5):777-793.
[4]SU C H,WU Y J,WANG H H,et al.Nonviral gene therapy targeting cardiovascular system[J].American Journal of Physiology Heart&Circulatory Physiology,2012,303(6):629-638.
[5]FERRARA K,POLLARD R,BORDEN M.Ultrasound microbubble contrast agents:fundamentals and application to gene and drug delivery[J].Annual Review of Biomedical Engineering,2007,9:415-447.
[6]BEI Y,XU T,L¨U D,et al.Exercise-induced circulating extracellular vesicles protect against cardiac ischemia-reperfusion injury[J].Basic Research in Cardiology,2017,112(4):38.
[7]EULALIO A,MANO M,DAL FERRO M,et al.Functional screening identif i es miRNAs inducing cardiac regeneration[J].Nature,2012,492(7429):376-381.
[8]SANTIAGORTIZ J L,SCHAFFER D V.Adeno-associated virus(AAV)vectors in cancer gene therapy[J].Journal of Controlled Release,2016,240:287-301.
[9]PRASAD K M,XU Y,YANG Z,et al.Robust cardiomyocyte-specif i c gene expression following systemic injection of AAV:in vivo gene delivery follows a Poisson distribution[J].Gene Therapy,2011,18(1):43-52.
[10]PLEGER S T,SHAN C,KSIENZYk J,et al.Cardiac AAV9-S100A1 gene therapy rescues postischemic heart failure in a preclinical large animal model[J].Science Translational Medicine,2011,3(92):92ra64.
[11]BEY K,CIRON C,DUBREIL L,et al.Eきcient CNS targeting in adult mice by intrathecal infusion of single-stranded AAV9-GFP for gene therapy of neurological disorders[J].Gene Therapy,2017,24(5):325-332.
[12]MARTINI S V,SILVA A L,FERREIRA D,et al.Tyrosine mutation in AAV9 capsid improves gene transfer to the mouse Lung[J].Cellular Physiology and Biochemistry,2016,39(2):544-553.
[13]CHEN B D,HE C H,CHEN X C,et al.Targeting transgene to the heart and liver with AAV9 by diあerent promoters[J].Clininal and Experimental Pharmacology and Physiology,2015,42(10):1108-1117.
