运动训练对心脏衰老的保护机制
2018-01-13陶丽婵
陶丽婵,贾 方
心力衰竭是一个典型的与心脏老化有关的疾病,其流行率和发病率均随着年龄的增长而急剧增加[1].老化所致的心脏结构重塑主要包括心肌细胞的丢失、剩余心肌细胞的反应性肥大以及心肌纤维化[2-3].心肌细胞的丢失主要是通过凋亡,而线粒体相关的凋亡途径被认为是最关键的调控老化相关凋亡的通路[4].研究认为,对于70岁男性而言,由于心脏老化,约30%的心肌细胞会丢失[4-5].
越来越多的研究表明,运动训练对心血管具有保护作用,主要体现在减少心血管疾病发生的风险,促进生理性心脏生长,提高抗氧化能力和线粒体稳定性[6-7].过氧化物酶体增殖物激活受体 γ辅激活因子 (peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)和蛋白激酶B(Akt)的信号通路的激活对运动介导的心脏保护具有重要的意义[8].已有研究表明,运动训练是老年人心脏康复有效的手段[9].但是,目前运动训练抵抗心脏衰老的机制还有待完善.本研究通过在衰老模型小鼠中引入运动训练,明确运动训练是否能通过线粒体复制,线粒体代谢以及DNA损伤等方式保护心脏衰老.
1 材料与方法
1.1 材料
1.1.1 实验动物
无特定病原体(specif i c pathogen free,SPF)级雄性C57BL/6小鼠,8~10周,所有操作均依照美国国立卫生院(National Institutes of Health)的相关规定.
1.1.2 实验仪器
小鼠跑台、聚合酶链反应(polymerase chain reaction,PCR)仪、荧光定量PCR仪.
1.1.3 材料
D-gal(D-galactosamine)购于Sigma公司.PCR相关试剂:Trizol、反转录试剂盒和SYBR Green,购于Takara公司.384孔PCR板购于Roche公司.
1.2 实验方法
1.2.1 动物实验方案
8~10周的C57BL/6小鼠随机分为3组:对照组(n=6),D-gal注射组(n=6),D-gal注射+运动组(n=6).D-gal注射组按照100 mg/(kg·d)的剂量皮下注射4个月,对照组则注射等量的生理盐水.D-gal注射+运动组的处理方式为在注射D-gal的同时按照10 m/min速度连续运动训练4个月,每天运动1 h.
1.2.2 荧光定量PCR
利用Trizol提取小鼠心脏组织的核糖核酸(ribonucleic acid,RNA),取1µg的总RNA,加入5倍的逆转录试剂2µL,利焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水将总体积补充到10µL,将RNA逆转录为互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDAN),用于检测基因信使RNA(messenger ribonucleic acid,mRNA)水平的表达.利用合成的cDNA和特异性的PCR引物检测目标mRNA的表达,扩增的脱氧核糖核酸(deoxyribonucleic acid,DNA)产物以SYBR Green标记,采用18S作为内参基因,以2−ΔΔCT的方法进行目标基因相对表达量的计算.本研究采用的实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)引物序列如表1所示.
1.2.3 统计方法
运用SPSS 20.0统计软件进行分析,数据均采用“均值±标准差”表示,选用单因素方差分析进行组间比较,并以Bonferroni作两两比较,其中p<0.050表示有统计学差异.

表1 qRT-PCR引物序列Table 1 Sequences of the primers for qRT-PCR
2 结果
2.1 心功能损伤
采用荧光定量PCR检测心钠素(atrial natriuretic peptide,ANP)的表达,注射D-gal后小鼠心肌中ANP的mRNA的表达水平如图1所示,其中**表示p<0.010,n=6.由图1可以看出,与对照组相比,注射D-gal组ANP的表达量明显升高,而注射D-gal+运动组的ANP表达水平降低.
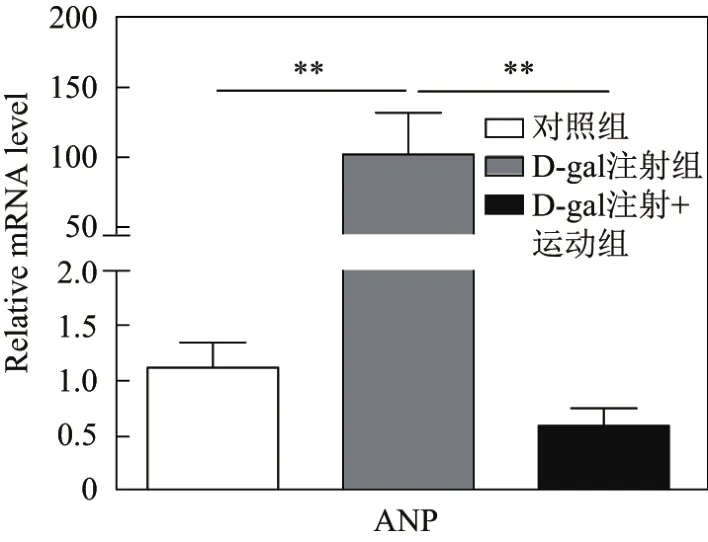
图1 注射D-gal后小鼠心肌中ANP的表达水平Fig.1 Expression of ANP in the mouse myocardium after hypodermic injection of D-gal
2.2 线粒体生成
采用荧光定量PCR分别检测小鼠心脏组织中线粒体DNA(mitochondrion DNA,mtDNA)复制相关的基因(POLG,SSBP1,TWINKLE和TOP1MT)和由线粒体DNA编码的参与能量代谢的基因(ND1,ND2,ND6,COX1,COX2,16S,ATPase6和Cytb),结果如图2和3表示,其中*表示p<0.050,**表示p<0.010,***表示p<0.001,n=6.由图2可以看出,在与线粒体复制相关的基因中,与对照组相比,D-gal组中POLG,TWINKLE和TOP1MT的表达量明显降低,而进行跑步训练后POLG,TWINKLE,TOP1MT和SSBP1的表达水平明显升高.由图3可以看出,在线粒体DNA编码的参与能量代谢的基因中,D-gal注射组中ND1,ND6,COX1,COX2,16S和Cytb的表达量明显降低,而进行跑步训练后ND1,ND2,ND6,COX1,COX2,16S,ATPase6和Cytb的表达水平均升高.
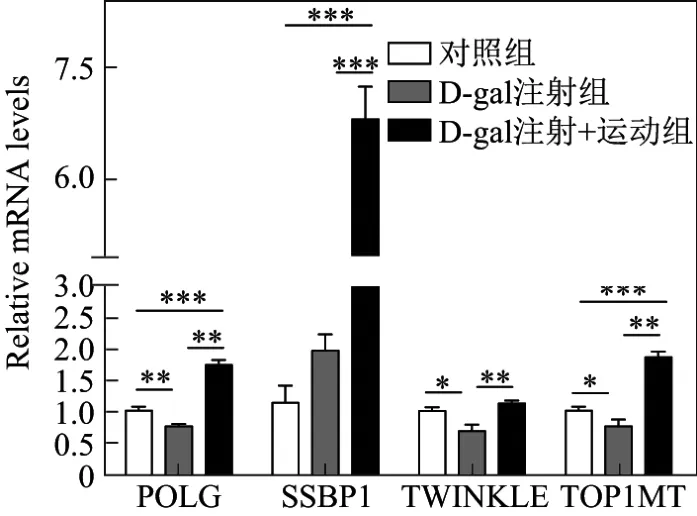
图2 注射D-gal后小鼠心肌中线粒体DNA复制相关基因的表达水平Fig.2 Expression of mtDNA replication-related genes in the mouse myocardium after hypodermic injection of D-gal
2.3 PGC-1α 和PGC-1β
采用荧光定量PCR检测小鼠心肌中能量代谢相关的PGC-1α和PGC-1β的表达量,结果如图4所示,其中*表示p<0.050,**表示p<0.010,***表示p<0.001,n=6.由图4可以发现,在注射D-gal导致心脏衰老组中,PGC-1α和PGC-1β的表达水平明显降低,但同时加入跑步训练后,PGC-1α和PGC-1β的表达量则明显升高.
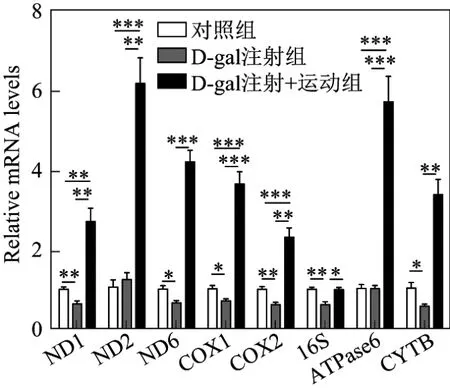
图3 注射D-gal后小鼠心肌中线粒体DNA编码的基因的表达水平Fig.3 Expression of mtDNA encoded genes in the mouse myocardium after hypodermic injection of D-gal

图4 注射D-gal后小鼠心肌中PGC-1α和PGC-1β的表达水平Fig.4 Expression of PGC-1α和PGC-1β in the mouse myocardium after hypodermic injection of D-gal
2.4 减少DNA损伤
采用荧光定量PCR检测小鼠心脏DNA损伤相关的基因,结果如图5所示,其中*表示p<0.05,**表示p<0.01,n=6.由图5可以看出,注射D-gal后,ATR的表达明显降低,而同时添加跑步后,ATR和ATM的表达水平明显升高.
3 讨论
越来越多的研究表明,衰老可以导致心肌细胞结构和功能的改变.这些由于衰老而导致的心功能的退化,也许是老年人更易于患各种心血管疾病的主要原因[10].基于此,本研究采用D-gal诱导小鼠衰老模型.D-gal是一种生理性营养物质,使用过量会导致代谢的异常,主要会产生活性氧(reactive oxygen species,ROS),随之引发一系列的细胞膜结构的损伤和基因表达异常等[11].D-gal慢性处理动物引起的加速衰老是目前老年病学可靠的模型建立方式.D-gal处理引发动物寿命减短,表现出正常衰老的一些特征[12].本研究发现:处理D-gal小鼠表现为ANP表达升高,这表明衰老后,小鼠心脏受损,心功能异常;而运动使得衰老小鼠ANP的表达量降低,这表明运动对于衰老后的心功能具有保护作用.
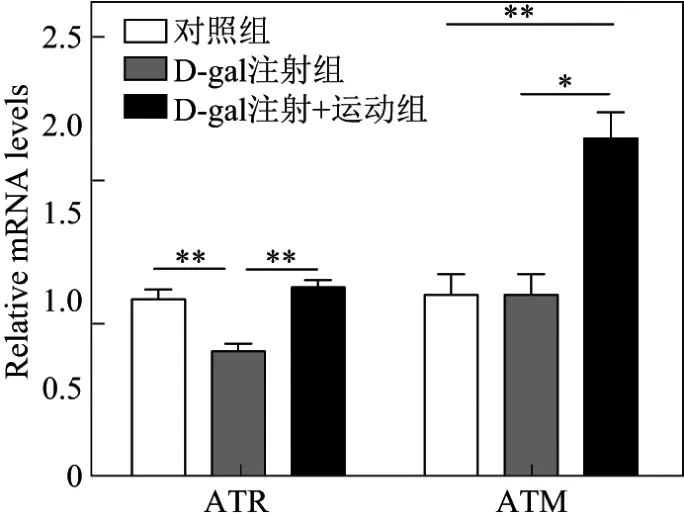
图5 注射D-gal后小鼠心肌中ATR和ATM的表达水平Fig.5 Expression of ATR和ATM in the mouse myocardium after hypodermic injection of D-gal
衰老往往与线粒体功能的降低相关,主要表现在氧化磷酸化水平降低,三磷酸腺苷(adenosine triphosphate,ATP)合成能力减弱,线粒体DNA突变增加,线粒体结构异常,氧化自由基增多[13].本研究首先发现了在D-gal所致的衰老心肌中,线粒体复制相关基因(POLG,SSBP1,TWINKLE和TOP1MT)和编码的基因(ND1,ND2,ND6,COX1,COX2,16S,ATPase6和Cytb)表达量出现降低的情况,而运动训练后这些基因的表达恢复甚至高于正常不运动的小鼠.这表明,运动对线粒体数量和功能的维持甚至是促进具有十分重要的意义.同时,从PGC-1α介导的能量代谢来看,D-gal所致的衰老心肌中PGC-1α和PGC-1β表达量降低,表明能量代谢能力降低,而运动训练后表达水平的显著升高表明能量代谢能力的恢复.这部分结果揭示出,运动训练可以通过保护线粒体的数量、功能以及代谢能力达到心肌保护的作用.此外,在D-gal注射组的小鼠中ATR的表达下降,而运动训练后ATR和ATM的表达升高,表明运动训练对抗DNA损伤具有促进意义.
总之,本研究表明长时间的运动训练对于心脏衰老具有保护作用,具体是通过促进线粒体的生成,维持线粒体的功能和激活PGC-1α途径来实现.这为心脏康复提供了新的理论依据和潜在的治疗策略.
[1]STRAIT J B,LAkATTA E G.Aging-associated cardiovascular changes and their relationship to heart failure[J].Heart Failure Clinics,2012,8(1):143-164.
[2]MISAkA T,SUZUkI S,MIYATA M,et al.Def i ciency of senescence marker protein 30 exacerbates angiotensinⅡ-induced cardiac remodelling[J].Cardiovascular Research,2013,99(3):461-470.
[3]KWAk H B.Aging,exercise,and extracellular matrix in the heart[J].Journal of Exercise Rehabilitation,2013,9(3):338-347.
[4]KWAk H B.Eあects of aging and exercise training on apoptosis in the heart[J].Journal of Exercise Rehabilitation,2013,9(2):212-219.
[5]BERGMANN O,BHARDWAj R D,BERNARD S,et al.Evidence for cardiomyocyte renewal in humans[J].Science,2009,324(5923):98-102.
[6]WEINER R B,BAGGISH A L.Exercise-induced cardiac remodeling[J].Progress in Cardiovascular Diseases,2012,54(5):380-386.
[7]ELLISON G M,WARING C D,VICINANZA C,et al.Physiological cardiac remodelling in response to endurance exercise training:cellular and molecular mechanisms[J].Heart,2012,98(1):5-10.
[8]MANN N,ROSENZWEIG A.Can exercise teach us how to treat heart disease?[J].Circulation,2012,126(22):2625-2635.
[9]LAI C H,HO T J,KUO W W,et al.Exercise training enhanced SIRT1 longevity signaling replaces the IGF1 survival pathway to attenuate aging-induced rat heart apoptosis[J].AGE,2014,36(5):9706-9709.
[10]OZTURk N,OLGAR Y,ER H,et al.Swimming exercise reverses aging-related contractile abnormalities of female heart by improving structural alterations[J].Cardiology Journal,2017,24(1):85-93.
[11]KUMAR A,DOGRA S,PRAkASH A.Eあect of carvedilol on behavioral,mitochondrial dysfunction,and oxidative damage against D-galactose induced senescence in mice[J].Naunyn Schmiedeberg’s Archives of Pharmacology,2009,380(5):431-441.
[12]WANG W,LI S,DONG H P,et al.Diあerential impairment of spatial and nonspatial cognition in a mouse model of brain aging[J].Life Sciences,2009,85(3/4):127-135.
[13]ZHANG Y,MI S L,HU N,et al.Mitochondrial aldehyde dehydrogenase 2 accentuates aginginduced cardiac remodeling and contractile dysfunction:role of AMPK,Sirt1,and mitochondrial function[J].Free Radical Biology&Medicine,2014,71:208-220.
