分子印迹磁性纳米粒的制备及其在蛋白质分离纯化中的应用
2018-01-10唐骁爽王嗣岑西安交通大学第二附属医院陕西西安70004西安交通大学药学院陕西西安7006
唐骁爽,王 莉,王嗣岑(. 西安交通大学第二附属医院,陕西西安 70004;. 西安交通大学药学院,陕西西安 7006)
◇技术方法研究◇
分子印迹磁性纳米粒的制备及其在蛋白质分离纯化中的应用
唐骁爽1,王 莉1,王嗣岑2
(1. 西安交通大学第二附属医院,陕西西安 710004;2. 西安交通大学药学院,陕西西安 710061)
目的发展一种分子印迹磁性纳米粒用于分离纯化目标蛋白质的新策略。方法水热法制备Fe3O4磁性纳米粒,溶胶凝胶法制备分子印迹聚合物,动力学、等温、特异性吸附考察分子印迹磁性纳米粒吸附性能。结果所得聚合物可以在30 min内达到吸附平衡,吸附量高达44.51 mg/g,印迹因子和选择性因子分别为3.50和2.92,对牛血中的牛血红蛋白质有良好的特异性识别能力。结论所制备的分子印迹磁性纳米粒及其良好的选择性吸附性能为目标蛋白质的分离纯化提供了一条有效的途径。
蛋白质;分离;纯化;分子印迹聚合物
蛋白质组学通过对比健康与疾病状态的细胞或组织的蛋白质组表达差异,用于药物研究或药物受体研究,以评价药物类似物的结构与活性关系,寻找高活性的药物。蛋白质组学的研究需要将目标蛋白质从复杂生物样品中分离出来再进行研究分析。目前,分离蛋白质的主要技术有固定金属亲和色谱法[1]、双向电泳技术[2]和毛细管电色谱[3]等方法,但是这些方法成本高、费时费力、稳定性差。因此,发展蛋白质分离纯化新技术成为科学工作者关注的热点。
分子印迹技术作为一种新型的对目标蛋白质分子具有专一性识别作用的人工合成技术,具有很大的发展潜力和应用前景[4]。近年来,表面分子印迹技术被广泛用于目标蛋白质的分离和纯化。其一般是以纳米粒[5-8]为“核”,在“核”的表面发生聚合,形成聚合物“壳”。这种聚合方法在一定程度上解决了生物大分子由于体积庞大难以进出聚合物材料的问题,有利于目标蛋白质接近识别位点。本研究以磁性纳米粒为“核”,采用表面分子印迹技术,制备了牛血红蛋白质的分子印迹聚合物,以期能为目标蛋白质的分离纯化提供一条有效的途径。
1 材料与方法
1.1材料四乙氧基硅烷(TEOS)、氨丙基三乙氧基硅烷(APTES)、三甲氧基辛基硅烷(OTMS)均购于英国Alfa Aesar化学试剂公司;牛血红蛋白(BHb)和牛血清白蛋白(BSA)均购于Sigma公司;三羟甲基胺基甲烷(Tris)购于上海蓝季科技有限公司;六水合三氯化铁(FeCl3·6H2O)、乙二醇(EG)、聚乙二醇(PEG, MW 4000)、醋酸钠(NaOAc)、氢氧化钠(NaOH)、盐酸(HCl)和乙醇均购于天津光复精细化工厂;水为超纯水。
FA2004电子天平(上海上平仪器有限公司);RW20机械搅拌器(德国艾卡公司);9600-1振动样品磁强计(美国 LDJ Electronics公司);Bio-Rad电泳仪(美国伯乐公司);UV-2450型紫外/可见分光光度计(日本岛津公司);TecnaiG2透射电子显微镜(荷兰飞利浦公司);KQ-100E超声波清洗器(昆山市超声仪器有限公司);WGL-30B电热恒温鼓风干燥箱(天津市泰斯特仪器有限公司);HY-4调速多用振荡器(常州国华电器有限公司);聚四氟乙烯不锈钢高压反应釜(巩义市予泰仪器设备销售有限公司)。
1.2方法
1.2.1Fe3O4磁性纳米粒的制备 Fe3O4磁性纳米粒通过一步水热法制备获得[9],首先将1.01 g FeCl3·6H2O,2.8 g NaOAc,0.085 g PEG溶解于装有20 mL EG溶液的聚四氟乙烯不锈钢高压反应釜中,搅拌均匀后,密闭加热至200 ℃反应12 h,然后冷却至室温。得到的黑色产物用超纯水洗涤至上清液呈无色,50 ℃真空干燥12 h,即得Fe3O4磁性纳米粒。
1.2.2分子印迹和非分子印迹聚合物的制备 将30 mg BHb溶解到盛有30 mL Tris-HCl(pH=7.0)缓冲溶液的三口瓶中,加入200 mg Fe3O4,搅拌30 min。再加入TEOS 2 mL,APTES和OTMS各100 μL,室温下继续搅拌反应3 h。所得产物用超纯水洗涤直至上清液澄清,接着用0.1 mol/L NaOH洗脱BHb,在外加磁场作用下将聚合物与上清液分离,并将聚合物在50 ℃ 下真空干燥,即得BHb分子印迹聚合物(Fe3O4@BHb-MIPs)。非分子印迹聚合物(Fe3O4@NIPs)的制备,除不加BHb外,其余步骤同上。
1.2.3动力学吸附性能的考察 分别取Fe3O4@BHb-MIPs和Fe3O4@NIPs 20 mg置于10 mL质量浓度为0.40 mg/mL的BHb Tris-HCl(pH=7.0)缓冲溶液中,室温下,分别振荡5、10、15、20、25、30、35、40、45 min,用磁铁将聚合物和上清液分离。再用紫外-可见分光光度计检测上清液中BHb的浓度。通过公式(1)计算相应的吸附量。

(1)
C0和Ce(mg/mL)分别指目标蛋白质的起始和平衡浓度,V(mL)指吸附液的体积,W(g)指聚合物的质量。
1.2.4等温吸附性能的考察 分别取Fe3O4@BHb-MIPs和Fe3O4@NIPs 20 mg于10 mL质量浓度为0.050 mg/mL~0.50 mg/mL的BHb Tris-HCl(pH=7.0)缓冲溶液中,室温下振荡30 min,后续处理同1.2.3。
1.2.5特异性吸附能力的考察 分别取Fe3O4@BHb-MIPs和Fe3O4@NIPs 20 mg于10 mL质量浓度为0.40 mg/mL的同时含有BSA和BHb的Tris-HCl(pH=7.0)标准混合溶液中,室温下振摇30 min,后续处理同1.2.3。
1.2.6实际样品的应用分析 取新鲜牛血样品,用Tris-HCl(pH=7.0)缓冲溶液稀释150倍。取50 mg Fe3O4@BHb-MIPs分散于上述稀释的牛血样品中,室温下振荡30 min后,用磁铁将聚合物与上清液分离,吸附牛血后的聚合物用0.1 mol/L NaOH洗脱。稀释的牛血样,聚合物吸附后的牛血样以及洗脱目标蛋白质的洗脱液作为凝胶电泳的分析样品。
2 结 果
2.1Fe3O4和Fe3O4@BHb-MIPs的透射电子显微镜(TEM)表征取适量Fe3O4和Fe3O4@BHb-MIPs均匀分散于一定量的乙醇中,将5 μL该混悬液滴加到铜网上,并在透射电子显微镜下观察。结果如图1所示,Fe3O4(A)和Fe3O4@BHb-MIPs(B)都是类球形结构,且Fe3O4的粒径在230 nm左右,Fe3O4@BHb-MIPs的表面明显有印迹层的存在,其粒径大约在260 nm,表明印迹层的厚度约为15 nm。
2.2Fe3O4和Fe3O4@BHb-MIPs的磁滞回线表征各称取Fe3O4和Fe3O4@BHb-MIPs 10~20 mg,300 K下,对样品施加强度为-6 000 Oe~6 000 Oe的磁场,测定样品的磁滞回线。结果如图2所示,两样品的矫顽力和剩磁均很小,表现出良好的顺磁性。Fe3O4@BHb-MIPs的饱和磁化强度低于Fe3O4的,这是由于印迹层的屏蔽效应引起的。但Fe3O4@BHb-MIPs的饱和磁化强度仍高达43.95 emu/g,能够实现聚合物在外加磁场引导下快速从吸附液中分离出来,这对于目标蛋白质的大规模磁性分离非常有利。

图1Fe3O4(A)和Fe3O4@BHb-MIPs(B)的TEM图
Fig.1 TEM images of Fe3O4(A) and Fe3O4@BHb-MIPs (B)
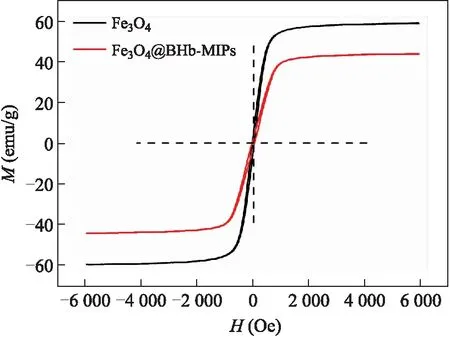
图2Fe3O4和Fe3O4@BHb-MIPs的磁滞回线图
Fig.2 Magnetization curves of Fe3O4and Fe3O4@BHb-MIPs
2.3Fe3O4@BHb-MIPs和Fe3O4@NIPs吸附性能的考察动力学吸附性能的考察结果如图3所示,聚合物在前25 min有较快的吸附速率,30 min时达到吸附平衡。聚合物吸附目标蛋白质的初始阶段,由于其表面有很多空的结合位点,因此吸附速率较快;随着时间的延长,结合位点被目标蛋白质所占据,吸附能力逐渐下降,最终达到吸附平衡。

图3Fe3O4@BHb-MIPs和Fe3O4@NIPs的动力学吸附曲线
Fig.3 Adsorption kinetics of Fe3O4@BHb-MIPs and Fe3O4@NIPs
等温吸附性能的考察结果如图4所示,当BHb溶液浓度达到0.40 mg/mL时,聚合物对目标蛋白质的吸附量达到平衡。另外,Fe3O4@BHb-MIPs对BHb的吸附量远大于Fe3O4@NIPs的。

图4Fe3O4@BHb-MIPs和Fe3O4@NIPs的等温吸附曲线
Fig.4 Adsorption isotherms of Fe3O4@BHb-MIPs and Fe3O4@NIPs
印迹因子(IF)和选择性因子(SC)常用作评价分子印迹和非印迹聚合物选择性吸附性能的重要参数。其定义如下:

(2)

(3)
QMIP和QNIP(mg/g)分别代表Fe3O4@BHb-MIPs和Fe3O4@NIPs对蛋白质的吸附量,IFTEM和IFCOM分别代表目标蛋白质和竞争蛋白质的印迹因子。
BSA的体积和分子量都与BHb接近,且是牛血中存在的另一种高丰度蛋白质,因此,以其作为竞争蛋白质来衡量Fe3O4@BHb-MIPs对BHb的特异性吸附能力。结果如表1所示,Fe3O4@BHb-MIPs对BHb的IF和SC值分别为3.50和2.92。
表1Fe3O4@BHb-MIPs和Fe3O4@NIPs对BHb及BSA的吸附量、印迹因子和选择性因子
Tab.1 The adsorption capacities, imprinting factors, and selectivity coefficients of Fe3O4@BHb-MIPs and Fe3O4@NIPs for BHb and BSA

ProteinsQMIP(mg/g)QNIP(mg/g)IFSCBHb44.5112.713.50—BSA15.2312.671.202.92
2.4Fe3O4@BHb-MIPs在实际样品中的应用如图5所示,实际牛血样品(Lane 1)经Fe3O4@BHb-MIPs吸附后,样品中BHb条带明显变浅,而其他条带几乎没有明显的变化(Lane 2),当洗脱Fe3O4@BHb-MIPs后,洗脱液中BHb条带又清晰地重新显现(Lane 3)。这说明Fe3O4@BHb-MIPs只对实际牛血样中的BHb有特异性吸附,而对其他蛋白质分子几乎没有吸附作用。
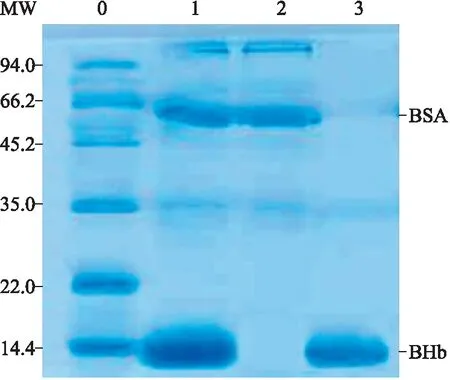
图5Fe3O4@BHb-MIPs应用于牛血样品中的SDS-PAGE分析
Fig.5 SDS-PAGE analysis to evaluate the applicability of Fe3O4@BHb-MIPs towards BHb
Lane 0:标准蛋白分子量标记;Lane 1:稀释150倍的牛血样;Lane 2:经Fe3O4@BHb-MIPs吸附后的牛血样;Lane 3:用0.1 mol/L NaOH洗脱吸附后的Fe3O4@BHb-MIPs的上清液。
3 讨 论
蛋白质分子印迹聚合物由于具有稳定性好、易于制备、可重复利用和选择性高等优势,被认为是一种可以从复杂基质中去除高丰度蛋白质的有效新型手段。表面分子印迹聚合物表面存在大量的印迹识别位点,有利于加快蛋白质对位点的可接近性,可以解决蛋白质传质速率慢的问题。蛋白质组学的研究,首先需要将目标蛋白质从复杂生物样品中分离出来进行纯化。Fe3O4磁性纳米粒除具有一般纳米粒的小尺寸效应、量子效应和表面效应外,还具有超顺磁性、易于分离性、低毒性、良好的生物相容性等特性,被广泛地应用于生物领域。本文以Fe3O4磁性纳米粒为核,采用溶胶凝胶技术和表面分子印迹技术制备出包覆聚合物薄膜的核-壳型结构的材料。
所得分子印迹磁性纳米粒与其他特异性吸附BHb的分子印迹聚合物相比较(5 h[10],80 min[11]),本实验所制备的聚合物到达吸附平衡的时间更短(30 min),这主要是由于Fe3O4@BHb-MIPs的印迹层较薄,厚度仅为约15 nm,更有利于BHb在Fe3O4@BHb-MIPs和吸附液之间进行传质,极大地缩短了吸附时间,提高了吸附效率。
所得分子印迹磁性纳米粒的吸附性能优于非分子印迹磁性纳米粒的吸附性能。主要是由于Fe3O4@BHb-MIPs具有大量的与目标蛋白质的空间结构、大小尺寸完全匹配的识别位点,可以实现对目标蛋白质的特异性结合,而Fe3O4@NIPs对BHb的吸附作用是非特异性的。
Fe3O4@BHb-MIPs对BHb的吸附量高达44.51 mg/g,远高于对竞争蛋白质BSA的吸附量,进一步说明在Fe3O4@BHb-MIPs形成的过程中,印迹薄层上形成了对BHb具有特异性结合能力的作用位点。印迹因子和选择性因子分别为3.50和2.92。将其应用于实际牛血样品中,表现出对牛血中的BHb有良好的特异性识别能力。
本实验制备方法简单,条件温和。制得的分子印迹磁性纳米粒可以在外加磁场作用下,实现快速分离,后处理过程简单。采用透射电镜和磁滞回线对制备的纳米材料进行了表征分析。通过动力学吸附、等温吸附、选择性吸附实验等考察了分子印迹磁性纳米粒的吸附和识别性能。结果显示,所得分子印迹磁性纳米粒不仅具有良好的形貌和超顺磁性,还有快的动力学吸附速率、高的吸附量、良好的选择性。实际样品分析实验证明该印迹材料为目标蛋白质的分离纯化提供了一种新的可行方法。
[1] WANG FR, CHMIL C, PIERCE F, et al. Immobilized metal affinity chromatography and human serum proteomics[J]. J Chromatogr B, 2013, 934(9):26-33.
[2] 李居怡,刘巧媚,黄文静,等. 适用于细粒棘球蚴囊液蛋白质组分析的双向电泳技术[J]. 西安交通大学学报(医学版), 2015, 36(5):711-714.
[3] LIU HY, LI XH, HUANG LQ, et al. An open tubular capillary electrochromatography column with porous inner surface for protein separation[J]. Anal Biochem, 2013, 442(2):186-188.
[4] 陈晖. 分子印迹复合膜在中药活性成分分离纯化中的应用[J]. 西北药学杂志, 2009, 24(4):336-338.
[5] CHEN T, SHAO MW, XU HY, et al. Molecularly imprinted polymer-coated silicon nanowires for protein specific recognition and fast separation[J]. J Mater Chem, 2012, 22(9):3990-3996.
[6] JING T, XIA H, GUAN Q, et al. Rapid and selective determination of urinary lysozyme based on magnetic molecularly imprinted polymers extraction followed by chemiluminescence detection[J]. Anal Chim Acta, 2011, 692(1-2):73-79.
[7] XU WZ, ZHOU W, XU PP, et al. A molecularly imprinted polymer based on TiO2as a sacrificial support for selective recognition of dibenzothiophenne[J]. Chem Eng J, 2011, 172(1):191-198.
[8] ZHANG XL, ZHANG Y, YIN XF, et al. A facile approach for preparation of molecularly imprinted polymers layer on the surface of carbon nanotubes[J]. Talanta, 2013, 105(4):403-408.
[9] GAO RX, ZHANG LL, HAO Y, et al. One-step preparation of magnetic imprinted nanoparticles adopting dopamine-cupric ion as a co-monomer for the specific recognition of bovine hemoglobin[J]. J Sep Sci, 2015, 38(20):3568-3574.
[10] ZHANG M, CHENG D, HE XW, et al. Magnetic silica-coated sub-microspheres with immobilized metal ions for the selective removal of bovine hemoglobin from bovine blood[J]. Chem Asian J, 2010, 5(6):1332-1340.
[11] LI L, HE XW, CHEN LX, et al. Preparation of core-shell magnetic molecularly imprinted polymernnanoparticles for recognition of bovine hemoglobin [J]. Chem Asian J, 2009, 4(2):286-293.
Preparationandapplicationofmagneticmolecularlyimprintednanoparticlesforseparationandpurificationofprotein
TANG Xiao-shuang1, WANG Li1, WANG Si-cen2
(1. the Second Affiliated Hospital, Xi’an Jiaotong University 710004; 2. College of Pharmacy, Xi’an Jiaotong University, Xi’an 710061, China)
ObjectiveTo develop a novel strategy for separation and purification of target protein by magnetic molecularly imprinted nanoparticles.MethodsFe3O4nanoparticles were synthesized through a hydrothermal method. A sol-gel technique was adopted to prepare imprinting layers. The adsorption capability of magnetic molecularly imprinted nanoparticles was investigated by kinetic, isothermal, and selective binding experiments.ResultsThe imprinted nanomaterials could reach equilibrium within 30 min. The adsorption capacity was 44.51 mg/g. The imprinting factor and selectivity coefficient were 3.50 and 2.92, respectively. The resulting imprinted polymers could selectively separate and enrich bovine hemoglobin from a bovine blood sample.ConclusionThe prepared imprinted nanomaterials with good specific adsoprtion ability can provide an effective strategy for separation and purification of target protein.
protein; separation; purification; molecularly imprinted polymer
2017-08-29
2017-11-08
国家自然科学基金青年科学基金项目(No.81701830),陕西省自然科学基础研究计划青年项目(No.2017JQ8052)
Supported by the National Natural Science Foundation of China (No.81701830) and the Natural Science Foundation of Shaanxi Province (No.2017JQ8052)
唐骁爽,助理研究员,博士. E-mail: tangxiaos@sina.com
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171205.1808.028.html(2017-12-05)
R313
A
10.7652/jdyxb201801027
(编辑 卓选鹏)
