竹叶提取物通过调控Akt/HIF-1α通路抑制低氧条件下人乳腺癌MCF-7细胞的恶性生长
2018-01-10徐其锋温晓琼河南省中医院乳腺科河南郑州450002
徐其锋,温晓琼(河南省中医院乳腺科,河南郑州 450002)
竹叶提取物通过调控Akt/HIF-1α通路抑制低氧条件下人乳腺癌MCF-7细胞的恶性生长
徐其锋,温晓琼
(河南省中医院乳腺科,河南郑州 450002)
目的探究竹叶提取物对低氧条件下人乳腺癌MCF-7细胞恶性生长的影响及分子机制。方法将培养的人乳腺癌MCF-7细胞随机分为正常组、低氧组以及0.2、0.4、0.8 μg/mL竹叶提取物组和0.8 μg/mL竹叶提取物组+IGF-1组。CCK-8法检测各组细胞的增殖活性变化,RT-PCR和Western blot检测细胞增殖标记蛋白PCNA、Ki-67和MCM2表达,流式细胞术检测细胞周期和细胞凋亡变化。Western blot检测凋亡相关蛋白Bax、Bcl-2、caspase-3和survivin表达;并探讨Akt/HIF-1α通路在竹叶提取物抑制癌细胞生长中的作用。结果竹叶提取物处理后,低氧下MCF-7细胞的增殖活性和PCNA、Ki-67和MCM2的表达显著性降低并呈现剂量依赖性(P<0.01);而细胞G2/M期比例增加(P<0.01);此外,竹叶提取物处理后细胞凋亡率明显增加,同时Bax和caspase-3表达上调,Bcl-2和survivin表达下调(P<0.01);此外,竹叶提取物组Akt/HIF-1α通路中p-Akt和HIF-1α的表达下调 (P<0.01),Akt/HIF-1α通路激动剂IGF-1可逆转竹叶提取物对低氧下MCF-7恶性生长的抑制作用。结论竹叶提取物可通过下调Akt/HIF-1α信号通路抑制低氧条件下人乳腺癌MCF-7细胞恶性生长。
竹叶提取物;MCF-7;增殖;凋亡;低氧;Akt/HIF-1α通路;Bax;Bcl-2;caspase-3
乳腺癌是女性最常见的恶性肿瘤之一,严重危害女性健康。低氧微环境是实体肿瘤的常见特征,乳腺癌作为一种实体肿瘤,低氧下可显示出较强的恶性特征。而传统治疗方法疗效不理想的原因可能与忽视了低氧微环境的存在有关[1-2]。因此,探讨低氧微环境下乳腺癌实体肿瘤恶性进程的调控对乳腺癌的防治具有重要意义。竹子是禾本科竹亚科多年常绿植物,含有大量黄酮、活性多糖、茶多酚等具有抗癌活性的有效成分,目前已有广泛研究[3]。已有文献证实,竹叶提取物对肝癌、黑色素瘤等疾病具有显著的疗效[4-5],而有关竹叶提取物应用于乳腺癌的研究较少。本研究观察了不同浓度的竹叶提取物对低氧环境下乳腺癌MCF-7细胞恶性生长的影响,并进一步探讨其可能的作用机制,期望为乳腺癌的临床治疗提供科学合理的实验依据。
1 材料与方法
1.1试剂和仪器竹叶提取物购自西安康尔美生物科技有限公司;人乳腺癌细胞系MCF-7购自中科院上海细胞所;RPMI-1640培养基、胎牛血清均购自美国GIBCO BRI公司;CCK-8试剂盒购自美国Sigma公司;Real-time PCR(RT-PCR)试剂盒购于Invitrogen公司;Annexin V-FITC检测试剂盒购自TREVIGEN. Inc;Western blot所用抗体均购自美国Santa Cruz公司;casepase-3活性检测试剂盒购于美国Abcam公司。
MCO-18AIC型细胞培养箱购自日本三洋公司;ABI 2700型PCR仪购自美国ABI公司;Multiskan FC型酶标仪购自美国Thermo公司;FACS Calibur TM流式细胞仪购自美国BD公司;5417小型台式冷冻离心机购自德国Eppendorf公司;化学发光仪购自美国Kodak公司。
1.2细胞培养MCF-7细胞置于含100 mL/L胎牛血清、1×105IU/L青霉素和100 mg/L链霉素的RPMI 1640培养基中,在37 ℃、50 mL/L CO2的培养箱中贴壁生长。更换培养基,用2.5 g/L胰酶消化传代。取对数期细胞进行实验。
1.3CCK-8法检测MCF-7细胞增殖活性将细胞按照1×104个/孔接种至96孔板中,12 h后换液,进行24 h无血清培养,加入终质量浓度为0.2、0.4、0.8 μg/mL竹叶提取物的培养基,37 ℃条件下培养24 h后,加入20 μL、5 mg/mL CCK8液培养4 h。2 000 r/min离心5 min,弃上清,加入DMSO,溶解后,于酶标仪测定490 nm处的吸光度值(A)。
1.4实验分组及RT-PCR检测MCF-7细胞增殖标记蛋白的表达分为正常组(200 mL/L O2)、低氧组(10 mL/L O2)及0.2、0.4、0.8 μg/mL竹叶提取物组和0.8 μg/mL竹叶提取物+IGF-1组(先予以10 μmol/L IGF-1作用30 min后,放入低氧环境培养)。低氧环境为10 mL/L O2、940 mL/L N2和50 mL/L CO2组成的三气培养箱,通过控制O2或N2输入量实现对O2的精确控制,维持培养箱内持续的低氧环境。竹叶提取物用9 g/L生理盐水配成相应浓度。
将细胞按照4×105个/孔接种到6孔板,12 h后无血清培养24 h。按以上分组添加相应处理的培养基,培养24 h后收集细胞。Trizol法提取总RNA,紫外分光光度计测定RNA的纯度及浓度,逆转录成cDNA后,再利用SYBR Premix ExTaq进行RT-PCR,扩增PCNA、Ki-67和MCM2,引物序列见表1。
表1基因的引物序列
Tab.1 Primer sequences of genes

基因名称引物序列(5′-3′)PCNATGATGAGGTCCTTGAGTGGAGTGGTCGTTGTCTTTCKi⁃67ACTTGCCTCCTAATACGCCTTACTACATCTGCCCATGAMCM2CACGCTTTGACATCCTGTGTGTTGATCTGACGAGCCTTAGAPDHATGGGGAAGGTGAAGGTCGTTACTCCTTGGAGGCCATGTG
1.5流式细胞仪检测MCF-7细胞凋亡及细胞周期分组处理同1.4。700 mL/L乙醇固定过夜,离心取沉淀物,加入1 mg/mL RNA酶A溶液37 ℃消化30 min。用200 μL碘化丙啶染色液和Annexin V 4 ℃染色30 min,流式细胞仪于488 nm激发波长处进行分析。
1.6Westernblot检测增殖标记蛋白、凋亡相关蛋白和Akt/HIF-1α通路蛋白的表达分组处理同1.4。提取全蛋白,经BCA定量、上样、SDS-PAGE凝胶电泳、转膜、40 g/L脱脂奶粉封闭2 h后,加入一抗为鼠抗人的各蛋白抗体(1∶1 000)4 ℃封闭过夜。加入HRP标记的兔抗鼠二抗(1∶10 000)孵育2 h,ECL显影后,检测细胞蛋白表达。
1.7caspase-3试剂盒检测caspase-3活性将细胞按照2×106个/孔接种到96孔板中,12 h后换无血清培养24 h,加入终质量浓度为0.8 μg/mL竹叶提取物的培养基或者预先加入IGF-1及竹叶提取物的培养基。按照casepase-3活性检测试剂盒说明书操作,比色法测定caspase-3活性,分光光度计于405 nm处检测底物裂解产生的荧光强度。
2 结 果
2.1竹叶提取物对MCF-7细胞增殖的影响CCK-8法检测结果显示,药物作用72 h后,0.2、0.4、0.8 μg/mL竹叶提取物组均不同程度地抑制低氧下MCF-7细胞增殖,且随着浓度的升高而增强(P值依次分别为0.021、0.012、0.004 5,图1A)。
RT-PCR结果显示,各浓度竹叶提取物组的肿瘤增殖标志蛋白PCNA、Ki-67和MCM2的mRNA表达均较低氧组降低,并随着竹叶提取物浓度的升高而抑制作用更显著(RT-PCR结果P值依次分别为,PCNA:0.030、0.022和0.002 5;Ki-67:0.036、0.028及0.003 3;MCM2:0.047、0.025及0.001 5);Western blot结果显示各肿瘤增殖标志蛋白表达变化趋势与mRNA表达变化一致(P值依次分别为,PCNA:0.035、0.028和0.003 5;Ki-67:0.029、0.026及0.002 9;MCM2:0.031、0.020及0.002 3)(图1B~D)。
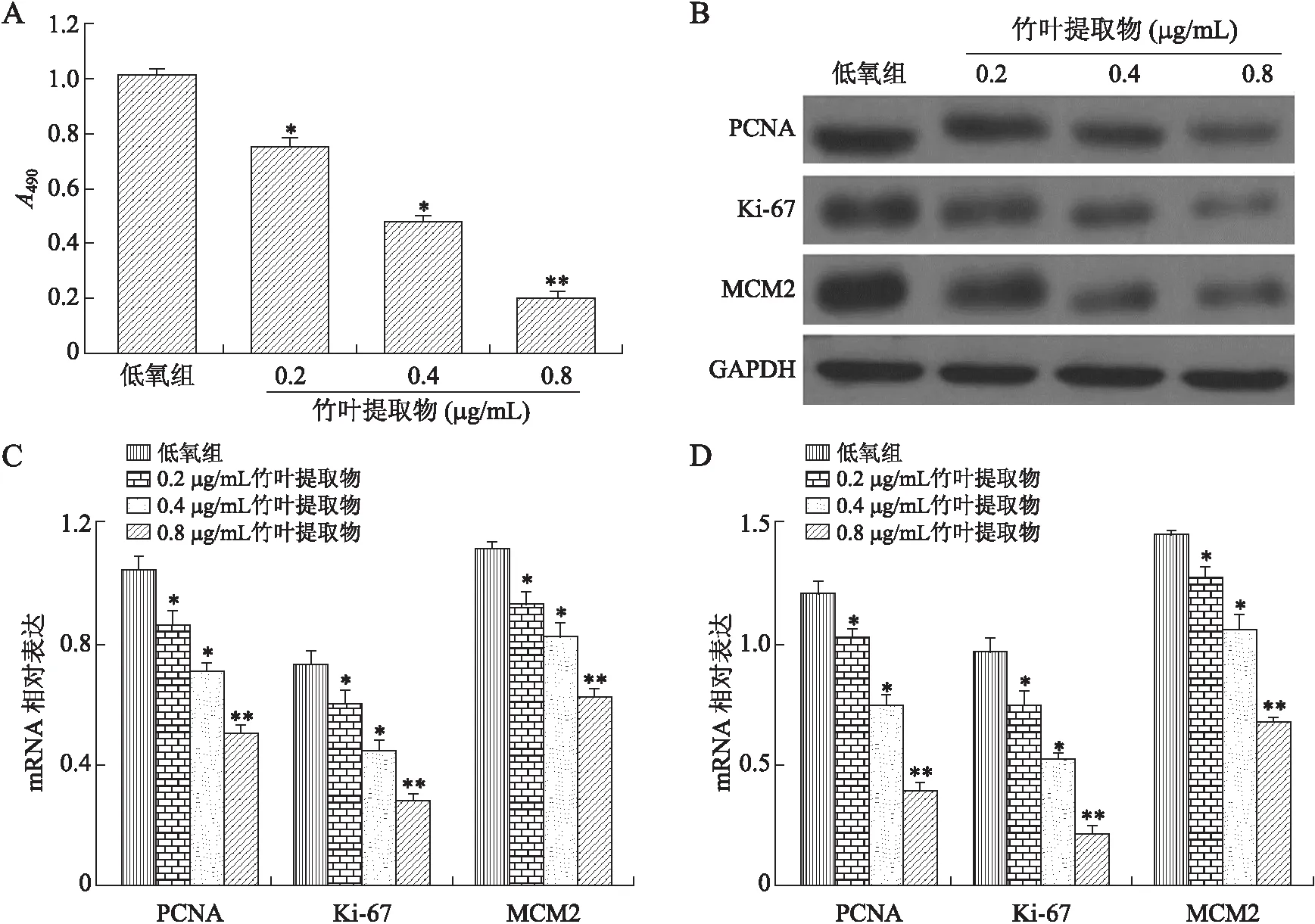
图1不同浓度竹叶提取物对低氧下MCF-7细胞增殖的影响
Fig.1 Effects of different concentrations of bamboo leaf extracts on MCF-7 cells’ proliferation under hypoxia
A:CCK-8法检测MCF-7细胞活性;B、D:Western blot检测结果与统计学分析;C:RT-PCR法检测结果的统计学分析。与低氧组相比,*P<0.05,**P<0.01。
2.2竹叶提取物对MCF-7细胞周期的诱导阻滞流式细胞仪检测结果显示,与低氧组相比,0.2、0.4、0.8 μg/mL竹叶提取物组均促使低氧下MCF-7细胞G1和S期比例减少,G2/M期比例增多,并随着浓度的升高而增加(图2)。
2.3竹叶提取物对MCF-7细胞凋亡的影响流式细胞仪检测结果显示,与低氧组相比,0.2、0.4和0.8 μg/mL竹叶提取物均能显著诱导低氧下MCF-7细胞凋亡,且呈现浓度依赖性趋势(P值依次分别为0.030 0、0.022 0及0.002 5,图3A、B);Western blot结果显示,与低氧组相比,不同浓度的竹叶提取物作用下,低氧细胞中Bax和caspase-3表达均升高,Bcl-2和survivin表达均降低,且都随着浓度的升高而增强(P值依次分别为caspase-3:0.032 0、0.026 0及0.004 0;Bax:0.026 0、0.020 0及0.003 2;Bcl-2:0.044 0、0.038 0及0.005 5;survivin:0.039 0、0.031 0及0.005 2,图3C、D)。
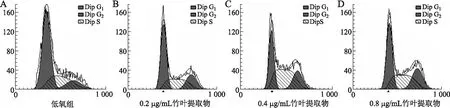
图2流式细胞仪检测不同浓度竹叶提取物对低氧下MCF-7细胞周期分布的影响
Fig.2 Effects of different concentrations of bamboo leaf extracts on MCF-7 cells’ cycle arrest under hypoxia using flow cytometer
A:低氧组;B:0.2 μg/mL竹叶提取物组;C:0.4 μg/mL竹叶提取物组;D:0.8 μg/mL竹叶提取物组。
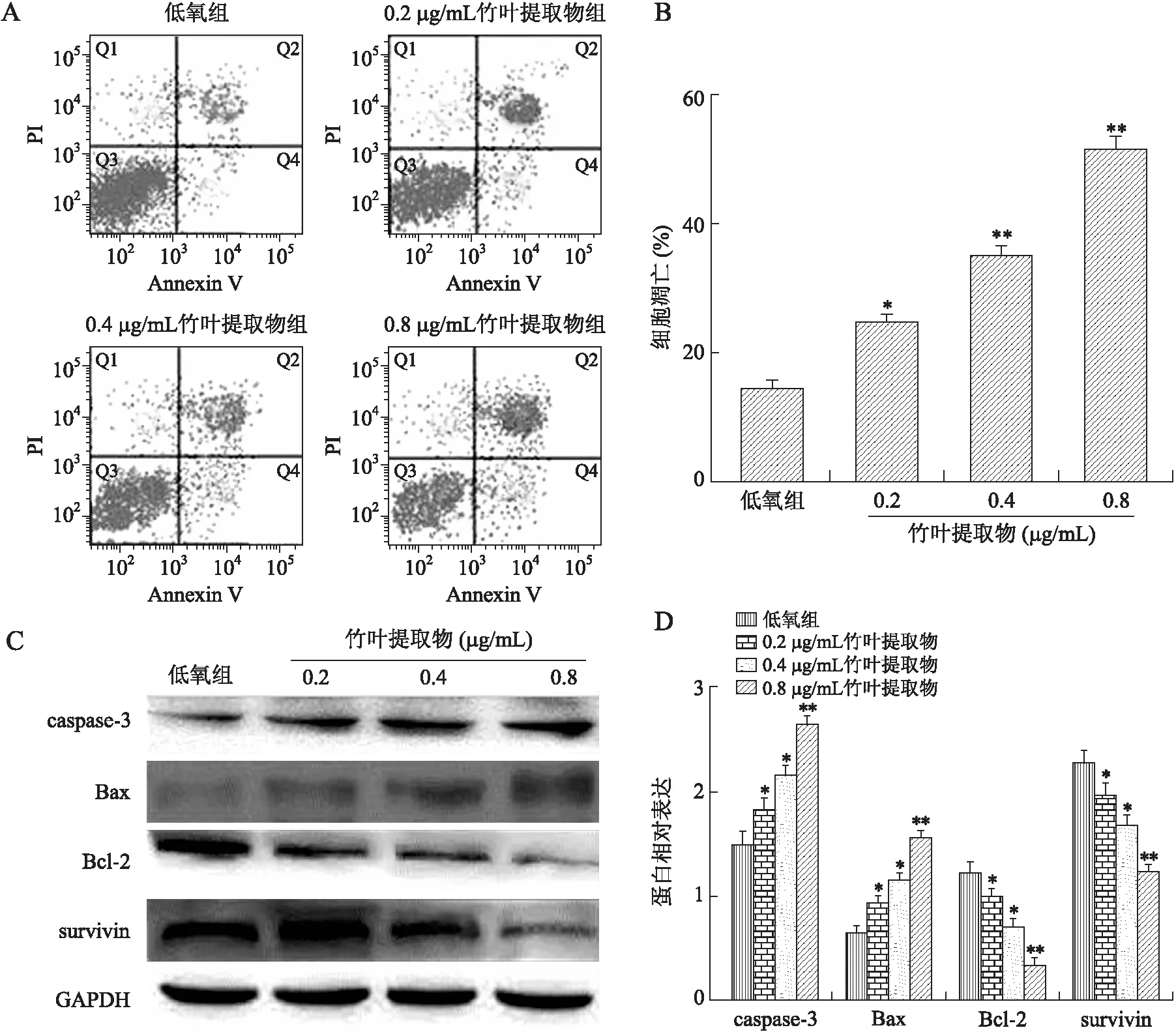
图3不同浓度竹叶提取物对低氧条件下MCF-7细胞凋亡的影响
Fig.3 Effects of different concentrations of bamboo leaf extract on MCF-7 cells’ apoptosis upon hypoxia
A、B:流式细胞仪检测MCF-7细胞凋亡;C、D:Western blot法检测凋亡相关蛋白表达。与低氧组相比,*P<0.05,**P<0.01。
2.4竹叶提取物抑制Akt/HIF-1α信号通路转导Western blot结果显示,与正常组相比,低氧组Akt/HIF-1α通路被显著激活,而0.8 μg/mL的竹叶提取物能下调低氧组Akt的磷酸化和HIF-1α的表达(P值 依次分别为,p-Akt:0.004 2、0.006 3及0.008 1;HIF-1α:0.004 4、0.006 1及0.007 4,图4A、B)。同时发现,IGF-1不仅可逆转竹叶提取物对Akt/HIF-1α通路的下调,也减小了竹叶提取物对MCF-7细胞增殖(P值为0.005 6)和凋亡(P值为0.006 0)的影响(P值分别为,PCNA:0.005 0;Ki-67:0.006 2;MCM2:0.005 5;caspase-3:0.005 5,图4C~F)。
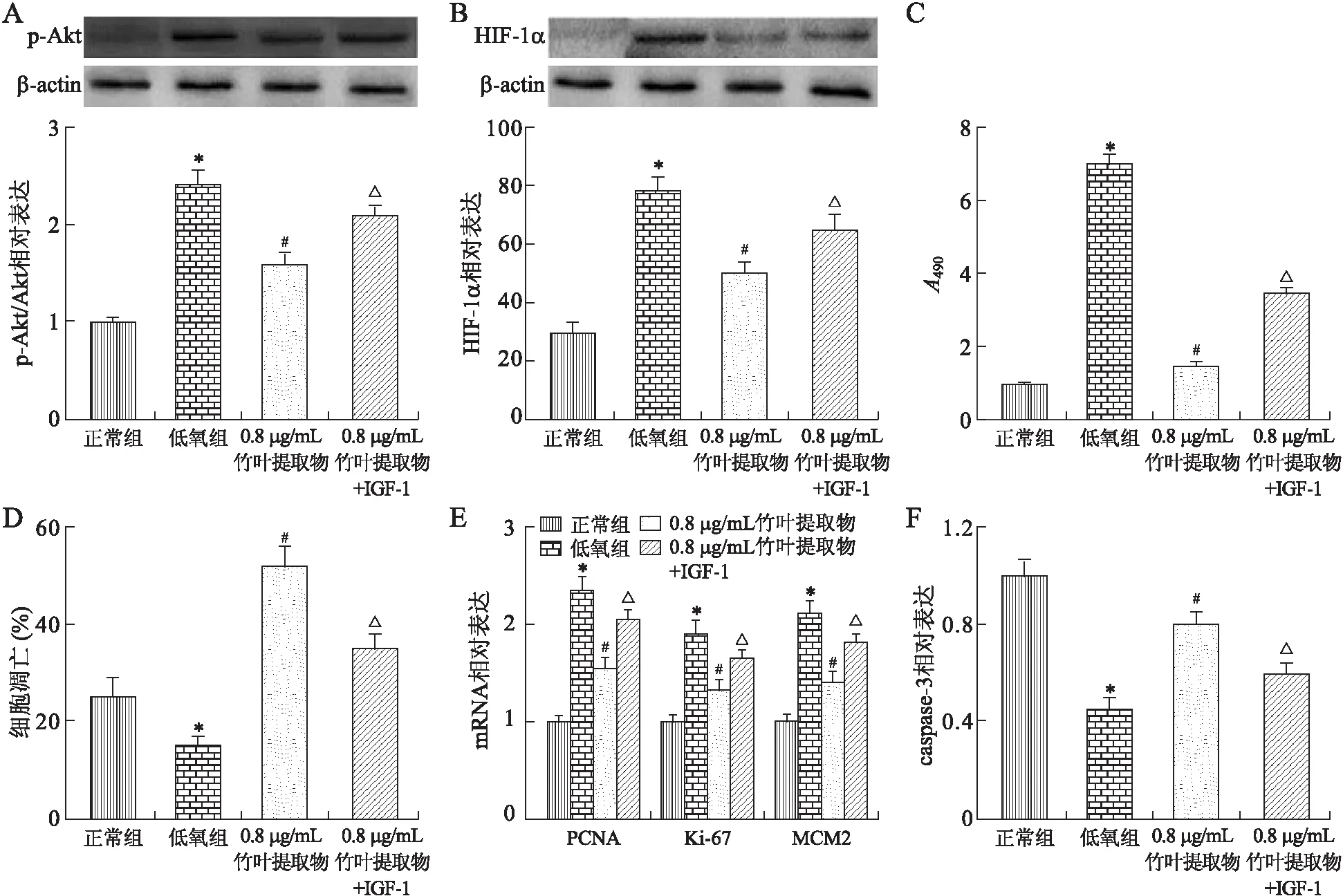
图4不同浓度竹叶提取物对Akt/HIF-1α信号通路的影响
Fig.4 Effects of different concentrations of bamboo leaf extracts on the Akt/HIF-1α signaling pathway
A、B:p-Akt和HIF-1α蛋白的Western blot检测结果;C:CCK-8法检测MCF-7细胞活性;D:流式细胞仪检测MCF-7细胞凋亡;E:PCNA、Ki-67和MCM2的RT-PCR检测结果;F:caspase-3试剂盒检测caspase-3活性。与正常组相比,*P<0.01;与低氧组相比,#P<0.01;与0.8 μg/mL竹叶提取物组相比,△P<0.01。
3 讨 论
乳腺癌作为困扰女性健康的一大难题,其发病率正在以2%~3%的速度逐年攀升[6-7]。临床应用的肿瘤化疗药物常伴有疼痛、呕吐、进食困难等严重的不良反应。因此,从传统中药中筛选具有良好抗乳腺癌活性的药物已成为近年来人们关注的热点。竹叶作为新开发的一类天然植物资源,已发现其具有抗癌活性。竹叶黄酮可显著抑制体内肝癌实体瘤的生长,延长荷瘤小鼠的寿命[4]。而竹叶多糖对移植性肿瘤有间接抑制作用,抑制率高达50%[5,8]。也有研究提示,竹叶提取物能通过刺激动物排泄和泌乳雌激素的分泌,促进免疫血清中超氧化物歧化酶活性,抑制乳腺肿瘤生长[3]。这提示竹叶提取物对乳腺癌具有一定的抑制作用。
细胞增殖过度和凋亡阻遏是肿瘤的基本特征。而在癌细胞恶性生长过程中,低氧或缺氧也是实质性肿瘤物理微环境的基本表现之一[9]。有文献证实,在低氧环境下乳腺癌细胞表现出恶性增殖趋势,HIF-1α和caspase-3可作为判断乳腺癌恶性程度和预后状况的重要指标[10]。研究发现HIF-1α在正常乳腺组织中少量或几乎不表达,而在乳腺癌组织中高表达[11]。本实验结果显示,竹叶提取物可浓度依赖性地抑制低氧条件下MCF-7细胞的增殖,促进MCF-7细胞凋亡,同时抑制HIF-1α的上调,诱导caspase-3表达,均证实了竹叶提取物具有良好的抗乳腺癌活性。另外,从竹叶中获得的一种天然光敏感剂可显著增加鳞状癌细胞系HSC2和HSC3 G2/M期细胞比例[12]。这提示竹叶提取物可能通过诱导乳腺癌细胞周期阻滞抑制其增殖。本实验结果显示不同浓度的竹叶提取物均可诱导低氧条件下MCF-7细胞阻滞在G2/M期,为竹叶提取物的抗乳腺癌作用提供了进一步的依据。
近年来,发现实体肿瘤中普遍存在低氧现象,而HIF-1α与低氧环境关系最为密切,其可在低氧状态下被激活并参与癌细胞增殖、凋亡等病理过程[13]。因此,HIF-1α及其上游信号通路成为目前针对肿瘤治疗的一个新靶点。一方面,Akt可促进下游靶蛋白GSK-3磷酸化、抑制HIF-1α降解使HIF-1α表达上调,另一方面,Akt也可通过激活下游mTOR表达促进HIF-1α基因转录[14]。文献表明,在胃癌中PI3K/Akt通路调控HIF-1α表达,提示HIF-1α介导的促肿瘤作用可能是受上游PI3K/Akt通路调节[15]。本实验发现,竹叶提取物可显著下调低氧条件下MCF-7细胞中Akt的磷酸化和HIF-1α的表达,且Akt激活剂IGF-1可逆转竹叶提取物对MCF-7细胞的抑制作用,提示竹叶提取物可能是通过下调Akt/HIF-1α信号通路来抑制低氧下MCF-7细胞恶性生长。
综上,本研究初步证实竹叶提取物可抑制低氧条件下MCF-7细胞的恶性增殖,且这种作用可能是通过抑制异常的Akt/HIF-1α信号通路而实现,初步肯定了竹叶提取物在乳腺癌中的重要作用,为竹叶在乳腺癌实体肿瘤中的应用提供了前期的理论依据和实验基础。但是其具体作用机制仍需进一步研究。
[1] 张华. CD40、HIF-1α、VEGF在乳腺导管癌中的表达及低氧对乳腺癌细胞株M231、MCF-7生物学行为的影响[D]. 苏州:苏州大学,2012:1-43.
[2] 张亚军,钱立庭,陈昌杰. 黄连素对乳腺癌MCF-7细胞增殖和凋亡的影响[J]. 安徽医科大学学报, 2015, 50(9):1276-1280.
[3] 夏玉红,董晋文,钟耕. 竹叶提取物的研究开发现状[J]. 中国食品添加剂,2009, (2):53-57.
[4] 黄宇玫,罗文艳. 竹叶黄酮对小鼠H22肿瘤抑制作用的研究[J]. 实用中西医结合临床, 2012, 12(5):1-3.
[5] 张永兵. 竹叶提取物对酪氨酸酶和黑色素瘤细胞的影响[D]. 北京:中国林业科学研究院, 2009:1-103.
[6] 葛嘉,祝青,余晓梅,等. 乳腺造影和弹性成像在乳腺癌诊断中的意义[J]. 中国实验诊断学, 2015, 19(8):1328-1329.
[7] 李静,范金虎,庞轶,等. 以医院为基础的全国多中心女性原发性乳腺癌临床流行病学调查[J]. 中国肿瘤, 2013, 22(4): 254-259.
[8] 郝培应,徐有明,皮忠来. 竹类植物衍生物的生理活性及其疗效的研究进展[J]. 世界林业研究, 2004, 17(3):21-24.
[9] DONG YL, RHIM T, LEE M. Cancer cell respiration: Hypoxia and pH in solid tumors[M]. New York: Springer, 2013:183-206.
[10] 马兆生,戴岳楚,谢伯剑,等. HIF-1α与caspase-3在乳腺癌中的表达及临床病理意义[J]. 现代肿瘤医学, 2011, 19(11):2216-2219.
[11] 闫哲,白立立,赵伟静, 等. HIF-1α E-cadherin在乳腺中的表达及意义[J]. 河北医学, 2015, 21(6):914-917.
[12] LIM SH, LEE HB, HO AS. A new naturally derived photosensitizer and its phototoxicity on head and neck cancer cells[J]. Photochem Photobiol, 2011, 87(5):1152-1158.
[13] 余平,刘晓旺,钟丽菲,等. 低氧微环境相关因子HIF-1α与癌症的研究[J]. 湖南生态科学学报, 2015, 2(2):52-56.
[14] 郭花,朱金水,王龙,等. PI3K/Akt信号通路及HIF-1α在胃癌中的表达[J]. 现代肿瘤医学, 2009, 17(10):1913-1916.
[15] MELILLO G. Targeting hypoxia cell signaling for cancer therapy[J]. Cancer Metastasis Rev, 2007, 26(2):341-352.
BambooleafextractinhibitsthemalignantgrowthofhumanbreastcancerMCF-7cellsbyregulatingtheAkt/HIF-1αpathwayunderhypoxicmicroenvironment
XU Qi-feng, WEN Xiao-qiong
(Department of Breast Surgery, Henan Province Hospital of TCM, Zhengzhou 450002, China)
ObjectiveTo investigate the effects of bamboo leaf extract on the malignant growth of human breast cancer MCF-7 cells under hypoxic microenvironment and the molecular mechanism.MethodsCultured human breast cancer MCF-7 cells were randomized into six groups: control group, hypoxia group, 0.2 μg/mL bamboo leaf extract group, 0.4 μg/mL bamboo leaf extract group, 0.8 μg/mL bamboo leaf extract group and 0.8 μg/mL bamboo leaf extract group treated with IGF-1. The cell proliferation activity in each group was determined using cell counting Kit-8 (CCK-8) assay. The expressions of proliferation markers PCNA, Ki-67 and CCK-8 MCM2 in MCF-7 cells were detected by RT-PCR and Western blot. Flow cytometer was used to analyze the cell cycle arrest and cell apoptosis. The protein expressions of Bax, Bcl-2, caspase-3 and survivin were measured by Western blot. Furthermore, the effect of Akt/HIF-1α pathway underlying bamboo leaf extract-mediated inhibition on cancer cell growth was also explored.ResultsAfter treatment with bamboo leaf extract, cell proliferation activity and the expressions of PCNA, Ki-67 and MCM2 under hypoxia were obviously inhibited in a dose-dependent manner (P<0.01). The proportion of MCF-7 cells upon hypoxia in the G2/M phase of the cell cycle was increased after treatment with bamboo leaf extract (P<0.01). The apoptosis rate of MCF-7 cells was enhanced after bamboo leaf extract stimulation, accompanied with an increased protein levels of Bax and caspase-3, and decreased expressions of Bcl-2 and survivin (bothP<0.01). Moreover, bamboo leaf extract down-regulated the expressions of p-Akt and HIF-1α in MCF-7 cells under hypoxia. IGF-1, an Akt/HIF-1α pathway agonist, reversed the inhibiting effect of bamboo leaf extract on the malignant growth of MCF-7 cells under hypoxia.ConclusionBamboo leaf extract inhibits the malignant growth of human breast cancer MCF-7 cells by suppressing the Akt/HIF-1α signaling pathway under hypoxic microenvironment.
bamboo leaf extract; MCF-7; proliferation; apoptosis; hypoxia; Akt/HIF-1α signaling pathway; Bax; Bcl-2; caspase-3
2017-03-30
2017-08-04
徐其锋,主治医师. E-mail: xuqifengxqf@126.com
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171205.1805.026.html(2017-12-05)
R737.9
A
10.7652/jdyxb201801026
(编辑 国 荣)
