Sox11在宫颈癌及其癌前病变中的表达及意义
2018-01-10吴晓玲李晓芳崔雨蒙高艳娥西安交通大学第二附属医院妇产科陕西西安70004温州医科大学附属慈溪医院慈溪市人民医院妇产科浙江慈溪35300
吴晓玲,厉 云,李 牧,李晓芳,崔雨蒙,杨 阳,高艳娥(. 西安交通大学第二附属医院妇产科,陕西西安 70004;. 温州医科大学附属慈溪医院慈溪市人民医院妇产科,浙江慈溪 35300)
Sox11在宫颈癌及其癌前病变中的表达及意义
吴晓玲1,厉 云2,李 牧1,李晓芳1,崔雨蒙1,杨 阳1,高艳娥1
(1. 西安交通大学第二附属医院妇产科,陕西西安 710004;2. 温州医科大学附属慈溪医院慈溪市人民医院妇产科,浙江慈溪 315300)
目的检测Sox11基因在宫颈癌细胞系和不同宫颈病变组织中的表达情况。方法应用免疫组织化学法和Western blot 技术检测Sox11蛋白在宫颈癌细胞系(HeLa、CaSki、SiHa和C-33A)以及在正常宫颈、低度及高度宫颈鳞状上皮内病变、宫颈浸润癌组织中的表达情况及差异,分析宫颈癌组织中Sox11蛋白表达与临床病理参数之间的相关性。结果Sox11蛋白在正常宫颈、低度宫颈鳞状上皮内病变中的表达显著高于高度宫颈鳞状上皮内病变及宫颈浸润癌组织中的表达,其表达随宫颈病变的进展而降低;Sox11蛋白在宫颈浸润癌中的表达随恶性程度增加而降低;Sox11蛋白在宫颈浸润癌中的表达与HPV感染有关,与年龄、临床分期、淋巴结转移及浸润肌层深度无相关性。结论Sox11表达与宫颈癌发生发展呈负相关,提示Sox11可能作为一个肿瘤抑制基因发挥作用,其表达缺失或低表达与宫颈癌的发生发展有关,是宫颈癌发生的早期事件,可能是宫颈组织恶变的一个信号。
Sox11基因;宫颈癌;免疫组化技术;免疫印迹法;抑癌基因
宫颈癌是全球女性发病率仅次于乳腺癌的第二大恶性疾病,在肿瘤相关性死亡疾病中排名第四,全世界每年新增宫颈癌患者约50余万例,死亡约20余万例,超过85%发生于发展中国家[1]。我国每年新增病例超过13万,约占全世界总数的1/4,位居妇女生殖道恶性肿瘤的第一位,严重危害妇女的健康和生命[2]。Sox11作为胚胎发育中与细胞增殖、分化、凋亡相关的调节基因,在一些实体恶性肿瘤和淋巴造血肿瘤中对肿瘤细胞的存活、生长和转化有一定影响[3]。在生殖道恶性肿瘤中,目前已有研究报道Sox11在卵巢癌[4]中的表达,但国内外尚无报道其在宫颈癌中的作用及机制。本研究检测Sox11基因在宫颈癌细胞系和不同宫颈病变组织中的表达情况,分析其表达与临床病理参数之间的相关性,为宫颈癌的发病机制、预防、诊断和治疗提供理论依据。
1 对象与方法
1.1细胞系及细胞培养畸胎瘤细胞株Tera-1和宫颈癌细胞株HeLa、SiHa、CaSki 和C-33A均购自美国模式培养物集存库(American type culture collection, ATCC)细胞库。采用含100 mL/L胎牛血清的DMEM高糖培养基及McCoy’s 5A 培养基,于37 ℃、50 mL/L CO2细胞培养箱中静置培养。取对数生长期的细胞进行冻存、复苏、传代,重新放置于37 ℃、含50 mL/L CO2饱和湿度细胞培养箱中培养,分别提取各组细胞的核蛋白。
1.2组织取材与标本处理54例宫颈癌组织为2015年4月-2016年3月间在西安交通大学第二附属医院妇产科住院的宫颈癌住院患者,年龄范围为43~69岁,中位年龄55岁。肿瘤患者术前或取材前均未接受放疗及化疗,早期患者手术行广泛全子宫加/不加双侧附件切除+盆腔淋巴结清扫术,术后进一步病理确诊,于癌灶中心部位切取小块组织。晚期患者在同步放化疗前活检获得癌组织标本。采用国际妇产科联盟( FIGO,2009) 的标准对54例宫颈癌组织临床分期和病理分级,其中FIGOⅠ期6例,Ⅱ期42例,Ⅲ~Ⅳ期6例;病理I级20例,病理Ⅱ~Ⅲ级34例;年龄小于45岁者8例,年龄大于等于45岁者46例;浅肌层浸润者22例,深肌层浸润者32例;有淋巴结转移者10例,无淋巴结转移者44例;HPV感染阳性者50例,HPV感染阴性者4例。
宫颈癌前病变组织来自同期门诊活检及住院手术患者。根据2014年第四版WHO女性生殖系统所采用的分类法[5]分为低度鳞状上皮内病变(low grade squamous intraepithelial lesion, LSIL)和高度鳞状上皮内病变(high grade squamous intraepithelial lesion, HSIL),其中LSIL 20例,HSIL 24例。
30例正常宫颈组织来自于同时期宫颈HPV及液基细胞学检查均阴性的子宫肌瘤子宫全切术患者。
所有标本均经查阅病例资料并由本院病理医师复阅HE切片证实。所取组织一部分用新鲜配制40 g/L多聚甲醛(pH 7.4)固定后石蜡包埋处理;另一部分装入已编号的灭菌冻存管中,迅速放入液氮转移罐中,再转至―80 ℃超低温冰箱长期保存,随机抽取8例正常宫颈组织和20例宫颈癌组织分别进行总蛋白提取待后续实验使用。以上标本的获取均取得患者知情同意。
1.3Westernblot检测Sox11蛋白的表达情况分别将提取的宫颈癌细胞系(HeLa、CaSki、SiHa和C-33A)核蛋白和随机抽取的8例正常宫颈组织和20例宫颈癌组织的提取总蛋白进行Western blot检测。制备凝胶,样品制备,上样,电泳后转膜,封闭,抗体孵育,其中一抗为兔抗人Sox11多克隆抗体(1∶1 000,Santa Cruz)及鼠抗人GAPDH单克隆抗体(1∶1 000,Santa Cruz),二抗为HRP-羊抗兔抗体(1∶10 000,Pierce)和HRP-羊抗鼠抗体(1∶10 000,Pierce),自动曝光仪器曝光显影,用Image J进行灰度分析。
1.4免疫组织化学检测兔抗人多克隆Sox11抗体购自美国Santa Cruz(货号sc-20096)。采用免疫组织化学SP 法检测各组宫颈组织标本中Sox11的表达,其中30例正常宫颈组织(NC)、20例低度鳞状上皮内病变(LSIL)、24例高度鳞状上皮内病变(HSIL)和54例宫颈癌(CC)临床标本。将4 μm厚石蜡切片烤干,于二甲苯液中脱蜡,梯度浓度乙醇脱水,30 mL/L H2O2溶液消除内源性过氧化物酶的活性,EDTA 修复液常规修复,玻片封闭,孵育盒中抗体孵育暴露抗原,加入山羊血清,依次滴加一抗(1∶1 000),二抗(1∶1 000),DBA 显色,苏木精复染,烘干封片(Sox11的抗体工作液稀释比为1∶200,PBS代替一抗作为对照组) 。
结果判定:Sox11染色阳性者为细胞核呈棕黄色或黄色者为准。取有代表性的5个高倍视野(×1 000)进行计数。根据染色强度和细胞染色阳性率进行评分:未着色为1分,淡黄色为2分,黄色为3分,棕黄色为4分;按着色细胞与计数细胞的百分比记为1(0%~25%)、2(26%~50%)、3(51%~75%)、4(76%~100%)。每张切片染色强度与染色阳性率的得分相乘后得到最后得分即免疫反应评分(immunoreactivity score, IRS):1~4分为Sox11 阴性(―),5~9分为(+),10~16分为()。
1.5Sox11蛋白表达与宫颈浸润癌的临床病理参数的关系分析各种临床因素(如患者年龄、HPV感染、临床分期、淋巴结转移、浸润肌层深度)与Sox11在宫颈癌组织中的表达情况及其相关性。
1.6统计学处理所有实验资料经GraphPad Prism 5软件处理,结果都以均值±标准差表示,计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异具有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1宫颈癌细胞系中Sox11的表达Western blot结果(图1)显示,宫颈癌细胞系中Sox11蛋白表达条带为46.7 ku;阳性对照人畸胎瘤细胞系Tera-1中Sox11蛋白高表达,在宫颈癌细胞系中均未检测到HeLa、C-33A、CaSki、SiHa的表达。
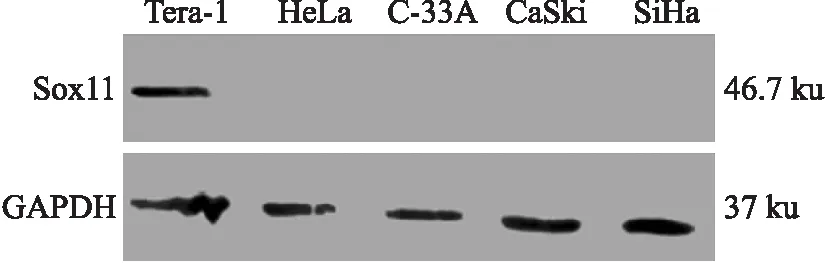
图1Westernblot检测Sox11在宫颈癌细胞系中的表达
Fig.1 Western blot detecting Sox11 expression in cervical cancer cell lines
2.2正常宫颈组织及宫颈癌组织中Sox11的表达情况
Western blot结果(图2)显示,8例 正常宫颈组织中均检测出Sox11蛋白;而20例宫颈癌组织中均为弱表达或不表达;以GAPDH为内对照,采用Image J灰度分析软件进行定量分析的结果显示(图2),相对于正常宫颈,Sox11在宫颈癌组织中表达水平显著下降(P<0.000 1)。
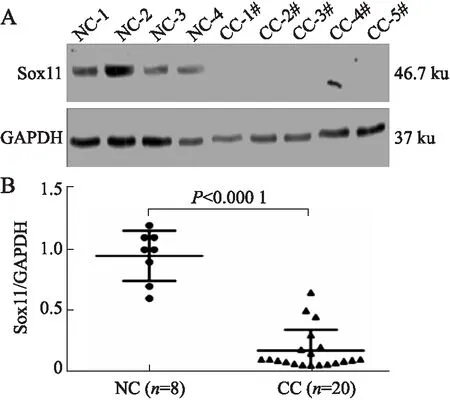
图2Westernblot检测Sox11在正常宫颈组织和宫颈癌组织中的表达
Fig.2 Western blot detecting Sox11 expression in normal cervical tissue and cervical cancer
NC:正常宫颈;CC:宫颈癌。
2.3各组宫颈组织Sox11的免疫组织化学检测结果Sox11蛋白定位于细胞核中,强表达于NC和LSIL上皮基底层细胞,而弱表达或不表达于HSIL和CC的肿瘤实质细胞中(图3A);各组IRS染色评分分别为NC(9.933±5.192)、LSIL(7.200±3.427)、HSIL(4.917± 2.412)及CC(3.074±2.214),各组间差异具有统计学意义(P<0.05,图3B)。128例不同病变宫颈组织中,Sox11表达阳性率分别为NC73.33%(22/30)、LSIL65.00%(14/20)、HSIL41.67%(10/24)及CC 22.22%(12/54),组间比较差异有统计学意义(P<0.001);CC组Sox11阳性率显著低于NC组(P<0.001),CC组与LSIL组差异有统计学意义(P=0.023),CC组与HSIL、NC组与LSIL组、NC组与HSIL组、LSIL组与HSIL组比较差异无统计学意义(P=0.175,P=0.739,P=0.040,P=0.264,图3C)。
2.4Sox11蛋白表达与宫颈浸润癌的临床病理参数的关系Sox11蛋白在低度恶性(病理分级为Ⅰ级)的宫颈癌中的阳性表达率(45.00%)显著高于中、高度恶性者(病理分级为Ⅱ、Ⅲ级)(8.82%),差异有统计学意义(P<0.01)。Sox11蛋白在HPV阴性的宫颈癌中的阳性表达率(83.33%)显著高于HPV阳性者(14.00%),差异有统计学意义(P<0.05,表1),提示Sox11蛋白的表达与HPV感染有关。而Sox11蛋白表达与患者年龄、临床分期、淋巴结转移、浸润肌层深度无相关性(P>0.05)。
表1Sox11表达与宫颈浸润癌临床病理参数的关系
Tab.1 The relationship between Sox11 expression and clinicopathologic parameters of cervical cancer
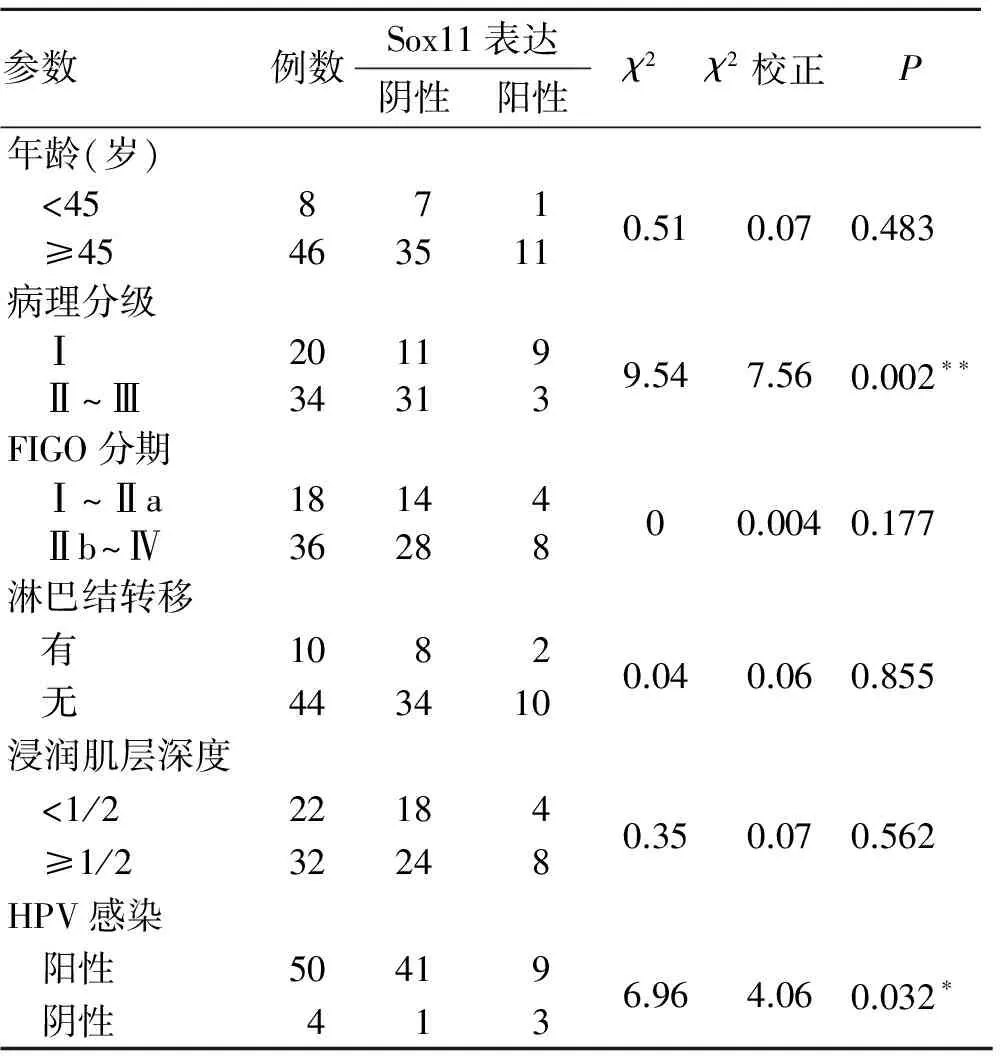
参数例数Sox11表达阴性阳性χ2χ2校正P年龄(岁) <45871 ≥454635110.510.070.483病理分级 Ⅰ20119 Ⅱ~Ⅲ343139.547.560.002∗∗FIGO分期 Ⅰ~Ⅱa18144 Ⅱb~Ⅳ3628800.0040.177淋巴结转移 有1082 无4434100.040.060.855浸润肌层深度 <1/222184 ≥1/2322480.350.070.562HPV感染 阳性50419 阴性4136.964.060.032∗
*P<0.05,**P<0.01。

图3不同宫颈上皮病变Sox11的免疫组织化学染色
Fig.3 IHC detecting Sox11 in different cervical intraepithelial lesions (×1 000)
NC:正常宫颈;LSIL:低度鳞状上皮内瘤变;HSIL:高度鳞状上皮内瘤变;CC:宫颈癌。A:Sox11在NC(a2)、LSIL (b2)、HSIL(c2)和CC(d2)组织中的免疫染色,a1~d1,相应的阴性对照;B:Sox11的IRS比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;C:不同宫颈上皮病变组织中Sox11阳性细胞百分率的比较。
3 讨 论
宫颈癌的发生与发展是在各种高危因素的基础上,由人类乳头瘤病毒通过不同的作用机制使细胞增殖、凋亡失衡所致[6],包括众多原癌基因的激活与抑癌基因的异常调控等[7]。研究表明,干细胞相关基因Sox家族基因编码的蛋白是一类重要的转录调控因子,控制基因表达,调控机制的异常可导致细胞蛋白的错误表达[8]。Sox11作为胚胎发育中与细胞增殖分化凋亡相关的调节基因,在一些实体恶性肿瘤和淋巴造血肿瘤中对肿瘤细胞的存活、生长和转化有一定影响。
本研究分析了Sox11在正常宫颈及不同宫颈病变组织中的表达情况,发现随着宫颈病变的不断进展,Sox11蛋白的表达下降,提示Sox11的表达与宫颈癌的发生呈负性相关,而Sox11蛋白在低度恶性的宫颈癌中的阳性表达率显著高于中高度恶性者,提示Sox11的表达随着宫颈癌恶性程度的增加而降低。由此推断宫颈癌的发生过程可能与Sox11表达沉默有关,Sox11在宫颈癌发生中扮演着一个抑癌基因的角色。
但是,其在宫颈癌中具体的失活机制尚不明确。有关Sox11的结构研究发现其5′端含有多个CpG岛,提示其表达下调有可能是受启动子区DNA高甲基化修饰的调控[9-10]。SERNBO等[4]对154例原位侵袭性卵巢上皮细胞癌组织和5株卵巢上皮细胞癌细胞甲基化状态进行研究,发现其中3株细胞出现Sox11基因启动子区高甲基化及mRNA和蛋白的表达缺失,另2株细胞其Sox11基因启动子呈现非甲基化且mRNA和蛋白表达正常;用去甲基化药物5-Aza-CdR作用于Sox11基因低表达而启动子区DNA高甲基化的细胞,则Sox11基因mRNA和蛋白表达恢复,这说明其启动子区DNA的高甲基化同卵巢上皮细胞癌的细胞增殖和分化密切相关。提示Sox11基因的DNA高甲基化可能在恶性肿瘤的发生发展中起重要作用。
也有研究发现,在不同的恶性肿瘤中Sox11的表达调控机制并不完全相同甚至恰恰相反[11]。乙酰化是Sox11的共价修饰形式之一,其水平增加与转录活性增强有关,组蛋白乙酰化可影响相应的染色体结构,改变基因转录水平,继而影响细胞周期、分化及凋亡等调控,从而引起肿瘤的发生[11]。VEGLIANTE等[12]研究淋巴样肿瘤中Sox11基因表达与表观遗传学的相关性时发现,Sox11基因低表达的细胞系无论是否处于甲基化状态,应用组蛋白乙酰化抑制剂(SAHA)都可逆转Sox11 基因的表达,而甲基化转移酶抑制剂(AZA)不能使其表达上调或上调不明显,因此,推测Sox11基因的表达与组蛋白的沉默调控有关。
本研究还发现Sox11蛋白表达与HPV感染密切相关,而HPV感染是宫颈癌发生的一个关键因素,HPV的E6基因在宫颈癌的发生发展中具有重要作用,HPV16的E6基因能够经泛素化途径诱导p53的降解,抑制p53作为抑制基因的功能[13]。而Sox11在宫颈癌发生发展中的表达是否与HPV的E6基因和抑癌基因p53有某种联系及其有无相互作用和具体作用机制,目前仍不明确。下一步有必要扩大样本量并长期追踪,从表观遗传学等角度进行一系列体内外实验,证实Sox11作为抑癌基因在宫颈癌发生发展中发挥作用,并阐明其作用机制。
[1] TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2] 马丁.中国妇女宫颈癌流行病学及临床特征的变迁[C]. 中国福建厦门, 2012: 8.
[3] SIMONSEN AT, SORENSEN CD, EBBESEN LH, et al. SOX11 as a minimal residual disease marker for Mantle cell lymphoma[J]. Leuk Res, 2014, 38(8):918-924.
[4] SERNBO S, GUSTAVSSON E, BRENNAN DJ, et al. The tumour suppressor SOX11 is associated with improved survival among high grade epithelial ovarian cancers and is regulated by reversible promoter methylation[J]. BMC Cancer, 2011, 11:405.
[5] DARRAGH TM, COLGAN TJ, THOMAS COX J, et al. The lower anogenital squamous terminology standardization project for HPV-associated lesions: Background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology[J]. Int J Gynecol Pathol, 2013, 32(1):76-115.
[6] WOODMAN CB, COLLINS SI, YOUNG LS. The natural history of cervical HPV infection: Unresolved issues[J]. Nat Rev Cancer, 2007, 7(1):11-22.
[7] 庄勋,顾晓梅,何爱琴,等. 宫颈癌危险因素的流行病学调查[J]. 中国妇幼保健, 2008, (28):4053-4056.
[8] 王钰婷,薛立辉,聂刘旺. SOX基因与肿瘤关系的研究进展[J]. 癌变畸变突变, 2009, (1):77-80.
[9] PAMNANI M, SINHA P, NARA S, et al. Study of promoter DNA methylation of Sox11 and its correlation with tissue-specific expression in the laboratory mouse[J]. Gene, 2014, 552(1):133-139.
[10] NORDSTROM L, ANDERSSON E, KUCI V, et al. DNA methylation and histone modifications regulate SOX11 expression in lymphoid and solid cancer cells[J]. BMC Cancer, 2015, 15:273.
[11] VERDONE L, AGRICOLA E, CASERTA M, et al. Histone acetylation in gene regulation[J]. Brief Funct Genomic Proteomic, 2006, 5(3):209-221.
[12] VEGLIANTE MC, ROYO C, PALOMERO J, et al. Epigenetic activation of SOX11 in lymphoid neoplasms by histone modifications[J]. PLoS One, 2011, 6(6):e21382.
[13] JONES EE, WELLS SI. Cervical cancer and human papillomaviruses: Inactivation of retinoblastoma and other tumor suppressor pathways[J]. Curr Mol Med, 2006, 6(7):795-808.
TheexpressionandclinicalsignificanceofSox11incervicalcarcinogenesis
WU Xiao-ling1, LI Yun2, LI Mu1, LI Xiao-fang1, CUI Yu-meng1, YANG Yang1, GAO Yan-e1
(1. Department of Obstetrics and Gynecology, the Second Affiliated Hospital of Jiaotong University Health Science Center, Xi’an 710004; 2. Department of Obstetrics and Gynecology, the Affiliated Cixi Hospital of Wenzhou Medical University, Cixi 315300, China)
ObjectiveTo explore the expression level of Sox11 gene in cervical cancer cell lines and cervical pathology tissue.MethodsThe expression of Sox11 protein was detected in cervical cancer cell lines HeLa, CaSki, SiHa and C-33A as well as NC, LSIL, HSIL and CC using immunohistochemistry and Western blot. We analyzed the relationship between Sox11 expression in cervical cancer and clinicopathologic parameters.ResultsThe expression of Sox11 protein in normal cervical tissue, low-grade cervical squamous intraepithelial neoplasia was significantly higher than that in the high-grade cervical squamous intraepithelial neoplasia and invasive cervical cancer tissue, and the expression was reduced with the progression of cervical lesions.The expression of Sox11 protein in the invasive cervical cancer was reduced with increased malignant degree. The expression of Sox11 protein in the invasive cervical cancer was significantly correlated with HPV infection, but not associated with the age, clinical stage, lymph node metastasis or muscular infiltration depth.ConclusionSox11 expression is negatively correlated with cervical cancer development, suggesting that as a tumor suppressor gene, Sox11 may play a role in cervical cancer development and its absence or low expression is associated with the development of cervical cancer and is an early event of cervical carcinogenesis and may be a sign of malignant change of cervical tissue.
Sox11 gene; cervical cancer; immunohistochemical technique; Western blot; tumor suppressor gene
2017-04-03
2017-09-13
陕西省科学技术研究发展计划项目(No.2017SF-013);西安交通大学第二附属医院科研基金项目[No.YJ(QN)201501]
Supported by the Sci-tech Program Foundation of Shaanxi Province (No.2017SF-013) and the Youth Scientific Research Foundation of the Second Affiliated Hospital of Xi’an Jiaotong University [No.YJ(QN)201501]
高艳娥,教授,博士生导师. E-mail: yanegao@163.com. 厉云为共同第一作者.
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171205.1455.002.html(2017-12-05)
R737.33
A
10.7652/jdyxb201801016
(编辑 国 荣)
