甲状腺乳头状癌合并代谢综合征患者的复发特点
2018-01-10殷德涛何华楠马润声李红强王勇飞江金花王庆端郑州大学第一附属医院甲状腺外科河南省高等学校临床医学重点学科开放实验室河南郑州45005河南省医药科学研究院河南郑州45005
殷德涛,何华楠,马润声,李红强,王勇飞,江金花,王庆端(. 郑州大学第一附属医院甲状腺外科,河南省高等学校临床医学重点学科开放实验室,河南郑州 45005;. 河南省医药科学研究院,河南郑州 45005)
甲状腺乳头状癌合并代谢综合征患者的复发特点
殷德涛1,何华楠1,马润声1,李红强1,王勇飞1,江金花2,王庆端2
(1. 郑州大学第一附属医院甲状腺外科,河南省高等学校临床医学重点学科开放实验室,河南郑州 450052;2. 河南省医药科学研究院,河南郑州 450052)
目的分析合并代谢综合征及其组分的甲状腺乳头状癌患者的复发特点。方法回顾性分析郑州大学第一附属医院2010年1月1日至2015年12月31日,于甲状腺外科初次手术后复发的甲状腺乳头状癌患者。比较伴与不伴代谢异常的复发甲状腺乳头状癌的结节大小、淋巴结转移分区、复发时间及术后浸润几率之间的差异。结果82例复发甲状腺乳头状癌中,男性34例,女性48例,经典代谢综合征分组方法下的两组差异无统计学意义。当以同时合并2个以上代谢异常为依据分组时,发现代谢综合征组初发时淋巴结转移分级较低,尤其以女性患者显著(P=0.002),而且复发时间较短,男性差异有统计学意义(P=0.036);分析合并单一代谢异常组分者,男性患者复发时间较短(P血糖=0.034,P血脂=0.037,PBMI=0.004)。结论合并代谢异常的甲状腺乳头状癌患者,尤其是同时合并2种以上代谢综合征组分,或超重肥胖的患者,甲状腺癌复发风险增加。
代谢综合征;肥胖;甲状腺乳头状癌;复发;淋巴结转移
代谢综合征(metabolic syndrome, MetS)由多种常见的营养代谢紊乱组合而成,它包括肥胖、糖代谢紊乱、高血压、血脂异常等。近年来,MetS的发病率逐年上升,成为主要威胁大众健康的疾病之一。越来越多的研究表明,MetS与癌症的发生发展相关,常见的有肝癌、结肠癌、胰腺癌及乳腺癌,其中尤以糖代谢异常和肥胖这两种组分对癌症的影响为明显[1]。而近年来甲状腺癌的发病率也显著增加,大部分为甲状腺乳头状癌(papillary thyroid carcinoma, PTC)。ALMQUIST等[2]联合奥地利、挪威、瑞典等欧洲医学研究机构,就MetS对甲状腺癌发病率的影响做了相关研究,发现糖代谢异常与身体质量指数(body mass index, BMI)异常与甲状腺癌发生有关。但是,MetS对甲状腺癌复发的关系尚不清楚。为此,本研究收集了郑州大学第一附属医院2010年至2015年的82例PTC复发的患者资料,回顾性分析伴与不伴MetS的复发患者的特点。
1 资料与方法
1.1一般资料回顾性分析郑州大学第一附属医院2010年1月1日至2015年12月31日,于甲状腺外科初次手术后复发的患者,包括曾经核医学科确诊病情已控制,Tg再次突然升高而行I131治疗的患者共193例。资料纳入标准:①所有患者均于本院行甲状腺手术,有明确的手术记录;②所有患者均满足随访1年以上;③于术后坚持按要求服用左旋甲状腺素片;④近 5年来患者体质量波动在5 kg内。排除标准:①患者发病年龄<18周岁;②家族中2例或2例以上甲状腺滤泡上皮细胞起源的甲状腺癌;③儿童时期有颈部放射史的患者;④数据不完整。经病历资料回顾、电话及门诊随访,结合纳入标准及排除标准共获得了85例甲状腺癌复发数据。经病理医师复核病理切片,证实2次手术病理结果与术后诊断一致,结合核医学科医师对比判断前后碘扫描图像,最终纳入82例PTC复发患者。
1.2定义、指标检测及方法目前,关于MetS的定义不尽相同,我们采用2004年中华医学会糖尿病学分会的MetS诊断标准,具备以下4项组成成分中的3项或全部者诊断为MetS:①超重和/或肥胖,BMI≥25.0 kg/m2;②高血糖,空腹血糖(fasting blood glucose, FBG)≥6.1 mmol/L,和(或)糖负荷后2 h血糖≥7.8 mmol/L,和(或)已确诊为糖尿病并治疗者;③高血压,血压≥140/90 mmHg(1 mmHg=0.133 kPa),和(或)已确诊为高血压并治疗者;④血脂紊乱,空腹血TG≥1.7 mmol/L,和(或)空腹血HDL-C<0.9 mmol/L(男)或<1.0 mmol/L(女)。甲状腺癌的TNM分级及复发危险度,均依照2013年中华医学会出版的《甲状腺结节和分化型甲状腺癌诊疗指南》评定。患者的一般情况及代谢指标由入院时常规检查测得,考虑到如血糖、血压等在治疗状态下,入院体检结果可能正常,故所有患者均电话随访核对病情,对有争议的指标再次评估。
所有患者经术前评估后,均至少接受患侧腺叶+峡部切除术,对有颈部淋巴结转移的患者,行双侧腺叶切除术加行颈清扫术,并于术后行I131治疗。将资料依据是否合并MetS分为2组,比较伴MetS复发组与不伴MetS复发组,在结节分级、大小、淋巴结转移分区、复发时间及术后浸润几率之间的差异。术后远处血行转移,及病理报道有突破包膜,浸润周围软组织标记为复发浸润或远处转移。我们也分析了单一组分,以及同时合并MetS其中2个以上组分时的复发特点差异。
1.3统计学方法采用SPSS 21.0统计学软件进行统计分析。对于正态分布的定量资料并方差齐的用t检验,非正态分布及等级资料用秩和检验,分类资料用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
82例复发的PTC患者,男性34例,女性48例,约 7∶10。这些复发患者的平均初发年龄为:男(51.47±3.28)岁,女(50.17±3.13)岁,二者差异无统计学意义(P=0.78)。其中患糖尿病女性占21%(10/48),男性占11%(4/34);高血压女性占38%(18/48),男性占47%(16/34);血脂异常女性占38%(18/48),男性占29%(10/34);超重或肥胖女性占50%(24/48),男性占76%(16/34)。所有观察指标的数据均进行了以性别和年龄(45岁)为分层因素的差异分析。我们发现有代谢异常的复发PTC患者有癌灶直径相对较大、复发时间较短、初次淋巴结转移级别较低的倾向。以MetS分组观察复发PTC特点的结果见表1。
在性别分层下比较不同的代谢异常,对于超重或肥胖的女性PTC复发患者,她们相较于体质量正常的患者癌灶较大(P=0.001);男性患者虽然癌灶直径均数较大,二者差异却无统计学意义(P=0.816)。比较这些复发患者首次就诊时淋巴结转移情况,同时合并2个以上代谢异常的复发PTC,初发时淋巴结转移分级较低,尤其在女性患者(P=0.002),其差异有统计学意义;血压高的患者也分级较低,男性患者(P=0.046),女性患者(P=0.006);比较复发时浸润或远处转移情况,发现合并超重或肥胖患者,与正常体质量患者的侵袭率有差异(P=0.001),同时合并两种以上代谢异常的男性患者的侵袭率也不同 (P=0.002)。比较复发时间发现,除合并高血压的患者外,大部分代谢异常的患者复发时间较短,差异有统计学意义。首次发现PTC时的癌灶大小及淋巴结转移特点详见表2。复发PTC的侵袭性及复发的时间见表3。在年龄分层下,发现同时合并两个以上代谢异常的复发PTC患者,其初发时评估的复发危险度较低,尤其在<45岁的患者中,其差异有统计学意义(P=0.019)。其他指标差异无统计学意义。
表1伴与不伴代谢综合征的82例PTC复发患者的临床特点比较
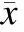

3 讨 论
甲状腺癌是常见的颈部恶性肿瘤,近年来发病率逐年上升,2003-2007年间我国甲状腺癌发病率以14.51%的速度上升。城市的发病率比农村增长较快,女性是男性的3.38倍[3]。本组复发数据女性是男性1.43倍。甲状腺癌的预后差异较大,其中以PTC发病率最高且预后最好[4]。由于其他病理类型的甲状腺癌病例较少,因此我们的分析主要立足于PTC。MetS诊断方法尚未统一,但多以中心性肥胖和胰岛素分泌异常为主要指标[5]。我们以经典的MetS诊断标准分组的研究显示,观察指标均无统计学意义。当我们分析同时合并两个以上组分的MetS(≥2)时发现,男性复发时,远处血行转移或周围浸润率相较于MetS(<2)低。但这并不能说明合并MetS(≥2)的PTC侵袭性低。这可能与MetS(≥2)提高了本身侵袭能力并不高的PTC复发的可能性有关。因而在统计学上降低了MetS组侵袭性高的PTC患者的比例,而这也有待于以PTC病理亚型分层进行进一步的比较。女性的侵袭性比较虽然在统计学上无差异,但在初次淋巴结转移区域上的差别有意义。也就是说,合并有MetS(≥2)的女性患者,即使无转移或近处转移PTC的复发率也提高了。我们在评估复发危险度分层时也同样得到了类似的结果。我们发现复发PTC的MetS(≥2)组本身的复发危险度是相对较低的,尤其在年龄<45岁组。
表2合并不同代谢异常的复发PTC患者在初发时的肿瘤大小及淋巴结转移情况
Tab.2 The primary tumor size and lymphatic metastasis level in different metabolic disorders

参数肿瘤大小(cm, x±s)男P女P淋巴结转移a(秩均值)男P女P血糖正常高1.99±1.191.50±0.710.4171.88±1.021.44±0.850.2078.909.750.73613.299.500.109血压正常高2.38±1.181.36±0.830.0081.65±0.762.02±1.290.19810.617.190.04614.539.110.006血脂正常异常1.86±1.272.08±0.870.6191.99±1.971.44±0.760.0578.3310.600.23812.9011.800.591BMI≥25kg/m2无有1.85±0.931.96±1.230.8161.25±0.672.33±0.970.0018.889.040.95213.7111.290.209MetS2b无有2.20±1.211.66±1.060.1771.63±0.871.95±1.100.2519.138.890.90515.549.460.002MetS3c无有2.07±1.201.33±0.580.3301.83±1.051.67±0.820.6249.148.330.74113.449.670.089
a:淋巴结转移按等级资料分4级,0:无淋巴结转移;1:中央区淋巴结转移;2:(Ⅲ、Ⅳ)颈侧区淋巴结转移;3:(Ⅰ、Ⅱ、Ⅴ)远处淋巴结转移;
b:≥2个MetS组分的代谢异常;c:≥3个MetS组分的代谢异常,即经典诊断标准的MetS。
表3合并不同代谢异常的复发PTC患者的复发时间及侵袭情况
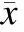


MetS的中心发病环节是胰岛素抵抗(insulin resistance, IR)。IR通过影响糖、脂肪、蛋白质等物质代谢和血管壁等组织生长影响机体运作[6]。因此,IR也是肥胖、糖尿病等代谢紊乱的特点。关于高胰岛素血症与甲状腺癌关系的研究鲜有报道,但是却有很多研究发现胰岛素受体在甲状腺癌组织中过表达,可能与甲状腺癌的早期的发生发展有关。PITOIA等[7]研究了IR与甲状腺癌复发的关系,发现IR增加了甲状腺癌的复发率。其中影响较大的是胰岛素样生长因子(insulin-like growth factor-I, IGF-I),它在癌组织中起到促进有丝分裂和抗凋亡的作用[8],与之相应的受体IGF-IR也在甲状腺癌组织中高表达。胰岛素和IGF有着共同的信号通路,其混合受体IR/IGF-IR通过MAPK与PI3K-AKT信号传导通路,介导促进细胞的生长与分化。
在代谢综合征组分的比较中,我们发现超重或肥胖的甲状腺癌患者的癌灶直径较大且复发时间较短。这与之前的研究结果相似,虽然2010年PAES等[9]发现BMI虽然与甲状腺癌发病率相关但与预后无关。但在之后的研究中,DIERINGER等[10]分析了1 077例PTC患者。KIM等[11]分析了2 057例PTC患者的病理特点,均发现有较高BMI的PTC患者的癌灶更大,TNM分期更高。HARARI等[12]分析了443例PTC患者,发现高BMI值甚至与PTC 的病理亚型相关。超重肥胖与甲状腺癌关系的机制尚不明确,可能是因为初次手术时,脂肪组织较多影响了对淋巴结清扫范围的判断,从而使复发率增加,也可能与脂肪细胞分泌的脂联素和瘦素有关。已有研究表明这些由脂肪细胞分泌的细胞因子,可能影响着TSH受体的表达和甲状腺自身免疫[13],从而在甲状腺癌的发生发展中起到一定作用。MARCELLO等[14]首次尝试研究了瘦素蛋白表达的相关基因LEP,LEPR的多态性,这些基因的多态性已经被证实与乳腺癌、胰腺癌、肺癌等多种类型的恶性肿瘤相关。他们发现,基因LEP rs7799039和rs2167270的多态性,影响了DTC患者血清瘦素浓度和DTC的进展。此外,已有研究表明糖尿病与甲状腺癌的发病相关。但是,本研究结果显示糖尿病与甲状腺癌的复发无关,这可能因为本研究中共7例糖尿病患者,5例接受了治疗,且治疗药物中均有二甲双胍。而二甲双胍可能降低甲状腺癌的发病率和复发率[15-16]。
本研究为回顾性研究,且为了保证资料的完整性,排除了首次于外院就诊的患者,因而纳入的样本数量有限。虽然BMI可评估肥胖的类型,但并不能严格代表。甲状腺乳头状癌本身病理亚型与预后密切相关。因此,在病例足够的情况下将病理亚型的侵袭性考虑在内将会得到更为可靠的结果。
综上所述,代谢异常可能增加了甲状腺乳头状癌患者的复发风险。同时合并2个以上代谢综合征组分时,应再评估淋巴结转移情况,做出最佳的清扫范围。对于超重或肥胖的甲状腺癌患者,即使初次手术评估侵袭性不高,也应严格按时随访,甚至增加早期随访频率。
[1] GALLAGHER EJ, LEROITH D. Epidemiology and molecular mechanisms tying obesity, diabetes, and the metabolic syndrome with cancer[J]. Diabetes Care, 2013, 36 (Suppl 2):S233-239.
[2] ALMQUIST M, JOHANSEN D, BJORGE T, et al. Metabolic factors and risk of thyroid cancer in the metabolic syndrome and Cancer project (Me-Can)[J]. Cancer Cause Control, 2011, 22(5):743-751.
[3] 刘玉琴,张书全,陈万青,等. 中国2003-2007年甲状腺癌发病死亡现状及流行趋势分析[J]. 中华流行病学杂志, 2012, 33(10):1044-1048.
[4] CABANILLAS ME, MCFADDEN DG, DURANTE C. Thyroid cancer[J]. Lancet, 2016, 6736 (16):30172-30176.
[5] O’NEILL S, O’DRISCOLL L. Metabolic syndrome: A closer look at the growing epidemic and its associated pathologies[J]. Obes Rev, 2015, 16(1):1-12.
[6] SOETERS MR, SOETERS PB. The evolutionary benefit of insulin resistance[J]. Clin Nutr, 2012, 31(6):1002-1007.
[7] PITOIA F, ABELLEIRA E, BUENO F, et al. Insulin resistance is another factor that increases the risk of recurrence in patients with thyroid cancer[J]. Endocrine, 2015, 48(3):894-901.
[8] MALAGUARNERA R, MORCAVALLO A, BELFIORE A. The insulin and igf-I pathway in endocrine glands carcinogenesis[J]. J Oncol, 2012, 2012:635614.
[9] PAES JE, HUA K, NAGY R, et al. The relationship between body mass index and thyroid cancer pathology features and outcomes: A clinicopathological cohort study[J]. J Clin Endocrinol Metab, 2010, 95(9):4244-4250.
[10] DIERINGER P, KLASS EM, CAINE B, et al. Associations between body mass and papillary thyroid cancer stage and tumor size: A population-based study[J]. J Cancer Res Clin Oncol, 2015, 141(1):93-98.
[11] KIM HJ, KIM NK, CHOI JH, et al. Associations between body mass index and clinico-pathological characteristics of papillary thyroid cancer[J]. Clin Endocrinol (Oxf), 2013, 78(1):134-140.
[12] HARARI A, ENDO B, NISHIMOTO S, et al. Risk of advanced papillary thyroid cancer in obese patients[J]. Arch Surg, 2012, 147(9):805-811.
[13] DUNTAS LH, BIONDI B. The interconnections between obesity, thyroid function, and autoimmunity: The multifold role of leptin[J]. Thyroid, 2013, 23(6):646-653.
[14] MARCELLO MA, CALIXTO AR, MARTINS DE ALMEIDA JF, et al. Polymorphism in LEP and LEPR may modify leptin levels and represent risk factors for thyroid cancer[J]. Int J Endocrinol, 2015, 2015:1-8.
[15] TSENG CH. Metformin reduces thyroid cancer risk in taiwanese patients with type 2 diabetes[J]. PLoS One, 2014, 9(10):e109852.
[16] JANG EK, KIM WG, KWON H, et al. Metformin is associated with a favorable outcome in diabetic patients with cervical lymph node metastasis of differentiated thyroid cancer[J]. Eur Thyroid J, 2015, 4(3):181-188.
Characteristicsofrecurrentpapillarythyroidcancerinmetabolicsyndromepatients
YIN De-tao1, HE Hua-nan1, MA Run-sheng1, LI Hong-qiang1,WANG Yong-fei1, JIANG Jin-hua2, WANG Qing-duan2
(1. Department of Thyroid Surgery, the First Affiliated Hospital of Zhengzhou University; Key Discipline Laboratory of Clinical Medicine of Higher Learning Institutions in Henan Province, Zhengzhou 450052;2. Medical Science Institute of Henan Province, Zhengzhou 450052, China)
ObjectiveTo explore the characteristics and components of recurrent papillary thyroid cancer in patients with metabolic syndrome.MethodsWe retrospectively reviewed the information of the patients with recurrent papillary thyroid cancer after initial surgery during January 1st, 2010 and December 31st, 2015 in the First Affiliated Hospital of Zhengzhou University. We compared tumor size, lymph node metastasis, recurrence time and postoperative invasion rate in metabolic syndrome and non-metabolic syndrome groups.ResultsTotally 82 patients were included with 34 men and 48 women. There was no significant difference between patients with and those without metabolic syndrome grouped by the classic diagnosis approach. However, the lymph node metastasis grade of recurrent papillary thyroid cancer patients who also suffered from at least two metabolic disorders, was lower, especially in women (P=0.002). Moreover, patients with metabolic disorders had shorter recurrence time (Pdiabetes=0.034,Pdyslipidemia=0.037,PBMI=0.004,PMetS2=0.036).ConclusionPapillary thyroid cancer patients with metabolic disorder, especially with two or more components of metabolic syndrome and overweight and/or obesity, may have an increasing risk of recurrence.
metabolic syndrome; obesity; papillary thyroid cancer; recurrence; lymphatic metastasis
2017-05-31
2017-11-15
国家自然科学基金资助项目(No.81372863);河南省科技攻关项目(No.162102310514)
Supported by the National Natural Science Foundation of China (No.81372863) and the Scientific and Technological Project of Henan Province (No.162102310514)
殷德涛,教授,博士生导师. E-mail: detaoyin@zzu.edu.cn
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171219.1935.006.html(2017-12-19)
R736.1
A
10.7652/jdyxb201801005
(编辑 韩维栋)
