乙醇对谷朊粉酶解产物的苦味影响研究
2018-01-10郭晓娜朱科学
彭 晶 郭晓娜 朱科学
(江南大学食品学院;江苏省食品安全与质量控制协同创新中心,无锡 214122)
乙醇对谷朊粉酶解产物的苦味影响研究
彭 晶 郭晓娜 朱科学
(江南大学食品学院;江苏省食品安全与质量控制协同创新中心,无锡 214122)
为了探寻降低谷朊粉酶解产物苦味的方法,通过添加不同浓度的乙醇(5%、10%和15%),研究其对碱性蛋白酶酶解产物苦味值、游离氨基酸和相对分子质量分布的影响,以及在乙醇存在下碱性蛋白酶、中性蛋白酶以及风味蛋白酶3种复配酶解体系所制得的酶解产物的苦味值和相对分子质量分布变化。结果表明:加入乙醇后,在相同的水解度下(DH),碱性蛋白酶的酶解产物苦味值降低,并与加入乙醇的浓度呈负相关。添加乙醇后,相对分子质量小于1 000的组分含量显著(P<0.05)降低,游离疏水性氨基酸(Pro,Ile,Phe和Met)显著(P<0.05)增加。添加乙醇后,3种复配酶解体系酶解产物苦味降低,相对分子质量小于1 000的组分含量显著(P<0.05)降低。与添加碱性蛋白酶单一酶解相比,在相同的水解度下3种酶复配酶解产物的苦味值进一步降低。添加低浓度乙醇对3种酶的活性影响较小。
乙醇 碱性蛋白酶 中性蛋白酶 风味蛋白酶 苦味肽
谷朊粉即面筋蛋白,是小麦淀粉生产过程中的副产物。谷朊粉中蛋白质质量分数在70%~80%,是优质的植物蛋白[1]。但随着小麦淀粉产量的增加,谷朊粉的产量也急剧增加,导致谷朊粉供大于求。此外,谷朊粉的溶解度低,功能性质差,也极大地限制了谷朊粉在食品工业中的应用[2]。
利用蛋白酶酶解谷朊粉,不仅能够改善谷朊粉的溶解性,而且还能够产生一些具有生物活性的小分子肽[3-4],具有极高的经济价值。谷朊粉中含有人体所需氨基酸15种,尤其是谷氨酰胺含量超过30%[5],谷氨酰胺肽在医药食品有着较好的应用前景。因此,酶解谷朊粉制备具有生物活性肽产品具有天然的优势。然而,在酶解过程中,疏水性氨基酸不断地暴露出来,酶解产物的苦味值增加[6]。苦味的出现极大的限制了酶解产物的应用。有关酶解产物脱苦的研究主要集中在以下几个方面[7]:1)应用活性炭吸附苦味肽;2)使用不同的内切酶和外切酶,切除端位疏水性氨基酸;3)加入添加剂掩盖苦味。使用活性炭处理酶解样品,苦味肽吸附在活性炭中并脱除,降低酶解产物的苦味值[8]。但在苦味肽脱除过程中,酶解产物的氮得率也会降低,成本增加。选用外肽酶切除苦味肽末端氨基酸[9-10],能得到苦味值较低的酶解产物。但氨肽酶和羧肽酶专一性相对较高,增加酶解成本,因此并不适合工业化大规模生产。环糊精为常用的苦味掩盖剂,利用其疏水性空腔包裹苦味肽,能够掩盖酶解产物的苦味。掩盖剂一般添加量较大,既会造成成本增加[11],同时也会降低单位质量中活性肽的百分含量。因此,亟需简单高效的方法生产低苦味活性肽。
大多数酶解过程都是在水相中进行,而有机试剂存在下对于酶解产物苦味值影响的研究较少。根据前期的调研与试验已证实,乙醇溶液对制备低苦味酶解产物有着积极作用。本试验研究乙醇的添加,对碱性蛋白酶酶解产物苦味值的影响,酶解产物中肽分子质量变化以及低水解度下游离氨基酸的释放规律。碱性蛋白酶的较高酶解效率,被食品工业青睐。但由于酶解产物苦味值较重,并不适合单一使用酶解生产。因此,本试验通过碱性蛋白酶,中性蛋白酶和风味蛋白酶的复配,探究了在不同乙醇浓度下的苦味值和相对分子质量变化。最后测定了在不同乙醇浓度下,3种蛋白酶的活性变化,以期为工业化酶解谷朊粉制备低苦味肽粉提供参考。
1 材料与方法
1.1 材料与试剂
谷朊粉:安徽瑞福祥公司,蛋白质质量分数78.08%;碱性蛋白酶,中性蛋白酶和风味蛋白酶:诺维信酶制剂公司,为液体,酶活分别为1.26×103U/mL、3.40×103U/mL和2.30×103U/mL;牛血清蛋白、无水乙醇、奎宁:国药集团化学试剂有限公司。
1.2 仪器与设备
EL204-IC电子天平、FE20实验室pH计:梅特勒-托利多仪器(上海)有限公司;HH-4数显恒温水浴锅:江苏金坛市荣华仪器制造有限公司;Agilentl100 氨基酸分析仪:Agilent(美国)公司;冷冻干燥机:LABCONCO (美国)公司。
1.3 试验方法
1.3.1 碱性蛋白酶酶解试验
称取10.00 g的谷朊粉,分别加入100 mL去离子水以及100 mL 的5%、10%、15%(V/V)的乙醇溶液调制成5%(m/V)谷朊粉悬浮液。在50 ℃恒温水浴下,加入1 mol/L的NaOH溶液,保持体系pH=8.0稳定不变。加入1%(底物蛋白质含量)的碱性蛋白酶。酶解达到相同的水解度时,100 mL样品置于沸水浴中,加热10 min灭酶,冷却后,冷冻干燥。
1.3.2 碱性、中性和风味蛋白酶复配试验
称取10.00 g的谷朊粉,分别加入100 mL去离子水以及100 mL的5%、10%、15%(V/V)的乙醇溶液调配成5%(m/V)的悬浮液。在50 ℃恒温水浴下,依次加入碱性蛋白酶,中性蛋白酶和风味蛋白酶反应8 h。3种蛋白酶加入比例为2∶2∶1,总量为1%(底物蛋白质含量),加入的时间依次为0、2、6 h。反应过程中,加入1 mol/L的NaOH溶液保持体系pH稳定,分别为碱性蛋白酶pH=8.0,中性蛋白酶和风味蛋白酶pH=7.0。酶解1h后,100 mL样品置于沸水浴中,并放置于沸水浴中,加热10 min灭酶,冷却后,冷冻干燥。
1.3.3 水解度的测定
水解度是指反应体系中断裂的肽键占原总肽键的比例。当水解度越高时,断裂的肽键数越多,得到的肽分子质量就越小。本试验采用pH-stat[12]法测定酶解过程中的水解度,其公式为:
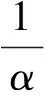
式中:DH为水解度/%;B为反应过程中消耗碱液体积/mL;Nb为碱液浓度/mol/L; α为氨基解离度,对于碱性蛋白酶1/α=1.13,中性蛋白酶和风味蛋白酶1/α=2;Mp为酶解底物中蛋白质含量;htot为每克蛋白质中肽键的毫摩尔数,对于小麦面筋蛋白htot=8.38。
1.3.4 苦味的评价方法
酶解产物苦味值的测定方法参考Fu等[13]的方法,并作部分修改。将冷冻干燥的酶解样品溶解于去离子水中,配制成2%的待测液。感官评定小组由10人组成,取溶解样品2~3 mL于口中,10 s后吐出。以奎宁溶液为标准物,分别以1.0×10-4、5.0×10-5、2.5×10-5、1.0×10-5、5.0×10-6g/mL代表苦味值10、5、2.5、1、0.5分。感官评定的平均值即为此样品的苦味值。
1.3.5 相对分子质量分布测定
相对分子质量分布的测定采用QB/T 2653-2004[14]中的高效液相排阻色谱法。HPLC 系统为 Waters 600,色谱柱为 TSKgel 2000 SWXL(7.8 mm×300 mm),流动相为乙腈/水/三氟乙酸(45/55/0.1),流速为0.5 mL/min,柱温 30 ℃,检测波长220 nm。称取2.0 mg干燥的样品,加入1 mL的流动相并漩涡震荡10 min,透过0.22 μm的有机滤膜后取10 μL上柱。分别采用标准品杆菌酶、细胞色素、抑肽酶、乙氨酸-乙氨酸-乙氨酸和乙氨酸-乙氨酸-酪氨酸-精氨酸进行相对分子质量的校正。根据所得的相对分子质量与保留时间之间的回归方程测定酶解产物的相对分子质量。
1.3.6 酶解产物游离氨基酸测定
游离氨基酸含量测定参考Fekkes等[15]方法。酶解样品冷冻干燥后用,精确称取1.000 g左右样品,用5%三氯乙酸分散沉淀后过滤离心,取上清液。采用邻苯二甲醛OPA柱前自动衍生,Agilent 1100 液相色谱仪进行氨基酸组成分析。流动相由0.02 mol/L的醋酸钠和体积比为1∶2的甲醇-乙腈溶液组成,柱温40℃,流速1.0 mL/min,检测波长为338 nm。氨基酸组成定性以色谱峰的保留时间判断,氨基酸组成含量以峰面积外标法进行计算。
1.3.7 水溶性蛋白含量的测定
酶解产物中的水溶性蛋白质含量测定采用福林酚法,具体操作参考贾维宝等[16]方法。称取1~2 mg的冻干样品,溶解于1 mL的去离子水中,漩涡震荡10 min后,7 690 g 离心10 min。取上清液加入福林酚试剂,于750 nm处测量吸光度值,从标准曲线中得出酶解产物中水溶性蛋白质含量。
1.3.8 酶活性的测定
酶活性的测定具体步骤采用GB 25594—2010[17]中的方法,并作部分修改。配置乙醇浓度分别为0%、5%、10%和15%的0.015 mol/L,pH=8.0的磷酸盐缓冲液。称取适量的酪蛋白,配置成1%(m/V)的酪蛋白磷酸盐溶液。移取2 mL酪蛋白溶液,加入10 μL的酶试剂,在37 ℃恒温水浴反应5 min。待反应结束后,加入2.0 mL的10%三氯乙酸溶液,7 690 g离心15 min。1单位酶活即为在37 ℃下1 min内催化酪蛋白产生酪氨酸的量。
1.4 数据统计与分析
本试验采用Excel 2010 软件处理数据(平均值±标准偏差),利用 IBM SPSS Statistics 16.0统计分析软件进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 乙醇对碱性蛋白酶酶解产物苦味值的影响
图1为不同浓度乙醇添加量,相同水解度的碱性蛋白酶酶解产物苦味值。随着酶解过程的进行,苦味值都呈现出先增高后降低的趋势。在酶解初期,疏水性氨基酸暴露,苦味肽产生,酶解产物的苦味值增加;随着酶解程度增大,肽被水解成游离的氨基酸,游离氨基酸较其组成短肽的苦味值低[6],从而酶解产物苦味值降低。
加入乙醇后,相同水解度下的酶解产物苦味值降低,酶解产物的苦味值与乙醇浓度呈负相关。Tchorbanov等[18]的研究中表明,乙醇的添加增加了酶与某些肽段结合的困难,降低了酶解这些肽段的几率。添加乙醇后,酶解产物的苦味值降低,苦味肽含量降低。相同的酶解条件下,同一水解度则表明酶解体系中断裂的肽键总数相同。乙醇添加后苦味值的降低,有可能是因为乙醇存在下,酶解体系中产生的肽段发生改变,无法生成一些能够产生苦味的肽段。
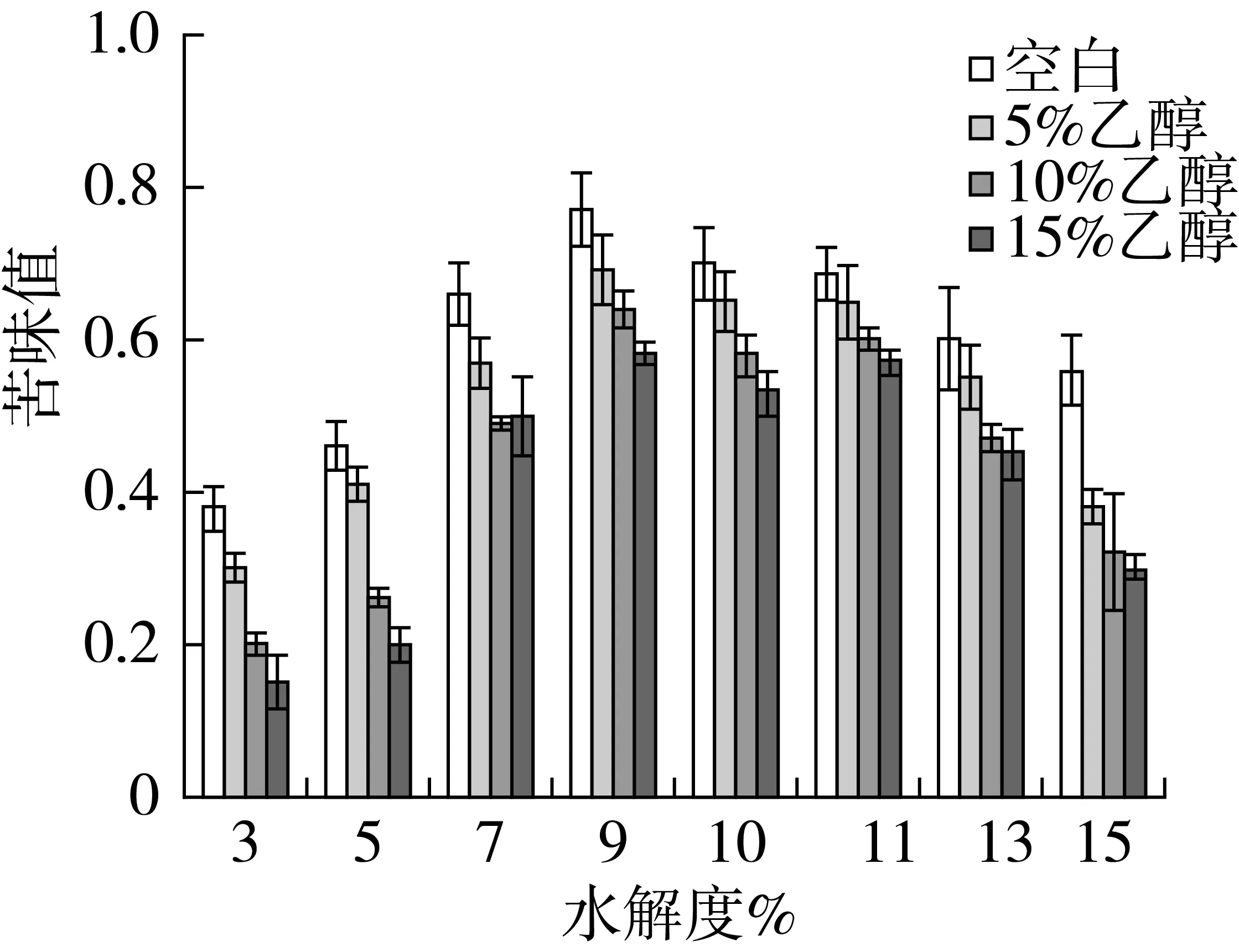
图1 乙醇对碱性蛋白酶酶解产物苦味值影响
2.2 乙醇对碱性蛋白酶酶解产物相对分子质量分布的影响
表1表明,随着水解度的增高,酶解产物中低分子质量组分含量不断地增加。相同水解度下,加入乙醇组,低分子质量(<1 000)组分所占得比例显著降低(P<0.05),与乙醇浓度负相关。
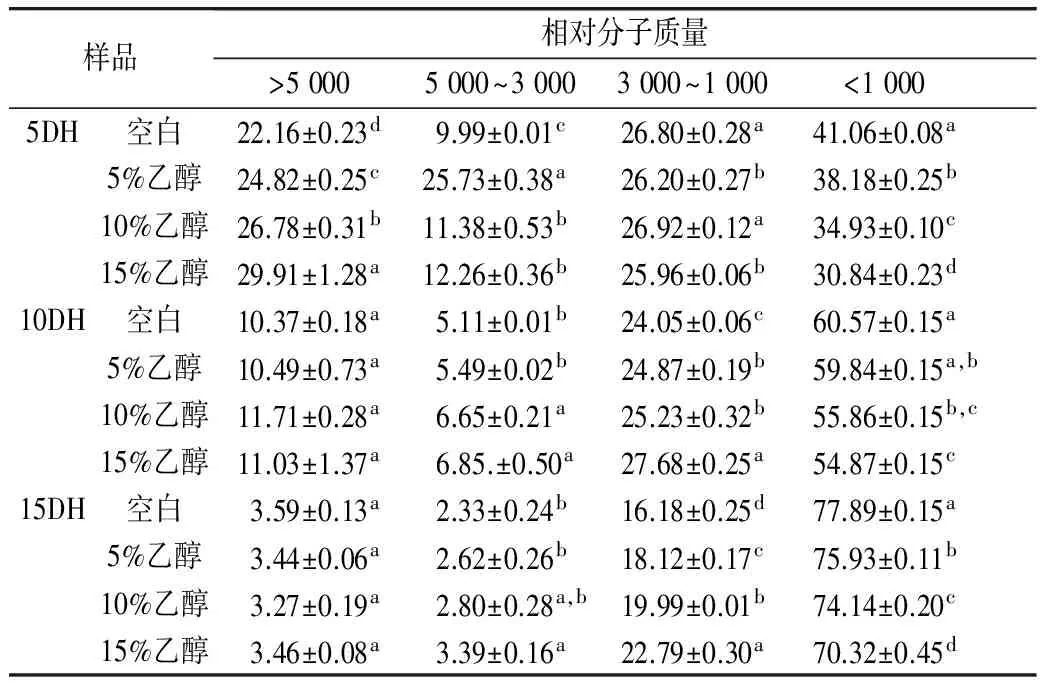
表1 不同浓度乙醇对碱性蛋白酶酶解产物分子质量影响
注:数据均为平均值±标准偏差;同列中不同字母表示有显著性差异(P<0.05);n=3,表3~表5同。
酶解产物产生苦味的原因主要是由于产生苦味肽。肽来源相同的情况下,肽的苦味值随着肽相对分子质量的降低而增加[6]。在Guigoz等[19]的研究中,分离出200多种苦味肽,其中大部分的苦味肽是由2~15个氨基酸组成,这些苦味肽的相对分子质量大多数都小于1 000。5%和10%水解度下,酶解产物中肽含量较多,加入乙醇后低分子质量组分含量降低,苦味值降低,可能是添加乙醇,限制了某些苦味肽的产生。15%水解度下,酶解产物中低相对分子质量比例增加,多肽被水解为游离氨基酸,游离的氨基酸比其组成的多肽苦味值低。添加乙醇组的酶解产物中低相对分子质量含量比空白组低,可能是因为乙醇的存在下,一些非苦味的肽段并不能够被蛋白酶继续酶解。
2.3 乙醇对5%DH下酶解产物中游离氨基酸含量的影响
单一使用碱性蛋白酶过程中,为保持体系pH的稳定,加入了较多的碱液导致酶解产物的盐分含量较高,降低了酶解产物的风味,增加了后续脱盐成本。碱性蛋白酶的酶切位点主要在肽羧基侧具有芳香或疏水性氨基酸[6],酶解产物苦味值较大,因此选择3种酶复配降低酶解产物的苦味值。在3种酶复配体系中,碱性蛋白酶加入量少,酶解时间短,对整个酶解的水解度贡献度并不高。本试验研究了在5%水解度下,不同乙醇的添加对碱性蛋白酶酶解产物中游离氨基酸释放量的影响。表2表明,在5%的水解度下,加入乙醇后疏水性氨基酸如Pro,Ile,Phe和Met含量都有显著性增加(P<0.05),并随着乙醇浓度的增加,疏水性氨基酸的释放增多。疏水性氨基酸影响酶解产物的苦味主要在两个方面[6]:1. 位于肽两端的疏水性氨基酸种类;2. 肽段中疏水性氨基酸的含量。Ishibashi等[20]研究含有Pro的肽段时发现,当Pro位于肽两端时,肽呈现出较强的苦味值。当疏水性氨基酸位于肽的C-端或N-端时,肽呈现苦味的可能性增加。乙醇添加后,酶解产物中疏水性氨基酸释放量增加,疏水氨基酸位于肽端的几率降低,酶解产物的苦味值也随之降低。
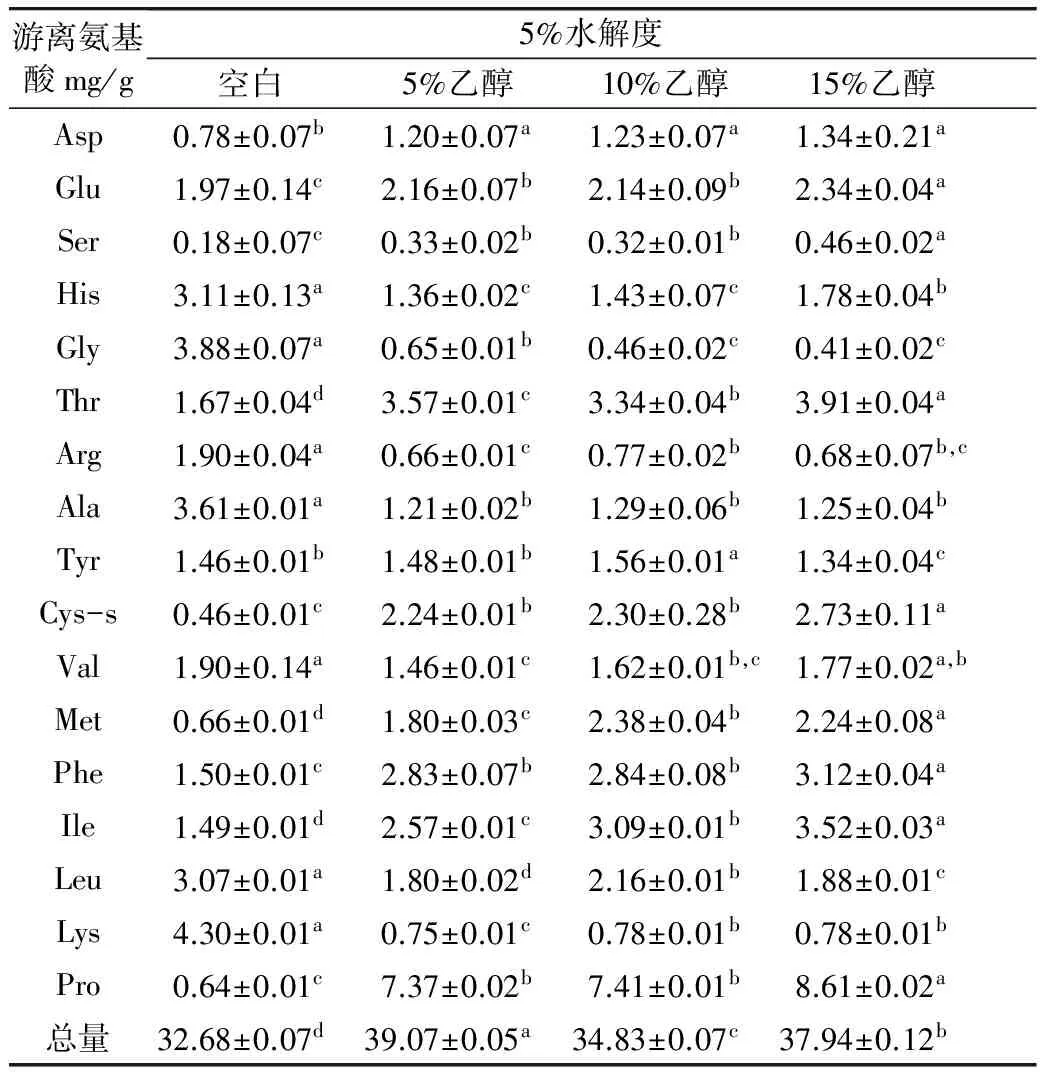
表2 不同浓度的乙醇对5%水解度下碱性蛋白酶水解产物中游离氨基酸的影响
注:数据均为平均值±标准偏差;同行中不同字母表示有显著性差异(P<0.05);n=3。
2.4 乙醇对3种酶复配酶水解度产物的影响
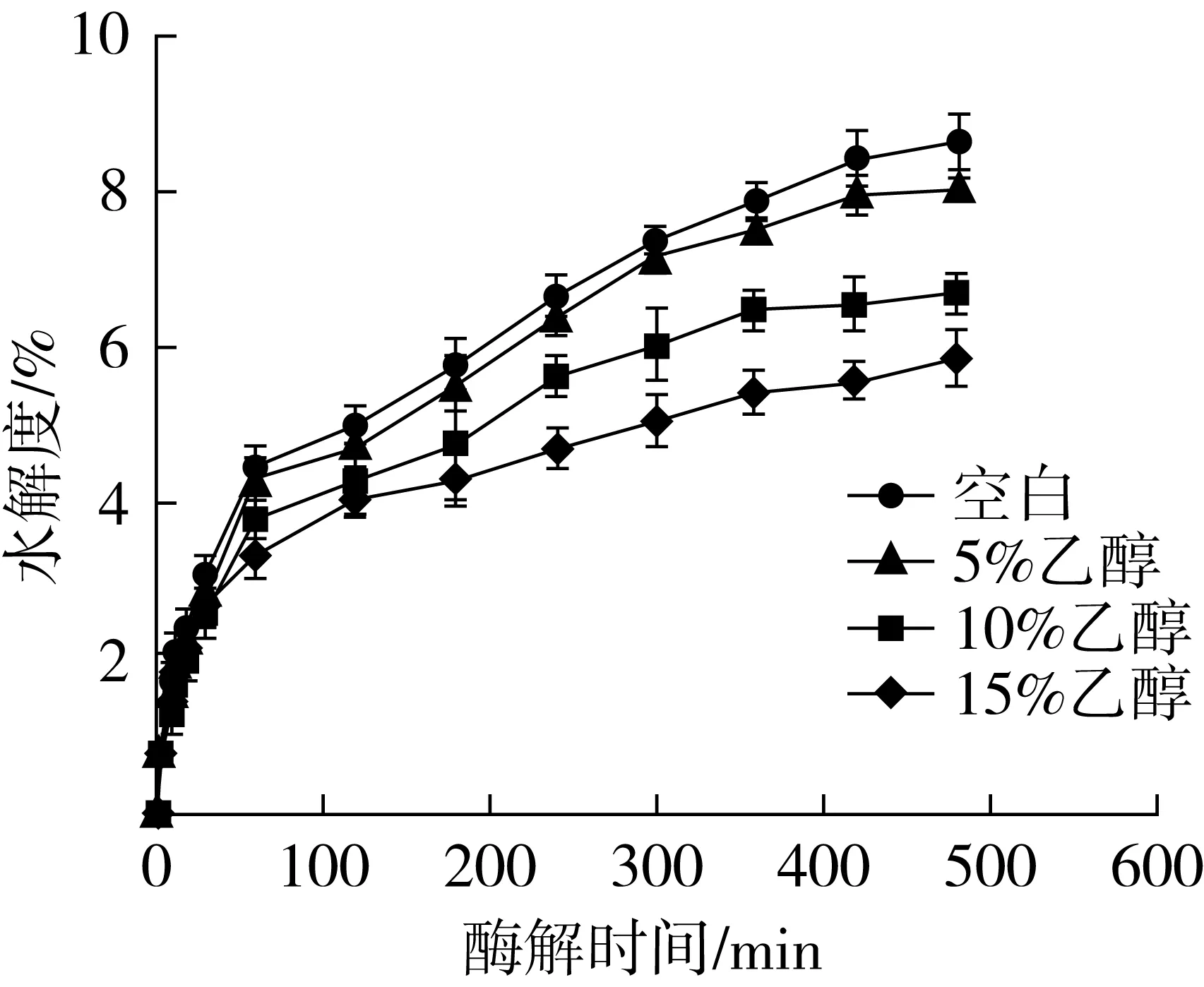
图2 乙醇对3种酶复配酶解产物的水解度影响
水解度的大小可以用来表征酶解反应程度。图2所示为空白以及在乙醇添加量5%、10%、15%下,3种酶复配时水解度变化。从图2可以看出,随着酶解时间的延长,空白组和对照组的水解度都有着不同程度的增加。酶解起始阶段,水解度快速增加,随着酶解过程的进行,水解度增加趋于平缓。
加入不同浓度的乙醇后,对于酶解产物的水解度都有着不同的影响。其中,5%的乙醇添加量影响较小,10%和15%的乙醇添加量影响较大。水解度可从侧面表征酶解产物中肽段的大小。加入乙醇对水解度的影响,可能是由于在高浓度乙醇(10%和15%)添加量下,存在一些肽段,蛋白酶与之接触变难,即使有充分的酶解时间,也不能够被酶解[21]。
2.5 乙醇对3种酶复配酶解产物苦味值的影响
图3所示为在相同酶解时间下,添加不同浓度的乙醇,对3种酶复配酶解产物苦味值的影响。随着碱性蛋白酶和中性蛋白酶的加入,酶解产物的苦味值呈现出增高的趋势,而加入风味蛋白酶后酶解产物的苦味值有所降低。这是由于风味蛋白酶是外切酶,主要作用于肽端的氨基酸,切除肽端疏水性氨基酸后,酶解产物苦味值则会降低[22]。由图1~图3可知,与单一使用碱性蛋白酶相比,在相同的水解度下,复配酶解产物的苦味值更低。3种酶复配中,在相同的酶解时间下,加入乙醇后酶解产物的苦味值降低。并随着乙醇浓度的增加,苦味值进一步降低。加入乙醇后,不仅对单一碱性蛋白酶的酶解产物苦味值有降低作用,并且对3种复配酶体系的酶解产物苦味值的降低也有着一定的作用。
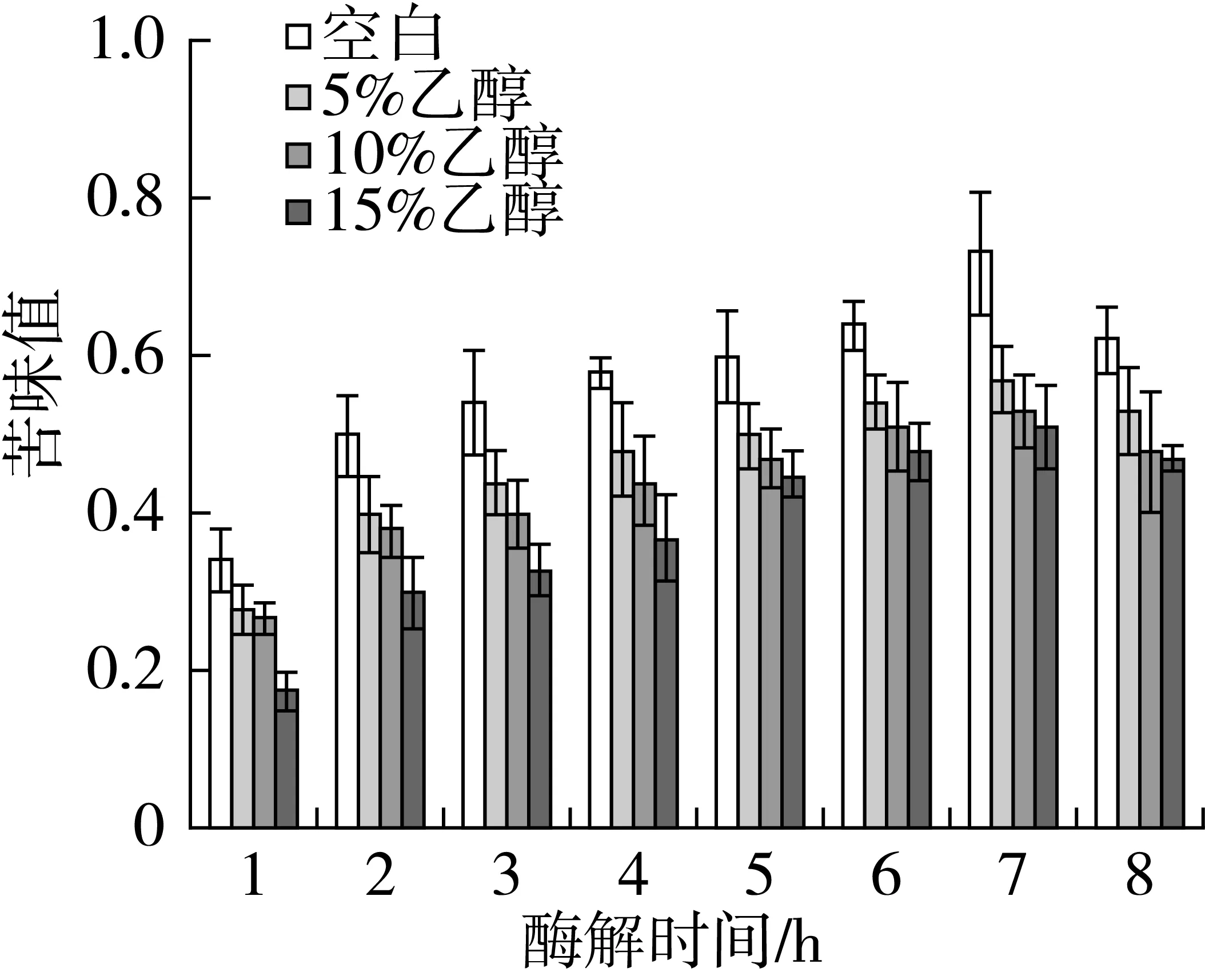
图3 乙醇对3种酶复配酶解产物苦味值的影响
2.6 乙醇对3种酶复配酶解产物相对分子质量的影响
表3为在同一水解时间下,不同乙醇添加浓度对酶解产物分子质量分布影响。乙醇对3种酶复配体系的酶解产物相对分子质量影响与单一碱性蛋白酶水解的趋势一致,即相对分子质量小于1 000酶解产物含量降低,并随着乙醇浓度的增加,低分子质量组分含量呈现降低趋势。
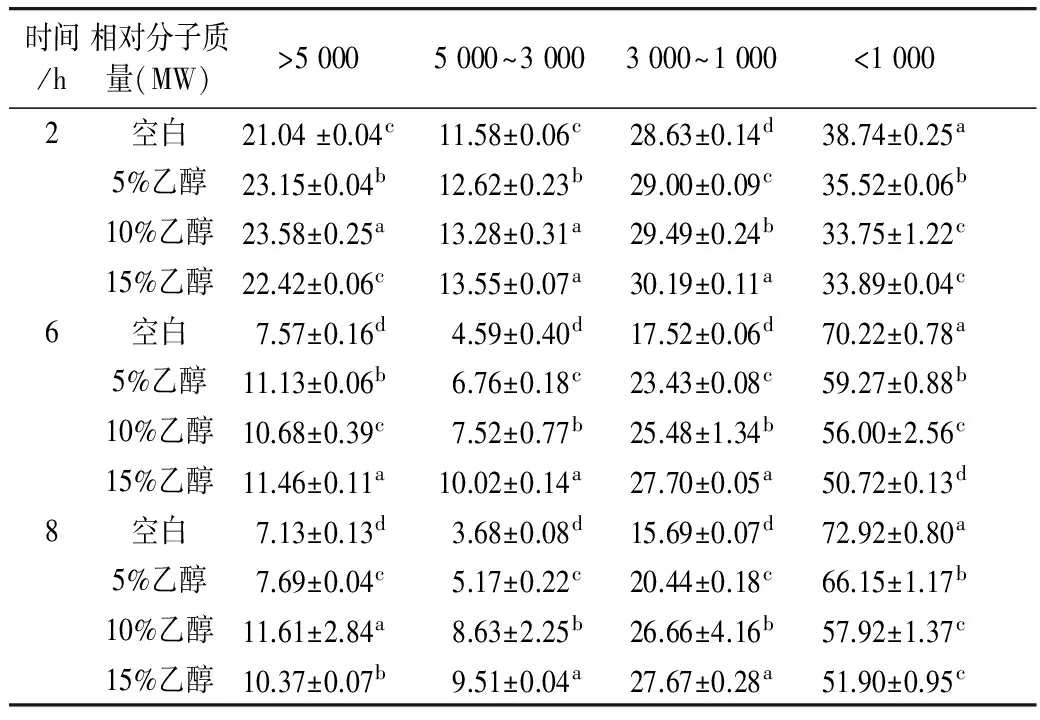
表3 不同浓度的乙醇对3种酶复配酶解产物相对分子质量分布影响
2.7 不同酶解条件下,酶解产物中水溶性蛋白含量变化
表4和表5分别为碱性蛋白酶和3种酶复配下,酶解产物中水溶性蛋白质含量的变化。在同一水解度下,乙醇对于碱性蛋白酶酶解产物水溶性蛋白质含量的影响较小。对于3种酶复配,在同一酶解时间下,加入5%的乙醇对与水溶性蛋白质含量影响较小,加入10%和15%乙醇影响较大,并随着乙醇浓度的增加含量降低。
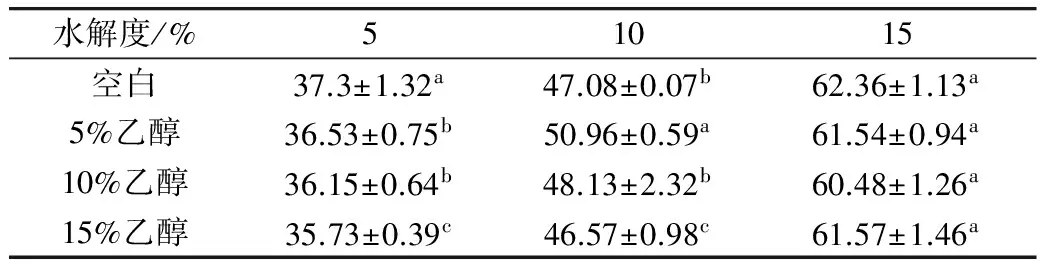
表4 碱性蛋白酶酶解产物水溶性蛋白含量
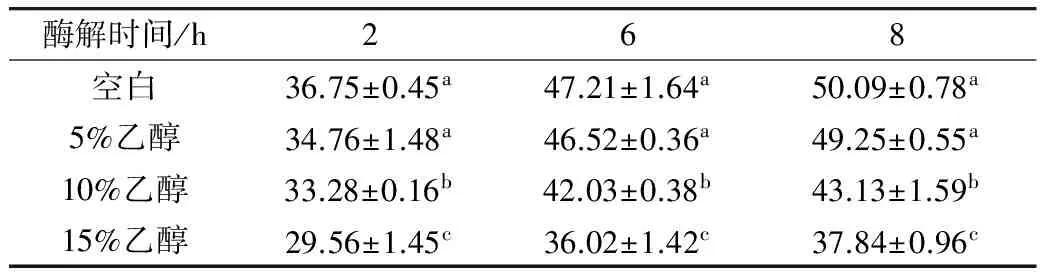
表5 3种酶复配酶解产物水溶性蛋白含量
2.8 乙醇对3种酶活性的影响
图4为3种酶在不同乙醇浓度下的酶活。在加入乙醇后,3种酶的活性都有不同程度的降低。其中碱性蛋白酶在5%和10%乙醇浓度下,酶活性降低并不明显。在高浓度乙醇(15%)中,酶活性明显降低。中性蛋白酶在高浓度乙醇的存在下,酶活性降低速度快。乙醇对于风味蛋白酶的影响较小。有机试剂对酶蛋白作用,主要是由于蛋白质构象中的“柔性”随着水分含量的减少而下降,导致酶对外界干扰的抵抗力降低[23]。不同种类酶的蛋白质构象不同,因此不同种类酶在有机试剂中酶活性也不同。在实际应用中,需要考虑酶解效率问题,而低浓度的乙醇(5%)对3种蛋白酶的酶活性影响较小,酶解产物的苦味值也有所降低,因此更适合工业化生产。
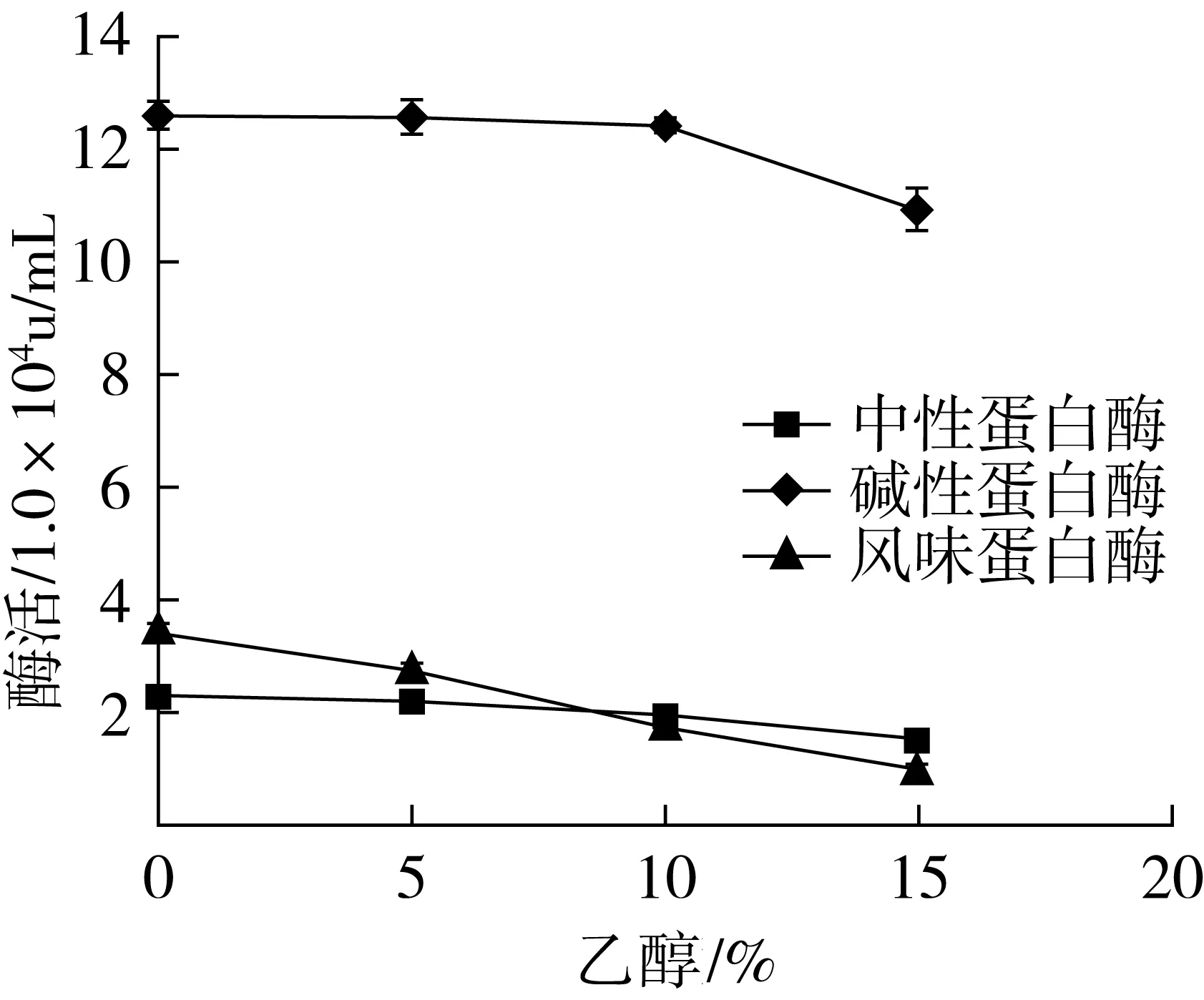
图4 乙醇对3种酶的酶活影响
3 结论
以谷朊粉作为底物,研究添加5%、10%和15%不同浓度的乙醇对碱性蛋白酶酶解产物苦味值的影响。随着乙醇浓度的增加,酶解产物的苦味值降低,相对分子质量小于1 000的组分含量显著降低(P<0.05)。在5%的水解度下,疏水性氨基酸(Pro,Ile,Phe和Met)释放量显著(P<0.05)增加。添加低浓度(5%)乙醇,对于碱性蛋白酶,中性蛋白酶和风味蛋白酶复合酶酶解程度的影响较小,添加高浓度的乙醇(10%和15%),对酶解程度的影响较大。乙醇加入后,产生苦味的低分子质量组分含量显著降低,并随着乙醇添加量的增加而降低。在低浓度乙醇(5%)添加量下,对于碱性蛋白酶和风味蛋白酶的酶活性影响较小,更适合工业化生产低苦味活性肽。
[1]付博菲,杜方岭,徐同成,等. 谷朊粉应用概述 [J]. 粮食与饲料工业, 2013 (10): 25-27
Fu Bofei, Du Fangling, Xu Tongcheng, et al. The overview of gluten applications[J]. Cereal and Feed Indutry,2013(10):25-27
[2]徐颖,汪璇,刘小丹,等. 谷朊粉的功能特性及应用现状 [J]. 粮食与饲料工业, 2010(10): 29-32
Xu Yin,Wang Xuan, Liu Xiaodan, et al. Functional characteristics and application status of wheat gluten[J]. Cereal and Feed Industry, 2010(10): 29-32
[3]王章存,原媛,王许东,等. 谷朊粉酶解条件优化及其抗氧化活性 [J]. 中国粮油学报, 2014, 29(11): 7-13
Wang Zhangcun, Yuan Yuan, Wang Xudon, et al. Optimization of enzymatic hydrolysis of wheat gluten and antioxidant activities of its hydrolysates[J]. Journal of the Chinese Cereals and Oils Association, 2014,29(11): 7-13
[4]王章存,王颖,张子峰,等. 小麦蛋白酶解物中抗氧化肽的纯化与鉴定 [J]. 中国粮油学报, 2016, 31(5): 17-21
Wang Zhangcun, Wang Yin, Zhang Zifen, et al. Purification and identification of antioxidant peptides from wheat gluten hydrolysates[J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(5): 17-21
[5]马洪龙,韩飞,李爱科,等. 碱性蛋白酶水解小麦面筋蛋白制取谷氨酰胺肽的研究[J].粮油食品科技, 2014, 22(1): 54-57
Ma Honglong, Han Fei, Li Aike, et al. Study on the production of glutamine-bioactive peptides by hydrolysis of wheat gluten with alkaline protease[J]. Journal of the Chinese Cereals and Oils Association, 2014, 22(1): 54-57
[6]马铁铮,王强,周素梅. 蛋白短肽苦味成因与脱苦技术研究进展[J]. 中国粮油学报, 2008, 23(6): 220-226
Ma Tiezheng, Wang Qiang, Zhou Sumei. Research progress on cause of bitterness formation of protein oligopeptides and debittering technology[J]. Journal of the Chinese Cereals and Oils Association, 2008, 23(6): 220-226
[7]冯红霞,陆兆新,尤华. 苦味肽的形成及脱苦方法的研究 [J]. 食品科学, 2002, 23(5): 151-154
Feng Hongxia, Lu Zhaoxin, You Hua.Research on cause of bitterness formation of protein and debittering technology [J]. Food Chemistry, 2002, 23(5): 151-154
[8]解铭. 鳕鱼肉酶解液中苦味肽的分离纯化及脱苦方法研究 [D].青岛:中国海洋大学, 2015
Xie Ming.Separation and purificafion of bitter peptides and debittering methods in hydrolysates of cod fish [D]. Qingdao: Ocean University of China, 2015
[9]陈丹. 米曲霉羧肽酶O在毕赤酵母中的表达鉴定及其脱苦效应的研究 [D]. 广州:华南理工大学, 2014
Chen Dan.Expression and identification of a recombiant carboxypeptidase O from Aspergillus oryzae expressed in Pichia pastoris and application in debittering [D]. Guangzhou: South China Univerdity of Technology, 2014
[10]须瑛敏. 氨肽酶脱苦效果的研究 [J]. 食品与药品, 2007, 9(11): 36-39
Xu Yingming. Study on debittering effect of aminopeptidase [J]. Food and Drug, 2007, 9(11): 36-39
[11]何慧,王进,裴凡,等. 蛋白质水解物与苦味的构效关系及脱苦研究 [J]. 食品科学, 2006, 27(10): 571-574
He Hui, Wang Jin, Pei Fan, et al. Review on the relationship of structure to bitter taste of protein hydrolysate and debittering. Food Science 2006, 27(10): 571-574
[12]Adler-Nissen J. Enzymic hydrolysis of food proteins [M]. London: Elsevier Applied Science Publishers. 1986: 116-124
[13]Fu J, Li L, Yang X Q. Specificity of carboxypeptidases from actinomucor elegans and their debittering effect on soybean protein hydrolysates [J]. Applied Biochemistry and Biotechnology, 2011, 165(5): 1201-1210
[14]QB/T 2563—2004 大豆肽粉 [S]. 北京:中国轻工业出版社,2005
QB/T 2563—2004 Soy peptides powder [S]. Beijing: China light industry press, 2005
[15]Fekkes D, Van D A, Edelman M, et al. Validation of the determination of amino acids in plasma by high-performance liquid chromatography using automated pre-column derivatization with o-phthaldialdehyde [J]. Journal of Chromatography B Biomedical Applications, 1995, 669(2): 177-186
[16]贾维宝,刘良忠,黄婷,等. 几种用于肽粉中蛋白质含量测定方法的比较 [J].武汉轻工业大学学报, 2016, 35(1): 17-20
Jia Weibao, Liu Liangzhong, Huang ting, et, al. Comparison of several methods for determinating the content of protein in peptides[J].Journal of Wuhan Polytechnic University, 2016, 35(1): 17-20
[17]GB 25594—2010 食品安全国家标准 食品工业用酶制剂 [S] GB 25594—2010 National food safety standards of food industrial enzyme preparation [S]
[18]Tchorbanov B, Iliev I. Limited enzymic hydrolysis of casein in the presence of ethanol [J]. Enzyme and Microbial Technology, 1993, 15(11): 974-978
[19]Guigoz Y, Solms J. Bitter peptides, occurrence and structure [J]. Chemical Senses and Flavour, 1976, 2(1): 71-84
[20]Ishibashi N, Kubo T, Chino M, et al. Taste of proline-containing peptides [J]. Bioscience, Biotechnology and Biochemistry, 1988, 52(1): 95-98
[21]Vorob’ev M. M, Strauss K, Vogel V, et al. Demasking of peptide bonds during tryptic hydrolysis of β-casein in the presence of ethanol [J]. Food Biophysics, 2015, 10(3):309-315
[22]付光中,章超桦,吉宏武,等. 虾头自溶产物苦味与蛋白平均疏水度的联系及脱苦[J]. 食品科学, 2010, 31(19): 121-123
Fu Guangzhong, Zhang Chaohua, Ji Hongwu, et al. Analysis of bitterness-average protein hydrophobicity relationship and debittering of autolysis products of shrimp head [J]. Food Science,2010, 31(19): 121-123
[23]彭立风. 有机溶剂对酶催化活性和选择性的影响 [J]. 化学进展, 2000, 12(3): 296-304
Peng Lifeng. Effect of organic solvents on enzymatic activity and selectivity [J]. Progress in Chemistry, 12(3): 296-304.
Effects of Ethanol on Debittering of Wheat Gluten Hydrolysates
Peng Jing Guo Xiaona Zhu Kexue
(School of Food Science and Technology, Collaborative Innovation Center for Food Safety and Quality Control, Jiangnan University, Wuxi 214122)
To explore the way to reduce the bitter of wheat gluten hydrolysates, different concentration of ethanol (5%, 10% and 15%) were added during hydrolysis process. The changes of free amino acid, molecular weight distribution and bitterness value of hydrolysates produced by Alcalase were studied. Furthermore, the changes of molecular weight distribution and bitterness value of hydrolysates produced by the combination of Alcalase, neutral protease and flavourzyme were also measured. The results showed that at the same degree of hydrolysis (DH), hydrolysates produced by Alcalase had less bitterness after adding ethanol. The bitterness value had negative correlation with the ethanol concentration. The content of protein (MW<1 000) and free hydrophobic amino acids (Pro, Ile, Phe and Met) were increased (P<0.05) in ethanol groups.Hydrolysates produced by combination of three kinds of enzymes showed less bitterness value and the content of protein (MW<1 000) significant (P<0.05) increased in ethanol groups. The bitterness of hydrolysates produced by the combination of enzymes showed less value than Alcalase at the same DH. Low concentration of ethanol had less effect on the enzyme activity.
ethanol, alcalase, neutral protease, flavourzyme, bitter peptides
TS213.2
A
1003-0174(2017)12-0056-07
国家高技术研究发展计划(2013AA102201),江苏省重点研发计划项目(BE2015327)
2016-11-23
彭晶,男,1990年出生,硕士,食品科学与工程
朱科学,男,1978年出生,教授,博士生导师,小麦精深加工
《中国油脂》(月刊)
国内邮发代号52-129国外发行代号M5889
追踪学科发展动态 报道行业最新成果
关注油脂发展热点 共谋油脂创新未
主要栏目:油脂加工/油料蛋白/油脂化学/油脂储藏/油脂营养/新油源/特种油脂/油脂化工/生物柴油/综合利用/实用技术/检测分析/标准规范/食品安全/节能减排/环境保护/纵横信息/特色专栏/产品广告等。
发行对象:从事油脂及相关行业规划、决策、咨询、研究、开发、生产、检测、工程服务、项目管理、工厂管理、设备运行、维修等组织和个人。
各地邮局均可订阅我社常年办理邮购及逾期补订
大16开本每本10元全年120元
■邮局订阅:邮发代号52-129
■邮局汇款:710082 西安市劳动路118号 《中国油脂》杂志社
■ 银行转账:开户单位:西安中粮工程研究设计院有限公司
账号:3700021709088100275

开户行:工行陕西省分行营业部西安西关支行
地址:陕西省西安市劳动路118号 邮编:710082
电话:029-88653157/888621360 传真:029-88625310
E-mail:zyzzoil@163.com http://www.chinaoils.cn
