黄独微型块茎低温离体保存的转录组分析
2018-01-09洪森荣熊思敏
洪森荣 吴 辉 钟 露 熊思敏 罗 霞 刘 行
(上饶师范学院生命科学学院,上饶 334001)
黄独微型块茎低温离体保存的转录组分析
洪森荣 吴 辉 钟 露 熊思敏 罗 霞 刘 行
(上饶师范学院生命科学学院,上饶 334001)
以黄独微型块茎为材料,进行了4℃低温离体保存,并对其进行了转录组分析。结果表明:原始数据进行质量预处理后,对照组(Con25)和处理组(Con4)的reads有效比分别为98.67%和98.69%;对拼接序列去重复后最终得到了219 792个长度大于200 bp的transcripts(177 Mb)和161066个Unigenes(99 Mb);Unigenes的NR注释数目最多的10个物种分别为出芽短梗霉EXF-150、葡萄、可可、水稻粳稻组、无油樟、谷子、出芽短梗霉变种namibiae CBS 147.97、麻疯树、短至生黑醋杆菌CBS 110374和无花果拟盘多毛孢w106-1;样本注释基因最多的5个KOG是一般的功能预测、信号转导机制、翻译后修饰和蛋白质周转以及伴侣、翻译和核糖体结构和生物合成、能源生产和转换;样本KEGG注释Unigenes最多的5个pathway分别为碳代谢、氨基酸生物合成、糖酵解途径、淀粉蔗糖代谢和丙酮酸代谢。注释到的Unigenes个数为26 006,注释到的不同酶数为1 177,映射到的不同pathway数为327;样本基因的功能在Biological Process分类中主要聚集于cellular process和metabiolic process,在Cellular Component分类中主要聚集于cell和cell part,在Molecular Function分类中主要聚集于binding和catalytic activity;在黄独微型块茎低温离体保存中,共获得164 145个差异表达基因,其中有63 305个基因表达上调,有100 840个基因表达下调;差异表达基因部分极其显著的GO term有液泡继承、单链断裂修复、纺锤体伸长、麦芽糖分解代谢过程、甘露糖基转移酶的活性、甘露糖磷酸转移酶活性、细胞壁甘露糖蛋白的生物合成过程、G1期细胞有丝分裂周期早期细胞芽和有丝分裂纺锤体定位的建立;差异表达基因部分极其显著的pathway有原发性胆汁酸的生物合成、类固醇激素的合成、氯代环己烷和氯苯降解、双酚A降解、氟苯甲酸降解、糖胺聚糖合成硫酸软骨素、糖胺聚糖合成硫酸乙酰肝素、甲苯降解、萘的降解和核黄素代谢。本实验结果可为黄独微型块茎的种质保存和后续萌发提供理论依据。
黄独;微型块茎;低温离体保存;转录组分析
黄独(DioscoreabulbiferaL.)为薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)多年生藤本植物[1],其地下块茎俗称黄药子,性平、味苦、有毒[2]。在中医治疗上,常用来散结消瘿、清热解毒和凉血止血;在临床上,黄药子可抗病毒、抗肿瘤,常用来治疗甲状腺疾病和多种癌症[3~4]。薯蓣属植物试管苗和大田栽培苗的叶腋内一般会形成微型块茎(也称珠芽),可直接食用,是功能性食品和皮肤保护剂[5],还可用作繁殖材料,可提高繁殖系数[6],特别是脱毒微型块茎可代替脱毒苗用于大田种植[7]。但微型块茎在大田收获或试管苗收获后,容易造成滋生病菌,引起变软腐烂,特别是试管苗诱导的微型块茎保存期更短。而微型块茎的低温离体保存可解决这个问题。本课题组的研究表明,微型块茎的低温离体保存,不但可较好地保存其种质资源,也可打破其休眠、促进其萌发。因此研究微型块茎的低温离体保存具有一定的现实意义。目前,有关薯蓣属微型块茎方面的研究大多集中在离体诱导[8]和萌发生理[9]等方面,而针对其低温离体保存的研究相对较少,更无见有关微型块茎低温离体保存转录组测序等方面的研究报道。转录组表现的是生物或组织细胞在特定状态下的所有RNA的总和,是连接基因组遗传信息与生物功能蛋白质组的必然纽带,因而,转录组的测序研究成为探究基因结构及功能的基础[10]。本研究通过对4℃低温离体保存下黄独微型块茎转录组的分析,探索黄独微型块茎低温离体保存的机理,并挖掘黄独微型块茎低温离体保存的相关基因,以期为黄独微型块茎的种质保存和后期萌发提供理论依据。
1 材料和方法
1.1 材料
黄独离体诱导的微型块茎(由上饶师范学院生命科学学院植物组织培养室提供)。
1.2 方法
1.2.1 黄独的低温离体保存
挑选出黄独离体诱导直径约0.5 cm的微型块茎转移到无菌100 mL三角瓶(空瓶)中,然后进行4℃低温离体保存。试验材料分成4℃低温离体保存处理组(以Con4表示)和25℃常温离体保存对照组(以Con25表示),保存60 d后进行转录组学分析。
1.2.2 总RNA提取
将样品液氮研磨,取100 mg细粉加入CLB裂解液(北京艾德莱),裂解液含20%β-巯基乙醇,立即振荡混匀,65℃水浴5 min,13 000 r·min-1离心10分钟,取上清,加入等体积氯仿/异戊醇=25∶24∶1(pH<5.0),大力振荡60 s,4 500 r·min-1离心10 min;取上清加入等体积氯仿/异戊醇=24∶1,大力振荡60 s,4 500r·min-1离心2 min,重复以上步骤直至中间层干净;取上清,加入2.5倍体积的预冷无水乙醇和0.1倍体积5 mol·L-1乙酸钾4℃过夜沉淀,12 000 r·min-1离心20 min,弃去上清后用氮吹除去乙醇,用60 μL RNase-Free H2O复溶。
1.2.3 测序
总RNA样品的质量控制是通过Bioanalyzer 2100(Agilent,Germany)完成的。首先,5 μg总RNA通过Dynabeads Oligo(dT)(Life technologie,USA)进行mRNA捕获,并进行片段化处理,随后用SuperScriptⅢ cDNA Synthesis Kit(Life technologies,USA)进行cDNA的反转录。进行cDNA末端修复、3′平末端加“A”、Adapters连接反应最终连接至illumina的测序接头并进行PCR扩增反应。根据Illumina公司HiSeq SBS Kit and Cluster Kit v4(Illumina,Sandiego)说明制备Total RNA测序文库。建立的文库进一步用Qubit 2.0(Life technologies,USA)and Bioanalyzer 2100(Agilent,Germany)进行质量控制。最后,按照Illumina公司Hiseq 2500的操作说明对形成的cDNA文库进行2×125 bp的高通量测序(测序无生物学重复),利用CASAVA 1.8软件进行图像分析,碱基转换,并根据不同的INDEX进行多通路筛选。
2 结果与分析
2.1 测序数据预处理
通过illlumina Hiseq2500的paired-end测序,得到了大量的样本数据。鉴于illlumina Hiseq 2500错误率对结果的影响,对原始数据进行质量预处理(表1)。原始数据进行质量预处理后,对照组(Con25)和处理组(Con4)以及这两组所有样本的有效比分别为98.67%、98.69%和98.68%。
2.2 De novo拼接
将黄独处理组(Con4)和对照组(Con25)2组样本的有效reads合并,并使用软件Trinity的paired-end拼接方法进行de novo拼接。对拼接序列去重复,最终得到了219 792个长度大于200 bp的转录本,大小177 Mb;取每个Loci下最长的转录本作为Unigenes,得到了161 066个Unigenes,大小99 Mb(表2和图1)。

表1 质量预处理前后数据结果
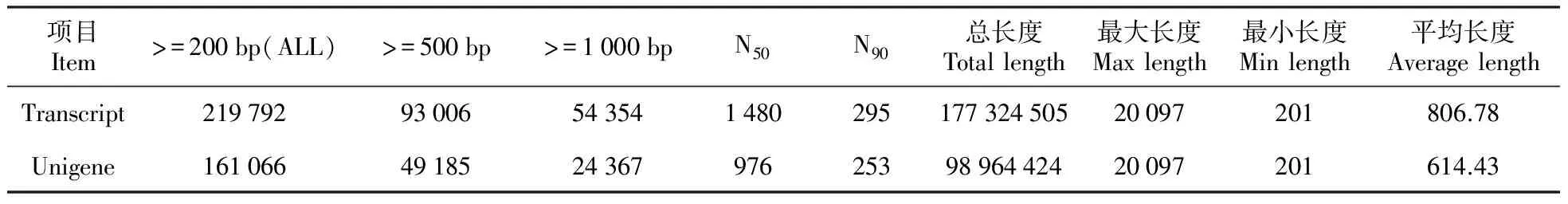
表2 De novo拼接结果
注:N50:将transcript从长到短排序,依次累加transcript碱基数,当累计碱基数达到transcript总碱基数的50%时的transcript的长度,Unigene同;N90以相似的方法统计
Note:The transcript is sorted from long to short,and the base number of the transcript base is accumulated successively.When the cumulative base number reaches 50% of the total base number of transcript,the length of the spliced transcript is N50.The unigene is the same as that of transcript.
2.3 Unigenes与公共数据库比较
将样本Unigenes与公共数据gene进行比较,样本基因序列分别与SWISS-PROT、TREMBL、CDD、PFAM、NR和KOG库进行比对,取相似度>30%,且e<1e-5的注释,合并基因得到的所有注释详细信息(表3)。在NR注释中,Unigenes注释上数目最多的10个物种分别为出芽短梗霉EXF-150、葡萄、可可、水稻粳稻组、无油樟、谷子、出芽短梗霉变种namibiae CBS 147.97、麻疯树、短至生黑醋杆菌CBS 110374和无花果拟盘多毛孢w106-1(图2)。

图1 Unigenes的长度和GC含量分布Fig.1 Unigenes length and GC content distribution
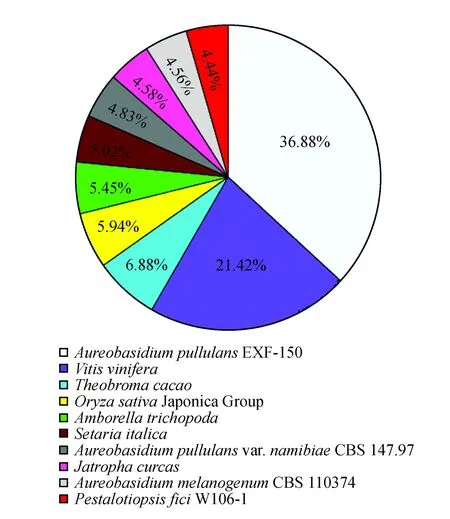
图2 黄独微型块茎组装转录物与NR数据库比对后的分类分布图Fig.2 Classification distribution of D.bulbifera L. microtubers assembled Unigenes after comparison with the NR database

表3 注释统计结果

图3 Unigenes的KOG功能分类 横坐标为KOG的25个group的名称;纵坐标为注释到该group下的基因个数占被注释上的基因总数的比例Fig.3 KOG functional classification of unigenes The name of the abscissa is 25 groups KOG,the ordinate is the number of notes to the group gene accounted for the proportion of the total number of gene annotation.
2.4 Unigenes的KOG分类
对预测基因进行KOG功能分类预测:共有23 743个Unigenes被注释上25种KOG分类(图3)。注释上样本基因最多的5个KOG是一般的功能预测、信号转导机制、翻译后修饰和蛋白质周转以及伴侣、翻译和核糖体结构和生物合成、能源生产和转换(表4)。
2.5 Unigenes的KEGG注释
对Unigenes进行了KEGG注释,该样本注释上Unigenes最多的5个pathway分别为碳代谢、氨基酸生物合成、糖酵解途径、淀粉蔗糖代谢和丙酮酸代谢(表5)。注释到的Unigenes个数为26 006,注释到的不同酶数为1 177,映射到的不同pathway数为327。以ko00190为例,Unigenes注释上的pathway见图4。从图4可知,Unigenes注释上的基因有NADH dehydrogenase、Succinate dehydrogenase/Fumarate reductase、Cytochrome C reductase、Cytochrome C oxidase、F-type ATPase(Bacteria)、F-type ATPase(Eukaryotes)、V-type ATPase(Eukaryotes)。这些基因主要与能量代谢有关,这表明黄独微型块茎的低温离体保存牵涉到能量代谢有关基因的表达。
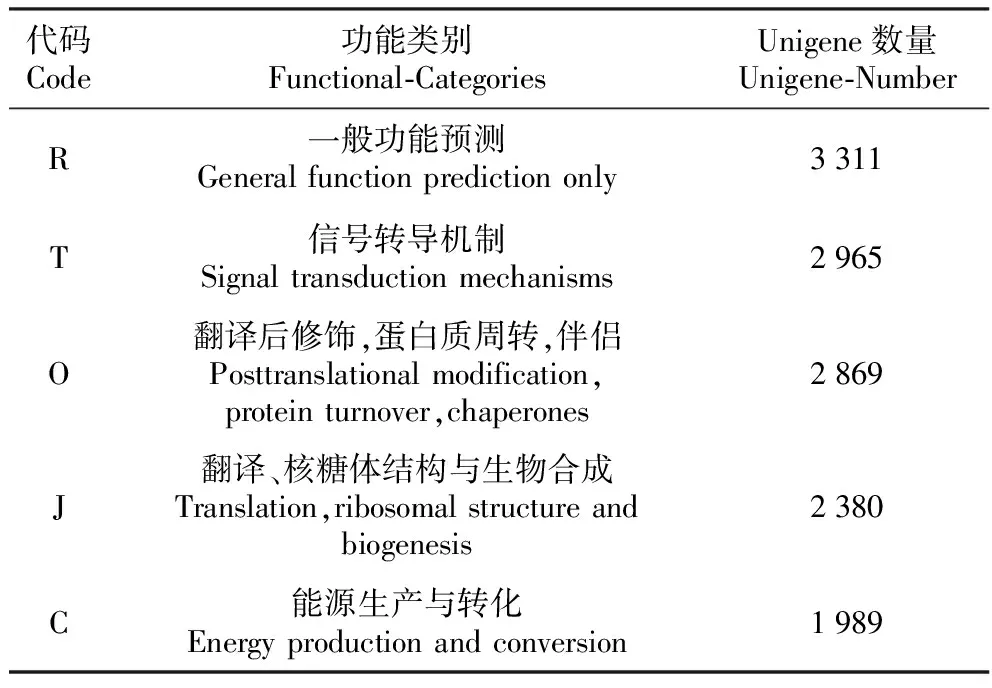
表4 注释上样本基因最多的5个KOG
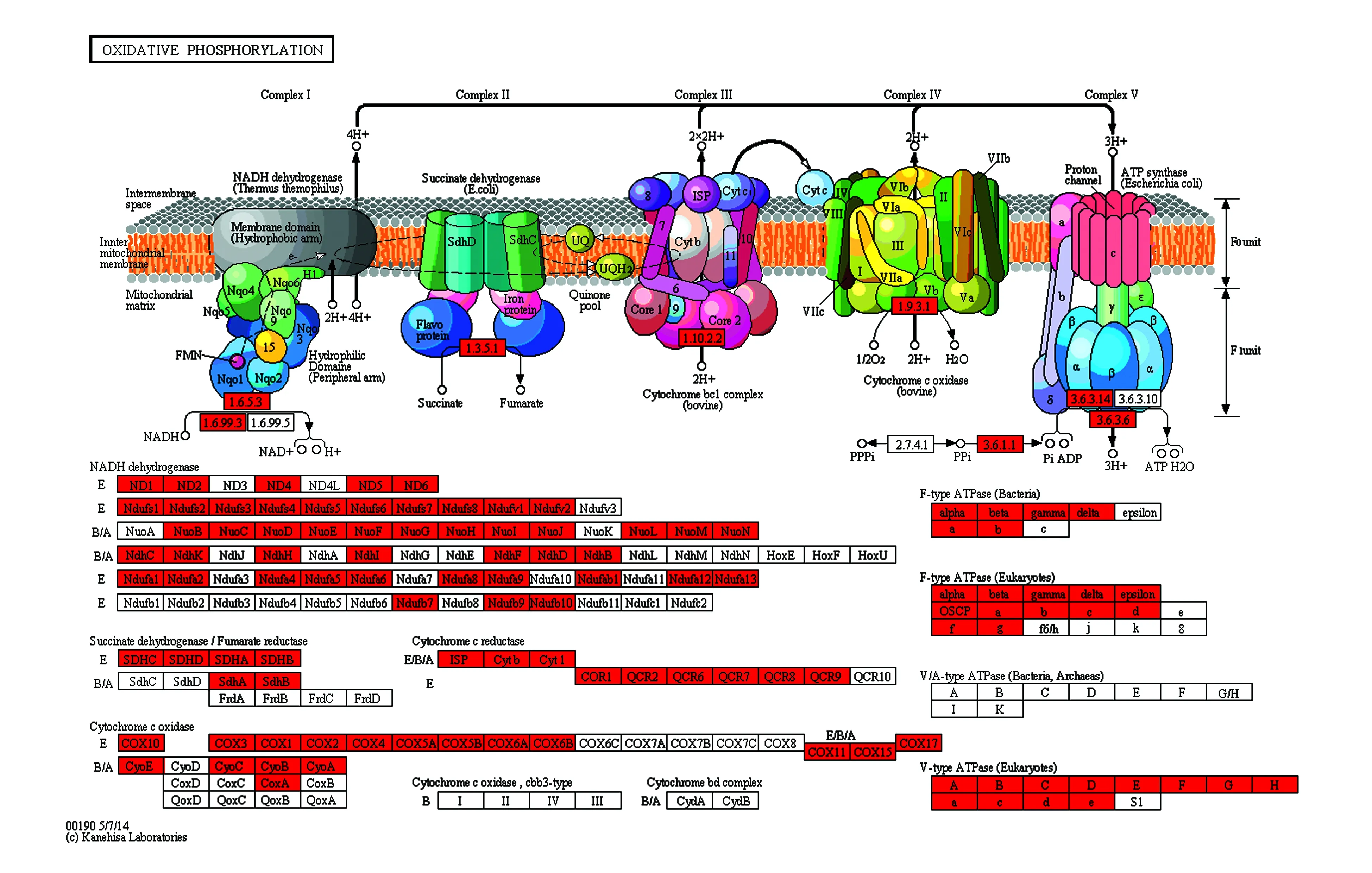
图4 Unigenes注释上的ko00190 pathway 图上红色表示注释上基因。Fig.4 The ko00190 pathway of Unigene annotation The red on the graph represents the annotation gene.

表5 样本注释上Unigenes最多的5个pathway

图5 Unigenes的GO注释Fig.5 GO annotation of Unigenes
2.6 Unigenes的GO注释
对得到的基因进行GO分类,统计基因在Biological Process,Cellular Component,Molecular Function 3个类别的各GO term。此分析是基于blast uniprot的结果(即合并与swissprot和trembl的结果),利用得到的uniprot号比对GO term。样本基因的功能在Biological Process分类中主要聚集于cellular process和metabiolic process;在Cellular Component主要聚集于cell和cell part;在Molecular Function分类中主要聚集于binding和catalytic activity(图5)。
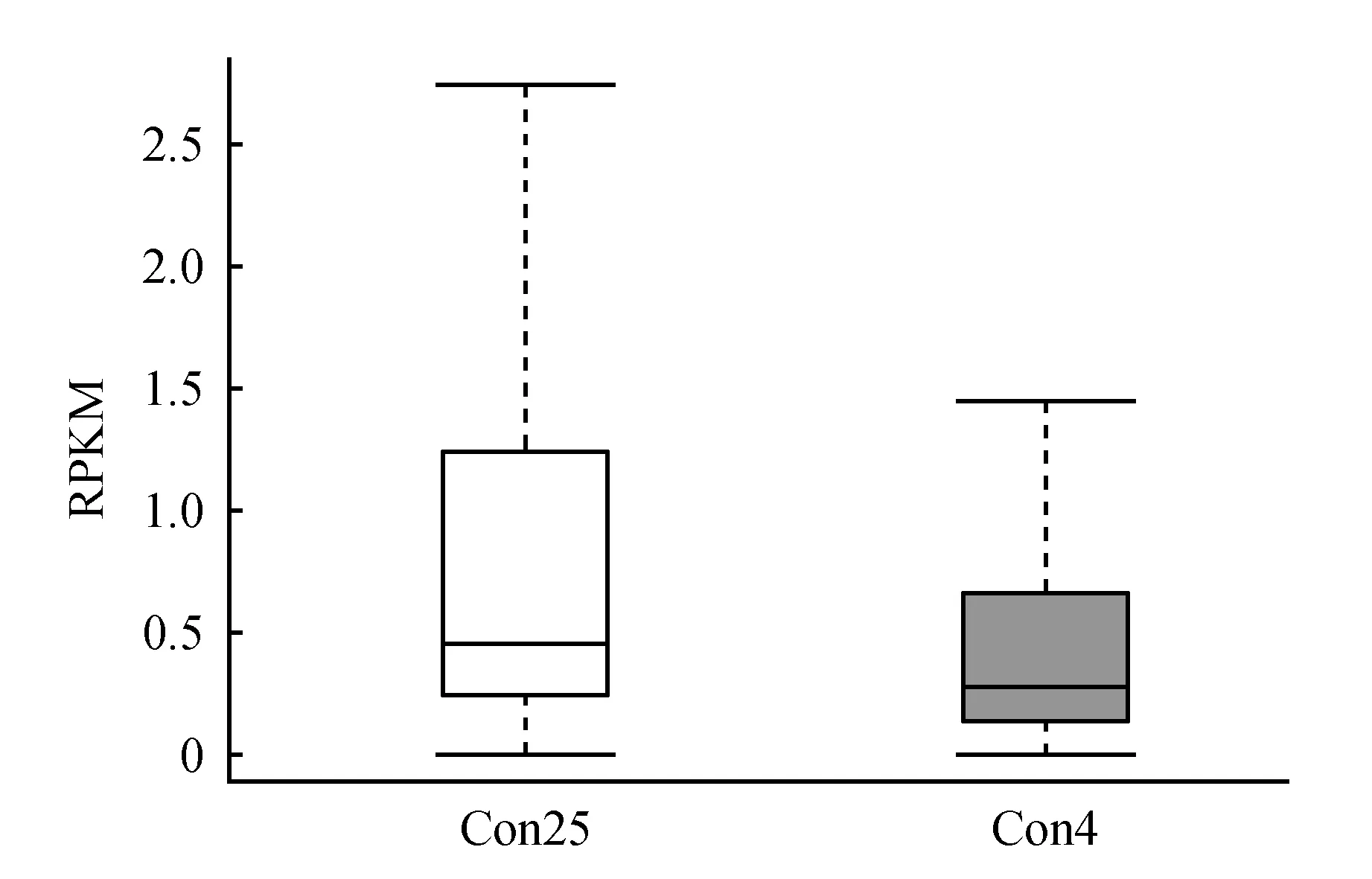
图6 基因表达值分布盒图Fig.6 RPKM distribution of transcript
2.7 Transcripts的表达丰度
用拼接得到的所有转录本做库,用序列相似性比对的方法求各转录本在各样本中的表达丰度。对照组(Con25)和处理组(Con4)的reads利用率分别为89.04%和88.34%,其转录本表达率则分别为80.85%和88.40%(表6);对照组(Con25)和处理组(Con4)丰度(RPKM)的Mean分别为3.3和2.44,其总和分别为587 179.88和474 833.1(表7);对照组(Con25)和处理组(Con4)丰度(RPKM)的分布分别为0-1.5和0-1.0(图6)。

表6 各样本reads利用率及转录本表达率统计结果
2.8 差异表达基因分析
根据各样本基因的表达丰度值做差异表达分析,包括:fold change分析,fisher检验,chisq检验等差异表达分析;最终结果以fold change为主。双层过滤筛选差异基因:①FC值筛选:采用Fold-change(FC),表达差异倍数进行第一层次的差异基因筛选。②FDR检验:一般采用卡方检验中的fisher精确检验进行p值检验,采用Benjamini FDR(False discovery ratio)校验方法对p值进行假阳性检验,即,通过FDR显著性参数进行第二层次的差异基因筛选。在黄独微型块茎低温离体保存中,共获得164 145个差异表达基因,其中有63 305个基因表达上调,有100 840个基因表达下调。
2.9 差异表达基因的GO和KEGG富集分析
在差异表达基因的GO和KEGG富集分析中,Con4相对Con25的上调的转录本为2 035和110(P≤0.05)以及1 672和84(P≤0.01);Con4相对Con25的下调的转录本为1 795和61(P≤0.05)以及1 341和45(P≤0.01)(表8)。以Con25_Con4的所有差异转录本(all)为例,部分极其显著的GO term有液泡继承、单链断裂修复、纺锤体伸长、麦芽糖分解代谢过程、甘露糖基转移酶的活性、甘露糖磷酸转移酶活性、细胞壁甘露糖蛋白的生物合成过程、细胞有丝分裂周期G1期、早期细胞芽位置、有丝分裂纺锤体定位的建立(表9)。部分极其显著的pathway有原发性胆汁酸的生物合成、类固醇激素的合成、氯代环己烷和氯苯降解、双酚A降解、氟苯甲酸降解、糖胺聚糖合成硫酸软骨素、糖胺聚糖合成硫酸乙酰肝素、甲苯降解、萘的降解和核黄素代谢(表10)。ko00190标记差异基因颜色的pathway见图8。

图7 差异表达基因量散点图 采用fold change分析(2倍上调/下调),包括特异性组织表达差异基因和共组织表达差异基因。Fig.7 The scatter plot of differentially expressed genes Using fold change analysis(2 fold up / down),including differential expression of specific tissues and the expression of genes differentially expressed in tissues.

表8 三类差异转录本统计结果
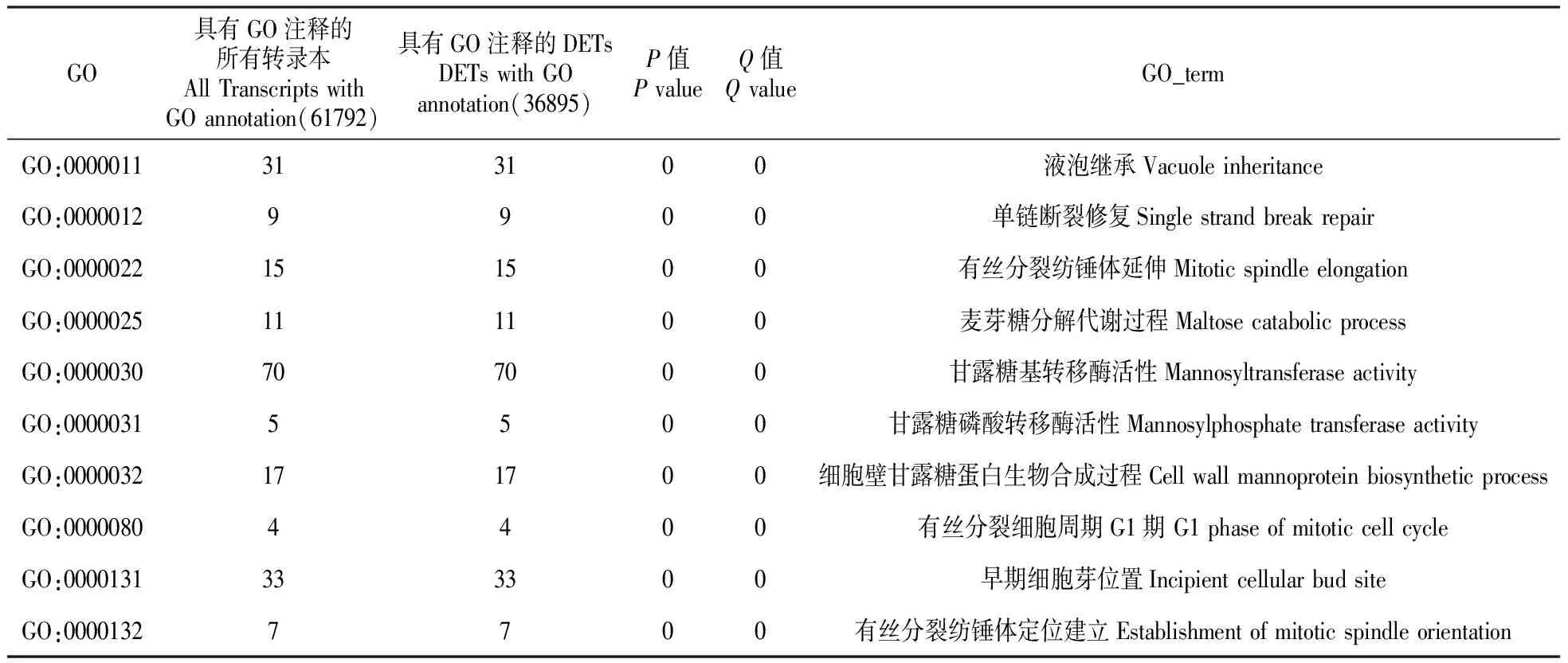
表9 Con25_Con4所有差异转录本部分极其显著的GO term
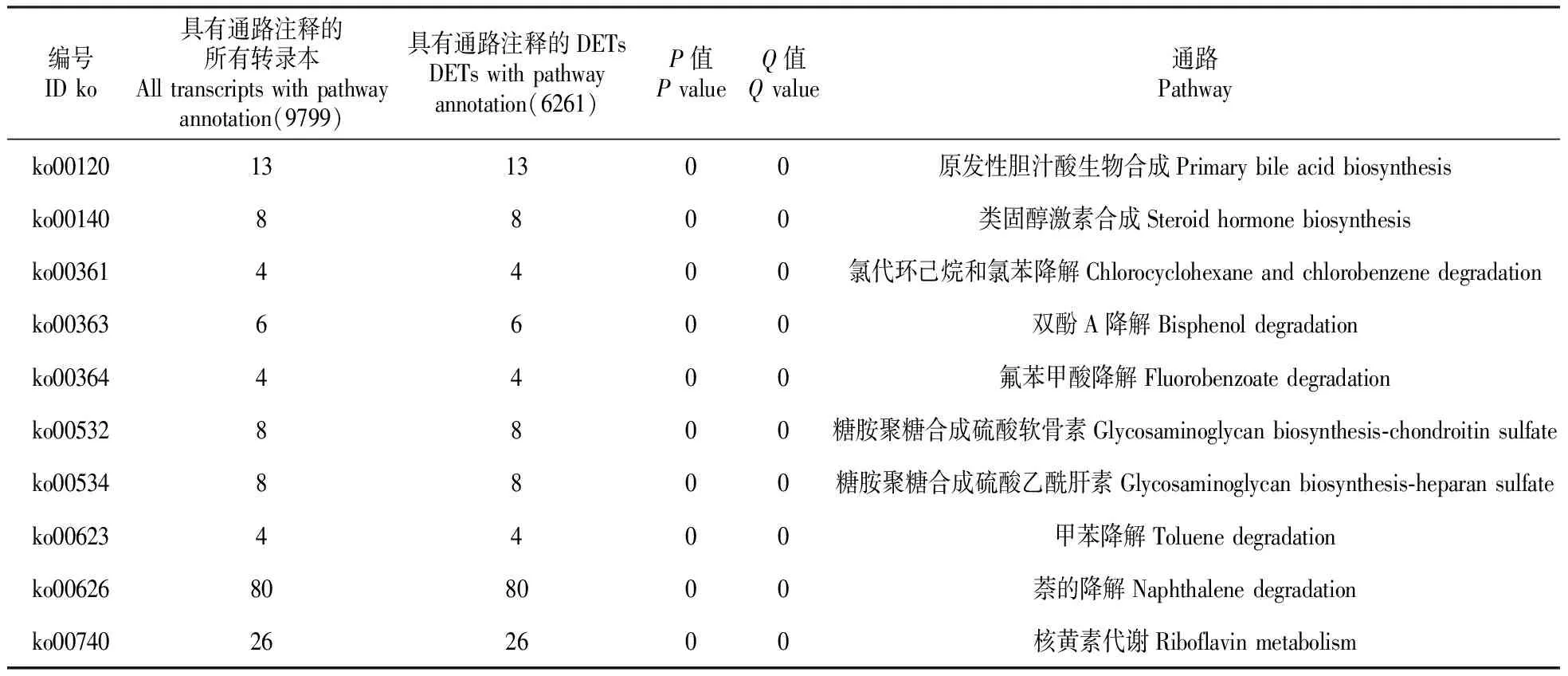
表10 Con25_Con4所有差异转录本部分极其显著的pathway
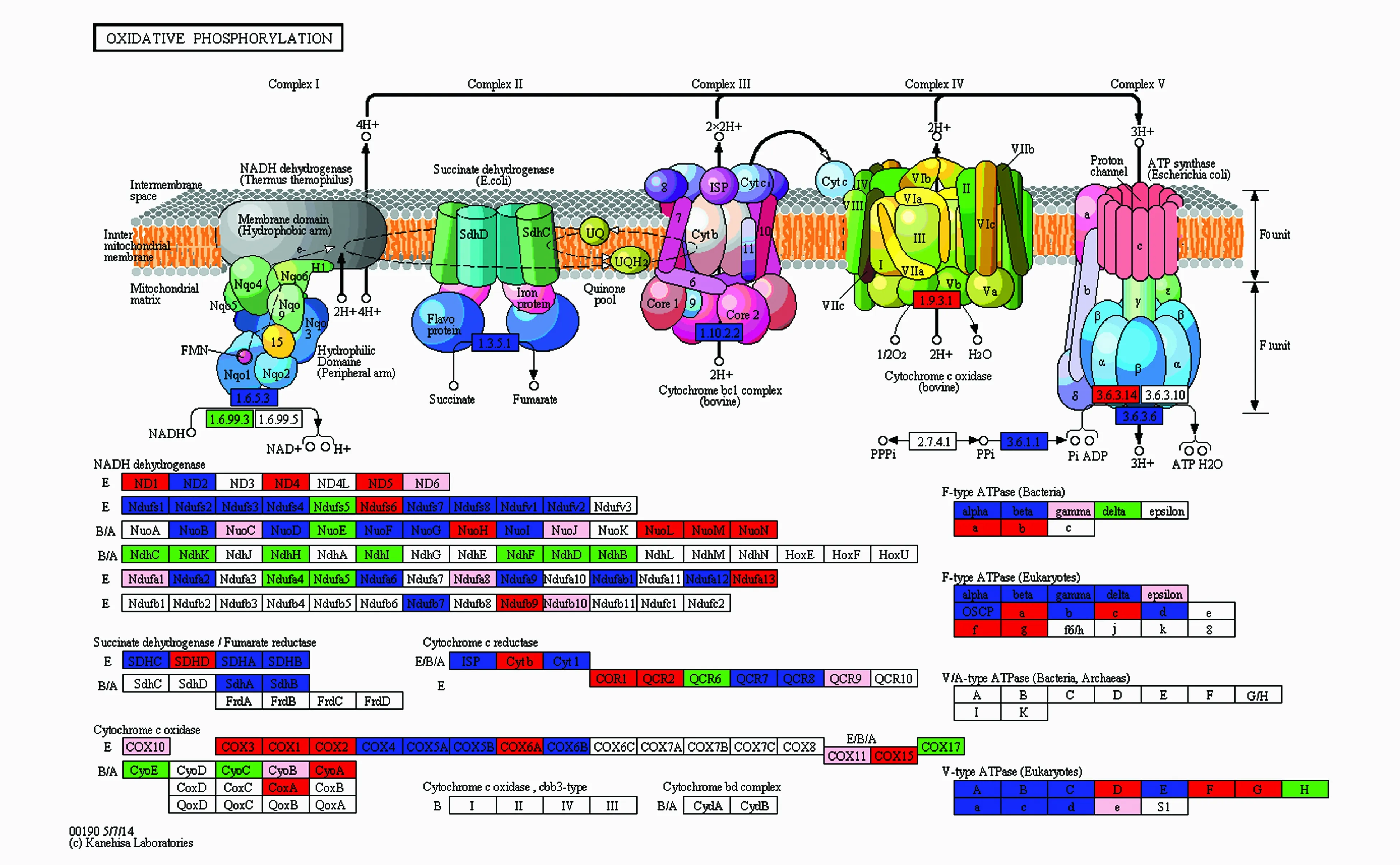
图8 ko00190标记差异基因颜色的pathway 红色代表注释上表达上调差异基因;蓝色代表注释上表达下调差异基因;绿色代表既注释上表达上调差异基因,也注释上表达下调差异基因;粉色代表只注释上非差异表达基因。Fig.8 Pathway of ko00190 differential gene signed by color The red color represents the up expression of differential genes; The blue color represents the down expression of differential genes; The green color represents the up and down expression of differential genes; The pink color represents only non differentially expressed genes.
3 讨论
本研究对黄独微型块茎处理组(Con4)和对照组(Con25)的转录组进行了illlumina Hiseq2500的paired-end测序。共获得160605816 Read和20 236 332 816 Base的原始数据,有效数据为158 483 948 Read和19 284 915 778 Base,平均长度为121.68。reads有效率为98.68%。研究表明,此次转录组测序数据质量较好,可以满足转录组分析的基本要求。
将黄独微型块茎处理组(Con4)和对照组(Con25)进行基因表达分析,共获得164 145个差异表达基因,有100 840个基因表达下调,63 305个基因表达上调。在差异表达基因的GO和KEGG富集分析中,Con4相对Con25的上调的转录本为2 035和110(P≤0.05)以及1 672和84(P≤0.01);Con4相对Con25的下调的转录本为1 795和61(P≤0.05)以及1 341和45(P≤0.01)。这说明黄独微型块茎在4℃低温离体保存的过程中,其主要以下调基因和上调基因协同表达的模式来同时应答低温离体保存,且上调和下调基因表达数没有显著性差异。抗寒性西葫芦SS1和冷敏感西葫芦SS3低温响应有613个差异表达基因检测到,其中612个差异表达基因显示相同的差异表达模式(308个上调表达,304个下调表达)[11];海南细枝木麻黄无性系处理组低温胁迫中的差异表达基因共有8 585个,其中包括3 872个上调和4 713个下调基因[12]。甘蓝型油菜低温胁迫12 h后诱导表达的差异基因数量最多,有18 641个,其中8 499个表现上调,10 142个表现下调[13]。低温胁迫下菊花共有2 310个基因发生差异表达,其中有1 592个上调基因,718个下调基因,上调基因和下调基因数量之间无显著性差异[14]。这些植物均是以下调基因和上调基因协同表达的模式来同时应答低温胁迫。上述结果与杨伟等[10]在枇杷幼果低温胁迫的研究结果也相一致。
对黄独微型块茎4℃低温离体保存中获得的差异表达基因进行GO的功能分类发现,部分极其显著的GO term有液泡继承、单链断裂修复、纺锤体伸长、麦芽糖分解代谢过程、甘露糖基转移酶的活性、露糖磷酸转移酶活性、细胞壁甘露糖蛋白的生物合成过程、G1期细胞有丝分裂周期的早期细胞芽和有丝分裂纺锤体定位的建立等。但郭彤[14]发现,低温胁迫下菊花差异基因富集相关性由高向低依次为肉桂酸生物合成过程、蛋白发色基团连接、盐胁迫反应、L-苯丙氨酸分解代谢过程、高渗反应、光合作用、光捕捉、胞浆转运、镉离子反应、光呼吸等。
对黄独微型块茎4℃低温离体保存中获得的差异表达基因进行KEGG的功能分类发现,部分极其显著的pathway有原发性胆汁酸的生物合成、类固醇激素的合成、氯代环己烷和氯苯降解、双酚A降解、氟苯甲酸降解、糖胺聚糖合成硫酸软骨素、糖胺聚糖合成硫酸乙酰肝素、甲苯降解、萘的降解和核黄素代谢等。值得注意的是,差异表达基因的pathway类中大多开始出现降解的功能亚类,这可能是植物对低温离体保存的一种应激反应,值得进一步研究。但在西葫芦[11]、枇杷幼果[10]、番茄[15]、甘蓝型油菜[13]和菊花[14]的低温胁迫中,显著富集的代谢通路表现不同,分别有6条和5条显著富集的代谢通路,包括光合作用代谢通路、色氨酸代谢通路、丙氨酸、天冬氨酸和谷氨酸代谢通路、苯丙素生物合成代谢通路、植物激素信号转导通路和抗坏血酸代谢通路以及光合作用—天线蛋白、抗坏血酸代谢、植物激素信号转导、苯基丙氨酸代谢和戊糖与葡萄糖醛酸脂互作代谢等。这表明,在低温胁迫中,微型块茎对低温胁迫的GO功能和代谢通路与植物体应对低温胁迫的代谢通路显著不同,究其原因,可能是微型块茎为薯蓣属变态器官所致。
本研究采用illlumina Hiseq2500高通量测序技术对黄独低温离体保存微型块茎的转录组进行测序,获得了大量的高质量数据和转录本信息,并对处理组的差异表达基因进行了功能注释、基于各数据库的功能分类富集分析、代谢通路富集分析等,获得了大量与黄独微型块低温离体保存茎相关的信息,为黄独微型块茎的种质保存和后期萌发提供了理论依据。
1.Dixit S,Mandal B B,Ahuja S,et al.Genetic stability assessment of plants regenerated from cryopreserved embryogenic tissues ofDioscoreabulbiferaL.Using RAPD,biochemical and morphological analysis[J].Cryo Letters,2003,24(2):77-84.
2.李玉娟,田园,欧婉露,等.以黄独乙素和儿茶素为指标成分研究黄药子—当归配伍组合[J].北京理工大学学报,2013,33(8):866-870.
Li Y J,Tian Y,Ou W L,et al.Study on combination ofRhizomaDioscoreaeBulbiferaeandRadixAngelicaeSinensiswith diosbulbin B and catechin as marker components[J].Transactions of Beijing Institute of Technology,2013,33(8):866-870.
3.Gao H,Kuroyanagi M,Wu L,et al.Antitumor-promoting constituents fromDioscoreabulbiferaL.in JB6 mouse epidermal cells[J].Biological & Pharmaceutical Bulletin,2002,25(9):1241-1243.
4.刘劲松,高卫娜,郑娟,等.黄独鲜块根化学成分研究[J].中国中药杂志,2017,42(3):510-516.
Liu J S,Gao W N,Zheng J,et al.Chemical constituents from fresh tubers ofDioscoreabulbifera[J].China Journal of Chinese Materia Medica,2017,42(3):510-516.
5.Fu Y C,Ferng L H A,Huang P Y.Quantitative analysis of allantoin and allantoic acid in yam tuber,mucilage,skin and bulbil of theDioscoreaspecies[J].Food Chemistry,2006,94(4):541-549.
6.龙雯虹,王琼,肖关丽,等.黄独珠芽生长期内源激素及糖类物质含量的变化[J].云南农业大学学报,2013,28(2):283-286.
Long W H,Wang Q,Xiao G L,et al.Variation of endogenous hormone and carbohydrate contents in growing bulbils ofDioscoreabulbifera[J].Journal of Yunnan Agricultural University,2013,28(2):283-286.
7.于倩,李明军.怀山药微型块茎愈伤组织的诱导形成及高频率再生[J].生态学报,2004,24(5):1022-1026.
Yu Q,Li M J.The callus induction and high-frequency regeneration ofDioscoreaoppositaThunb[J].Acta Ecologica Sinica,2004,24(5):1022-1026.
8.李明军,陈明霞,郭君丽,等.生长调节物质和糖对怀山药微型块茎诱导形成的影响[J].华北农学报,2004,19(3):69-72.
Li M J,Chen M X,Guo J L,et al.The effect of growth regulation substance and carbohydrate on the induction of bubils ofDioscoreaoppositaThunb[J].Acta Agriculturae Boreali-Sinica,2004,19(3):69-72.
9.尹明华,王丽,徐玉琴,等.江西产山药微型块茎萌发苗耐盐性隶属函数及主成分分析[J].中草药,2016,47(14):2526-2533.
Yin M H,Wang L,Xu Y Q,et al.Subordinate function and principal component analysis of salt tolerance of seedlings germinated from microtubers of Jiangxi local yam[J].Chinese Traditional and Herbal Drugs,2016,47(14):2526-2533.
10.杨伟,龚荣高,石佳佳,等.低温胁迫下枇杷幼果转录组的De novo组装和功能注释[J].西北农林科技大学学报:自然科学版,2014,42(8):138-146.
Yang W,Gong R G,Shi J J,et al.De novo assembly and functional annotation of the loquat young fruit transcriptome under chilling stress[J].Journal of Northwest A&F University:Natural Science Edition,2014,42(8):138-146.
11.张宏亮.低温胁迫下西葫芦转录组分析与SSR分子标记开发[D].晋中:山西农业大学,2015:6.
Zhang H L.Transcription analysis of summer squash in response to cold stress and the development of SSR molecular marker[D].Taigu:Shanxi Agricultural University,2015:6.
12.刘芬.低温胁迫对细枝木麻黄无性系生理指标和转录组的影响[D].长沙:中南林业科技大学,2015:5.
Liu F.Effect of low temperature on physiological traits and transcriptome ofCasuarinacunninghamianaMiq.clones[D].Changsha:Central South University of Forestry and Technology,2015:5.
13.杜春芳.甘蓝型油菜低温诱导的转录组和蛋白组分析[D].武汉:华中农业大学,2016:6.
Du C F.Analysis of transcriptomics and proteomics induced by cold stress inBrassicanapusL.[D].Wuhan:Huazhong Agricultural University,2016:6.
14.郭彤.低温胁迫下菊花叶片转录组比较分析[D].郑州:河南农业大学,2016:6.
Guo T.Comparative transcriptome analysis of the regulation of responding to low temperature inDendranthemamorifoliumby RNA-Seq[D].Zhengzhou:He’nan Agricultural University,2016:6.
15.刘辉.番茄耐寒种质低温胁迫下的转录组分析及相关基因功能鉴定[D].武汉:华中农业大学,2012:11.
LIU H.Transcriptome analysis of cold-tolerant tomato germplasm under cold stress and functional characterization of cold responsive genes[D].Wuhan:Huazhong Agricultural University,2012:11.
National Natural Science Foundation of China(31360072)
introduction:HONG Sen-Rong(1974—),male,master,professor,mainly engaging in plant biotechnology.
date:2017-03-21
TranscriptomeAnalysisofDioscoreabulbiferaL.MicrotubersConservedinvitroatLowTemperature
HONG Sen-Rong WU Hui ZHONG Lu XIONG Si-Min LUO Xia LIU Xing
(College of Life Sciences,Shangrao Normal University,Shangrao 334001)
WithDioscoreabulbiferaL. microtubers, we studied the conservationinvitroat 4℃ low temperature and its transcriptome analysis. After the original data were pretreated, the effective ratio of reads in the control group(Con25) and the treatment group(Con4) was 98.67% and 98.69%, respectively. The 219792 transcripts of 200 bp(177Mb) and 161066 Unigenes(99Mb) were obtained after the removal of the splicing sequence; 10 species of the most NR annotations in the Unigene was Aureobasidium pullulans EXF-150, Vitis vinifera, Theobroma cacao, Oryza sativa Japonica Group, Amborella trichopoda, Setaria italica, Aureobasidium pullulans var. namibiae CBS 147.97, Jatropha curcas, Aureobasidium melanogenum CBS 110374 and Pestalotiopsis fici W106-1, respectively. The 5 KOG of the annotated most unigenes were general function prediction only, signal transduction mechanisms, posttranslational modification, protein turnover, chaperones, translation, ribosomal structure and biogenesis and energy production and conversion. The 5 pathway of the KEGG annotated most unigenes were carbon metabolism, biosynthesis of amino acids, glycolysis/gluconeogenesis, starch and sucrose metabolism and pyruvate metabolism. The number of annotated unigenes was 26 006, the number of different annotated enzymes was 1 177, and the number of different pathway was mapped to 327. Gene function of samples in Biological Process classification mainly gathered at cellular process and metabolic process, in Cellular Component classification it gathered at cell and cell part, in Molecular Function classification mainly concentrated in binding and catalytic activity. In conservationinvitroat low temperature ofD.bulbiferaL. microtubers, a total of 164 145 differentially expressed genes was obtained, of which 63305 genes were up-regulated and 100 840 genes were down regulated. Extremely significant GO terms of the differentially expressed genes were vacuole inheritance, single strand break repair, mitotic spindle elongation, maltose catabolic process, mannosyltransferase activity, mannosylphosphate transferase activity, cell wall mannoprotein biosynthetic process, G1 phase of mitotic cell cycle, incipient cellular bud site and establishment of mitotic spindle orientation. Extremely significant pathways of the differentially expressed genes were primary bile acid biosynthesis, steroid hormone biosynthesis, chlorocyclohexane and chlorobenzene degradation, bisphenol degradation, fluorobenzoate degradation, glycosaminoglycan biosynthesis-chondroitin sulfate, glycosaminoglycan biosynthesis-heparan sulfate, toluene degradation, naphthalene degradation and riboflavin metabolism. The experimental results provides a theoretical basis for germplasm conservation ofD.bulbiferaL. microtuber and its subsequent germination.
DioscoreabulbiferaL.;microtuber;conservationinvitroat low temperature;transcriptome analysis
国家自然科学基金项目(31360072)
洪森荣(1974—),男,硕士,教授,主要从事植物生物技术方面的研究。
2017-03-21
S632.1
A
10.7525/j.issn.1673-5102.2018.01.012
