核桃JrGRAS2基因响应热胁迫的表达及功能分析
2018-01-09粟莉圆李孝哲陈淑雯张芳芳赵婷婷杨桂燕
粟莉圆 李孝哲 陈淑雯 张芳芳 赵婷婷 杨桂燕*
(1.西北农林科技大学林学院山阳核桃板栗试验示范站,杨凌 712100; 2.西北农林科技大学林学院陕西省经济植物资源开发利用重点实验室,杨凌 712100)
核桃JrGRAS2基因响应热胁迫的表达及功能分析
粟莉圆1,2李孝哲1陈淑雯1,2张芳芳1,2赵婷婷1,2杨桂燕1,2*
(1.西北农林科技大学林学院山阳核桃板栗试验示范站,杨凌 712100;2.西北农林科技大学林学院陕西省经济植物资源开发利用重点实验室,杨凌 712100)
GRAS转录因子在植物响应逆境中起重要作用。为更好的了解核桃(Juglansregia)在逆境胁迫下的适应机制,本研究从‘香玲’核桃转录组中克隆获得一条GRAS基因(命名为JrGRAS2),对其在不同高温胁迫下的表达进行分析,并将该基因插入酵母表达载体pYES2中构建重组载体pYES2-JrGRAS2,将pYES2-JrGRAS2转入酿酒酵母(Saccharomycescerevisiae)INVSCI,同时以转化pYES2的重组酵母作为阴性对照,在酵母表达系统中研究该基因的抗热胁迫功能。结果显示,该基因开放读码框(ORF)全长1 296 bp,拟推导的蛋白分子量为47 405.83 Da,含有氨基酸数为431,理论等电点为5.66。在热胁迫下,JrGRAS2基因被显著诱导,特别是在36℃胁迫0.5 h的茎内,其表达相对于对照被上调了335.5倍。对两种酵母进行热胁迫,发现转JrGRAS2基因酵母表现出较对照更高的生存活性。表明JrGRAS2基因具有响应热胁迫的能力,且能提高酵母的抗性,JrGRAS2基因可作为核桃逆境应答的重要候选基因。
核桃;热胁迫;GRAS转录因子;表达分析;酵母表达系统
GRAS是近年来发现的一种高等植物特有的转录因子家族,命名来源于其功能成员GAI(gibberellicacid insensitive)、RGA(repressor of GA1-3 mutant)和SCR(scarecrow)[1]。其特征是含有一个由氨基酸和天门冬氨酸组成的高度保守的VHIID区域,在VHIID区域的两侧还各含有一个富含亮氨酸的重复序列LZ[2]。目前,已经在拟南芥(Arabidopsisthaliana)基因组中鉴定得到了33个GRAS家族基因,如d8、rNT、PAT1、SCL13和SCL14等基因[1,3]。在其他一些草本植物中也陆续有GRAS家族基因的报道,如番茄(Solanumlycopersicum)、水稻(Oryzasativa)、葡萄(Vitisvinifera)等[4~6]。
植物中GRAS蛋白的数量众多、功能多样,是生长发育过程的关键调控蛋白。如,赤霉素信号转导、根的发育、根瘤和菌根的形成等[1~2,7~8]。GRAS家族基因也参与植物对各种环境胁迫的应答,如在拟南芥、水稻、烟草(Nicotianatabacum)等多种植物中发现了响应低温、干旱、渗透和激素等胁迫的GRAS家族基因[9~11]。但目前关于GRAS家族基因的研究主要集中在草本模式植物中,而对木本植物GRAS转录因子的研究较少。特别是对GRAS家族中大多数分支的具体作用机制尚不完全清楚。
核桃(Juglansregia)属多年生落叶乔木,是世界四大坚果之一,也是我国主要经济树种之一。但由于近年来全球环境的变化,环境因子特别是西北地区夏秋核桃成熟期严重的高温干旱等气候现象,已成为影响核桃发展的重要限制因素之一。因此研究核桃的抗逆机理将有利于为核桃抗高温胁迫等抗逆调控提供一定的指导作用。然而,目前国内外对核桃的研究主要集中在核桃品质鉴定、品种选育及化学成分分析等方面,从分子水平探讨核桃抗逆调控方式仍属相对空白的领域。本研究我们对核桃的一条GRAS基因(JrGRAS2)进行表达分析,并利用酵母表达系统对JrGRAS2基因在酵母中的抗热功能进行分析。
1 材料与方法
1.1 JrGRAS2基因的克隆与分析
以“GRAS”为关键词在‘香玲’核桃转录组中查找相关基因,经Blast比对选取其中1条GRAS基因(命名为JrGRAS2)进行分析。用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)确定JrGRAS2基因开放读码框(ORF),再根据ORF两端序列设计引物JrGRAS2-F和JrGRAS2-R(表1),进行PCR扩增。产物经回收纯化后与pMD-18-T载体连接并转化大肠杆菌DH5α感受态细胞。挑取阳性克隆扩大培养进行菌液PCR验证,对可获得目的片段的克隆测序。利用Expasy ProtParam(http://web.expasy.org/protparam/)对确认的JrGRAS2基因序列特征进行分析。利用BLASTP(http://blast.ncbi.nlm.nih.gov/Blast)进行序列同源性搜索;利用Clustal 3.0软件对不同物种的GRAS基因进行多序列比对和进化分析。
1.2 JrGRAS2基因的表达分析
对培养于相同条件下的2年生‘香玲’核桃嫁接苗分别进行28、32、36、40、44℃处理0、0.5、1 h,分别提取根、茎、叶总RNA进行表达分析,胁迫0 h为对照。每个处理设置3次重复。RNA提取采用CTAB方法[12]进行,RNA经DNA消化酶处理后采用PrimeScriptTMRT reagent Kit(CWBIO)反转录为cDNA,稀释10倍后用作qRT-PCR的模板。qRT-PCR使用SYBR Green Real time PCR Master mix(CWBIO,康为世纪,中国)进行,内参基因为核桃18S rRNA(HE574850)基因[12]。所用引物如表1所示,JrGRAS2定量引物为DL-F和DL-R。定量反应所用仪器为Applied Biosystems生产的StepOneTMReal-Time PCR System。反应程序为:94℃预变性30 s;94℃变性12 s,60℃退火45 s,72℃延伸45 s,45个循环;81℃读板1 s,每个样品重复3次。采用2-△△Ct法对定量结果进行相对分析[13]。
1.3 酵母表达载体构建及胁迫分析
根据JrGRAS2基因序列特征及pYES2酶切位点特性设计酵母表达载体引物JrGRAS2-JM-F和JrGRAS2-JM-R(表1)。通过PCR反应获得含有酶切位点的JrGRAS2序列,经酶切纯化后与pYES2连接获得重组载体pYES2-JrGRAS2。将pYES2-JrGRAS2和空pYES2载体分别转入酵母INVSC1中[12],分别记为INVSC1(pYES2-JrGRAS2)和INVSC1(pYES2),后者为对照。本研究所用工具酶均为宝生物(Takara)公司产品。
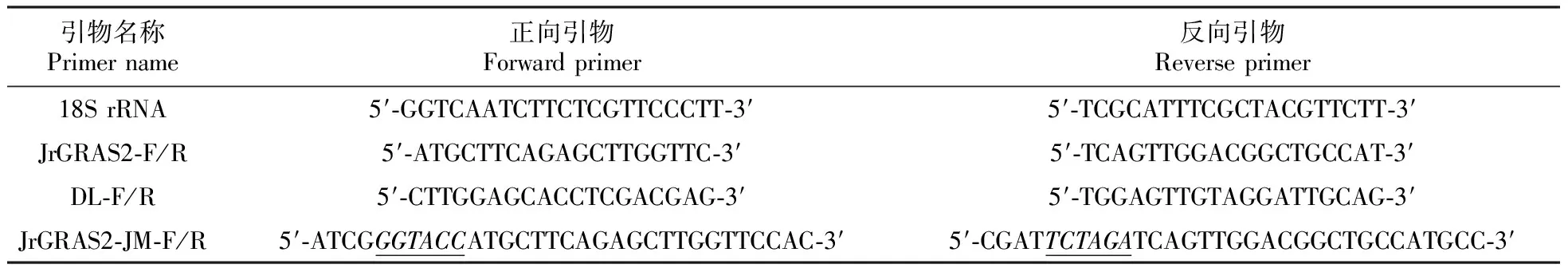
表1 本研究所用引物
注:正体下划线序列为KpnⅠ酶切位点;斜体下划线序列为XbaⅠ酶切位点
Note:The normal underlined sequence is theKpnⅠ restriction site,the italic underlined sequence isXbaⅠ restriction site.
分别挑取INVSC1(pYES2-JrGRAS2)和INVSC1(pYES2)单克隆置于含2%葡萄糖的SC-Ura液体培养基中,30℃震荡培养16 h,收集酵母菌体重悬于含2%半乳糖的SC-Ura液体培养基中,且调整OD600=0.5,30℃继续震荡培养至OD600=1.8,分别收集菌体进行胁迫处理。
酵母热胁迫生长恢复力比较[12]:将收集的INVSC1(pYES2-JrGRAS2)和INVSC1(pYES2)分别在28℃、30℃(对照)、32、36、40、44、53℃下处理2 h,然后对菌液作10×稀释,再分别取2 μL点在含2%葡萄糖的SC-Ura固体培养基上,30℃培养分别培养48 h(28~36℃)或52 h(40~53℃),观察酵母生长情况。
酵母热胁迫成活率测定[12]:取5 mL收集的菌体分别在28℃、30℃(对照)、32、36、40、44、53℃水浴处理1 h,在30℃恢复生长20 h,测定OD600。每个实验重复3次。数据使用SPSS软件(SPSS,Chicago,Illinois,USA)分析。
2 结果与分析
2.1 JrGRAS2基因全长cDNA的获得及序列分析
通过查找核桃转录组获得JrGRAS2基因,根据获得的cDNA序列设计引物JrGRAS2-F/R进行PCR验证,经分析发现JrGRAS2基因ORF长1 269 bp(图1),拟推导的蛋白分子量为47 405.83 Da,含有氨基酸数为431,理论等电点为5.66。BLAST分析发现该基因具有保守域,表明该蛋白为GRAS蛋白。经BLASTP同源搜索及TAIR网查找获得不同植物的GRAS蛋白,与JrGRAS2基因翻译的蛋白进行进化分析,发现JrGRAS2与龙眼(Dimocarpuslongan)DlGRAS进化关系较近(图2)。

图1 JrGRAS2基因序列Fig.1 The JrGRAS2 gene sequence
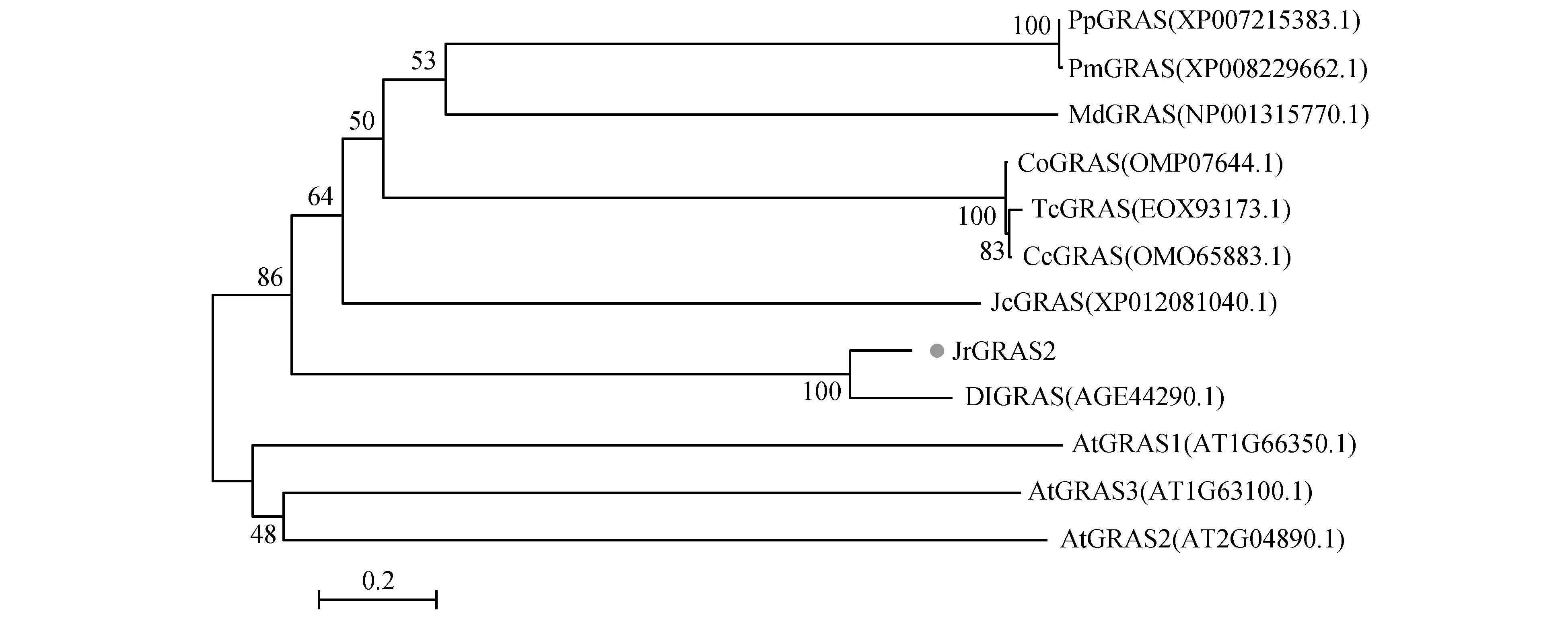
图2 JrGRAS2蛋白的进化分析 进化树中蛋白名称后括号内为蛋白GeneBank登录号;标尺表示蛋白之间的差异性;分支上数值表示同一分支上蛋白的相关性 PpGRAS.碧桃;PmGRAS.梅;TcGRAS.可可;JcGRAS.麻疯树;CoGRAS.长种黄麻;MdGRAS.苹果;CcGRAS.圆果种黄麻;DlGRAS.龙眼;AtGRAS1、AtGRAS2、AtGRAS3. 三个拟南芥GRASFig.2 Phylogenetic analysis of JrGRAS2 protein The symbol behind the protein in the brackets were GeneBank numbers; The scaleplate means the difference of proteins; The numerical value means the correlation of proteins in a same branch PpGRAS. Prunus persica;PmGRAS. Prunus mume; TcGRAS. Theobroma cacao; cGRAS. Jatropha curcas; CoGRAS. Corchorus olitorius; MdGRAS. Malus domestica; CcGRAS. Orchorus capsulari; DlGRAS. Dimocarpus longan; AtGRAS1,AtGRAS2,AtGRAS3. Three GRAS from Arabidopsis thaliana
2.2 JrGRAS2基因在不同温度处理下的表达
对核桃进行不同温度处理后,提取根、茎、叶的总RNA分别反转录为cDNA后用作qRT-PCR的模板。结果显示,JrGRAS2基因在28~44℃胁迫0.5和1.0 h时,在根、茎、叶中均被明显诱导(图3)。胁迫0.5 h,JrGRAS2基因在根中的表达相对茎和叶较低,为对照的1.9~11.9倍,叶中为2.5~39.1倍,其中36℃胁迫0.5 h,JrGRAS2基因在茎中的表达被上调最大,为对照的335.5倍(图3A)。胁迫1 h,JrGRAS2基因在根、茎、叶中的变化趋势相似,即,随着胁迫温度升高,其表达也逐渐上升,至40℃达到最大值,在44℃时又有所下降。40℃处理下,JrGRAS2基因在根、茎、叶中的表达分别为对照的53.4、81.0、146.0倍。在根中的最低表达出现在28℃,为对照的1.5倍;茎和叶中最低值均出现在44℃,分别为对照的1.5和2.1倍(图3B)。
2.3 高温胁迫下INVSC1(pYES2-JrGRAS2)和INVSC1(pYES2)的抗热能力
挑取INVSC1(pYES2-JrGRAS2)和INVSC1(pYES2)单克隆在相同条件下培养至相同的OD600,对其进行不同温度处理后经不同稀释点点于培养基上培养,观察酵母的生长情况。结果显示,在非胁迫条件下,INVSC1(pYES2-JrGRAS2)和INVSC1(pYES2)的生长没有明显区别,但在热胁迫处理后(36~53℃),INVSC1(pYES2-JrGRAS2)在稀释10 000倍后仍能较好的生长,而INVSC1(pYES2)没有观察到酵母生长(图4),说明热胁迫处理影响了酵母的生长活性。对两种酵母进行不同温度处理后进行培养,通过比较其OD600分析其抗热性。结果显示随着胁迫温度增加,OD600逐渐变小,但INVSC1(pYES2-JrGRAS2)一直高于INVSC1(pYES2),且当温度大于36℃时差异显著(图5),表明JrGRAS2基因的表达显著改善了酵母的抗热性。
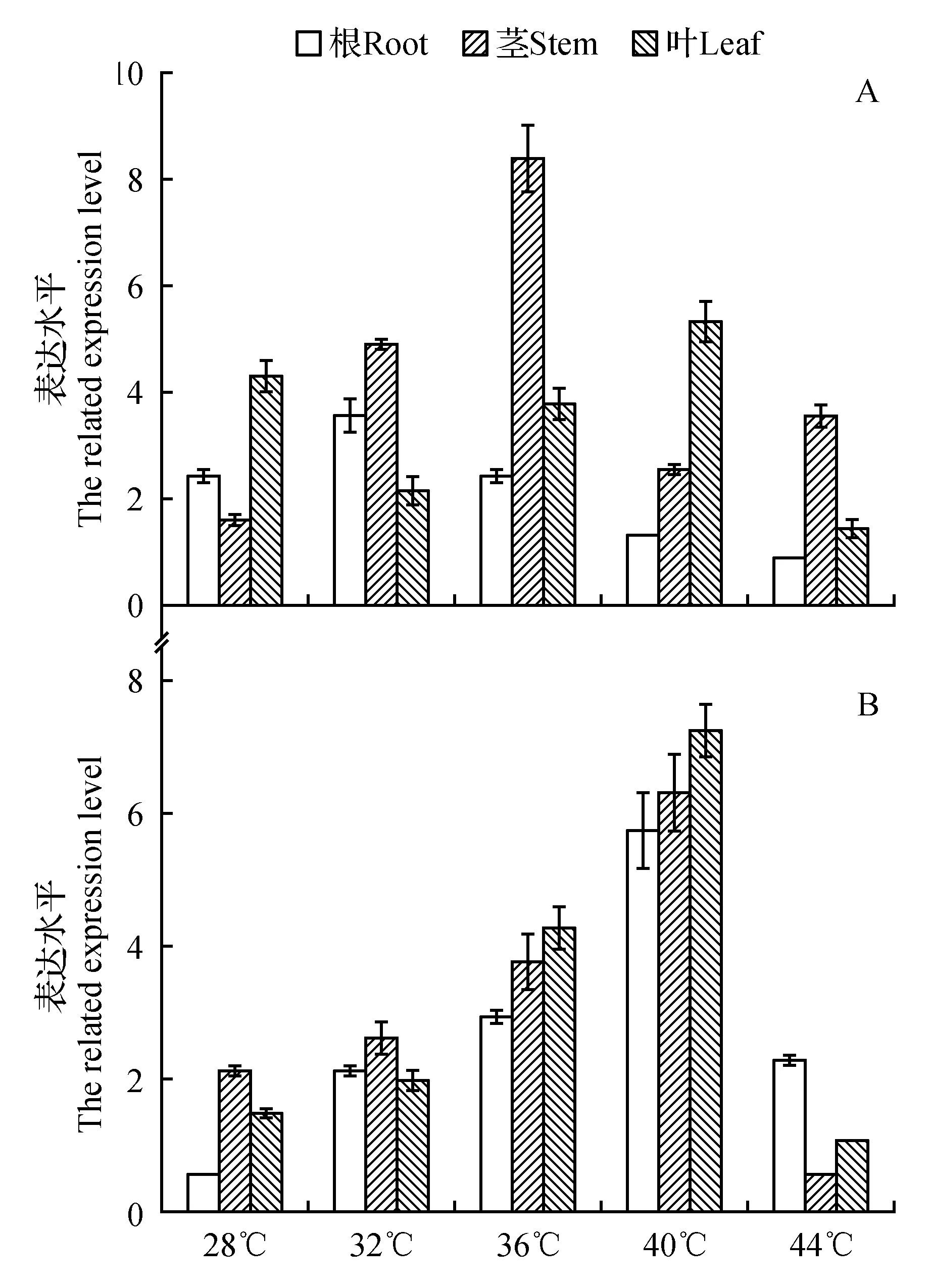
图3 JrGRAS2基因在不同温度胁迫下的表达水平 A. 0.5 h胁迫下的表达;B. 1.0 h胁迫下的表达Fig.3 The expression level of JrGRAS2 gene under different high temperature stresses A. The expression under 0.5 h treatment; B. The expression under 1.0 h treatment

图4 转JrGRAS2基因酵母在热胁迫下的抗性Fig.4 The heat stress tolerance of JrGRAS2 gene transgenic yeasts
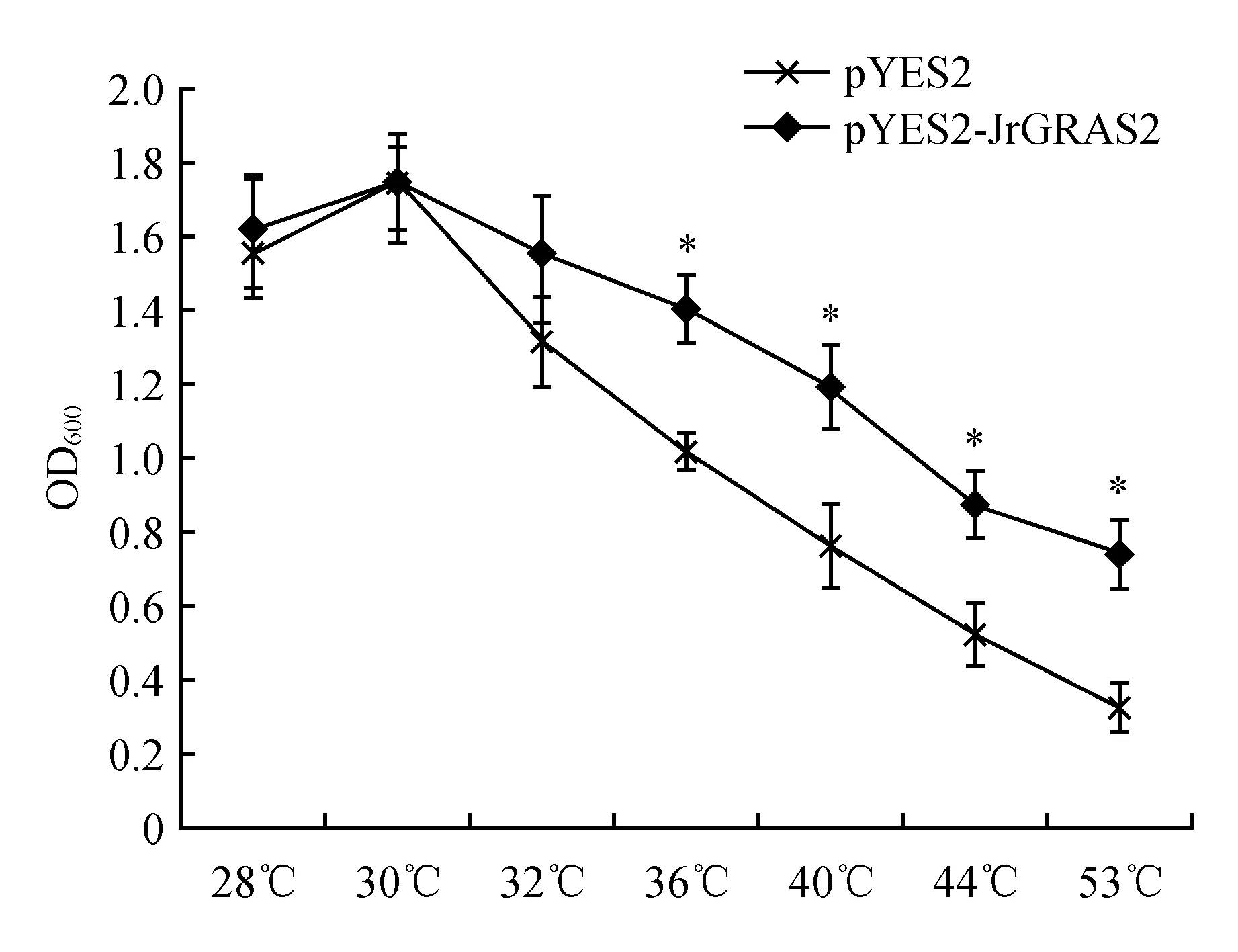
图5 转JrGRAS2基因酵母在热胁迫下的OD600Fig.5 The heat tolerance showed by OD600 of JrGRAS2 transgenic yeasts under different temperature treatments
3 讨论
核桃是重要木本油料植物,是我国扶贫攻坚项目的重要树种,核桃产业在推动区域经济上具有重要作用。而核桃产业的健康快速发展与核桃的产量和质量息息相关。但由于全球气候变化严重制约了我国西北地区核桃产业的发展。因此,选育抗逆优良核桃品种、掌握核桃抗逆适应机制,特别是异常温度下的调控机制对深入了解核桃的适应性具有重要指导作用[14]。GRAS是植物中新发现的一类重要转录因子,具有多重功能。研究表明,拟南芥GRAS转录因子与渗透胁迫调控相关[9],水稻OsGRAS23基因与干旱胁迫响应相关[10],烟草NtGRAS1基因也属于胁迫诱导型蛋白[11]。本研究我们从核桃获得JrGRAS2基因,该基因与拟南芥AT1G63100、AT1G66350、AT2G04890等的进化关系较近,其中AT1G63100与赤霉素(GA)代谢途径相关[15],AT1G66350与根系发生相关[16],AT2G04890与光敏色素A信号转导相关[17],而这些功能又与逆境响应具有联系,因此,推测JrGRAS2基因可能参与逆境响应,且在行使功能时也可能涉及赤霉素信号通路。
对核桃进行不同的温度处理,分析JrGRAS2基因在热胁迫下的表达,结果显示,JrGRAS2基因在不同温度不同时间处理下,在根、茎、叶中均能被明显诱导,表明该基因可能参与核桃的热胁迫响应调控。这与其他一些报道相似,如,周莲洁等人分析盐穗木(Halostachyscaspica)GRAS基因在盐胁迫下的表达推测该基因可能与盐胁迫响应相关[18];石瑞等人表明佛手(Citrusmedicavar.sarcodactylis)GRAS转录因子在低温胁迫下被诱导,推测该基因与耐寒调控相关[19];龙眼DlGRAS4和DlGRAS54主要在发育的中晚期起作用,其表达在外源赤霉素处理后明显上调,说明DlGRAS4和DlGRAS54可能与赤霉素信号响应相关[20]。
酵母表达系统是现代分子生物学研究不可缺少的重要手段,有不少基因的功能通过酵母表达系统进行了快速验证,为后续开展深入研究打下了良好的基础。如,拟南芥AtHKT1基因[21]、柽柳TheIF1A基因[22]、核桃JrWRKY2基因[12]等。因此,本研究采用酵母表达系统对JrGRAS2基因在热胁迫下的功能进行分析。即,将该基因构建酵母表达载体并转入酵母中,通过与对照酵母在热胁迫下的生长比较分析其抗热能力。结果发现在低于32℃情况下(28~32℃,酵母最适生长温度为30℃)JrGRAS2转基因酵母与对照酵母稀释点点后的生长及OD600均无明显区别;但当温度不低于36℃情况下,JrGRAS2转基因酵母在稀释10 000后能有较好的生长,对照酵母生长克隆较少,特别是在52℃胁迫下,差异更为明显,且JrGRAS2转基因酵母与对照酵母的OD600值差异显著(图4~5),表明JrGRAS2基因在酵母中的表达能改善酵母应对热胁迫的能力。这与TheIF1A、JrWRKY2、AtHKT1等基因在酵母表达系统中改善抗逆能力[13,21~22]的表现一致,说明JrGRAS2基因确实与热胁迫调控有关。这为进一步研究JrGRAS2的抗逆机理奠定了基础。在后续研究中,将对JrGRAS2基因在植物表达系统中的抗逆能力进行分析,以期全面理解JrGRAS2基因的抗逆功能。
1.Wang L,Mai Y X,Zhang Y C,et al.MicroRNA171c-TargetedSCL6-Ⅱ,SCL6-Ⅲ andSCL6-Ⅳ genes regulate shoot branching inArabidopsis[J].Molecular Plant,2010,3(5):794-806.
2.Liu W,Kohlen W,Lillo A,et al.Strigolactone Biosynthesis inMedicagotruncatulaand rice requires the symbiotic GRAS-Type transcription factors NSP1 and NSP2[J].The Plant Cell,2011,23(10):3853-3865.
3.Wu N N,Zhu Y,Song W L,et al.Unusual tandem expansion and positive selection in subgroups of the plant GRAS transcription factor superfamily[J].BMC Plant Biology,2014,14:373.
4.汪莹,孔俊花,陈微微,等.番茄果实成熟相关转录因子的研究进展[J].园艺学报,2014,41(9):1811-1820.
Wang Y,Kong J H,Chen W W,et al.Fruit ripening-related transcription factors in tomato[J].Acta Horticulturae Sinica,2014,41(9):1811-1820.
5.张利娟,梁卫红,刘月霞,等.两种水稻OsRhoGDIs基因启动子的克隆及分析[J].中国农业科学,2008,41(10):2916-2922.
Zhang L J,Liang W H,Liu Y X,et al.Cloning and analysis of the promoters of twoOsRhoGDIsgenes in rice[J].Scientia Agricultura Sinica,2008,41(10):2916-2922.
6.孙欣,王晨,房经贵,等.葡萄GRAS基因家族生物信息学分析[J].江西农业学报,2011,23(7):1-8.
Sun X,Wang C,Fang J G,et al.Bioinformatics analysis ofGRASgene family in grapevine[J].Acta Agriculture Jiangxi,2011,23(7):1-8.
7.Li J H,Yu C Y,Wu H,et al.Knockdown of a JmjC domain-containing geneJMJ524 confers altered gibberellin responses by transcriptional regulation of GRAS protein lacking the DELLA domain genes in tomato[J].Journal of Experimental Botany,2015,66(5):1413-1426.
8.Hessam S,Georges D,Sand M,et al.Comparison of lipidocolloid and chlorhexidine-impregnated tulle gras dressings following microscopically controlled surgery[J].Journal of Wound Care,2015,24(3):135-138.
9.郭华军,焦远年,邸超,等.拟南芥转录因子GRAS家族基因群响应渗透和干旱胁迫的初步探索[J].植物学报,2009,44(3):290-299.
Guo H J,Jiao Y N,Di C,et al.Discovery ofArabidopsisGRASfamily genes in response to osmotic and drought stresses[J].Bulletin of Botany,44(3):290-299.
10.Xu K,Chen S J,Li T F,et al.OsGRAS23,a rice GRAS transcription factor gene,is involved in drought stress response through regulating expression of stress-responsive genes[J].BMC Plant Biology,2015,15:141.
11.Czikkel B E,Maxwell D P.NtGRAS1,a novel stress-induced member of the GRAS family in tobacco,localizes to the nucleus[J].Journal of Plant Physiology,2007,164(9):1220-1230.
12.Yang G,Zhang W,Liu Z,et al.Both JrWRKY2 and JrWRKY7 ofJuglansregiamediate responses to abiotic stresses and abscisic acid through formation of homodimers and interaction[J].Plant biology(Stuttgart,Germany),2017,19(2):268-278.
13.Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J].Methods,2001,25(4):402-408.
14.张甜,王玛丽,赵鹏.基于核基因序列JRD5680的核桃群体遗传多样性和遗传结构研究[J].植物研究,2016,36(2):232-241.
Zhang T,Wang M L,Zhao P.Sequence analysis of nuclear DNAJRD5680 for determining genetic diversity and genetic structure analysis of common walnut(JuglansregiaL.)[J].Bulletin of Botanical Research,2016,36(2):232-241.
15.Dogramaci M,Foley M E,Horvath D P,et al.Glyphosate’s impact on vegetative growth in leafy spurge identifies molecular processes and hormone cross-talk associated with increased branching[J].BMC Genomics,2015,16:395.
16.Busov V,Meilan R,Pearce D W,et al.Transgenic modification ofgaiorrgl1 causes dwarfing and alters gibberellins,root growth,and metabolite profiles in Populus[J].Planta,2006,224(2):288-299.
17.Torres-galea P,Hirtreiter B,Bolle C.Two GRAS proteins,SCARECROW-LIKE21 and PHYTOCHROME A SIGNAL TRANSDUCTION1,function cooperatively in phytochrome A signal transduction[J].Plant Physiology,2013,161(1):291-304.
18.周莲洁,杨中敏,张富春,等.新疆盐穗木GRAS转录因子基因克隆及表达分析[J].西北植物学报,2013,33(6):1091-1097.
Zhou L J,Yang Z M,Zhang F C,et al.Expression analysis and cloning ofGRAStranscription factor gene fromHalostachyscaspica[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(6):1091-1097.
19.石瑞,曹诣斌,陈文荣,等.佛手GRAS基因的克隆及表达分析[J].浙江师范大学学报:自然科学版,2011,34(4):446-451.
Shi R,Cao Y B,Chen W R,et al.On cDNA cloning and expression analysis ofGRASgene in fingered citron[J].Journal of Zhejiang Normal University:Natural Sciences Edition,2011,34(4):446-451.
20.陈裕坤,林玉玲,田奇琳,等.龙眼胚性愈伤组织DlGRAS4与DlGRAS54基因的克隆及表达分析[J].西北植物学报,2014,34(2):215-224.
Chen Y K,Lin Y L,Tian Q L,et al.Cloning and expression analysis ofDlGRAS4 andDlGRAS54 from embryogenic callus ofDimocarpuslonganLour[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34(2):215-224.
21.Mäser P,Hosoo Y,Goshima S,et al.Glycine residues in potassium channel-like selectivity filters determine potassium selectivity in four-loop-per-subunit HKT transporters from plants[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(9):6428-6433.
22.杨桂燕,于丽丽,赵玉琳,等.刚毛柽柳TheIF1A基因转入酵母的抗逆能力分析[J].南京林业大学学报:自然科学版,2014(5):62-66.
Yang G Y,Yu L L,Zhao Y L,et al.Stress tolerance analysis of aTamarixhispidaTheIF1AinSaccharomycescerevisiae[J].Journal of Nanjing Forestry University:Natural Sciences Edition,2014(5):62-66.
Fundamental Research Funds for the Central Universities(2452016057/2452015171);China Postdoctoral Science Foundation Project(2016M590979);The Program of Innovative Entrepreneurship Training Programs for Northwest Agriculture & Forestry University Students(1201610712031)
introduction:SU Li-Yuan(1996—),female,the main research area is forest genetic breeding.
date:2017-05-24
ExpressionandFunctionAnalysisofWalnutJrGRAS2GeneunderHeatStress
SU Li-Yuan1,2LI Xiao-Zhe1CHEN Shu-Wen1,2ZHANG Fang-Fang1,2ZHAO Ting-Ting1,2YANG Gui-Yan1,2*
(1.Walnut and Chestnut Experiment Station of Shanyang,College of Forestry,Northwest A&F University,Yangling 712100;2.Key Laboratory of Economic Plant Resources Development and Utilization in Shaanxi Province,College of Forestry,Northwest A&F University,Yangling 712100)
TheGRAStranscription factor is important for plant response to abiotic stress. To well understand the adaptive mechanism to adverse environment of walnut tree, aGRASgene was cloned from the transcriptome ofJuglansregia(Named asJrGRAS2). The expression ofJrGRAS2 was analyzed under heat stress, andJrGRAS2 was inserted into the yeast expression vector pYES2 for constructing recombinant plasmidpYES2-JrGRAS2, which was transformed into aSaccharomycescerevisiaestrain(INVSCI). The yeast transformed with empty pYES2 was used as a negative control. The yeast expression system was used for analysis the heat stress tolerance. The full length open reading frame(ORF) ofJrGRAS2 was 1 296 bp, the deduced protein was 47 405.83 Da with 431 amino acids, and the theoretical isoelectric point(pI) was 5.66. Under heat stress,JrGRAS2 was highly induced, especially exposed to 36℃ for 0.5 h in the stems, it was induced to 335.5-fold of control. When both recombinant yeasts were treated with 53℃, theJrGRAS2 expressed yeast displayed higher vitality and survival rate than the control yeast. Therefore,JrGRAS2 gene could effectively response to heat stress and improve heat tolerance of transgenic yeasts,JrGRAS2 may be an important candidate gene for walnut response to adverse stimulus.
Juglansregia;heat stress;GRAS transcription factor;expression analysis;yeast expression system
中央高校基本科研业务费(2452016057/2452015171);中国博士后科学基金面上资助项目(2016M590979);西北农林科技大学校重点大学生创新创业训练计划项目(1201610712031)
粟莉圆(1996—),女,本科生,主要从事林木遗传育种研究。
* 通信作者:E-mail:yangguiyan@yahoo.com
2017-05-24
* Corresponding author:E-mail:yangguiyan@yahoo.com
Q943.2
A
10.7525/j.issn.1673-5102.2018.01.015
