刚毛柽柳腺苷甲硫氨酸脱羧酶(ThSAMDC)基因的克隆与胁迫下的表达分析
2018-01-09张春蕊王艳敏王玉成
张 玉 张 悦 张春蕊 王艳敏,2 王玉成 王 超*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.黑龙江省林业科学研究所,哈尔滨 150081)
刚毛柽柳腺苷甲硫氨酸脱羧酶(ThSAMDC)基因的克隆与胁迫下的表达分析
张 玉1张 悦1张春蕊1王艳敏1,2王玉成1王 超1*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;2.黑龙江省林业科学研究所,哈尔滨 150081)
S-腺苷甲硫氨酸脱羧酶(S-adenosyl-L-methionine decarboxylase,SAMDC)是一种通过参与多胺的代谢途径来调节植物生理生化过程的限速酶。通过分析刚毛柽柳(Tamarixhispida)的转录组数据,获得并克隆了SAMDC基因的cDNA序列,将其命名为ThSAMDC。该cDNA序列全长2 085 bp,包含tiny ORF(tORF)、upstream ORF(uORF)和main ORF(mORF)3个植物SAMDC基因特征ORF。主开放读码框(mORF)长1 107 bp,编码369个氨基酸多肽,相对分子质量为40.34 kD,理论等电点(PI)为4.72。ThSAMDC编码蛋白具有多个较强的亲水性区域,无明显跨膜区。通过与其他多个物种的氨基酸多序列比对结果表明,ThSAMDC具有两个典型的高度保守的结构域:酶原剪切位点(LSESSLF)与蛋白快速降解有关的PEST(TIHVTPEDGFSYAS)结构域。系统发育树结果表明ThSAMDC与菠菜(SoSAMDC)氨基酸序列一致性最高,为77%。实时荧光定量RT-PCR分析显示,ThSAMDC在NaCl、PEG、ABA、CdCl2诱导表达均上调,预示着ThSAMDC可能在刚毛柽柳非生物胁迫应答过程中发挥重要作用。
刚毛柽柳;腺苷甲硫氨酸脱羧酶;胁迫响应;基因表达
多胺(polyamines,PAs)是一种广泛存在于生物细胞中的具有生物活性的低分子量脂肪族含氮碱,主要包括腐胺(Putrescine,Put)、亚精胺(Spermidine,Spd)和精胺(Spermine,Spm)[1~2]。多胺参与胚胎发育、细胞分化、形态发生等发育过程[3],并在植物应答生物胁迫和非生物胁迫过程中起着重要作用[4~9]。S-腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxylase,SAMDC)是多胺合成的一个关键酶[10],主要催化S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)脱羧基,形成脱羧S-腺苷甲硫氨酸(decarboxy-lated S-adenosylmethionine,dcSAM),dcSAM为精胺和亚精胺的生物合成提供氨丙基。研究发现,过量表达SAMDC基因,能够调节植物体内多胺积累水平,从而提高植物抗逆能力。Bhavna[11]等将人类SAMDC基因转入烟草,转基因烟草植株体内源亚精胺和腐胺含量明显增高,植物耐盐性和渗透性显著提高。Momtaz[12]等通过基因枪遗传转化法将从酵母中分离的SAMDC基因导入棉花茎尖,SAMDC基因提高了棉花体内精胺含量,同时转基因植株的耐旱性也得到显著增强。Malabika和Ray[13]研究表明,在水稻植株体内过量表达SAMDC基因使多胺含量提高,耐盐性明显增强。可见,SAMDC基因在植物抗逆基因工程育种中具有广阔的应用前景,对其抗逆功能和调控机理的研究具有重要意义。
迄今为止,已经从拟南芥(Arabidopsisthaliana)[14]、大豆(Lycinemax)[15]、苹果(Malussylvestris)[16]、葡萄(Vitisvinifera)[17]等多种植物中分离了编码SAMDC基因,并对其表达活性与植物多胺合成和逆境响应的关系进行了研究,但是SAMDC基因在刚毛柽柳(Tamarixhispida)中的相关研究还未见报道。刚毛柽柳(Tamarixhispida)是一种具有极强抗逆能力和较强生态适应性的盐生木本植物,是研究木本植物抗逆机制和筛选及分离抗逆基因的理想材料[18]。为了深入了解SAMDC基因在柽柳非生物胁迫应答中的功能,本研究克隆获得了一条刚毛柽柳SAMDC基因(ThSAMDC)全长cDNA序列,并用生物信息学对该序列进行了分析,同时利用实时荧光定量RT-PCR技术分析了ThSAMDC在柽柳地上部分和根部分组织中对不同非生物胁迫的响应模式,为该基因的功能鉴定及利用奠定基础。
1 材料与方法
1.1 实验材料及处理方法
将柽柳的种子播种于V泥炭土∶V蛭石=3∶2的混合土壤中,放置于光/暗时间为16 h/8 h、光照强度为400 μmol·m-2·s-1温度(22±2)℃、相对湿度为70%~75%的温室中培养。待柽柳幼苗生长至2个月左右时,取长势一致且生长状态良好的幼苗,分别用0.4 mol·L-1NaCl、20% PEG6000、150 μmol·L-1CdCl2和100 μmol·L-1ABA溶液进行胁迫处理1、2、6、12、24和48 h,每个时间点都以正常水浇灌的幼苗作为对照,分别取刚毛柽柳的地上部组织和根部组织,每个样品取15颗幼苗,每个处理重复3次,将其充分混合后放入液氮速冻,置于-80℃冰箱用于RNA的提取。
1.2 总RNA的提取
采用CTAB法提取对照、0.4 mol·L-1NaCl、20% PEG、100 μmol·L-1ABA和150 μmol·L-1CdCl2处理下各个时间段的刚毛柽柳地上部分和地下组织总的RNA,采用DNaseI(Promega)消除残存的DNA。按照PrimeScriptTMRT reagent Kit(TaKaRa)说明书进行反转录合成cDNA第一条链,将合成的cDNA稀释10倍,用作定量RT-PCR的模板。
1.3 ThSAMDC基因的克隆与序列分析
根据刚毛柽柳转录组数据中Unigenes功能注释结果,查找并获得一条SAMDC基因的序列。为了验证基因序列的准确性,根据基因序列设计引物,上游引物序列为ATGACGGTTGGCCCTACAG,下游引物序列为TCAGTCCTTTTCTTCCTCC。将SAMDC基因克隆到pMD18-T载体上并重新测序。
利用在线工具ORF founder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)确定ThSAMDC的开放读码框;利用Bioedit软件进行多序列比对以及同源蛋白序列的分析;利用ExPASy(http://www.expasy.org/tools/protparam.html)预测ThSAMDC的理论等电点、分子式及蛋白质分子量。利用MEGA6.0软件构建系统进化树以及进行系统发育分析;利用在线工具TMpred(http://www.genome.cbs.dtu.dk/services/TMHMM/)预测ThSAMDC的跨膜区;使用Protscale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)在线软件对ThSAMDC蛋白质的疏水性进行分析。利用在线软件(https://www.predictprotein.org/)预测该基因编码的蛋白质的二级结构。利用CELLO2GO软件(http://cello.life.nctu.edu.tw/cello2go/)预测其亚细胞定位。
1.4 实时定量RT-PCR表达分析
根据ThSAMDC全长cDNA序列设计定量RT-PCR引物,以刚毛柽柳α-tubulin(FJ618518),β-actin(FJ618517)和β-tubulin(FJ618519)3个基因作为内参基因,引物序列见表1。利用MJ Opticon实时定量PCR仪(Bio-Rad,Hercules,CA)分析ThSAMDC基因的表达模式。采用实时荧光定量RT-PCR反应试剂盒为TransStart Top Green qPCR SuperMix(TransGen),反应体系:10 μL 2×TransStart Top Green qPCR SuperMix,10 μmol·L-1的上游引物和下游引物各1 μL,2 μL稀释后的cDNA模板,以无菌水补足体积至20 μL。反应程序为:94℃预变性30 s;94℃变性12 s,58℃退火30 s,72℃延伸45 s,79℃读板1 s,45个循环。每个样品重复3次,用2-ΔΔCt方法进行基因的相对定量分析[19~20]。

表1 实时定量RT-PCR引物序列
2 结果与分析
2.1 ThSAMDC基因全长cDNA的获得及序列分析
通过分析与查找刚毛柽柳转录组数据,获得一条SAMDC基因编码序列,cDNA长度为2 085 bp。为确保基因序列信息的准确性,根据SAMDC全长序列设计引物并进行基因克隆和测序。PCR扩增获得到一条长度约2 000 bp的条带,与预期相符(图1A)。将PCR产物回收,与pMD18-T载体连接并转化大肠杆菌。从转化子中提取质粒DNA进行酶切检测,结果显示,酶切产物出现2条预期条带,外源插入的cDNA片段长度约2 000 bp(图1B)。将质粒送至上海生工进行测序,测序的结果与转录组测序拼接结果完全一致,并将该基因命名为ThSAMDC。ThSAMDC全长2 085 bp,由ORF founder分析确定该基因包含3个植物SAMDC特征ORF(open reading frame,ORF),分别为9 bp的微型ORF(tiny ORF,tORF),162 bp的上游ORF(upstream ORF,uORF)和1 107 bp的主ORF(main ORF,mORF)。微型ORF(tORF)仅编码2个氨基酸,且与上游ORF(uORF)拥有共同碱基A,即uORF起始密码子ATG第一个碱基A为tORF的终止密码子最后一位碱基。

图1 柽柳ThSAMDC基因的克隆 A.柽柳ThSAMDC基因RT-PCR扩增;B.ThSAMD-PMD18-T质粒酶切(SaIⅠ和XbaⅠ)Fig.1 Cloning of ThSAMDC gene from T.hispida A. RT-PCR amplification of ThSAMDC gene; B. ThSAMDC-PMD18-T plasmid digestion(SaIⅠ and XbaⅠ)
ThSAMDCmORF长为1 107 bp,编码369个氨基酸(图2)。mORF编码蛋白质的分子量为40.34 kD,理论等电点(PI)为4.72,推测其分子式为C1795H2775N449O562S22。疏水性分析发现,ThSAMDC编码蛋白质在整个肽链中亲水性氨基酸多于疏水性氨基酸且具有明显的亲水区,虽然C末端有一个较强的疏水区,但整条肽链表现出亲水性(图3)。利用TMpred进行跨膜结构预测,结果表明无跨膜蛋白。利用Predict protein软件对ThSAMDC编码蛋白进行二级结构预测分析发现:蛋白质的二级结构主要由β-折叠和无规则卷曲构成,其中α-螺旋占18.75%,β-折叠占25.54%,无规则卷曲占55.71%(图4)。利用CELLO2GO在线软件预测ThSAMDC基因编码蛋白的亚细胞定位,结果显示ThSAMDC定位于细胞质概率最高,为85.91%,推测其定位于细胞质(表2)。

图2 ThSAMDC的核酸序列及推演的氨基酸序列 粗线表示tORF;细线表示uORF;细线框表示mORFFig.2 Nucleotide and predicted amino acid sequences of ThSAMDC Tiny ORF is showed in thick underline; Up-stream ORF is showed in thin box; Main ORF is showed in thick box

表2 ThSAMDC亚细胞定位

图3 ThSAMDC蛋白质的疏水结构预测Fig.3 Hydrophobicity analysis of ThSAMDC
2.2 ThSAMDC氨基酸比对与进化树分析
将ThSAMDC氨基酸序列与8种植物SAMDC蛋白的氨基酸序列进行多重比对分析,结果表明,ThSAMDC与其他植物的SAMDC蛋白氨基酸序列具有较高的一致性,其中与SoSAMDC(菠菜)序列一致性最高为77%。比对的9种植物SAMDC基因编码蛋白都包含两个SAMDC蛋白特有的保守结构域:酶原剪切位点结构域LSESSLF(在刚毛柽柳中是76~83位)和与蛋白快速降解有关的PEST(TIHITPEDGFSYAS)结构域(在刚毛柽柳中是254~267位)(图5)。在氨基酸比对的基础上,为进一步了解ThSAMDC与其他植物的SAMDC蛋白之间的进化关系,利用MEGA6.0的Neighbor-Joining方法构建系统进化树,结果显示:ThSAMDC与BvSAMDC(甜菜)聚为一组(图6),表明刚毛柽柳SAMDC与甜菜SAMDC的亲缘关系最近。

图4 ThSAMDC蛋白质二级结构预测Fig.4 Secondary structure prediction of ThSAMDC

图5 刚毛柽柳ThSAMDC与其他植物SAMDC同源序列的比较 细线框.酶原剪切位点结构域(LSESSLF);粗线框.蛋白快速降解有关的PEST(TIHVTPEDGFSYAS)结构域 图中从上至下依次代表的是刚毛柽柳、菠菜、棉花、拟南芥、高粱、玉米、大麦、葡萄、大豆、荠菜的SAMDC氨基酸列Fig.5 Comparison of ThSAMDC in Tamarix hispida with other plant SAMDC genes homologous sequences Thin box:enzyme cleavage site domain(LSESSLF); Thick box: rapid degraded Protein PEST(TIHVTPEDGFSYAS) domain The amino acid sequence in the map which from the top to the bottom represent is: Tamarix hispida(U44057),Spinacia olerace(KNA20761.1),Gossypium hirsutum(JN020148.1),Arabidopsis thaliana(NM_113454.3),Sorghum bicolor(XM_002446695.1),Zea(NM_001112243.2),Hordeum vulgare subsp(AK250521.1),Vitis vinifera(AJ567368.2),Glycine max(AF488307.1),Brassica juncea(AF215665.1)
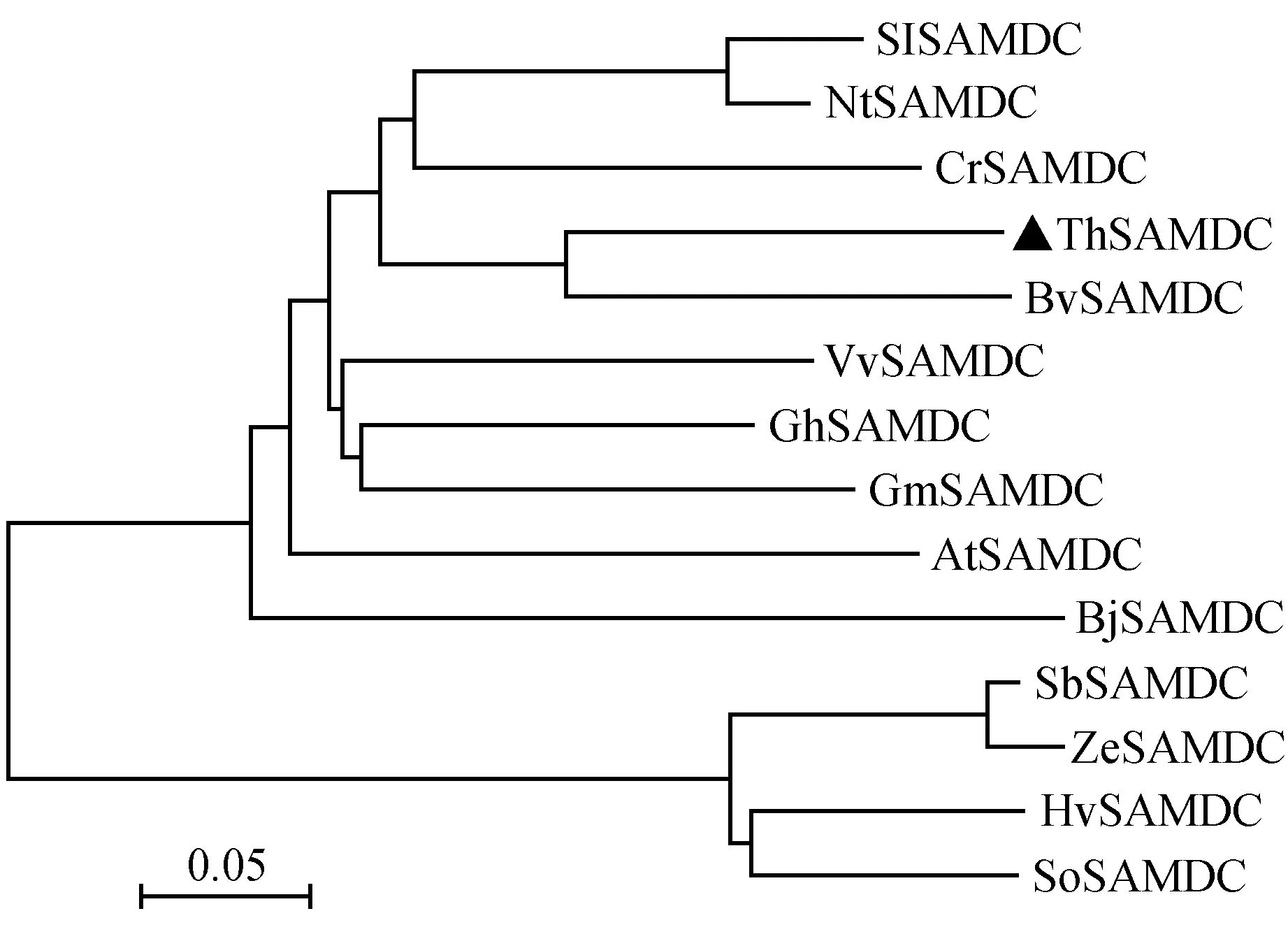
图6 几种植物蛋白同源序列的系统进化树分析 标尺代表每单位氨基酸的变化;0.05代表两个序列之间5%的差异 SlSAMDC.茄子;NtSAMDC.烟草;CrSAMDC.长春花;ThSAMDC.刚毛柽柳;BvSAMDC.甜菜;VvSAMDC.葡萄;GhSAMDC.棉花;GmSAMDC.大豆;AtSAMDC.拟南芥;BjSAMDC.荠菜;SbSAMDC.高粱;ZeSAMDC.玉米;HvSAMDC.大麦;SoSAMDC.甘蔗Fig.6 Phylogenetic tree analysis of SAMDC proteins from various plant species The scale bar expected number of substitutions per site;0.05 means 5% changes were observed between two sequences SlSAMDC.Solanum lycopersicum(EF550528.1); NtSAMDC.Nicotiana tabacum(AF033100.1); CrSAMDC.Catharanthus roseus(U12573.1); BvSAMDC.Beta vulgaris subsp(XP_010681339.2); VvSAMDC.Vitis vinifera(AJ567368.2); GhSAMDC.Gossypium hirsutum(JN020148.1); GmSAMDC.Glycine max(AF488307.1); AtSAMDC.Arabidopsis thaliana(NM_113454.3); BjSAMDC.Brassica juncea(AF215665.1); SbSAMDC.Sorghum bicolor(XM_002446695.1); ZeSAMDC.Zea(NM_001112243.2); HvSAMDC.Hordeum vulgare subsp(AK250521.1); SoSAMDC.Saccharum officinarum(GQ246459.1)

图7 ThSAMDC基因在不同胁迫下的表达模式分析基因相对表达量经过Log2转换,>0代表上调表达;=代表表达无变化;<0代表下调表达。Fig.7 Expression analysis of ThSAMDC gene under different abiotic stresses Relative expression level was Log2 transformed; >0,upregulation; =0,no change in regulation; <0,downregulation.
2.3 ThSAMDC基因在胁迫条件下的表达分析
为深入探究柽柳ThSAMDC基因在逆境胁迫条件下的相对表达量变化,我们利用实时荧光定量PCR方法检测该基因分别在0.4 mol·L-1NaCl、20% PEG和150 μmol·L-1CdCl2胁迫和、100 μmol·L-1外源ABA处理下的表达模式。如图7所示,无论在地上部分还是在根部组织中,ThSAMDC的表达都受到NaCl、PEG、CdCl2和外源ABA的诱导,但在不同处理下的表达模式有所差异。
在NaCl处理条件下,ThSAMDC基因在柽柳地上和根部组织中的相对表达量显著上升,且在胁迫24 h后达到峰值,分别是对照条件下的8.15和5.11倍。
在PEG处理条件下,ThSAMDC基因在柽柳地上和根部组织中都受到诱导表达。其中在根部组织中,ThSAMDC的相对表达量具有双峰型特征,分别在胁迫1和48 h其相对表达量达到峰值。ThSAMDC基因在地上部组织中与在根部组织中的表达具有相似性,在胁迫1 h后表达量达到最高水平,之后逐渐下降,在12 h后又有所回升。此外,与地上部分相比,ThSAMDC表达在根部组织中受诱导程度更高。
在外源ABA处理条件下,ThSAMDC的表达在柽柳地上部分和根部组织中也受到不同程度的诱导。其中在地上部组织中,ThSAMDC相对表达量同样具有双峰特征,在ABA处理1 h后和48 h达到峰值。ThSAMDC的表达在根部组织中也受到了ABA的诱导,与地上部分相比,在各时间点表达变化较平稳,表达量在对照的2~5倍。
在CdCl2的胁迫下,ThSAMDC的表达也受到强烈诱导。在地上部组织中,ThSAMDC的相对表达量在胁迫1 h时达到峰值,胁迫24 h后,相对表达量缓慢上升,之后降低。ThSAMDC在根部组织中的相对表达量变化较不稳定,胁迫后其相对表达量逐渐上升,而在胁迫2 h后下降,在12 h降到低谷,随后其相对表达量急剧上升,并在48 h达到峰值。
上述实验结果表明,ThSAMDC基因的表达可受NaCl、PEG、ABA和CdCl2等外界非生物胁迫条件的诱导,推测该基因可能参与植物非生物逆境胁迫的响应过程。同时,我们也发现,在不同组织中ThSAMDC的表达受胁迫诱导程度存在差异。NaCl胁迫下,ThSAMDC表达在地上部分受诱导程度略高于根部组织,而在PEG胁迫下,在根部组织中受诱导程度明显高于地上部组织;CdCl2胁迫下,ThSAMDC在根组织中受诱导程度略高,而在ABA处理下则表现为在地上部组织中受诱导程度更高。在胁迫条件下,ThSAMDC的表达具有一定的组织特异性,表明在柽柳响应非生物胁迫过程中,ThSAMDC在不同组织中存在不同的表达调控机制。
3 讨论
S-腺苷甲硫氨酸脱羧酶(SAMDC)在植物多胺的生物合成过程中具有重要的作用。目前,已在多种植物中发现并分离了编码S-腺苷甲硫氨酸脱羧酶的基因,并发现不同植物中SAMDC具有很高的序列相似性[21]。植物SAMDC基因在主要开放阅读框(main-ORF)内没有内含子,而5′-UTR中还含有2个ORF,分别是tORF和uORF,并且这2个ORF有1个碱基的重叠,这种重叠结构对于基因表达的影响目前尚不清楚。大多数植物的SAMDC基因uORF编码49~54个氨基酸残基,氨基酸序列十分保守,同源性在75%~100%[22]。植物中SAMDC上游uORF在转录或转录后水平调控基因表达中起关键作用[23]。去除SAMDC基因上游uORF将导致植物中该酶的翻译效率提高,破坏体内多胺含量的动态平衡,影响植物的生长发育[24]。本研究克隆的ThSAMDC全长2 085 bp,mORF长为1 107 bp,编码369个氨基酸。5′-UTR长162 bp,与其它植物SAMDC基因一样,5′-UTR内具有tORF和uORF,且tORF和uORF有一个碱基重叠,uORF编码54个氨基酸,可能参与ThSAMDC转录和转录后调控,对维持柽柳体内多胺的动态平衡具有重要的功能。
多胺不仅是植物体内的一种生长调节物质,同时作为一种渗透调节物质在植物抵御逆境胁迫中发挥作用[4,25]。作为多胺合成途径中的关键基因,SAMDC基因通过调控多胺含量来调节植物的抗逆性。SAMDC基因在水稻幼苗中的表达受盐、干旱和ABA的诱导[26];转入SAMDC基因使水稻体内亚精胺、精胺含量提高3~4倍,促进了幼苗在盐胁迫下的生长[27];过表达康乃馨SAMDC基因的转基因烟草体内多胺含量增加,抗氧化酶类基因转录水平提高,进而增强了转基因植株抵御盐、冷和ABA等非生物胁迫的能力[28]。这些研究已证实在植物中过量表达SAMDC基因可提高转基因植物的抗旱耐盐能力,表明该基因在植物的抗逆基因工程育种方面具有重要价值。为了研究SAMDC基因在柽柳非生物胁迫应答中的功能,本研究利用定量PCR技术分析了刚毛柽柳在NaCl、PEG、CdCl2和外源ABA处理下ThSAMDC的表达情况,结果显示,ThSAMDC基因的表达受NaCl、PEG和CdCl2的诱导,推测ThSAMDC基因在柽柳抵御高盐、干旱和重金属胁迫中发挥重要作用。同时,ThSAMDC表达还受到外源ABA的诱导,表明ThSAMDC依赖于ABA信号途径参与和调节柽柳的非生物胁迫应答。尽管ThSAMDC的表达能够受到高盐、干旱和重金属胁迫的诱导,但其在不同胁迫下的表达模式存在明显差异,这表明ThSAMDC对不同非生物胁迫的响应机制并不相同,其具体的生物学功能和作用机制需要进一步的研究。
1.Groppa M D,Benavides M P.Polamines and abiotic stress:Recent advances[J].Amino Acids,2008,34(1):35-45.
2.Kusano T,Berberich T,Tateda C,et al.Polyamines:essential factors for growth and survival[J].Planta,2008,228(3):367-381.
3.Fos M,Proao K,Alabadí D,et al.Polyamine metabolism is altered in unpollinated parthenocarpicpat-2 tomato ovaries[J].Plant Physiology,2003,131(1):359-366.
4.Boucherou A,Aziz A,Larher F,et al.Polyamines and environmental challenges:recent development[J].Plant Science,1999,140(2):103-125.
5.Shen W Y,Nada K,Tachibana S.Involvement of polyamines in the chilling tolerance of cucumber cultivars[J].Plant Physiology,2000,124(1):431-440.
6.Witzell J,Kuusela T,Sarjala T.Polyamine profiles of healthy and parasite-infectedVacciniummyrtillusplants under nitrogen enrichment[J].Journal of Chemical Ecology,2005,31(3):561-575.
7.Sharma S S,Dietz K J.The significance of amino acids and amino acid-derived molecules in plant responses and adaptation to heavy metal stress[J].Journal of Experimental Botany,2006,57(4):711-726.
8.汪沛洪.植物多胺代谢的酶类与胁迫反应[J].植物生理学通讯,1990(1):1-7.
Wang P H.Enzymes of polyamine metabolism and stress response in plants[J].Plant Physiology Communications,1990(1):1-7.
9.Kasukabe Y,He L,Nada K,et al.Overexpression of spermidine synthase enhances tolerance to multiple environmental stresses and up-regulates the expression of various stress-regulated genes in transgenicArabidopsisthaliana[J].Plant & Cell Physiology,45(6):712-722.
10.Galston A W,Sawhney R K.Polyamines in plant physiology[J].Plant Physiology,1990,94(2):406-410.
11.Bhavna W,Manchikatla V R.Effect of increased polyamine biosynthesis on stress responses in transgenic tobacco by introduction of human S-adenosylmethionine gene [J].Plant Sci,2003,164(5):727-734.
12.Momtaz O A,Hussein E M,Fahmy E M,et al.Expression of S-adenosyl methionine decarboxylase gene for polyamine accumulation in Egyptian cotton Giza 88 and Giza 90[J].GM Crops,2010,1(4):257-266.
13.Malabika R,Ray W.Overexpression of S-adenosylmethionine decarboxylase gene in rice increases polyamine level and enhances sodium chloride-stress tolerance [J].Plant Science,2002,163(5):987-992.
14.Kusano T,Yamaguchi K,Berberich T,et al.The polyamine spermine rescuesArabidopsisfrom salinity and drought stresses[J].Plant Signaling & Behavior,2007,2(4):251-252.
15.Bolle C,Hermann R G,Oelmüller R.A spinach cDNA with homology to S adenosylmethionine decarboxylase[J].Plant Physiology,1995,107(4):1461-1462.
16.Hao Y J,Zhang Z,Kitashiba H,et al.Molecular cloning and functional characterization of two apple S-adenosylmethionine decarboxylase genes and their different expression in fruit development,cell growth andstress responses[J].Gene,2005,350(1):41-50.
17.Tassoni A,Franceschetti M,Tasco G,et al.Cloning,functional identification and structural modelling ofVitisviniferaS-adenosylmethionine decarboxylase[J].Journal of Plant Physiology,2007,164(9):1208-1219.
18.刘桂丰,侯英杰,王玉成,等.干旱胁迫下刚毛柽柳消减文库的构建及分析[J].植物研究,2005,25(1):69-73.
Liu G F,Hou Y J,Wang Y C,et al.Construction and analysis ofTamarixhispidasuppression subtractive hybridization library under drought stress[J].Bulletin of Botanical Research,2005,25(1):69-73.
19.Vandesompele J,De Preter K,Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3(7):RESEARCH0034.
20.Livak K J,Schmittgen T D,Livak K J,et al.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
21.张佳景,丁淑丽,邹宜静,等.植物腺苷甲硫氨酸脱羧酶研究进展[J].细胞生物学杂志,2008,30(5):622-628.
Zhang J J,Ding S L,Zou Y J,et al.Research advance on s-adenosylmethionine decarboxylase in plants[J].Chinese Journal of Cell Biology,2008,30(5):622-628.
22.Franceschetti M,Hanfrey C,Scaramagli S,et al.Characterization of monocot and diont plant S-adenesyl-l-methionine decarboxylase gene families including identification in the mRNA of a highly conserved pair of upstream overlapping open reading frames[J].Biochemical Journal,2001,353(2):403-409.
23.Hu W W,Gong H B,Pua E C.Molecular cloning and characterization of S-adenosyl-methionine decarboxylase genes from mustard(Brassicajuncea)[J].Physiologia Plantarum,2005,124(1):25-40.
24.Hanfrey C,Franceschetti M,Mayer M J,et al.Abrogation of upstream open reading frame-mediated translational control of a plant S-adenosylmethionine decarboxylase results in polyamine disruption and growth perturbations[J].Journal of Biological Chemistry,2002,277(46):44131-44139.
25.刘建新,胡浩斌,王鑫.外源NO对盐胁迫下黑麦草幼苗活性氧代谢、多胺含量和光合作用的影响[J].植物研究,2009,29(3):313-319.
Liu J X,Hu H B,Wang X.Effects of exogenous nitric oxide on active oxygen metabolism,polyamine content and photosynthesis of ryegrass(LoliumperenneL.) seedlings under salt stress[J].Bulletin of Botanical Research,2009,29(3):313-319.
26.Li Z Y,Chen S Y.Differential accumulation of the S-adenosylmethionine decarboxylase transcript in rice seedlings in response to salt and drought stresses[J].Theoretical and Applied Genetics,2000,100(5):782-788.
27.Roy M,Wu R.Overexpression of S-adenosylmethionine decarboxylase gene in rice increases polyamine level and enhances sodium chloride-stress tolerance[J].Plant Science,2002,163(5):987-992.
28.Wi S J,Kim W T,Papk K Y.Overexpression of carnation S-adenosylmethionine decarboxylase gene generates a broadspectrum tolerance to abiotic stresses in transgenic tobacco plants[J].Plant Cell Reports,2006,25(10):1111-1121.
National Natural Science Foundation of Heilongjiang Province(QC2016019);Fundamental Research Funds for the Central Universities(2572014CA12)
introduction:ZHANG Yu(1991—),female,Mainly engaged in forestry research of stress resistance.
date:2017-07-04
CloningandExpressionAnalysisofS-AdenosineMethionineDecarboxylase(ThSAMDC)GenefromTamarixramosissima
ZHANG Yu1ZHANG Yue1ZHANG Chun-Rui1WANG Yan-Min1,2WANG Yu-Cheng1WANG Chao1*
(1.State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040;2.Forestry Science Reseach Institute of Heilongjiang Province,Harbin 150081)
S-adenosyl-L-methionine decarboxylase(SAMDC) is a rate-limiting enzyme that regulates the physiological and biochemical processes of plants by participating in the metabolic pathway of polyamines. The cDNA of S-Adenosine Methionine Decarboxylase gene(namedThSAMDC) was isolated and cloned by analyzing the transcriptome data ofTamarixhispida. The full-length ofThSAMDCis 2 085 bp, with three open reading frames, tiny ORF(tORF), upstream ORF(uORF) and main ORF(mORF). The mORF was 1 107 bp encoding 369 amino acids. The relative molecular weight and isoelectric points(PI) of the putative protein were 40.34 kD and 4.72.ThSAMDC-encoded protein has a number of strong hydrophilic regions, no obvious transmembrane region. Compared to the amino acid multiple sequence alignment of several other species, ThSAMDC includes two highly conserved domains: the proenzyme cleavage site(LSESSLF) and the PEST domain(TIHVTPEDGFSYAS) associated with the rapid degradation of the protein. Phylogenetic tree analysis shows thatThSAMDChas higher sequence similarity of 77% identities to theSpinach(SoSAMDC). Quantitative real-time PCR assay revealed that the mRNA level ofThSAMDCwas significantly up-regulated under NaCl, PEG, ABA and CdCl2treatments inT.hispida, suggesting thatThSAMDCmay play an important role in drought resistance, salt tolerance and other stresses.
Tamarixhispida;S-adenosylmethionine decarboxylase;stress responses;gene expression
黑龙江省科学基金项目(QC2016019);中央高校基本科研业务费专项资金项目(2572014CA12)
张玉(1991—),女,硕士研究生,主要从事林木抗逆机理方面研究。
* 通信作者:E-mail:wzyrgm@163.com
2017-07-04
* Corresponding author:E-mail:wzyrgm@163.com
S793.5
A
10.7525/j.issn.1673-5102.2018.01.016
投稿须知
1.投稿前请登陆本刊网站(http://bbr.nefu.edu.cn/)认真阅读本刊投稿中心中的各项说明,并按照本刊要求修改和补充论文中的有关内容,使论文符合本刊要求。投稿时请附作者单位介绍信或全体作者签名,说明无泄密、署名无误和未一稿多投,网上投稿请签订版权转让协议。作者自留底稿及软盘备份。
2.投稿时,请登陆本刊网站在线提交论文。投稿后,可随时登陆查询稿件处理状况。
3.稿件如初审通过,请作者按要求邮寄已签名的《版权转让协议》。
4.稿件经过外审和编审后,如符合我刊要求,须交寄发表费,待发表费收到后,作者可登陆本刊网站后,在发稿状态下打印《稿件录用通知》。
5.作者文责自负。本编辑部对来稿可做必要修改。
6.稿件一经发表,酌致稿酬,并赠样刊2本。
7.凡在本刊发表的论文,如荣获省部级以上成果奖,请及时通知本编辑部,并提供获奖证书复印件。
《植物研究》编辑部
