不同加热条件下牛肉嫩度和保水性的变化及机理
2018-01-08孙红霞丁振江张春江
孙红霞,黄 峰,2,丁振江,张春江,2,张 良,2,张 泓,2,*
(1.中国农业科学院农产品加工研究所,北京 100193;2.中国农业科学院农产品加工研究所主食加工技术研究院,黑龙江 哈尔滨 151900)
不同加热条件下牛肉嫩度和保水性的变化及机理
孙红霞1,黄 峰1,2,丁振江1,张春江1,2,张 良1,2,张 泓1,2,*
(1.中国农业科学院农产品加工研究所,北京 100193;2.中国农业科学院农产品加工研究所主食加工技术研究院,黑龙江 哈尔滨 151900)
为探究不同加热条件下牛肉嫩度及保水性的变化机理,测定了牛肉在不同加热温度和时间条件下的蒸煮损失率、剪切力、肌原纤维小片化指数和肌节长度,并进行了差示扫描量热和低场核磁共振测定。结果表明,随加热温度的升高,蒸煮损失率显著增大(P<0.05);剪切力整体趋于上升,但在45~55 ℃和75 ℃以上温度时均出现下降趋势,肌原纤维小片化指数在55~65 ℃显著增加(P<0.05),可能由肌动球蛋白解离造成,这也是55 ℃时剪切力下降的主要原因;差示扫描量热测定中变性焓值和低场核磁共振T2弛豫谱测定中的T21与A21逐渐降低,肌节长度呈缩短趋势,这与蒸煮损失率的变化一致。这些结果表明55~65 ℃是牛肉加热过程中的一个关键控制温度范围,可以为进一步形成牛肉类菜肴低温加热技术提供理论依据。
牛肉;蒸煮;水分;蛋白质;嫩度
嫩度是评价肉制品食用品质的一个最重要指标[1-3]。加热温度和时间对肉嫩度的影响最为显著,目前关于加热温度对肉嫩度的影响在兔肉、牛肉、猪肉等不同品种上都有相关报道,其总体变化趋势一致,随着加热温度的上升,剪切力值主要在两个阶段发生明显变化:原料肉在加热温度为50~65 ℃时剪切力值出现明显下降,继续加热,在65~80 ℃阶段的剪切力上升最为显著,大于80 ℃后剪切力基本保持稳定[4-6]。肉热加工过程中嫩度的变化主要归因于肉中肌原纤维蛋白和胶原蛋白的热变性。胶原蛋白由原胶原分子间共价键交联聚合而成,原胶原分子是一种高度紧锁的右手螺旋构象的纤维状蛋白,由3 条具有左手螺旋构象的肽链依靠链间氢键绞合在一起形成。胶原蛋白受热时会收缩并降解,吸水膨胀。热处理会给肌肉中不同肌原纤维蛋白带来结构性的变化,α-肌动蛋白最易变性,50 ℃条件下变为不可溶状态,肌球蛋白变性温度为55 ℃,肌动蛋白为70~80 ℃,原肌球蛋白和肌钙蛋白的变性温度为80 ℃以上,这些肌原纤维蛋白热变性影响着肉的嫩度变化[7-10]。对热加工过程中肉剪切力两个阶段的上升早期主要有2 种不同的解释:一种理论认为第一个阶段(50 ℃之前)剪切力的上升主要是由于肌肉结缔组织的变性和热收缩,第二个阶段(65~80 ℃)的上升主要归因于肉中肌原纤维蛋白的变性[11];另一种理论认为第一个阶段的上升主要是由于肌原纤维蛋白的变化,第二个阶段是因为结缔组织的变性[12]。这种差异可能是因为肉的种类和部位的不同而造成,因此全面探究加热温度和时间对特定肉品嫩度的研究仍是必要的。
炖煮是我国一种最为传统的肉制品加工热处理方式,不仅可以杀灭微生物,保证肉品安全,也是熟化和改善肉制品品质的重要手段。我国许多传统肉类菜肴,如红烧肉、土豆烧牛肉等数千个品种都是通过炖煮方式完成的,其成品香味浓郁、口感酥烂。在中式炖煮肉类菜肴制作过程中,加热时间不定,一般需要30 min到2 h,且加热温度不明确。对于牛肉炖煮类菜肴来说,目前对于适宜加热的牛肉部位——牛上脑的研究鲜见报道。故本研究选取了适宜加热的牛上脑部位,加热温度从低于蛋白初始变性温度至沸腾温度,即45~95 ℃,加热120 min以内来探究牛肉嫩度在不同的加热温度和时间条件下的变化,揭示牛肉加热过程中嫩度的变化机理,为牛肉加热类菜肴的工业化生产提供科学理论基础。
1 材料与方法
1.1 材料与试剂
实验材料:3 块牛上脑(7.5 kg左右)取自3 头4 ℃条件下成熟24 h的西门塔尔杂交公牛(年龄为2.5 岁左右,体质量为(450±50) kg),来自于北京卓宸畜牧有限公司。每块肉样均用于不同加热条件处理,每组10~15 块,共3 次重复。
氯化钾、磷酸氢二钾、磷酸二氢钾、乙二醇四乙酸(ethylene glycol tetraacetic acid,EGTA)、氯化镁等(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
HH-系列恒温水浴锅 金坛市科析仪器有限公司;TA-XT2i质构分析仪 英国Stable Micro Systems公司;SpectraMax 340PC 384酶标仪 美国MBD公司;3K15R高速冷冻离心机 上海力申科学仪器公司;S25N均质机 德国IKA集团;Q-200差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA公司;NMI20-030H-I型核磁共振分析与成像系统 上海纽迈电子科技有限公司;H-7500透射电子显微镜(transmission electron microscope,TEM) 日本日立公司。
1.3 方法
1.3.1 牛肉样品的制备
牛肉切成约3 cm3的方块后放入高于预期温度2 ℃的恒温水浴锅内,并将探针温度计插入肉块中心部位,待肉块中心温度达到设定温度后,调整水浴锅温度为设定温度并开始计时,分别在45、55、65、75、85、95 ℃条件下加热30、60、90、120 min,加热后的肉块在冰水中浸泡10 min以停止热反应,-35 ℃冰箱保存肉样[13]。
1.3.2 蒸煮损失率的测定
在加热之前将肉块准确称质量(精确到0.01 g),到达预期加热时间后取出肉块,用厨房纸轻吸表面水分后准确称质量。按照式(1)计算蒸煮损失率。

1.3.3 剪切力的测定
采用Warner-Bratzler法测定牛肉块的剪切力。将牛肉块顺着肌纤维方向切成1 cm×1 cm×2 cm的小块,用质构仪测定,每组至少5 个平行。测定条件:探头型号为HDP/BSW探头,测定前速率为2.0 mm/s,测定中速率为1.0 mm/s,测定后速率为2.0 mm/s,测定距离为33 mm,初始激发力为10 g。
1.3.4 肌原纤维小片化指数测定
参考魏秀丽等[14]的方法。分别称取1 g剁碎后的肉样,加入15 mL预冷(4 ℃)的肌原纤维小片化指数(myofibrillar fragmentation index,MFI)缓冲液(100 mmol/L KCl、11.2 mmol/L K2HPO4、8.8 mmol/L KH2PO4、1 mmol/L EGTA、1 mmol/L MgCl2),冰浴匀浆(12 000 r/min,40 s,每次10 s,中间间隔10 s),匀浆后离心(1 000×g、15 min、2 ℃)并弃掉上清液,再次加入15 mL预冷的MFI缓冲液将沉淀充分悬浮,再离心(1 000×g、15 min、2 ℃)并弃掉上清液;沉淀用2.5 mL预冷的MFI缓冲液充分悬浮后,用滤布过滤去除结缔组织,再用2.5 mL预冷的MFI缓冲液冲洗离心管并过滤,合并滤液得肌原纤维蛋白悬浮液。采用聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)法测定蛋白质质量浓度,调整蛋白质质量浓度至0.5 mg/mL后,在562 nm波长处用酶标仪测定吸光度,将所得结果乘以200即可得到MFI值。
1.3.5 DSC测定
称取10~12 mg的肉样于热分析铝坩埚中并加盖密封,20 ℃条件下平衡2 min后以2 ℃/min升温至100 ℃,由此获得肉样在不同加热条件下的DSC热相图。
1.3.6 弛豫时间测定
弛豫时间T2测定采用低场核磁共振T2弛豫谱检测,采用Carr-Purcell-Meiboom-Gill脉冲序列,其参数设置如下:采样点数为20 050,共振频率为21 MHz,采样频率为200 kHz,采样间隔时间为3 000 ms,回波个数为10 000,回波时间为0.1 s,90°脉冲宽度为7 μs,180°脉冲宽度为14 μs,累积次数为32。
1.3.7 肌节长度的测定
用TEM来观察肌纤维的超微结构。将肉样切成1.5 mm×1.5 mm×3 mm的小条并于体积分数为2.5%戊二醛溶液中固定24 h,然后用pH 7.2的磷酸缓冲液进行冲洗,经乙醇梯度脱水后,再利用无水丙酮进行置换。用Epon812树脂浸透包埋,用超薄切片机切片,薄片用醋酸双氧铀和柠檬酸铅进行染色,最后用TEM进行观察并照相。所得到的图片用Image-Pro Plus 6.0软件对肌节长度进行测量。
1.4 数据统计分析
用SAS 9.2软件对所得数据进行方差分析,并用Duncan法进行多重比较,显著性水平为0.05,如无特殊说明实验最少3 次重复,数据以±s表示。
2 结果与分析
2.1 不同加热条件对蒸煮损失率的影响
肉制品的蒸煮损失率与多汁性呈负相关,而多汁性是评价肉制品食用品质的重要指标之一。蒸煮损失率主要是由水分的流失造成,影响多汁性的根本原因是水分的直接损失和水分存在形式的改变,故一般而言,蒸煮损失率越小,其水分流失越少,成品的多汁性也相对较好,另外流失的汁液中包含部分可溶性蛋白,故营养损失也较少,同时其出品率也相应较高[15]。
由图1可知,在相同加热温度下,随加热时间的延长,肉样蒸煮损失率总体呈逐渐增大的趋势。45~75 ℃时,随着加热时间的延长,蒸煮损失率呈显著增大趋势(P<0.05),但85~95 ℃期间,蒸煮损失率随加热时间的延长基本无显著变化(P>0.05),这说明在较低温度时,即不大于75 ℃时,加热时间对肉样蒸煮损失率有显著影响(P<0.05),随加热时间的延长,蒸煮损失率显著增加(P<0.05)。
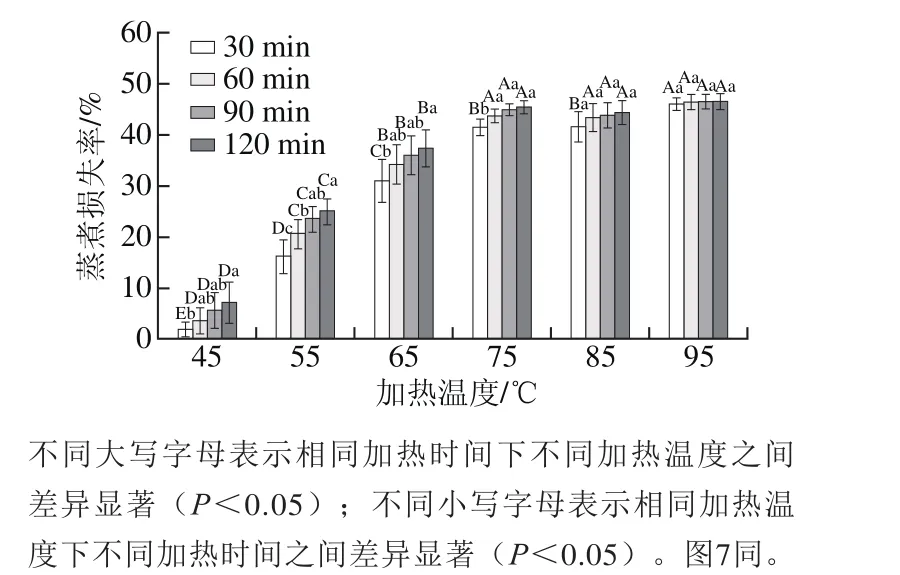
图1 加热温度和时间对蒸煮损失率的影响Fig. 1 Effect of heating temperature and time on cooking loss percentage
在相同加热时间下,随着加热温度的升高,肉样蒸煮损失率呈逐渐增大的趋势。在75 ℃之前,随加热温度的升高,蒸煮损失率呈显著增大趋势(P<0.05);在75 ℃之后,除在加热时间为30 min时存在显著差异(P<0.05),其余加热时间下,75、85 ℃和95 ℃的蒸煮损失率不存在显著性差异(P>0.05),这表明在75 ℃之后,肉样中结合力较弱的水分基本完全排出,肌原纤维蛋白基本完全变性,这与李超[8]的研究结果一致。
2.2 不同加热条件对剪切力的影响

图2 加热温度和时间对剪切力的影响Fig. 2 Effect of heating temperature and time on shear force
由图2可知,在相同加热温度下,加热30 min以后,随加热时间的延长,肉样的剪切力无显著变化趋势(P>0.05),可能加热时间对剪切力的影响主要集中在加热前期,与Combes等[4]的研究结果一致。在相同加热时间下,随着加热温度的升高,肉样剪切力总体呈先减小再增大最后再减小的趋势,在45~55 ℃和85~95 ℃时剪切力有下降趋势,其中在55 ℃时达到最低。有研究表明,剪切力的上升主要是由肌肉结缔组织和肌原纤维蛋白的变性和热收缩造成的[16]。对于55 ℃左右剪切力的下降,目前的研究结果发现可能与肌动球蛋白的解离有关[17-18];85~95 ℃左右剪切力的下降则可能是因为胶原蛋白的溶解性增加造成的,随着温度的升高,肌束膜的胶原纤维发生热变性而导致肌束膜和肌内膜的完整性开始被破坏,肌原纤维结构变得模糊,肌节长度缩短,接着肌束膜内出现颗粒化,最后颗粒化非常明显,这时肌肉会被逐步降解,肌纤维结构受到破坏。Palka[19]在研究肌间胶原蛋白时发现,肌间结缔组织在60 ℃时开始逐渐变成溶解状态,70 ℃时可溶性胶原蛋白含量约为之前的2 倍,80 ℃时开始形成凝胶,与本研究结果一致。
2.3 不同加热条件对MFI的影响
MFI是反映肌原纤维及其骨架蛋白完整程度的指标,MFI越大,表明肌原纤维内部结构完整性受到的破坏程度越大[20-21]。已有研究表明,MFI和肉品嫩度存在显著相关性;Geensink等[20]研究表明MFI与剪切力存在一定相关性,MFI越大剪切力越小。
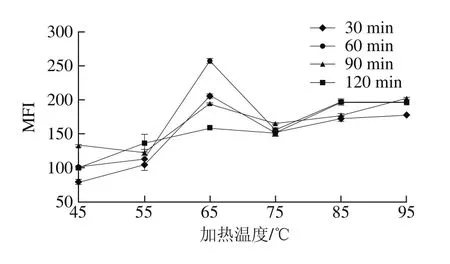
图3 加热温度和时间对MFI的影响Fig. 3 Effect of heating temperature and time on MFI
由图3可知,在相同加热温度下,随加热时间的延长,肉样的MFI总体呈逐渐增大的趋势,但在65 ℃时存在下降现象,75 ℃之后其上升趋势较缓慢,表明75 ℃之前氢键等断裂,导致蛋白质发生变性,而75 ℃之后,蛋白质几乎完全变性而趋于稳定,而65 ℃的反常现象则推测可能是肌动球蛋白在65 ℃条件下加热60 min已经发生解离,继续加热时肌动球蛋白解离程度开始降低或者肌动蛋白开始变性,导致其MFI降低。在相同加热时间下,随着加热温度的升高,肉样的MFI总体呈显著增大的趋势(P<0.05),但在65 ℃左右存在特殊现象,此时的MFI总体上显著高于其他温度下的MFI(P<0.05),特别是加热时间较短时,与前面结果一致,推测与肌动球蛋白在低温下的解离有关。
2.4 不同加热条件对蛋白质变性温度和变性焓值的影响
DSC热相图中,向上的峰为吸热峰,向下的峰为放热峰,峰面积为焓变,可以反映蛋白质的变性程度,当吸热峰和放热峰峰面积消失,说明已经完全变性[21]。从图4中可以看出,随着肉样加热温度的升高,峰的个数减少,峰面积也逐渐减小,最终消失。当肉样加热温度为45 ℃和55 ℃时有2 个峰;当加热温度为65 ℃时,第1个峰消失;当加热温度为75 ℃时,第2个峰也消失,且没有峰出现。表明温度越高,蛋白质变性程度越大,75 ℃以后,肉样中的蛋白质基本完全变性。

图4 不同温度下肉样的DSC热相图Fig. 4 DSC thermogram of beef samples at different temperatures

表1 不同加热条件下肉样的DSC变性温度和变性焓值Table 1 DSC thermal denaturation temperature and denaturation enthalpy of beef samples under different heating conditions
研究表明,肉中肌球蛋白、胶原蛋白和肌动蛋白的变性温度分别为50~60、60~70、70~80 ℃[22-23]。由表1可知,45 ℃和55 ℃处理时均有2 个峰,但是45 ℃和55 ℃处理的变性温度有区别:45 ℃处理的初始温度在56~57 ℃,峰值集中在61 ℃左右,半峰宽为5~7 ℃;而55 ℃处理初始温度在60~61 ℃,峰值集中在65 ℃左右,半峰宽为3~4 ℃,45 ℃处理的峰明显宽于55 ℃处理的峰,这表明45 ℃处理的峰包括了55 ℃处理出现的峰,但因两个峰的变性温度相近而融合在一起,由此可判断出,在45 ℃处理出现的峰1中有2 种蛋白质发生了变性,第1种蛋白质的变性温度在56~60 ℃之间,即肌球蛋白的变性温度。55 ℃处理时出现的峰1即为45 ℃出现的峰1中的第2种变性蛋白质,即胶原蛋白,完全变性温度在65 ℃左右。45、55 ℃和65 ℃均出现的峰2的初始温度在70~73 ℃,峰值集中在75 ℃左右,半峰宽为3~4℃。
由表1可知,在相同温度下,随着加热时间的延长,峰1和峰2的变性焓值均显著降低(P<0.05);在相同加热时间内,随着加热温度的升高,峰1和峰2的变性焓值也显著降低(P<0.05),但是随着加热时间的延长,显著性越来越不明显(P>0.05),表明升高加热温度和延长加热时间均可以促进蛋白质的变性程度,与Christensen等[13]的研究结果一致。
2.5 不同加热条件对弛豫时间的影响

图5 不同温度下肉样的弛豫时间Fig. 5 Relaxation time distribution curves for beef samples at different temperatures
通过迭代寻优的方法,将T2衰减曲线代入弛豫模型中进行拟合并反演,得到不同加热温度下肉样的弛豫时间图谱(图5),横坐标为弛豫时间,纵坐标为各弛豫时间对应的信号幅度,积分面积A为样品在该弛豫时间段的信号量。弛豫时间反映了样品内部氢质子所处的化学环境,与氢质子所受的束缚力及其自由度有关。弛豫时间越短,在图谱上峰位置越靠左,表明氢质子受束缚越大或自由度越小,反之则弛豫时间越长,在图谱上峰位置越靠右,氢质子受束缚越小或自由度越大。一般将弛豫时间区间划分为3 个区域:T2b(<10 ms)为结合水,T21(10~100 ms)为不易流动水和T22(>100 ms)为自由水,即随着弛豫时间的增加,水分变得更自由[24-25]。有研究表明,T21与加热过程中的蛋白变化紧密相关,不易流动水主要存在于肌原纤维间隙中,含量高达87%[26],加热过程中肌原纤维蛋白发生变性、收缩,不易流动水被挤出,导致肉制品多汁性降低,对肉品嫩度也有一定影响。由图5可看出,3 个区域中,T21的峰值和峰面积变化最大,随加热温度的升高,T21左移,弛豫时间降低,信号幅度降低,A21减小。
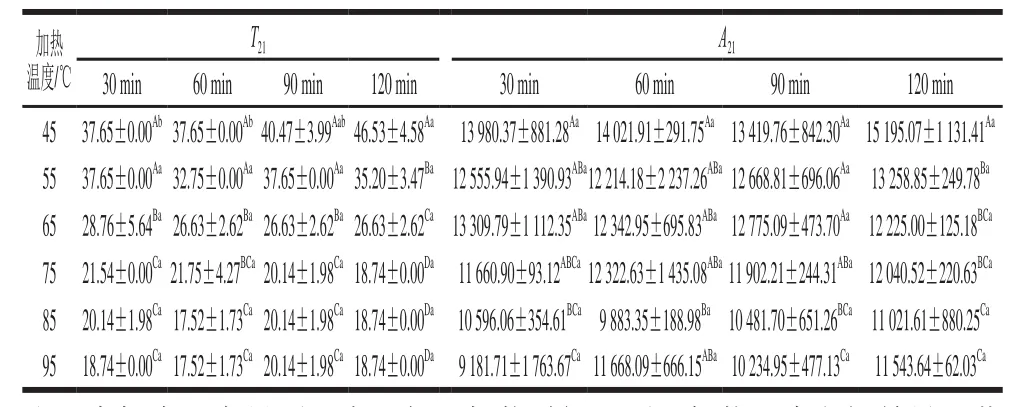
表2 不同加热条件下肉样的弛豫时间T21和峰面积A21Table 2 Relaxation time T21 and peak area A21 of beef samples under different heating conditions
由表2可知,在相同加热温度下,除45 ℃条件下的弛豫时间T21随加热时间的延长显著增大(P<0.05)外,其他温度下的弛豫时间T21和峰面积A21均无显著差别(P>0.05)。在相同加热时间下,随加热温度的升高,总体上弛豫时间T21和峰面积A21均显著减小(P<0.05),这可能是因为随着加热温度的升高,蛋白质变性程度增大且发生收缩,同时水-蛋白质的氢键被破坏,将肌原纤维间的水分挤出,所以不易流动水含量减少,即峰面积A21降低,剩余滞留的不易流动水的氢键键能较大,所以弛豫时间T21左移,即弛豫时间T21减小。另外,从表2可看出,随着加热时间的延长,弛豫时间T21和峰面积A21随加热温度的升高降低得越来越快,这表明加热温度对肌原纤维蛋白的变性、收缩有影响,加热时间对其虽然影响不显著但也有一定的影响。本质上来说,影响肉品嫩度的主要因素是肉品中的蛋白质,其中肌原纤维蛋白的含量最高,其变化对肉品嫩度的影响很大。
2.6 不同加热条件对肉样微观结构的影响
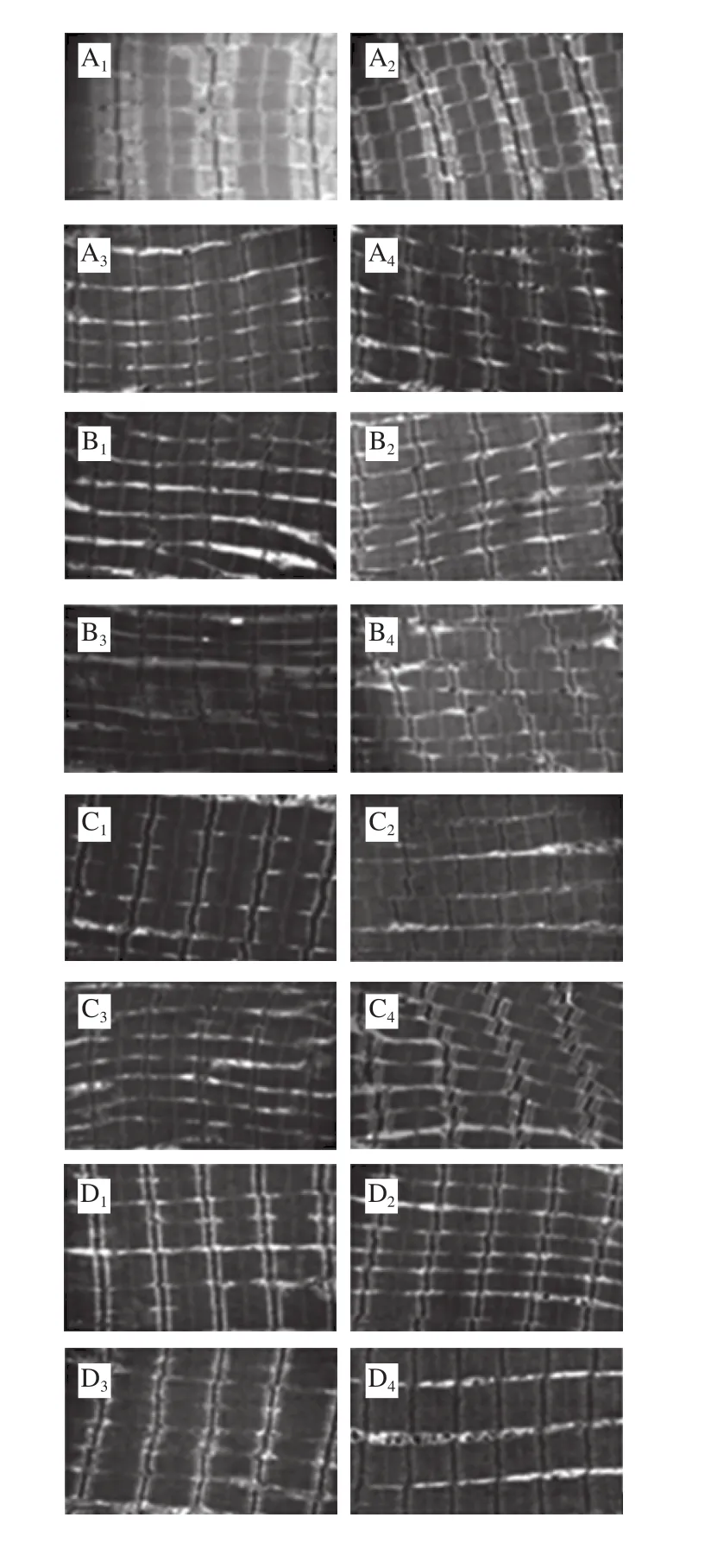

图6 牛肉在不同加热条件下的TEM图(25 000×)Fig. 6 TEM pictures of braised beef under different heating conditions (25 000 ×)
从图6可看出,随着加热温度的升高,暗带和明带的界限变模糊,A带收缩,M线膨胀并逐渐消失,Z线溶胀降解,肌节长度呈减小趋势,表明加热温度对肉品的微观结构产生了影响。
肌节是肌原纤维的基本单位,两条Z线之间的一段肌原纤维结构为一个肌节。加热过程中,肌原纤维会发生横向收缩和纵向收缩,肌节长度与肌原纤维的纵向收缩密切相关,收缩程度越大,肌节长度越短,相应地,出品率和营养成分也越少。
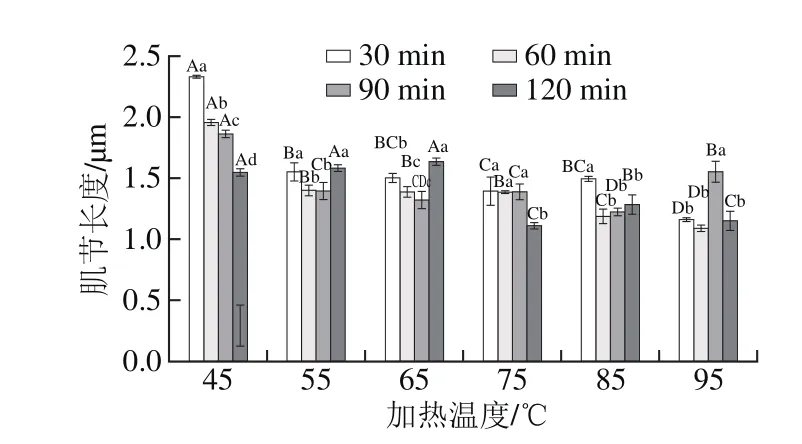
图7 加热温度和时间对肌节长度的影响Fig. 7 Eeffect of heating temperature and time on sarcomere length
由图7可知,相同温度下,随着加热时间的延长,肌节长度整体呈缩短的趋势,但在55、65 ℃和85、95 ℃处存在特殊现象。55 ℃和65 ℃的特殊现象与之前实验结果一致,可能与肌动球蛋白解离有关。Okitani等[18]研究发现,在较低温度且相对较长时间加热条件下,观察到肌动蛋白含量增加,即肌动球蛋白存在明显的解离现象,且嫩度较好;邓少颖等[27]研究发现加热温度为50~60 ℃,加热10~30 min时能显著促进肌动球蛋白的解离。85 ℃和95 ℃的特殊现象可能与胶原蛋白在高温下的溶解、凝胶化有关,解除了胶原蛋白收缩对肌原纤维蛋白的束缚,从而肌节长度出现增长的现象,同时由于结缔组织分布不均匀,肌节长度在该温度段的变化也不一致。
相同加热时间下,随着加热温度的升高,肌节长度呈缩短的趋势,但55 ℃和65 ℃无显著差异(P>0.05),在85 ℃(60 min以后)和95 ℃(90 min以后)存在反弹现象。出现该现象的原因与前面推测一致,55~65 ℃因肌动球蛋白的解离,肌节长度没有显著缩短(P>0.05);85 ℃和95 ℃因胶原蛋白的溶解,肌节长度出现增长趋势。
3 讨 论
加热处理广泛应用于肉品加工中,有利于改善肉的口感、杀灭细菌、保证肉品安全。肉经过加热处理以后,蛋白质变性、降解,结构发生了极大的变化,这些变化极大影响了肉品的嫩度、肉色、多汁性、风味等食用品质,其中嫩度是评价肉品品质的重要指标之一。在本研究中,加热温度和时间对肉品各项嫩度相关指标均有影响,特别是加热温度。
在75 ℃之前,蒸煮损失率随加热温度的升高和加热时间的延长显著增大(P<0.05),与DSC和低场核磁共振测定结果一致。热加工过程肉中水分的损失与蛋白质的变性及肌纤维结构收缩息息相关,在蒸煮温度达到50 ℃之前,水分损失可能主要与肌浆蛋白的变性有关,如大部分肌浆蛋白在45~50 ℃时就发生变性[6,28];而当温度到达50 ℃以后,肉中更多的蛋白质发生变性,特别是肌球蛋白在55~60 ℃时开始变性,肌球蛋白是肌纤维中含量最高的结构蛋白质,也是肌肉中保持水分最重要的载体;随着温度的增加,肉中另外一种重要组成蛋白——肌动蛋白也开始变性。Kirschner等[29]利用傅里叶变换红外光谱确定了肌肉组织中的水分状态在70 ℃附近有显著变化,而该温度正是肌原纤维蛋白中肌动蛋白的变性温度。故在45~75 ℃之间,随着肌原纤维蛋白的变性和收缩,减少了肌原纤维蛋白的亲水性和纤维间的水分存储空间,从而使肉样蒸煮损失率显著增加(P<0.05)。
剪切力、MFI和肌节长度在55~65 ℃和85~95 ℃处存在特殊现象。目前的研究结果发现55~65 ℃的特殊变化可能与肌动球蛋白的解离有关。有研究报道牛肉、猪肉、鸡肉加热温度到50~65 ℃左右时,大量的肌动蛋白可以从肌动球蛋白中解离,而当温度达到80 ℃后,这种解离过程停止,这也为低温长时加热提高肌肉嫩度提供了理论基础[18,30]。Wang Daoying等[17]在鸭肉加热过程中也发现肌动球蛋白在50 ℃开始解离,60 ℃解离程度最大,并认为这是造成50~65 ℃温度段剪切力平稳或下降的主要原因。在此加热阶段,肉品嫩度较低,剪切力较低,肌纤维收缩程度小,肌节长度减小程度较小。85~95 ℃的特殊变化则与胶原蛋白在高温下的溶解有关[10,19],随着温度的升高,结缔组织的胶原纤维发生热变性,其完整性开始被破坏,导致肌原纤维结构变得模糊,肌纤维结构受到破坏;胶原蛋白的溶解性不仅降低了肉品韧度,也削弱了结缔组织对肌原纤维的束缚,减少肉品收缩程度。
4 结 论
加热温度和加热时间对各项嫩度相关指标均有影响。在75 ℃以内,随加热温度的升高和加热时间的延长,蒸煮损失率显著增大(P<0.05),变性焓值、T21和A21总体上显著降低(P<0.05)。加热30 min后,剪切力随加热时间的延长无显著变化(P>0.05),随加热温度的升高呈先减小再增大再减小的趋势;MFI随加热时间的延长变化较不显著(P>0.05),随加热温度的升高呈逐渐增大的趋势;肌节长度随加热时间的延长和加热温度的升高呈缩短趋势。但剪切力、MFI和肌节长度在55~65 ℃和85~95 ℃处存在特殊现象。推测75 ℃以后蛋白质基本完全变性,55~65 ℃时肌动球蛋白发生解离,85~95 ℃时胶原蛋白发生溶解,这可为牛肉加热类菜肴的工业化生产提供科学理论指导。
[1] SASAKI K, MOTOYAMA M, NARITA T, et al. Characterization and classification of Japanese consumer perceptions for beef tenderness using descriptive texture characteristics assessed by a trained sensory panel[J]. Meat Science, 2014, 96(2): 994-1002. DOI:10.1016/j.meatsci.2013.10.021.
[2] 李超, 徐为民, 王道营, 等. 加热过程中肉嫩度变化的研究[J]. 食品科学, 2009, 30(11): 262-265. DOI:10.3321/j.issn:1002-6630.2009.11.059.
[3] WALSH H, MARTINS S, O’NEILL E E, et al. The effects of different cooking regimes on the cook yield and tenderness of non-injected and injection enhanced forequarter beef muscles[J]. Meat Science, 2010,84(3): 444-448. DOI:10.1016/j.meatsci.2009.09.014.
[4] COMBES S, LEPETIT J, DARCHE B, et al. Effect of cooking temperature and cooking time on Warner-Bratzler tenderness measurement and collagen content in rabbit meat[J]. Meat Science,2004, 66(1): 91-96. DOI:10.1016/S0309-1740(03)00019-6.
[5] PALKA K, DAUN H. Changes in texture, cooking losses, and myof i brillar structure of bovine M. semitendinosus during heating[J]. Meat Science,1999, 51(3): 237-243. DOI:10.1016/S0309-1740(98)00119-3.
[6] HUANG F, HUANG M, XU X L, et al. Inf l uence of heat on protein degradation, ultrastructure and eating quality indicators of pork[J].Journal of the Science of Food and Agriculture, 2011, 91(3): 443-448.DOI:10.1002/jsfa.4204.
[7] CHENG C S, PARRISH F C. Heat-induced changes in, myof i brillar proteins of bovine longissimus muscle[J]. Journal of Food Science,1979, 44(1): 22-24. DOI:10.1111/j.1365-2621.1979.tb09995.x.
[8] 李超. 加热处理对鸭肉嫩度的影响及其机制研究[D]. 南京: 南京农业大学, 2012: 4-17.
[9] 臧大存. 鸭肉嫩度影响因素及变化机制的研究[D]. 南京: 南京农业大学, 2007: 11-20.
[10] 常海军. 不同加工条件下牛肉肌内胶原蛋白特性变化及其对品质影响研究[D]. 南京: 南京农业大学, 2010: 3-13.
[11] BOUTON P E, HARRIS P V, RATCLIFF D. Effect of cooking temperature and time on the shear properties of meat[J]. Journal of Food Science, 1981,46(4): 1082-1087. DOI:10.1111/j.1365-2621.1981.tb02996.x.
[12] DAVEY C L, GILBERT K V. Temperature-dependent cooking toughness in beef[J]. Journal of the Science of Food and Agriculture,1974, 25(8): 931-938. DOI:10.1002/jsfa.2740250808.
[13] CHRISTENSEN L, BERTRAM H C, AASLYNG M D, et al. Protein denaturation and water-protein interactions as affected by low temperature long time treatment of porcine Longissimus dorsi[J]. Meat Science, 2011, 88(4): 718-722. DOI:10.1016/j.meatsci.2011.03.002.
[14] 魏秀丽, 谢小雷, 张春晖, 等. 猪宰后肌肉体系中μ-calpain及肌原纤维蛋白理化特性的变化规律[J]. 中国农业科学, 2015, 48(12): 2428-2438.DOI:10.3864/j.issn.0578-1752.2015.12.016.
[15] AASLYNG M D, BEJERHOLM C, ERTBJERG P, et al. Cooking loss and juiciness of pork in relation to raw meat quality and cooking procedure[J]. Food Quality and Preference, 2003, 14(4): 277-288.DOI:10.1016/S0950-3293(02)00086-1.
[16] CHRISTENSEN M, PURSLOW P P, LARSEN L M. The effect of cooking temperature on mechanical properties of whole meat, single muscle fi bres and perimysial connective tissue[J]. Meat Science, 2000,55(3): 301-307. DOI:10.1016/S0309-1740(99)00157-6.
[17] WANG Daoying, DONG Han, ZHANG Muhan, et al. Changes in actomyosin dissociation and endogenous enzyme activities during heating and their relationship with duck meat tenderness[J].Food Chemistry, 2013, 141(2): 675-679. DOI:10.1016/j.foodchem.2013.04.034.
[18] OKITANI A, ICHINOSE N, ITOH J, et al. Liberation of actin from actomyosin in meats heated to 65 ℃[J]. Meat Science, 2009, 81(3):446-450. DOI:10.1016/j.meatsci.2008.09.008.
[19] PALKA K. Changes in intramuscular connective tissue and collagen solubility of bovine M. semitendinosus during retorting[J]. Meat Science, 1999, 53(3): 189-194. DOI:10.1016/S0309-1740(99)00047-9.
[20] GEESINK G H, TAYLOR R G, BEKHIT A E D, et al. Evidence against the non-enzymatic calcium theory of tenderization[J]. Meat Science, 2001, 59(4): 417-422. DOI:10.1016/S0309-1740(01)00097-3.
[21] 张小燕, 何军波, 张如意, 等. 差示扫描量热法及其在猪肉凝胶机理探索中的应用[J]. 肉类工业, 2014(12): 18-20. DOI:10.3969/j.issn.1008-5467.2014.12.009.
[22] BERTRAM H C, WU Z, VAN DEN BERG F, et al. NMR relaxometry and differential scanning calorimetry during meat cooking[J]. Meat Science, 2006, 74 (4): 684-689. DOI:10.1016/j.meatsci.2006.05.020.
[23] DAI Y, ZHANG Q N, WANG L, et al. Changes in shear parameters,protein degradation and ultrastructure of pork following water bath and ohmic cooking[J]. Food and Bioprocess Technology, 2014, 7(5): 1393-1403. DOI:10.1007/s11947-013-1145-1.
[24] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes: a review[J].Meat Science, 2011, 89(2): 111-124. DOI:10.1016/j.meatsci.2011.04.007.
[25] LIN S Y, YANG S L, LI X F, et al. Dynamics of water mobility and distribution in soybean antioxidant peptide powders monitored by LF-NMR[J].Food Chemistry, 2016, 199: 280-286. DOI:10.1016/j.foodchem.2015.12.024.
[26] HUGHES J, OISETH S, PURSLOW P, et al. A structural approach to understanding the interactions between colour, water-holding capacity and tenderness[J]. Meat Science, 2014, 98(3): 520-532. DOI:10.1016/j.meatsci.2014.05.022.
[27] 邓少颖, 王道营, 张牧焓, 等. 鸭胸肌肉加热过程中肌动球蛋白解离研究[J]. 食品科学, 2015, 36(1): 1-5. DOI:10.7506/spkx1002-6630-201501001.
[28] 黄明, 黄峰, 张首玉, 等. 热处理对猪肉食用品质的影响[J]. 食品科学, 2009, 30(23): 189-192. DOI:3321/j.issn:1002-6630.2009.23.042.
[29] KIRSCHNER C, OFSTAD R, SKARPEID H J, et al. Monitoring of denaturation processes in aged beef loin by Fourier transform infrared microspectroscopy[J]. Journal of Agricultural and Food Chemistry,2004, 52 (12): 3920-3929. DOI:10.1021/jf0306136.
[30] OKITANI A, ICHINOSE N, KOZA M, et al. AMP and IMP dissociate actomyosin into actin and myosin[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(8): 2005-2011. DOI:10.1271/bbb.80128.
Changes in Tenderness and Water-Holding Capacity and Underlying Mechanism during Beef Stewing
SUN Hongxia1, HUANG Feng1,2, DING Zhenjiang1, ZHANG Chunjiang1,2, ZHANG Liang1,2, ZHANG Hong1,2,*
(1. Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China;2. College of Staple Food Technology, Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Harbin 151900, China)
The objective of the present study was to investigate the mechanism underlying the changes in beef tenderness and water-holding capacity during stewing by examining cooking loss rate, Warner-Bratzler shear force, myof i bril fragmentation index (MFI), sarcomere length and low fi eld nuclear magnetic resonance (LF-NMR) characteristics. Results showed that cooking loss percentage increased significantly with increasing heating temperature (P < 0.05). Warner-Bratzler shear force overall increased with increasing temperature despite a decrease from 45 to 55℃ and from 75 to 95 ℃. Meanwhile,MFI signif i cantly increased as temperature rose from 55 to 65 ℃ (P < 0.05), which may be ascribed to the liberation of actin from actomyosin, which also contributed to the decreased tenderness at 55 ℃. LF-NMR analysis indicated that both transverse relaxation time (T21) and peak area (A21) decreased signif i cantly. Sarcomere length and cooking loss percentage also decreased signif i cantly with increasing temperature from 55 to 65 ℃. These results demonstrated that controlling the temperature in the range of 55—65 ℃ is critical during beef stewing, which could provide a theoretical basis for processing Chinese braised beef at low temperature.
beef; stewing; water; protein; tenderness
10.7506/spkx1002-6630-201801013
TS251.6
A
1002-6630(2018)01-0084-07
孙红霞, 黄峰, 丁振江, 等. 不同加热条件下牛肉嫩度和保水性的变化及机理[J]. 食品科学, 2018, 39(1): 84-90.
DOI:10.7506/spkx1002-6630-201801013. http://www.spkx.net.cn
SUN Hongxia, HUANG Feng, DING Zhenjiang, et al. Changes in tenderness and water-holding capacity and underlying mechanism during beef stewing[J]. Food Science, 2018, 39(1): 84-90. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801013. http://www.spkx.net.cn
2016-10-20
中央级公益性科研院所基本科研业务费专项(0032015016);
中国农业科学院科技创新工程协同创新任务项目(CAAS-XTCX2016005)
孙红霞(1992—),女,硕士,研究方向为农产品加工理论与技术。E-mail:1559606458@qq.com
*通信作者简介:张泓(1958—),男,研究员,博士,研究方向为食品加工装备与工程。E-mail:zhang.h07@hotmail.com
