普罗布考对肾脏缺血再灌注损伤大鼠的保护作用及机制*
2018-01-05任星峰
杨 成, 任星峰, 彭 隽
中国人民解放军武汉总医院肾内科,武汉 430070
普罗布考对肾脏缺血再灌注损伤大鼠的保护作用及机制*
杨 成, 任星峰, 彭 隽
中国人民解放军武汉总医院肾内科,武汉 430070
目的观察普罗布考对缺血再灌注大鼠肾脏氧化应激损伤的保护作用,同时探讨其作用机制。方法雄性SD大鼠30只,随机分为假手术组(S组)、缺血再灌注组(IR组)、普罗布考治疗组(P+IR组),每组10只。P+IR组大鼠每天用普罗布考(500 mg/kg)灌胃,S组和IR组大鼠每天用等量温开水灌胃。1周后制备肾缺血再灌注大鼠模型:3组大鼠都摘除右肾,IR组和P+IR组用无创动脉夹夹闭左侧肾动脉,30 min后松夹恢复血流再灌注。再灌注后S组和IR组每天温开水灌胃,P+IR组每天普罗布考灌胃,连续1周。1周后处死所有大鼠,留取血及肾组织标本,检测大鼠各项血液生化指标,观察肾组织病理学改变。结果与IR组相比,P+IR组血尿素氮(BUN)、血肌酐(SCr)、血脂水平明显降低(均P<0.05),血清和肾组织中SOD活性明显上升、MDA含量明显下降(均P<0.05),肾组织病理损伤减轻,肾指数明显改善(P<0.05)。结论普罗布考能提高缺血再灌注损伤大鼠血及肾组织中SOD活性,改善肾功能,降低血脂水平,减轻肾组织病理损伤,发挥肾脏保护作用。
普罗布考; 肾脏; 缺血再灌注; 氧化应激
在日常生活中,各种突发事件、自然灾害以及战争伤导致的多器官损伤中,急性肾损伤(acute kidney injury,AKI)约占67%,其发病率和死亡率一直居高不下。肾脏的血液循环十分丰富,占人体总循环血量的1/4,因此肾脏对缺血及再灌注十分敏感。临床上缺血再灌注损伤(ischemia-reperfusion injury,IRI)是引起AKI最常见的病因,如何采取有效措施来预防、治疗IRI,始终是摆在我们面前的一道难题。近年来,伴随着一批批新药的问世以及人们对传统药物药理作用的进一步深入了解,为AKI、IRI的预防和治疗开辟了新的思路和途径。普罗布考(probucol)是一种人工合成抗氧化剂,具有很好的降血脂作用,目前已广泛应用于临床。我们通过普罗布考对缺血再灌注大鼠氧化应激损伤的保护作用的基础研究,以期为有效阻止AKI的发生发展提供新的临床用药理论依据。
1 材料与方法
1.1 实验动物
选择健康雄性SD大鼠30只,体重180~220 g,由华中科技大学实验动物中心提供。普通饲料喂养1周后,尿蛋白检测均为阴性。
1.2 药品与试剂
普罗布考(畅泰),由承德颈复康药业集团有限公司生产,剂量为0.25 g/片,国药准字H10960161,生产批号070801。血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自武汉科瑞生物科技公司,按试剂盒操作说明书进行测定。
1.3 分组和模型制备
将30只大鼠随机分为假手术组(S组)、缺血再灌注组(ischemia reperfusion,IR组)、普罗布考治疗组(probucol+IR组,P+IR组)。P+IR组大鼠每天用普罗布考灌胃,剂量为500 mg/(kg·d),S组和IR组大鼠每天用等量温开水灌胃。1周后制备肾缺血再灌注大鼠模型:3组大鼠术前禁食12 h,腹部去毛后,腹腔注射3.5%水合氯醛l mL/100 g进行动物麻醉,经剑突下腹正中线开腹,暴露右肾,右肾静脉穿刺取血,然后切除右肾,以避免因健侧肾脏的代偿作用对实验结果造成影响。暴露左肾,避开左输尿管,分离左肾动、静脉。用无创动脉夹夹闭左肾动脉,肾脏颜色由鲜红色转为暗红色表示缺血成功,缺血30 min后松开动脉夹,肾脏颜色由暗红色转为鲜红色表示再灌注成功,模型建立成功[1]。S组大鼠仅切除右肾和分离左肾动、静脉,但不夹闭左肾动脉。经腹腔补充生理盐水,逐层缝合伤口并覆盖湿纱布,注意保暖、补液,关闭腹腔。
1.4 标本采集
模型建立后S组和IR组仍然每天温开水灌胃,P+IR组每天普罗布考灌胃,剂量为500 mg/(kg·d),连续1周。1周后处死所有大鼠,留取血及肾组织标本。处死大鼠后在无菌条件下打开腹腔,立即取出肾脏,一部分肾组织用4℃生理盐水冲洗后,称重研磨制成匀浆,再离心,取上清液测定SOD、MDA的活性和含量。另一部分肾组织光镜下检测组织形态学变化,电镜下检测超微病理结构变化。
1.5 观测指标
1.5.1 一般状况及肾指数 观察动物一般状况,包括进食、活动、外观、体重、排泄物等。处死动物,取肾脏称重,计算肾指数(肾重量/体重×10-2)。
1.5.2 血液检测 血清总胆固醇(CHOL)、三酰甘油(TG)、尿素氮(BUN)、血清肌酐(SCr),由解放军武汉总医院检验科自动生化分析仪检测。
1.5.3 血清及肾组织SOD、MDA检测 血清及肾组织SOD活性测定采用羟胺法;血清及肾组织MDA含量测定采用硫代巴比妥酸法;按产品说明书操作步骤,测定血清及肾组织匀浆中SOD活性及MDA含量。
1.5.4 肾脏形态学检查 光镜检查:取肾脏组织后,10%甲醛溶液固定,常规脱水,石蜡包埋切成2~4 μm薄片,做苏木精-伊红(HE)、Masson及银染染色,普通光镜下观察,相机摄影。电镜检查:由华中科技大学同济医学院电镜室,采用透射电子显微镜观察肾脏组织切片超微结构。取肾脏组织后,用3%戊二醛-1.5%多聚甲醛前固定,再1%锇酸-1.5%亚铁氰化钾后固定,70%乙醇饱和醋酸铀染液块染,乙醇-丙酮梯度脱水,环氧树脂618包埋剂包埋,超薄切片80 nm,醋酸铀、柠檬酸铅各染色8~10 min,在透射电镜下观察,相机摄影。
1.6 统计学方法

2 结果
2.1 大鼠一般状况
与S组比较,IR组和P+IR组大鼠逐渐出现反应性降低,活动迟缓,蜷缩拱背,毛色差,体重减轻,进食及饮水减少,口唇及四肢出现水肿,腹增大。P+IR组用普罗布考灌胃治疗后1周,进食及饮水有所改善,体重开始增加,反应性好转,水肿有所减轻,但仍较S组差。IR组则无明显改善。实验结束时,IR组有1只大鼠死亡,S组、P+IR组无大鼠死亡。
2.2 普罗布考对大鼠血生化指标和肾指数的影响
治疗1周后各组大鼠血生化指标和肾指数见表1。P+IR组和IR组比较,SCr、BUN、CHOL、TG水平明显降低,肾指数水平明显改善,两组之间差异有统计学意义(均P<0.05),说明P+IR组大鼠肾功能损伤减轻,机体营养状况也得到改善。
2.3 普罗布考对大鼠血清和肾组织中SOD活性及MDA含量的影响
治疗1周后各组大鼠血清和肾组织中SOD活性及MDA含量见表2。IR组大鼠血清和肾组织中MDA含量显著增高,SOD活性显著降低,说明IRI导致机体的氧化和抗氧化平衡被打破。P+IR组和IR组比较,血清和肾组织中MDA含量明显下降,SOD明显上升(均P<0.05),说明P+IR组大鼠氧化应激损伤减轻。

表1 普罗布考对大鼠血生化指标和肾指数的影响Table 1 Effects of probucol on blood biochemical and renal indexes in rats(±s,n=10)
肾指数=(肾重量/体重)×10-2;与S组比较,aP<0.05;与IR组比较,bP<0.05

表2 普罗布考对大鼠血清和肾组织中SOD活性及MDA含量的影响Table 2 Effects of probucol on SOD activity and MDA content in serum and renal tissue of rats(±s,n=10)
与S组比较,aP<0.05;与IR组比较,bP<0.05
2.4 大鼠肾脏病理形态学观察结果
光镜下S组大鼠肾小球和肾小管及间质结构正常。IR组大鼠以肾小管损伤为主。HE染色可见肾小球系膜基质轻度增生,肾间质较正常增宽,间质内可见较多炎性细胞浸润,肾小管管腔扩张,可见细胞及蛋白管型,肾小管刷状缘模糊、消失,部分小管萎缩,部分小管上皮细胞坏死脱落,间质血管瘀血。Masson+银染染色可见间质区内胶原纤维增生,间质纤维化呈灶状分布。P+IR组大鼠的病理改变较IR组明显减轻,肾小球结构基本正常,系膜基质无明显增生,肾间质损伤较轻,肾小管管腔轻度扩张,细胞及蛋白管型较少,上皮细胞坏死、脱落较少,少量炎性细胞浸润。见图1。
各组大鼠肾小管形态学评级[2]:每张切片选择50个高倍视野观察,每高倍视野观察10个肾小管,分为5个等级。0级:肾组织结构无异常;1级:肾小管上皮细胞局灶性颗粒样空泡变性,小管腔中出现颗粒状碎屑,有或无灶状上皮细胞脱落(<1%肾小管出现上皮脱落);2级:1%~50%肾小管出现上皮细胞坏死及脱落;3级:>50%的近端肾小管出现上皮细胞坏死及脱落,但可见完好的肾小管;4级:完全或几乎完全的近端肾小管坏死。结果显示,IR组大鼠肾小管形态学评级基本为3级和4级,肾小管损伤严重;而P+IR组肾小管形态学评级基本为2级和3级,肾小管损伤明显减轻。
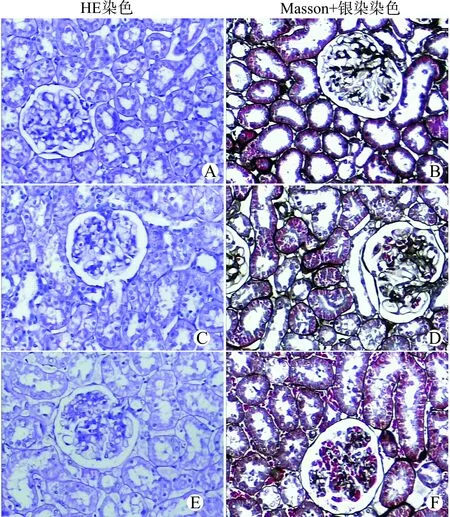
A、B:S组,肾小球和肾小管及间质结构正常(×200);C、D:IR组,肾间质增宽,肾小管管腔扩张,部分小管萎缩,可见细胞及蛋白管型(×200);E、F:P+IR组,肾间质损伤较轻,肾小管管腔轻度扩张,少量炎性细胞浸润(×200)图1 大鼠肾脏病理学变化Fig.1 Pathological changes of renal tissue in rats
3 讨论
临床上肾脏IRI在多器官损伤以及器官移植术后较为常见,也是导致AKI最常见的病因。肾脏IRI的发病机制较为复杂,目前认为主要与以下因素密切相关:机体氧化应激反应,炎症反应,细胞钙离子超载,内皮功能紊乱,肾组织细胞凋亡,细胞能量代谢障碍等[3-4]。其中肾脏氧化应激反应性增加,体内氧自由基生成增多尤为关键。氧自由基会攻击细胞膜的多不饱和脂肪酸,引发脂质过氧化反应,其分解产物可引起细胞结构和功能的损伤、破坏,导致细胞膜受损,细胞溶解、溶酶体破裂等。另外,氧化应激损伤还可引起线粒体通透性增加进而引发细胞凋亡。有研究发现,丝氨酸蛋白酶对肾缺血再灌注损伤具有保护作用,其具体机制是阻断肾脏氧化应激反应,同时抑制肾脏炎症反应[5]。另有报道,虾青素有预防器官缺血再灌注损伤的作用,其发挥保护作用的机制也是减轻氧化应激反应,消除氧自由基的影响[6]。肾脏发生缺血再灌注损伤时,机体通过黄嘌呤氧化酶途径,使氧自由基生成增多,同时因线粒体大量破坏,氧自由基清除能力下降,导致氧自由基大量聚集,并被进一步激活。激活的氧自由基可作用于肾组织细胞膜,引起脂质过氧化反应,形成大量MDA,使细胞膜不饱和脂肪酸减少,细胞膜的正常结构被破坏,导致细胞结构和功能障碍。MDA是反映机体脂质过氧化物含量及受超氧离子自由基攻击程度的常用指标[7]。SOD是人体内主要的抗氧化酶,在氧自由基清除中起关键作用。它不但能清除体内超氧阴离子,减轻氧化应激反应和脂质过氧化反应,保护细胞免受氧自由基的损伤,而且还能对抗活性氧对细胞造成的损伤,并及时修复受损细胞[8-9]。
普罗布考(probucol)化学名为4,4’-[(1-甲基亚乙基)二硫]双[2,6-二(1,1-二甲乙基)苯酚],是一种人工合成抗氧化剂,安全性及耐受性都很好,未发现致癌、致突变作用。普罗布考的药理作用主要有以下几方面:①降血脂作用,对于家族性和非家族性高胆固醇血症,普罗布考都有明显的降低作用。普罗布考可增加7α-羟化酶的表达,促进血液中的胆固醇进入胆汁随粪便排出[10];还可使肝细胞表面的低密度脂蛋白(LDL)受体数量增多,活性增强,从而增加胆固醇的清除[11]。②抗氧化作用,普罗布考能有效抑制LDL氧化形成氧化LDL(ox-LDL),抑制烟酰胺辅酶氧化酶的活性、清除自由基[12];还可升高屏氧酶1的血清水平和肝细胞中屏氧酶1 mRNA的表达[13]。③抗氧化应激作用,普罗布考通过抑制ox-LDL的产生,从而抑制巨噬细胞摄取ox-LDL,延缓ox-LDL诱导的细胞核脂化过程,抑制泡沫细胞的形成。同时普罗布考可抑制各种氧化脂质对单核细胞的趋化作用,以及对血管内皮组织、平滑肌细胞的毒性作用。④抗炎症作用,普罗布考可抑制肿瘤坏死因子-α(TNF-α)、白细胞介素1(IL-1)、活性氧类(ROS)等多种炎性因子表达,阻断C反应蛋白(CRP)形成的部分途径。普罗布考还通过抑制基质金属蛋白酶(MMPs)的分泌与表达,延缓动脉粥样硬化斑块的形成发展,起到稳定粥样斑块的作用[14]。⑤改善内皮功能作用,普罗布考能抑制粘附分子表达,抑制内皮细胞增生、移行;还通过上调bc1-2,减少p53表达,抑制核因子κB活性等途径抑制内皮细胞的凋亡。
我们前期研究已证实普罗布考对阿霉素肾病大鼠有保护作用[15],而对临床上常见的IRI的作用如何,目前研究较少。本研究中,大鼠IRI后,血清和肾组织中MDA含量显著增高,说明IRI导致机体产生大量的氧自由基,引发脂质过氧化;而血清和肾组织中SOD活性显著降低,说明IRI导致机体内源性抗氧化酶损伤,抗氧化能力降低;机体的氧化和抗氧化平衡被打破,从而造成严重的AKI。另外,IRI后血BUN、SCr水平也明显升高,肾组织病理损伤明显,肾指数恶化,这些都说明肾功能受到严重损伤,出现AKI的临床表现。给予普罗布考治疗后,P+IR组大鼠血清和肾组织中MDA含量明显下降,SOD明显上升(均P<0.05),血BUN、SCr水平也明显下降(均P<0.05),肾组织病理损伤和肾指数都明显改善,说明普罗布考具有强大的抗氧化作用,能明显增强肾脏的抗氧化能力,使机体的氧化和抗氧化平衡得到恢复,从而起到减轻IRI的作用。国外研究还发现,普罗布考可诱导血红素氧合酶-1(heme oxygenase-1,HO-1)的表达,使HO-1的活性上调[16]。我们前期研究已证实HO-1对慢性肾功能不全大鼠肾脏具有保护作用[17],而普罗布考能诱导HO-1的表达,并使其活性上调,这可能是其发挥肾脏保护作用的又一重要机制,有待进一步深入研究。
[1] Lee H T,Kim M,Kim M,et al.Isoflurane protects against renal ischemia and reperfusion injury and modulates leukocyte infiltration in mice[J].Am J Physiol Renal Physiol,2007,293(3):F713-F722.
[2] Houghton D C,Plamp C E 3rd,DeFehr J M,et a1.Gentamincin and tobramycin neprotoxicity.A morphological and functional comparison in the rats[J].Am J Pathol,1978,93(1):137-152.
[3] Horvath G,Brubel R,Kovacs K,et al.Effects of PACAP on oxidative stress-induced cell death in rat kidney and human hepatocyte cells[J].J Mol Neurosci,2011,43(1):67-75.
[4] 侯四川,高健刚,李奎.核转录因子NF-E2相关因子2在左卡尼汀减轻肾缺血再灌注损伤中的作用[J].中华肾脏病杂志,2014,30(1):60-61.
[5] Zhou S,Sun Y,Zhuang Y,et al.Effects of kallistatin on oxidative stress and inflammation on renal ischemia-reperfusion jury in mice[J].Curr Vasc Pharmacol,2015,13(2):265-273.
[6] Qiu X,Fu K,Zhao X,et al.Protective effects of astaxanthin against ischemia/reperfusion induced renal injury in mice[J].J Transl Med,2015,13:28.
[7] Kir H M,Sahin D,Oztas B,et al.effects of single-dose neuropeptide Y on levels of hippocampal BDNF,MDA,GSH,and NO in a rat model of pentylenetetrazole-induced epileptic seizure[J].Bosn J Basic Med Sci,2013,13(4):242-247.
[8] Lu Y,Zhang Y Y,Hu Y C,et al.Protective effects of 2′,4′-dihydroxy-6′-methoxy-3′,5′-dimethylchalcone against hydrogenperoxide-induced oxidative stress in hepatic L02 cell[J].Arch Pharm Res,2014,37(9):1211-1218.
[9] Badgujar P C,Chandratre G A,Pawar N N,et al.Fipronil inducedoxidative stress involves alterations in SOD1 and catalasegene expression in male mace liver:protection by vitamins E and C[J].Environ Toxicol,2016,31(9):1147-1158.
[10] Zhao S P,Ni Z L,Peng D Q.Probucol dose-dependently promotes reverse transport of cholesterol from macrophages to facesinvivo[J].Atheroscler Suppl,2007,8(1):29-31.
[11] Hirano K,Ikegami C,Tsujii K,et al.Probucol enhances the expression of human hepatic scavenger receptor class B type I,possibly through a species-specificmechanism[J].Atrerioscler Thromb Vasc Biol,2005,25(11):2422-2427.
[12] Bassenge E,Schneider H T,Daiber A.Oxidative stress and cardiovascular diseases[J].Dtsch Med Wochenschr,2005,130(50):2904-2909.
[13] Yi G H,Zhong C M,Yan P Y,et al.Effects of probucol on paraoxonase 1 expression and oxidative stress in hyperlipidemic mice[J].Cell Biol Intern,2008,32(1):67-71.
[14] Wu T C,Chen Y H,Leu H B,et al.Carvedilol,a pharmacological antioxidant,inhibits neointimalmatrixmetallop roteinase-2 and -9 in experimental atherosclerosis[J].Free Radic Biol Med,2007,43(11):1508-1522.
[15] 杨成,兰天飙.普罗布考对实验型大鼠胱抑素C、肾功能和肾脏病理学的影响[J].中华临床医师杂志:电子版,2011,5(9):2582-2586.
[16] Deng Y M,Wu B J,Witting P K,et al.Probucol protects against smooth muscle cell proliferation by up regulating heme oxygenase-1[J].Circulation,2004,110(13):855-860.
[17] 杨成,刘晓城.大鼠5/6肾切除肾脏中血红素氧合酶-1免疫组化及病理学研究[J].华中科技大学学报:医学版,2004,33(2):158-164.
ProtectiveEffectofProbucolonRatswithRenalIschemia-reperfusionInjuryandtheMechanism
Yang Cheng,Ren Xingfeng,Peng Jun
DepartmentofNephrology,WuhanGeneralHospitalofPLA,Wuhan430070,China
ObjectiveThe aim of the study was to investigate the protective effect of probucol on oxidative stress injury in rats with ischemia-reperfusion injury(IRI)and its mechanism.MethodsThirty male Sprague-Dawley rats were randomly divided into sham operation group(S group),ischemia-reperfusion group(IR group),and probucol treatment group(probucol+IR group,P+IR group).Rats in the S and IR groups were fed with warm water every day,and rats in P+IR group were treated with probucol.After 1 week,rat model of renal ischemia and reperfusion was established.Right kidneys of the rats were removed.In IR and P+IR groups,the left renal artery was clamped with a non-invasive artery clamp,and after 30 minutes the blood vessels restored patency by loosening the clamp.After reperfusion,the S and IR groups were perfused with warm water every day,and the P+IR group was treated with probucol for 1 week.After 1 week,all the rats were sacrificed and the blood and kidney tissue specimens were taken.The blood biochemical indexes of the rats were measured,and the pathological changes of the kidneys were observed.ResultsThe levels of blood urea nitrogen(BUN),serum creatinine(SCr)and blood lipids in P+IR group were significantly lower than those in IR group(allP<0.05);in P+IR group,the level of superoxide dismutase(SOD)in serum and renal tissue was increased significantly(allP<0.05),meanwhile,the levels of malondialdehyde(MDA)were significantly decreased(P<0.05).In P+IR group,the pathological damage of kidney tissue was reduced,and renal index was significantly improved(P<0.05).ConclusionProbucol can increase the activity of SOD in blood and kidney of rats with IRI,improve renal function,reduce the level of blood lipids,reduce the pathological injury of renal tissue,and play a role in renal protection.
probucol; kidney; ischemia-reperfusion; oxidative stress
*湖北省卫生计生委科研资助项目(No.WJ2015Z042)
杨 成,男,1971年生,医学硕士,副主任医师,E-mail:xxjjyycc@sina.com
R691.6
10.3870/j.issn.1672-0741.2017.06.009
(2017-06-27 收稿)
