miR-186对胶质母细胞瘤细胞增殖和凋亡的影响及机制
2018-01-05万春花杨世疆吴景冬郭清皓蒋林涛
万春花, 蔡 钧, 杨世疆, 吴景冬, 郭清皓, 蒋林涛△
华中科技大学同济医学院附属武汉中心医院 1麻醉科 2急诊创伤外科,武汉 430014
miR-186对胶质母细胞瘤细胞增殖和凋亡的影响及机制
万春花1, 蔡 钧2, 杨世疆2, 吴景冬2, 郭清皓2, 蒋林涛2△
华中科技大学同济医学院附属武汉中心医院1麻醉科2急诊创伤外科,武汉 430014
目的研究转染miR-186对胶质母细胞瘤细胞增殖能力的影响并探讨作用机制。方法采用荧光定量PCR检测miR-186在胶质母细胞瘤细胞系U251、U87-MG及正常星形胶质细胞系HA1800中的表达水平,将U251细胞分为miR-186模拟物组和对照组,分别转染miR-186模拟物和阴性随机对照序列,并用荧光定量PCR检测miR-186在两组中的表达量。采用CKK-8法检测两组细胞细胞增殖能力,流式细胞仪测定两组细胞凋亡率,Western blot分析Caspase-3、Caspase-8、Caspase-9及Cyclin D1蛋白的表达。结果miR-186低表达于胶质母细胞瘤细胞系U251及U87-MG,高表达于正常星形胶质细胞系HA1800。转染24、48、72及96 h后,miR-186模拟物组细胞增殖(A450nm值)低于对照组(均P<0.05)。转染48 h后,miR-186模拟物组凋亡率高于对照组;miR-186模拟物组Caspase-3、9的表达量高于对照组(均P<0.01),Caspase-8与对照组相比差异无统计学意义(P>0.05)。miR-186模拟物组Cyclin D1表达水平较对照组明显降低(P<0.01)。结论miR-186抑制胶质母细胞瘤细胞增殖能力,并诱导凋亡,其机制可能与上调Caspase-3、9,下调Cyclin D1有关。
miR-186; 胶质母细胞瘤; 增殖; 细胞凋亡
胶质母细胞瘤是成年人最常见的原发性脑部肿瘤,具有很强的侵袭和增殖能力,病死率很高,患者中位生存期一般不超过1年[1-2]。MicroRNAs (miRNA)是一类内源性的非编码RNA,长度在21~25 nt,具有在转录后水平调控靶基因表达的功能[3-4]。miRNA参与调节细胞生长、增殖、凋亡,与肿瘤的发生和发展有着密切关系[5]。miRNA-186被证实在神经内分泌肿瘤患者肿瘤组织中表达水平降低,且参与神经内分泌肿瘤增殖、浸润、转移等过程[6]。它通过靶向SKP2抑制食管鳞状细胞癌细胞增殖,并诱导凋亡[7]。miRNA-186在非小细胞肺癌中通过靶向结合MAP3K2基因而发挥抑制肿瘤细胞增殖和侵袭的作用[8]。细胞周期失调是发生癌变的重要原因,细胞周期蛋白D1(Cyclin D1)是G1期所必须的核蛋白,是G1/S期关键限速点的重要调节因子[9-10]。细胞凋亡是细胞死亡的调节性生理过程,Caspase引发的一系列级联反应被认为是细胞凋亡过程的重要途径[11]。本研究观察了miR-186基因转染对胶质母细胞瘤U251细胞系增殖和凋亡的影响,分析了miR-186对细胞周期蛋白Cyclin D1及Caspase家族重要成员3、8、9的调控作用,探讨miR-186在胶质母细胞瘤中的作用机制。
1 材料与方法
1.1 主要实验材料
胶质母细胞瘤细胞系U251、U87-MG及正常星形胶质细胞系HA1800购自中国医学科学院实验医学中心,DMEM细胞培养液、胎牛血清、胰蛋白酶均购自美国Hyclone公司,实验所需的一抗购自美国Cell Signaling公司,二抗购自武汉博士德生物科技有限公司, miRcute miRNA提取分离试剂盒(DP501)购自北京天根生物科技有限公司,All-in-OneTMmiRNA qRT-PCR 检测试剂盒购自北京亚太恒信生物科技有限公司,SYBR Green Reagents 购自TaKaRa公司,Caspase-3、8、9活性检测试剂盒购自碧云天生物科技有限公司,miR-186 mimics及scramble均由上海吉玛生物科技有限公司合成。
1.2 细胞培养、转染及分组
胶质母细胞瘤细胞系U251、U87-MG及正常星形胶质细胞系HA1800均加入DMEM培养液,于37℃、5%CO2培养箱中培养,培养48 h后消化传代。将胶质母细胞瘤细胞系U251分为miR-186模拟物组和对照组,分别转染miR-186 mimics和阴性随机对照序列scramble,采用Lipofectamine 2000 reagent (Invitrogen,USA)对两组进行转染。miR-186模拟物组转染序列:miR-186 mimics上游 5′-CAAAGAAUUCUCCUUUUGGGCU-3′,miR-186 mimics下游 5′-CCCAAAAGGAGAAUUCUUUG-UU-3′;对照组转染序列:miR-186 NC上游 5′-UUCUCCGAACGUGUCACGUTT-3′,miR-186 NC下游 5′-ACGUGACACGUUCGGAGAATT-3′。
1.3 miRNA提取及qRT-PCR检测
用miRcute miRNA提取分离试剂盒按操作说明书提取细胞系中miRNA ,采用All-in-OneTMmiRNA qRT-PCR 检测试剂盒进行反应,操作按试剂盒说明书进行。反应体系:2×All-in-OneTMqRT-PCR Mix 10 μL、引物序列(10 μmol/L)1 μL、反转录cDNA 1 μL,加双氧水至20 μL。反应条件:预变性95℃ 10 min、变性95℃ 10 s、退火60℃ 20 s、延伸72℃ 30 s,共35周期。miR-181引物序列:上游5′-TGCGGGTGCTCCGCTTCGGCAGC-3′,下游5′-CAGTGCAGGGTCCGAGGT-3′,U6小核引物序列:上游5′-CGCAAGGATGACACG-3′;下游5′-GAGCAGGCTGGAGAA-3′。采用ABI Prism 7700型荧光实时定量PCR仪进行检测分析,以U6小核RNA作为内参,2-ΔΔCt法定量分析miR-186相对表达水平。
1.4 细胞增殖能力测定
采用CCK-8法测定两组细胞增殖能力。将miR-186模拟物组和对照组两组细胞消化成单细胞悬液后,在96孔板上以2×103个/孔接种,每孔培养液体积200 μL。在分别培养0、24、48、72 、96 h后,每孔加入20 μL CCK-8溶液,继续培养1 h后,用酶标仪在450 nm波长下测定各孔吸光值(A),以时间为横坐标,吸光值为纵坐标绘制胶质瘤细胞增殖曲线。
1.5 细胞凋亡能力测定
采用流式细胞术测定两组细胞凋亡能力。用Annexin Ⅴ/PI 染色检测,将两组细胞消化成单细胞悬液后,PBS清洗2次,并使用Binding Buffer重悬,加入相应比例的Annexin Ⅴ抗体,避光染色10 min后加入适量PBS溶液以及PI染料,流式细胞仪检测Annexin Ⅴ阳性细胞比例来确定细胞凋亡的变化。
1.6 Caspase-3、8、9酶活性测定
将miR-186模拟物组和对照组两组细胞裂解后,离心处理(1 000 r/min,5min),按Caspase-3、8、9活性检测试剂盒说明书进行检测。利用96孔板,将细胞裂解液与分别含有Caspase-3、8、9底物的反应液共同孵育4 h,然后用TECAN酶标仪读取405 nm的吸光度值,计算相对活力值。
1.7 Cyclin D1蛋白表达量测定
采用Western blot法。将miR-186模拟物组和对照组两组细胞用RIPA细胞裂解液冰上裂解30 min后,变性、上样,以每孔30 μg总蛋白上样,浓缩胶80 V电泳40 min,分离胶100 V电泳2 h。常规湿法转膜,加入Cyclin D1一抗(1∶300),37℃孵育4 h,二抗(1∶500)孵育过夜, ECL液显影,Quantity One 1-D分析软件对蛋白质印迹条带进行定量。目的蛋白相对表达量=目的蛋白测定值/ GAPDH测定值,实验重复3次,取平均值。
1.8 统计学分析
2 结果
2.1 miR-186低表达于胶质母细胞瘤细胞系
荧光定量PCR结果示,以正常星形胶质细胞系HA1800中 miR-186相对表达量为1.0,miR-186在胶质母细胞瘤细胞系U251、U87-MG中的相对表达量分别是(0.20±0.04)、(0.30±0.05),明显低于正常星形胶质细胞系HA1800(均P<0.01),见图1。
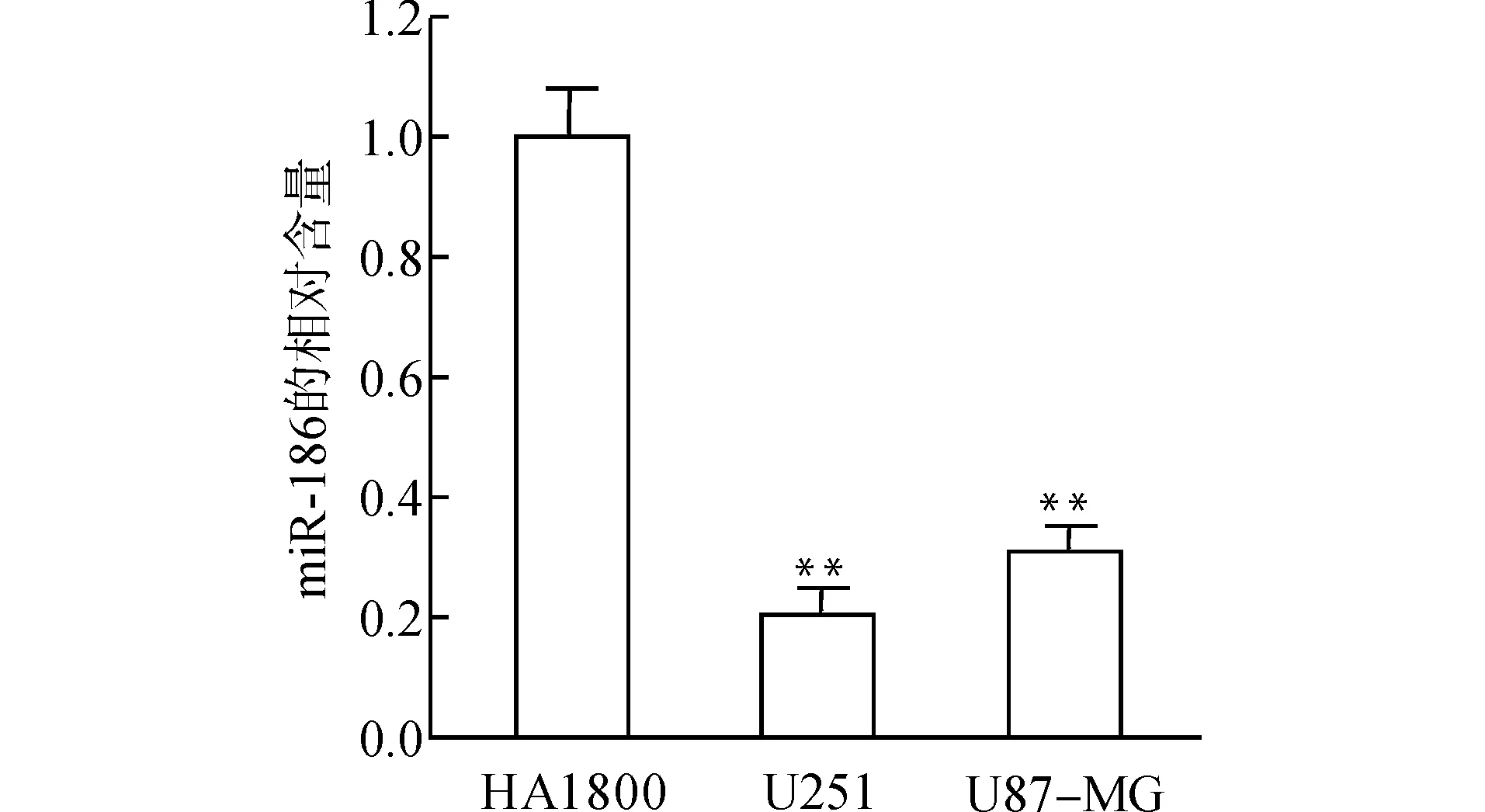
与HA1800细胞比较,**P<0.01图1 miR-186在胶质母细胞瘤细胞系U251、U87-MG及正常星形胶质细胞系中的表达Fig.1 The expression of miR-186 in glioblastoma cell line,U251 and U87-MG,and normal astrocyte cell line HA1800
2.2 miR-186过表达抑制胶质母细胞瘤细胞增殖
转染miR-186 mimics 24 h后,荧光定量PCR结果示,以阴性对照组中miR-186表达量为1.0,胶质母细胞瘤系U251中miR-186的相对表达量是(8.00±0.63),明显高于阴性对照组(P<0.01),见图2A。
采用CCK-8法测定U251细胞增殖。转染后0、24、48、72及96 h后,miR-186模拟物组与对照组的A450nm值分别为(0.33±0.03)vs.(0.35±0.04)、(0.43±0.08)vs.(0.75±0.10)、(0.72±0.09)vs.(1.67±0.25)、(1.33±0.15)vs.(2.43±0.19)及(1.92±0.20)vs.(3.78±0.32) ,除0 h时两组差异无统计学意义外,其余时间点差异均有统计学意义(P<0.05,P<0.01),见图2B。
2.3 miR-186过表达诱导胶质母细胞瘤细胞凋亡
转染miR-186模拟物48 h后,流式细胞术测定两组细胞的凋亡率。miR-186模拟物组凋亡率为 (20.0±1.5)%,阴性对照组凋亡率为 (8.0±1.0) %, miR-186模拟物组凋亡率高于对照组(P<0.01),见图3A。
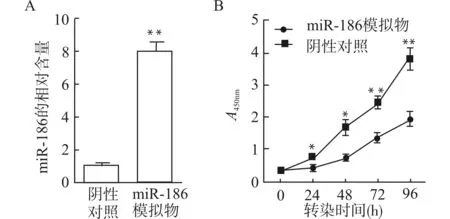
A:miR-186在miR-186模拟物组及阴性对照组中的表达;B:CCK-8实验示miR-186模拟物组及阴性对照组的增殖曲线;与阴性对照组比较,*P<0.05 **P<0.01图2 miR-186过表达抑制胶质母细胞瘤细胞增殖Fig.2 Over-expression of miR-186 inhibits the proliferation of glioblastoma cells
Caspase-3、8、9活性检测试剂盒检测Caspase-3、8、9活力。分别以阴性对照组Caspase-3、8、9的活力值为1.0,miR-186模拟物组Caspase-3、9的相对活力分别为(2.1±0.2)、(2.2±0.1),均显著高于阴性对照组(均P<0.01),而Caspase-8相对活力为(1.1±0.1),与对照组相比差异无统计学意义(P>0.05),见图3B。
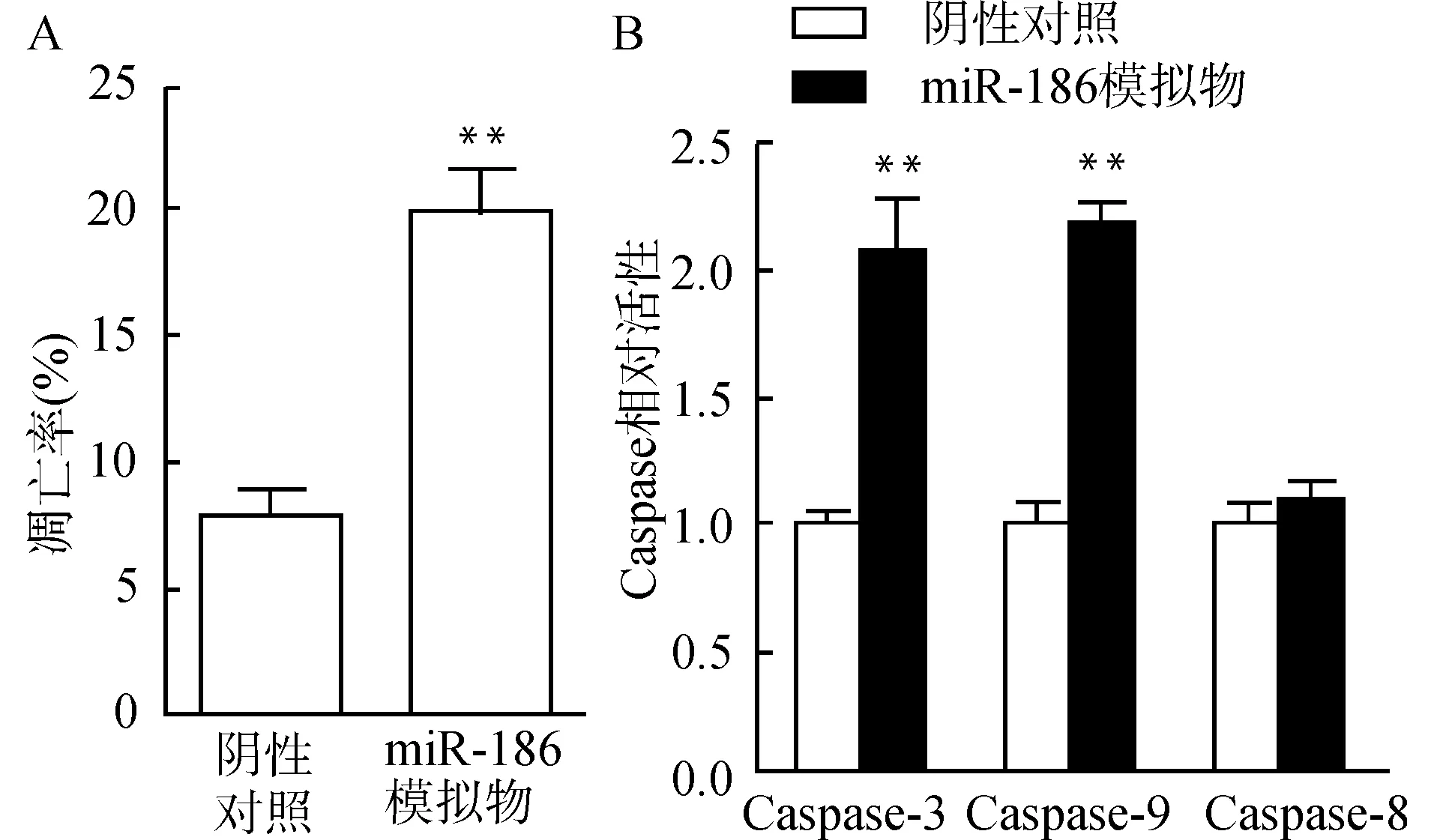
A:miR-186模拟物组与阴性对照组凋亡率的比较;B:miR-186模拟物组与阴性对照组Caspase-3、8、9活性比较;与阴性对照组比较,**P<0.01图3 miR-186过表达诱导胶质母细胞瘤细胞凋亡Fig.3 Over-expression of miR-186 induces the apoptosis of glioblastoma cells
2.4 miR-186下调Cyclin D1表达
Western blot结果示,以阴性对照组为1.0,miR-186模拟物组Cyclin D1相对表达量为(0.33±0.05),明显低于阴性对照组(P<0.01),见图4。
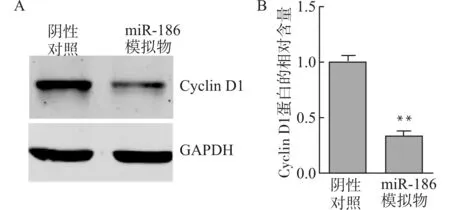
A:Western blot示miR-186模拟物组与阴性对照组Cyclin D1的表达;B:miR-186模拟物组与阴性对照组Cyclin D1相对表达量的比较;与阴性对照组比较,**P<0.01图4 miR-186下调Cyclin D1表达Fig.4 miR-186 down-regulates expression of Cyclin D1
3 讨论
胶质母细胞瘤是最常见的原发性恶性肿瘤,年发病率约为5.26/10万,每年新增患者约17 000人[12-13]。其发病机制尚不清楚,目前治疗上仍以手术切除、放疗同时联合替莫唑胺化疗为主,但患者普遍预后差、生活质量低、生存期短[14]。miRNA是一种内源性非编码小RNA,在调控细胞增殖、分化、凋亡及多种信号途径中起重要作用,参与肿瘤的发生和发展[15]。比如,miR-21通过调控程序性细胞死亡因子参与乳腺癌细胞增殖[16];miR-34a通过直接抑制CD44抑制前列腺癌干细胞的转移[17]。miR-186也被证实与肿瘤的发生有密切联系,miR-186干扰肺腺癌细胞周期进程,且与预后不良有关[18];miR-186调控PTTG1表达促进非小细胞肺癌迁移和侵袭[19];miR-186靶向NSBP1抑制膀胱癌的生长和转移[20]。但是,miR-186在胶质母细胞瘤中的作用尚不清楚。
细胞凋亡是导致细胞程序性死亡的特定过程,通过激活线粒体通路或死亡受体通路或内质网通路等途径而诱发[21-22]。线粒体介导的细胞凋亡通路通过激活细胞色素C释放到细胞质中,与Apaf1结合形成复合物,引起Caspase-9等级联反应,最后导致Caspase-3的激活,继而导致凋亡的发生[23]。本研究发现,miR-186模拟物组细胞凋亡率是(20.0±1.5)%,而对照组是(8.0±1.0)%,表明miR-186上调表达可诱导胶质母细胞瘤细胞凋亡。通过检测蛋白活力发现,miR-186模拟物组中Caspase-3和Caspase-9蛋白活力显著升高。故而证实miR-186过表达激活了线粒体凋亡途径进而促进胶质母细胞瘤U251细胞凋亡。
死亡受体如Fas和肿瘤坏死因子相关凋亡诱导配体(TRAIL),通过招募Fas相关死亡结构域和Caspase-8同型二聚体而自动酶解,Caspase-8被激活并释放到胞质中,作用于Caspase-3并使Caspase-3激活,从而诱导凋亡[24]。本研究中,蛋白活力检测表明miR-186模拟物组与对照组中Caspase-8蛋白活力无显著差异,表明细胞表面死亡受体途径没有参与到miR-186诱导的胶质母细胞瘤U251细胞凋亡过程。
细胞周期紊乱是导致恶性肿瘤转化和失控性增殖的重要原因[25]。细胞周期调控激酶复合物CDK/Cyclin是调控细胞周期的关键因素,G0/G1期阻滞是抑制细胞增殖的重要原因[26-28]。本研究也探讨了miR-186过表达是否引起U251细胞阻滞于G0/G1期。Western blot结果显示,miR-186模拟物组中Cyclin D1(G1/S转换期的重要正向调控因子[29])的表达水平较对照组明显下降。这表明,miR-186基因过量表达引起U251细胞阻滞于G0/G1期,抑制细胞的有丝分裂,进而抑制胶质母细胞瘤增殖过程。
综上,本研究发现转染miR-186后,能显著降低胶质母细胞瘤U251细胞的增殖能力,并促进凋亡,显著提高细胞凋亡蛋白酶Caspase-3、Caspase-9的活力,降低细胞周期蛋白Cyclin D1的表达。说明,miR-186通过参与调控细胞凋亡和细胞周期途径而抑制胶质母细胞瘤U251的增殖能力。miR-186有望成为胶质母细胞瘤治疗的潜在标志物,为肿瘤治疗提供了新靶点及思路。
[1] Oike T,Suzuki Y,Sugawara K,et al.Radiotherapy plus concomitant adjuvant temozolomide for glioblastoma:Japanese mono-institutional results[J].PLoS One,2013,8(11):e78943..
[2] Cortez M A,Nicoloso M S,Shimizu M,et al.miR-29b and miR-125a regulate podoplanin and suppress invasion in glioblastoma[J].Genes Chromosomes Cancer,2010,49(11):981-990.
[3] Zhu S,Wu H,Wu F,et al.MicroRNA-21 targets tumor suppressor genes in invasion and metastasis[J].Cell Res,2008,18(3):350-359.
[4] Shibuya H,Iinuma H,Shimada R,et al.Clinicopathological and prognostic value of microRNA-21 and microRNA-155 in colorectal cancer[J].Oncology,2011,79(3/4):313-320.
[5] Brennecke J,Hipfner D R,Stark A,et al.bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila[J].Cell,2003,113(1):25-36.
[6] Wang M,Xia X,Chu W,et al.Roles of miR-186 and PTTG1 in colorectal neuroendocrine tumors[J].Int J Clin Exp Med,2015,8(12):22149-22157.
[7] He W,Feng J,Zhang Y,et al.microRNA-186 inhibits cell proliferation and induces apoptosis in human esophageal squamous cell carcinoma by targeting SKP2[J].Lab Inves,2016,96(3):317-324.
[8] Huang T,She K,Peng G,et al.MicroRNA-186 suppresses cell proliferation and metastasis through targeting MAP3K2 in non-small cell lung cancer[J].Int J Oncol,2016,49(4):1437-1444.
[9] 王健,顾兵,季珊维,等.乳腺癌组织中 cyclin D1 及 MCT-1 水平与患者化疗疗效,临床病理特征及预后的关系[J].山东医药,2016,56(45):67-69.
[10] 蒋欣,孙卫华,张亚军.子宫颈鳞状细胞癌组织中 β-catenin,CyclinD1 的表达变化及意义[J].山东医药,2013,53(27):17-19.
[11] Morishima N,Nakanishi K,Takenouchi H,et al.An endoplasmic reticulum stress-specific caspase cascade in apoptosis cytochrome C-independent activation of caspase-9 by caspase-12[J].J Biol Chem,2002,277(37):34287-34294.
[12] Omuro A,DeAngelis L M.Glioblastoma and other malignant gliomas:a clinical review[J].JAMA,2013,310(17):1842-1850.
[13] Thon N,Kreth S,Kreth F W.Personalized treatment strategies in glioblastoma:MGMT promoter methylation status[J].Onco Targets Ther,2013,6:1363-1372.
[14] Fang C,Wang K,Stephen Z R,et al.Temozolomide nanoparticles for targeted glioblastoma therapy[J].ACS Appl Mater Interface,2015,7(12):6674-6682.
[15] Pereira D M,Rodrigues P M,Borralho P M,et al.Delivering the promise of miRNA cancer therapeutics[J].Drug Discov Today,2013,18(5):282-289.
[16] Frankel L B,Christoffersen N R,Jacobsen A,et al.Programmed cell death 4 (PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells[J].J Biol Chem,2008,283(2):1026-1033.
[17] Liu C,Kelnar K,Liu B,et al.The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44[J].Nat Med,2011,17(2):211-215.
[18] Cai J,Wu J,Zhang H,et al.miR-186 downregulation correlates with poor survival in lung adenocarcinoma,where it interferes with cell-cycle regulation[J].Cancer Res,2013,73(2):756-766.
[19] Li H,Yin C,Zhang B,et al.PTTG1 promotes migration and invasion of human non-small cell lung cancer cells and is modulated by miR-186[J].Carcinogenesis,2013,34(9):2145-2155.
[20] Yao K,He L,Gan Y,et al.MiR-186 suppresses the growth and metastasis of bladder cancer by targeting NSBP1[J].Diagn Pathol,2015,10(1):146.
[21] Bold R J,Termuhlen P M,McConkey D J.Apoptosis,cancer and cancer therapy[J].Surg Oncol,1997,6(3):133-142.
[22] Gupta S.Molecular signaling in death receptor and mitochondrial pathways of apoptosis (Review)[J].Int J Oncol,2003,22(1):15-20.
[23] Wang X.The expanding role of mitochondria in apoptosis[J].Genes Dev,2001,15(22):2922-2933.
[24] Qi F,Inagaki Y,Gao B,et al.Bufalin and cinobufagin induce apoptosis of human hepatocellular carcinoma cells via Fas-and mitochondria-mediated pathways[J].Cancer Sci,2011,102(5):951-958.
[25] Evan G I,Vousden K H.Proliferation,cell cycle and apoptosis in cancer[J].Nature,2001,411(6835):342-348.
[26] Santamaria D,Ortega S.Cyclins and CDKS in development and cancer:lessons from genetically modified mice[J].Front Biosci,2005,11:1164-1188.
[27] Liu B,Zhou Z,Zhou W,et al.Resveratrol inhibits proliferation in human colorectal carcinoma cells by inducing G1/Sphase cell cycle arrest and apoptosis through caspase/cyclinCDK pathways[J].Mol Med Rep,2014,10(4):1697-1702.
[28] 傅寅佳,杨熹,曹小年,等.p53通过调控p55PIK抑制肝细胞癌SMMC-7721细胞的增殖[J].华中科技大学学报:医学版,2015,44(3):247-250.
[29] Lee H R,Mitra J,Lee S,et al.Kaposi’s sarcoma-associated herpesvirus viral interferon regulatory factor 4 (vIRF4) perturbs the G1-S cell cycle progression via deregulation of cyclin D1[J].J Virol,2015,90(2):1139-1143.
EffectofmiR-186onProliferationandApoptosisofGliblastomaCellsandItsMechanisms
Wan Chunhua1, Cai Jun2, Yang Shijiang2etal
1DepartmentofAnesthesiology2DepartmentofEmergencyTraumaSurgery,WuhanCentralHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430014,China
ObjectiveTo explore the role of miR-186 transfection in the proliferation and apoptosis of glioblastoma cells,as well as the regulatory mechanism.MethodsReal-time fluorescent quantitative PCR (qRT-PCR) was performed to detect the expression of miR-186 in glioblastoma cell line,U251 and U87-MG,and normal astrocyte cell line HA1800.The U251 cells were divided into miR-186 mimic group and control group,which were transfected with miR-186 mimics and scramble sequence,respectively.MiR-186 expression levels of these two groups were detected by qRT-PCR.Cell proliferation ability of the two groups was evaluated by CKK-8 assay.Cell apoptosis rate was analyzed by flow cytometry.Caspase-3,Caspase-8,Caspase-9,and Cyclin D1 protein levels were quantified by Western blotting.ResultsLower miR-186 levels were observed in glioblastoma U251 and U87-MG cells than in normal brain cell line.However,miR-186 level was significantly higher in miR-186 mimic group than in control group (P<0.01).After transfection for 24,48,72,and 96 h,A450 nmvalues were lower in the miR-186 mimic group than in the control group (allP<0.05).After transfection for 48 h,apoptosis rate was higher in the miR-186 mimic group than in the control group.Caspase-3 and Caspase-9 were significantly higher in the miR-186 mimic group than in the control group (bothP<0.01).However,there was no significant difference in the expression of Caspase-8 between miR-186 mimic group and control group(P>0.05).Cyclin D1 protein expression was significantly lower in the miR-186 mimic group than in the control group (P<0.01).ConclusionMiR-186 inhibits the proliferation and induces apoptosis of U251 cells via up-regulating Caspase-3 and 9 and down-regulating Cyclin D1.
miR-186; glioblastoma; proliferation; apoptosis
万春花,女,1977年生,主治医师,E-mail:wanchunhuahp@tom.com
△通讯作者,Correspondina author,E-mail:lintaojiang99@21cn.com
R739.41
10.3870/j.issn.1672-0741.2017.06.005
(2017-05-17 收稿)
