血浆Aβ40、Aβ42早期诊断广泛性脑萎缩并认知功能障碍的价值
2018-01-04申潇竹田昌荣
申潇竹 田昌荣 王 新
连云港市第二人民医院老年医学科,江苏 连云港 222006
·论著临床诊治·
血浆Aβ40、Aβ42早期诊断广泛性脑萎缩并认知功能障碍的价值
申潇竹 田昌荣 王 新
连云港市第二人民医院老年医学科,江苏 连云港 222006
目的探讨血浆Aβ40、Aβ42对广泛性脑萎缩并发认知功能障碍早期诊断的预测价值。方法对150例中、重度广泛性脑萎缩的老年人进行健康体检、磁共振成像扫描,记录性别、年龄、血压、甘油三酯、胆固醇、低密度脂蛋白、白蛋白等一般情况。按认知功能程度不同分为3组,正常组、轻度认知功能障碍(MCI)组、痴呆组。应用双抗体夹心酶联免疫吸附法测定血浆Aβ40、Aβ42含量。结果Aβ40、Aβ42水平在MCI组即已出现明显下降;Aβ40、Aβ42水平均与MMSE评分值呈正相关;Aβ40与Aβ42呈正相关。结论血浆Aβ40、Aβ42水平可以作为脑萎缩老年人早期诊断认知功能损害的生物学标记物。
淀粉样蛋白;广泛性脑萎缩;认知功能障碍;老年;生物学标记物
淀粉样蛋白(Amyloid-beta protein,Aβ)变性与认知功能的损害密切相关,Aβ具有很强的神经毒性,还可以诱导炎症反应、氧化应激、自由基损伤、脂质过氧化等导致突触减少,神经元缺损,神经网络破坏,继而出现中枢整合功能异常[1-2]。同时,大量产生的Aβ40和AβAβ42无法被小胶质细胞清除,可透过已遭到破坏的血脑屏障(Blood-brain barrier,BBB)进入到外周血液循环,而在血浆中被检测出[3-4]。随着病情的发展,越来越多的Aβ如沉积在脑实质和血管壁,外周血能检测到的Aβ40和Aβ42也会有所下降[5-6]。磁共振检查发现大脑存在广泛性脑萎缩(Global brain atrophy)结果往往给被检查者带来诸多疑虑,脑萎缩可以解释一部分已经发生痴呆者认知功能损害的原因,但无法解释另一部分脑萎缩老年人认知功能尚在正常范围[7]。这可能与不同个体之间老化进程存在差异有关。轻度认知功能损害(Mild cognitive impairment,MCI)是阿尔茨海默病治疗性干预措施的靶点之一,是介于正常老化与轻度痴呆间的一种中间过渡状态和痴呆的早期阶段[8-9]。本研究旨在探讨不同认知功能脑萎缩老年人血浆Aβ40和Aβ42含量差异,为老年广泛性脑萎缩预防认知功能损害提供线索。
1 资料与方法
1.1一般资料2010-01—2017-02在连云港市第二人民医院就诊或体检发现中、重度广泛性脑萎缩的老年人建立脑萎缩随访病源库,入库患者均能主动定期随访或电话通知返院随访依从性强,按照Excell随机生成数法,随机抽取150例。在这些患者返院随访或电话通知来院随访时签署知情同意书(课题设计已获得院内伦理委员会批准),自愿配合完成实验要求的量表测试及血浆生化值检测。
纳入标准:年龄≥60岁,磁共振成像(MRI)扫描存在中度到重度的广泛性脑萎缩,对本项研究知情同意。
排除条件:明显失明、耳聋及言语表达困难者;诊断精神分裂症、情感性障碍、器质性精神障碍及精神发育迟滞者;存在假性痴呆情况者(抑郁、谵妄、脑脓肿、脑瘤、甲状腺功能低下、垂体功能低下、维生素缺乏症、慢性肾功能衰竭和肝性脑病等);认知功能正常,但已服用胆碱酯酶抑制剂者。
分组条件:按认知功能不同分为3组,痴呆组48例,MCI组51例,正常组51例。痴呆诊断标准参考美国精神障碍诊断与统计手册(第4版),根据MMSE评分进行简易痴呆严重程度分级:文盲≤17分,小学程度≤20分,中学程度(包括中专)≤22分,大学程度(包括大专)≤23分。轻度≥21分,中度10~20分,重度≤9分。
1.2方法磁共振检测:采用西门子Magnetom Harmoney 1.5T磁共振成像扫描仪,测量X-Monro孔水平的侧脑室宽度和Y—Monro孔水平的头颅最大内横径,根据Vassilouthis法,计数Y/X值,5.0~6.5为轻度脑萎缩,4.0~5.0为中度脑萎缩,小于4.0为重度脑萎缩。
Aβ40、Aβ42浓度的检测:所有受试者取空腹静脉血5 mL,采血后1 H内4 000 r/min离心10 min分钟,分离血浆,分装入Appendoff管,并存入-80 ℃冰箱保存。标本采集工作结束后,统一进行Aβ40、Aβ42浓度的检测。采用上海酶研生物技术有限公司试剂盒,应用双抗体夹心酶联免疫吸附法(ELISA)测定。
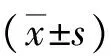
2 结果
2.1各组一般情况比较痴呆组、MCI组和正常组受试者性别、年龄、血压、甘油三酯、胆固醇、低密度脂蛋白、白蛋白、Y/X等一般情况比较未见明显差异;MCI组和痴呆组的MMSE均显著低于正常组,痴呆组MMSE显著低于MCI组(P<0.05)(见表1)。
2.2各组血浆Aβ40、Aβ42水平比较痴呆组和MCI组Aβ40、Aβ42水平均明显低于正常组(P<0.05);痴呆组Aβ42水平均明显低于MCI组(P<0.05,见表2)。
注:与正常组比较,*P<0.05;与MCI组比较,#P<0.05
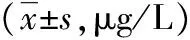
表2 各组Aβ40、Aβ42水平比较
注:与正常组比较,*P<0.05;与MCI组比较,#P<0.05
2.3 Aβ40、Aβ42与MMSE评分值逐步回归分析以MMSE评分值为自变量,血浆Aβ40、Aβ42值为因变量,行线性回归分析显示Aβ40、Aβ42均与MMSE评分值呈正相关(见表3)。
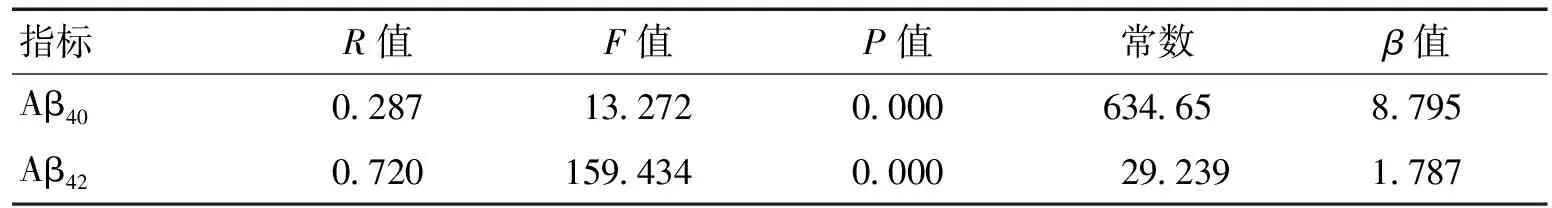
表3 Aβ40、Aβ42与MMSE逐步回归分析
2.4 Aβ40与Aβ42逐步回归分析以Aβ40为自变量,Aβ42为因变量行线性回归分析显示:血浆Aβ40与Aβ42值呈正相关(见表4)。
2.5 Aβ40、Aβ42各组性别间比较Aβ40、Aβ42各组性别间比较未见明显差异(见表5)。
2.6 Aβ40、Aβ42与年龄逐步回归分析以年龄为自变量,血浆Aβ40、Aβ42值为因变量,行线性回归分析显示:Aβ40、Aβ42与年龄无明显相关性(见表6)。

表4 Aβ40与Aβ42逐步回归分析
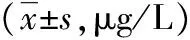
表5 Aβ40、Aβ42各组性别间比较
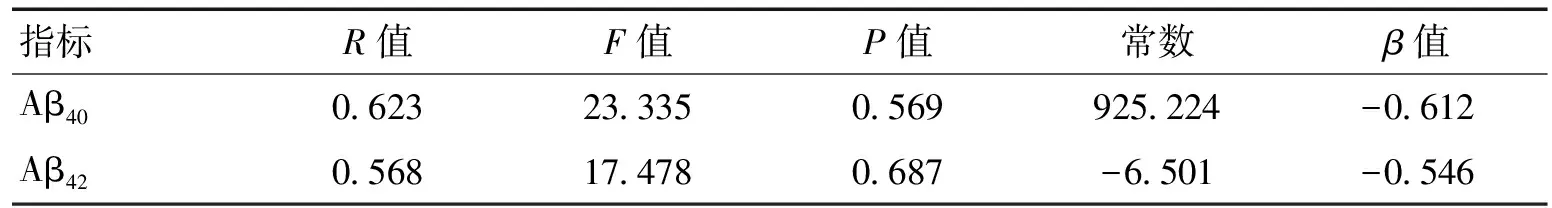
表6 Aβ40、Aβ42与年龄逐步回归分析
3 讨论
增龄导致的脑部影像学改变与阿尔茨海默病(AD)相关的脑影像学异常之间存在重叠,两者有时难以区分,但是很多人能够保持正常的认知功能[10-11]。不同个体之间病理生理可能存在差异。从脑萎缩老年人这一特定人群出发,寻找他们预防认知功能的途径目前国内外相关研究较少。Crawford等的研究[12]发现,Aβ42可明显增加血管收缩力,且不需要内皮细胞参与,Aβ在脑血管聚集致广泛血管壁淀粉样沉积,也是造成血管损伤的因素。因此,淀粉样变性被认为是血管性痴呆与阿尔茨海默病之间的桥梁,Aβ40和Aβ42在脑内清除在各个环节均可致认知功能损害。
外周血浆中可检测出Aβ,一方面与BBB功能下降脑内Aβ40和Aβ42外溢有关。BBB破坏的原因与Aβ诱发一系列炎性反应和氧化应激,作用于脑微循环血管内皮细胞,破坏内皮细胞间的紧密连接,增加血脑屏障的通透性和渗透性有关[13-14]。也有学者认为,Aβ可由全身组织的多种细胞产生,并分泌到细胞外,在血液、脑脊液与脑间质液之间循环[15-16]。BBB对于Aβ在脑内与血液之间的转运发挥关键作用,而这一转运作用是通过BBB上Aβ受体介导的。如晚期糖基化终末产物受体(RAGE)介导Aβ单项的向脑内流入的转胞作用[17-18]。低密度脂蛋白受体相关蛋白(LRP)中LRP-1通过内吞和转胞吞作用将Aβ转运出脑,是介导Aβ从脑内跨BBB清除的主要受体,LRP-2介导Aβ流入或流出大脑的双向转运[19]。P-糖蛋白、乳腺癌耐药相关蛋白通过限制血液内Aβ向脑内的流入,介导血脑屏障内皮细胞中Aβ流出来减少在脑内的聚集[20]。
本研究发现,痴呆组和MCI组Aβ40、Aβ42水平均明显高于正常组;痴呆组Aβ42水平均明显高于MCI组,Aβ40、Aβ42水平均与MMSE评分值呈正相关,Aβ40与Aβ42呈正相关。Vemuri P等[21]评估了Aβ和Aβ42/Aβ40比率作为Alzheimer病和MCI健忘型的可能生物标志。分别分析时,Aβ42和Aβ40水平与Alzheimer病或MCI风险不相关。随着年龄的增长,淀粉样蛋白积聚和神经系统退行性改变几乎是不可避免的,但是很多人能够保持正常的认知功能(虽然有影像学改变)[22]。Aβ40、Aβ42与年龄无明显相关性。且Aβ40、Aβ42各组性别间比较未见明显差异。
由本研究得出结论,Aβ40、Aβ42水平在MCI组即已出现明显下降,Aβ40、Aβ42水平均与MMSE评分值呈正相关,Aβ40与Aβ42呈正相关,提示Aβ40、Aβ42水平可以作为脑萎缩老年人早期诊断AD的生物学标记物。
[1] Luo X,Shi H,Hou L,et al.Different cerebrospinal fluid levels of Alzheimer-type biomarker Aβ42 between general paresis and asymptomatic neurosyphilis[J].Eur J Neurol,2015,22(5):853-858.
[2] LeahZuroff,David Daley,Keith L.Clearance of cerebral Aβ in Alzheimer’s disease:reassessing the role of microglia and monocytes[J].Cellular and Molecular Life Sciences,2017,74(6):2 167-2 201.
[3] Takahashi RH,Nagao T,Gouras GK.Plaque formation and the intraneuronal accumulation of β-amyloid in Alzheimer's disease[J].Pathol Int,2017,67(4):185-193.
[4] Zandl-Lang M,Fanaee-Danesh E,Sun Y,et al.Regu-latory effects of simvastatin and apoJ on APP processing and amyloid-β clearance in blood-brain barrier endothelial cells[J].Biochim Biophys Acta,2017,1 863(1):40-60.
[5] Huijbers W,Mormino EC,Schultz AP,et al.Amy-loid-β deposition in mild cognitive impairment is associated with increased hippocampal activity,atrophy and clinical progression[J].Brain,2015,138(Pt 4):1 023-1 035.
[6] Held F,Morris AWJ,Pirici D,et al.Vascular basement membrane alterations and β-amyloid accumulations in an animal model of cerebral small vessel disease[J].Clin Sci,2017,131(10):1 001-1 013.
[7] Khanal B,Lorenzi M,Ayache N,et al.A biophysical model of shape changes due to atrophy in the brain with Alzheimer's disease[J].Med Image Comput Comput Assist Interv,2014,17(Pt 2):41-48.
[8] Zheng L,Vinters HV,Mack WJ,et al.Differential effects of ischemic vascular disease and Alzheimer's disease on brain atrophy and cognition[J].J Cereb Blood Flow Metab,2016,36(1):204-215.
[9] Gomar JJ,Ragland JD,Ulugˇ AM,et al.Differential medial temporal lobe morphometric predictors of item-and relational-encoded memories in healthy individuals and in individuals with mild cognitive impairment and Alzheimer's disease[J].Alzheimers Dement (N Y),2017,3(2):238-246.
[10] Wiepert DA,Lowe VJ,Knopman DS,et al.A robust biomarker of large-scale network failure in Alzheimer's disease[J].Alzheimers Dement (Amst),2017,25(6):152-161.
[11] Weiner MW,Harvey D,Hayes J,et al.Effects of traumatic brain injury and posttraumatic stress disorder on development of Alzheimer's disease in Vietnam Vete-rans using the Alzheimer's Disease Neuroimaging Initiative:Preliminary Report[J].Alzheimers Dement (N Y),2017,3(2):177-188.
[12] Do Carmo S,Crynen G,Paradis T,et al.Hippocampal Proteomic Analysis Reveals Distinct Pathway Deregulation Profiles at Early and Late Stages in a Rat Model of Alzheimer's-Like Amyloid Pathology[J].Mol Neurobiol,2017,13(5):1-16.
[13] Keaney J,Campbell M.The dynamic blood-brain bar-rier[J].FEBS J,2015,282(21):4 067-4 079.
[14] Gosselet F,Saint-Pol J,Fenart L.Effects of oxysterols on the blood-brain barrier:implications for Alzheimer's disease[J].Biochem Biophys Res Commun,2014,446(3):687-691.
[15] Jose M,Farfel,Lei Yu,et al.Association of APOE with Tau-Tangle Pathology with and without β-amyloid[J].Neurobiol Aging,2016,37:19-25.
[16] Yi X,Yuan D,Farr SA,et al.Pluronic modified leptin with increased systemic circulation,brain uptake and efficacy for treatment of obesity[J].J Control Release,2014,191(10):34-46.
[17] Deane R1,Singh I,Sagare AP,et al.A multimodal RAGE-specific inhibitor reduces amyloid β-mediated brain disorder in a mouse model of Alzheimer disease[J].J Clin Invest,2012,122(4):1 377-1 392.
[18] Cui W,Liu R,Jin H,et al.pH gradient difference around ischemic brain tissue can serve as a trigger for delivering polyethylene glycol-conjugated urokinase nanogels[J].J Control Release,2016,225(4):53-63.
[19] de Oliveira J,Moreira EL,dos Santos DB,et al.Incre-ased susceptibility to amyloid-β-induced neurotoxicity in mice lacking the low-density lipoprotein receptor[J].J Alzheimers Dis,2014,41(1):43-60.
[20] Nordestgaard LT,Tybjrg-Hansen A,Nordestgaard BG,et al.Loss-of-function mutation in ABCA1 and risk of Alzheimer's disease and cerebrovascular disease[J].Alzheimers Dement,2015,11(12):1 430-1 438.
[21] Vemuri P,Knopman DS,Lesnick TG,et al.Evaluation of Amyloid Protective Factors and Alzheimer Disease Neurodegeneration Protective Factors in Elderly Individuals[J].JAMA Neurol,2017,74(6):718-726.
[22] Mormino EC.The relevance of beta-amyloid on mark-ers of Alzheimer's disease in clinically normal individu-als and factors that influence these associations[J].Neuropsychol Rev,2014,24(3):300-312.
PredictivevalueofplasmaAβ40andAβ42inearlydiagnosisofgeneralizedbrainatrophycomplicatedwithcognitivedysfunction
SHENXiaozhu,TIANChangrong,WANGXin
DepartmentofGeriatrics,NO.2People'sHospitalofLianyungang,Lianyungang222006,China
ObjectiveTo evaluate the predictive value of plasma Aβ40and Aβ42in early diagnosis of generalized brain atrophy complicated with cognitive dysfunction.MethodsA total of 150 elderly patients with moderate and severe brain atrophy were examined by physical examination,magnetic resonance imaging,sex,age,blood pressure,triglyceride,cholesterol,low density lipoprotein,albumin and other general conditions.Subjects were divided into three groups according to the degree of cognitive function,normal group,mild cognitive impairment (MCI) group,dementia group.The levels of plasma Aβ40and Aβ42were measured by double antibody sandwich enzyme-linked immunosorbent assay.ResultsAβ40,Aβ42levels were significantly decreased in the MCI group;Aβ40,Aβ42levels were positively correlated with MMSE score;Aβ40was positively correlated with Aβ42.ConclusionPlasma Aβ40and Aβ42levels can be used as early biomarkers for the diagnosis of cognitive dysfunction in brain atrophy.
Amyloid-beta protein;Global brain atrophy;Cognitive dysfunction;Elderly;Biomarker
10.3969/j.issn.1673-5110.2017.22.018
连云港市“521高层次人才培养工程”科研项目(75)
申潇竹(1982—),硕士,主治医师。研究方向:老年神经系统疾病。Email:tinasxz@aliyun.com
R749.1
A
1673-5110(2017)22-0068-04
(收稿2017-08-02)
王喜梅
