随意跑轮运动预适应对实验性溃疡性结肠炎小鼠结肠miR-214/PTEN信号环路的影响
2018-01-04孟宪欣葛吉生王希柳王晨宇马延超
孟宪欣,葛吉生,王希柳,王晨宇,马延超
MENG Xian-xin1,GE Ji-sheng1,WANG Xi-liu1,WANG Chen-yu2,MA Yan-chao3
随意跑轮运动预适应对实验性溃疡性结肠炎小鼠结肠miR-214/PTEN信号环路的影响
孟宪欣1,葛吉生1,王希柳1,王晨宇2,马延超3
MENG Xian-xin1,GE Ji-sheng1,WANG Xi-liu1,WANG Chen-yu2,MA Yan-chao3
目的:观察8周随意跑轮运动预适应对葡聚糖硫酸钠(DSS)诱导的C57BL/6小鼠实验性溃疡性结肠炎(UC)的影响,并探讨miR-214/PTEN信号环路在其间的可能作用机制。方法:40只雄性C57BL/6小鼠随机分为4组:安静组对照组(SED-CON)、安静组造模组(SED-DSS)、运动对照组(EXE-CON)、运动造模组(EXE-DSS)。SED-CON组和SED-DSS组大鼠安静饲养8周,EXE-CON组和EXE-DSS组进行8周随意跑轮运动。随后各造模组自由饮用3.5% DSS溶液诱导小鼠UC模型,各对照组自由饮用同等量的蒸馏水。每天观察并记录体重和疾病活动指数(DAI),7天后处死小鼠,取结肠观察组织病理学变化并进行组织损伤评分,检测IL-1β、IL-6、TNF-α、miR-214、PTEN、STAT3和Akt基因表达量以及NF-κB活性。结果:与SED-DSS组比较,EXE-DSS组小鼠临床症状改善(即体重增加、DAI降低、促炎症因子表达下调、结肠组织损伤减轻)。分子生物学测定发现:与SED-DSS组比较,EXE-DSS组miR-214,Akt、STAT3、IL-6表达量以及NF-κB活性降低(P<0.05),PTEN mRNA和蛋白表达量升高(P<0.05)。结论:长期随意跑轮运动预适应能够对DSS诱导的C57BL/6小鼠实验性UC起保护效应,其机制可能与部分恢复miR-214/PTEN信号环路功能有关。
运动预适应;溃疡性结肠炎;微小核糖核酸-214;PTEN;炎症反应;信号通路
炎症性肠病(inf l ammatory bowel disease,IBD)是一组病因和发病机制尚未明确的慢性非特异性肠道炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)两大类[35]。UC为IBD中常见类型,以结肠黏膜慢性炎症、溃疡形成和出血为主要病理特点,以腹痛、腹泻、黏液脓血便等为主要临床症状,其病程缓慢、反复发作、轻重不一,长期不愈可发展为结直肠癌[10],严重影响患者的健康与生活质量并增加社会医疗资源负担[21]。UC作为一种特发性疾病(idiopathic disorder),环境与遗传因素的相互作用以及肠道微生物代谢紊乱,从而破坏肠道生物屏障,引发炎症反应,此为UC的主要发病机制。针对UC目前尚无有效的根治手段,临床治疗主要包括药物和手术,但效果并不理想,且副作用大易复发[45]。因此,深入研究UC的关键机制,寻找干预靶点,探索作用持久且副作用小的治疗策略以减轻UC症状、降低住院率和癌变风险进而改善患者生活质量是亟待解决的课题。
微小核糖核酸(microRNAs,miRNAs)是一类大小为18~25 bp高度保守的非编码单链小分子RNA,miRNAs接受大量转录因子调控,通过与靶基因mRNA的3’端非翻译区(untranslated region,UTR)片段互补或部分互补,引起靶基因mRNA的降解或抑制其翻译,广泛负调控靶基因表达,调节生命活动和疾病发生[46]。每种miRNA可调节数百种mRNA的表达,对超过1/3的蛋白编码基因进行转录后调控,广泛参与个体发育、细胞增殖、分化、炎性反应、纤维化和凋亡等过程,可能导致人类多种疾病,如肿瘤、自身免疫性疾病、糖尿病、心血管疾病和肝脏疾病等。最近的一项研究发现[42],UC患者MicroRNA-214(miR-214)表达水平上调并通过抑制PTEN(phosphatase and tensin homology deleted on chromosome ten, 10号染色体有缺失的磷酸酶及张力蛋白同源蛋白)而激活Akt/核因子-κB (nuclear factor-κB,NF-κB)/白细胞介素6(interleukin 6,IL-6)/信号转导和转录活化蛋白3(signal transducer and activator of transcription 3,STAT3)——(Akt/NF-κB/IL-6/STAT3)炎症信号通路,STAT3作为miR-214的转录因子反过来又进一步促进miR-214表达,这一信号环路在UC发生发展过程中起重要作用。
规律运动可通过抗炎机制对诸多慢性炎症相关疾病产生辅助治疗或预防作用[11,23,24]。我们前期的研究发现[4-7],有氧运动可下调缓解期UC患者炎症因子,提示运动改善UC与抑制炎症反应有关。运动抗炎效应的具体分子机理尚未明确。本研究基于前期工作,以炎症反应及miR-214/PTEN信号环路对UC的调控为切入点,从整体、器官、细胞、分子、基因等多个层面观察并探讨8周随意跑轮运动预适应对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导C57BL/6小鼠实验性UC的作用及机制。
1 材料与方法
1.1 实验动物及分组
8周龄清洁级健康雄性C57BL/6小鼠40只,反相明暗周期(reverse light-dark cycle)饲养,自由进食水。适应环境1周后先随机分为4组(每组n=10):1)安静对照组(sedentary control,SED-CON),安静饲养8周后自由饮用蒸馏水7天;2)安静 造模组(sedentary DSS,SED-DSS),安静饲养8周后自由饮用3.5% DSS溶液7天进行UC造模;3)运动对照组(exercise control,EXE-CON),进行8周随意跑轮运动后自由饮用蒸馏水7天;4)运动造模组(exercise DSS,EXEDSS),进行8周随意跑轮运动后自由饮用3.5% DSS溶液7 d进行UC造模。末次实验结束后48 h取材。
1.2 运动预适应方案
各运动组(EXE-CON组、EXE-DSS组)放于含有跑轮的饲养笼内进行8周随意跑轮运动,5天/周(休息日将跑轮固定),不控制运动强度和运动时间。各对照组(SED-CON组和SED-DSS组)大鼠安静饲养8周。
1.3 UC造模方法
称取3.5 g DSS粉末溶于100 mL双蒸水中制备3.5%DSS溶液。各模型组(SED-DSS组、EXE-DSS组)动物自由饮用3.5% DSS溶液7 d诱导小鼠实验性UC模型,相应对照组(SED-CON组、EXE-CON组)自由饮用同等量的蒸馏水溶液。
1.4 一般情况观察与取材
造模过程中,每日观察小鼠精神、活动、毛发、饮食等一般情况,详细记录每只小鼠的体重变化、大便性状以及隐血情况(大便隐血采用联苯胺法检测)。参照Cooper等[18]的经典评分方法,将体重下降、大便性状和便血情况的评分相加后取平均数,作为UC疾病活动指数(disease activity index,DAI),即DAI=(体重下降分数+大便性状分数+便血情况分数)/3。实验结束后处死动物,取整段结肠(回盲部至肛门),测量全结肠长度(精确至0.1 cm)。取部分结肠进行组织病理学观察,剩余结肠组织用预冷PBS冲洗干净后,迅速置于液氮中,然后转入-80 ℃低温冰箱保存待测基因表达。
1.5 组织病理学观察与组织损伤评分
取结肠沿肠系膜纵向剖开,用预冷无菌生理盐水冲洗干净后,经4%甲醛固定、包埋、切片(4 μm)后行HE染色。光镜下观察肠黏膜损伤情况(组织结构改变,隐窝损坏程度及丢失情况,炎性细胞浸润等),参照Cooper等[18]的经典组织损伤分级标准,对结肠病变进行组织损伤评分。
1.6 mRNA表达水平检测
采用实时荧光定量PCR检测结肠炎症因子和PTEN mRNA表达。结肠组织匀浆后,用Trizol试剂盒(Qiagen,德国)提取总RNA,琼脂糖凝胶电泳检测RNA完整性、分光光度计检测RNA纯度(A260/A280在1.9~2.2 )和浓度。取总RNA 2 μg利用逆转录试剂盒(Qiagen,德国)进行逆转录生成cDNA。用实时荧光定量PCR仪(7300HT Fast,ABI美国)分别检测白细胞介素1β(interleukin 1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)和PTEN以及β-actin(内参基因)mRNA表达水平。引物序列见表1所示。PCR采用反应体系为(10 μL):上下游引物各0.4 μL,cDNA 1.5 μL,双蒸水7.7 μL。反应参数为:预变性95℃ 1 min;95℃ 15 s,58 ℃ 60 s,72 ℃ 15 s,共40个循环。记录循环数(Ct值),基因表达的扩增倍数以2-△Ct表示,△Ct=Ct目的基因-Ctβ-actin,计算相对表达量(SED-CON组的倍数)。

表1 基因引物序列Table 1 Gene Primer Sequence
1.7 miR-214表达量检测
参照文献[8],采用miRNA专用试剂盒(Sigma公司,美国)提取结肠总RNA。取2 μg总RNA利用One Step PrimeScript miRNA cDNA Synthesis Kit(Sigma公司,美国)逆转录为cDNA,反应条件:37 ℃反应1 h后95 ℃加热5 min灭活逆转录酶。采用SYBR Premix Ex TaqTMII(Perfect Real Time)试剂盒(Sigma公司,美国)用实时荧光定量PCR仪(7300HT Fast,ABI美国)检测miR-214的表达量。反应体系为20 μL:SYBR混合试剂10 μL,引物2 μL(引物序 列:5’-TAAGGCACGGTGAATGCC-3’),c DNA 1 μL,Nuclease-Free Water 7 μL;反应条件:95 ℃ 10 min,(95 ℃10 s、60 ℃ 1 min),共40个循环,使 用U6(引物序 列:5’-TGCGGGTGCTCGCTTCGGCAGC-3’)作为内参。应用Ct值法计算目的基因的表达量(2-△△Ct)。
1.8 蛋白表达水平检测
采用Western Bolt法检测结肠蛋白表达水平。结肠组织匀浆后,提取总蛋白,用考马斯亮兰法测定蛋白含量。蛋白样品经15% SDS-PAGE分离并转移至PVDF膜。一抗(IL-1β、IL-6、TNF-α、p-STAT3、STAT3、p-Akt、Akt、p-PTEN和PTEN)(注:“p-”为该蛋白的磷酸化形式)(Santa cruz公司)孵育过夜,HRP标记二抗(TBD公司)孵育1 h,ECL显影。采用凝胶系统分析软件扫描各条带灰度值,以β-actin为内参蛋白,计算相对表达量(SED-CON组的倍数)。
1.9 NF-κB活性检测
结肠组织匀浆后,用Nuclear Extract Kit(美国Pierce公司)提取核蛋白,考马斯亮兰法测定蛋白含量。参照文献[2,3],利用TransAMTMNF-κB p65活性检测试剂盒(Sigma公司)检测NF-κB p65与DNA结合活性,其中一抗(NF-κB p65 抗体)(1:1 000)孵育过夜,HRP标记二抗孵育1 h,用450 nm波长吸光度值表示NF-κB活性(OD 450 nm)。
1.10 统计学分析
使用SPSS 20.0进行统计学分析。所有数据以“均数±标准差”表示。采用双因素方差分析进行主效应和交互作用(运动×模型)检验,多重比较使用LSD检验。统计学检验水准为P=0.05。
2 结果
由于造模失败、运动过程中拒跑、死亡等原因,共剔除2只动物,最终纳入统计的小鼠为38只,各组样本量分别为:SED-CON组(n=10)、SED-DSS组(n=10)、EXE-CON组(n=9)、EXE-DSS组(n=9)。
2.1 临床症状的变化
体重:主效应(F造模=860.544,P=0.000;F运动=28.257,P=0.000)以及交互作用(F造模×运动=140.908,P=0.000)对体重的影响均有统计学意义;多重比较显示,造模过程中SED-DSS组体重低于SED-CON组(P=0.000),而EXE-DSS组则高于SED-DSS组(P=0.015,图1a)。

图1 造模期间大鼠体重 (a) 、DAI(b) 以及造模后大鼠结肠长度 (c) 的变化Figure 1. Change of Body Weight (a),DAI (b) during Modelling and Length of Colon (c) after Modelling
DAI:造模前,各组DAI均为0。造模期间,SED-CON和EXE-CON组DAI均为0;SED-DSS组出现典型的UC临床表现(第4天开始出现体重下降,第3天开始出现腹泻、直肠出血,第5天后所有小鼠均出现腹泻和直肠出血;小鼠蜷缩少动,皮毛凌乱,无光泽,精神萎靡),EXE-DSS组小鼠的生长状况、毛色、精神及活动度较SED-DSS组健康,其腹泻、便血症状均有不同程度的减轻。统计结果显示,主效应(F造模=4259.328,P=0.000;F运动=43.387,P=0.000)以及交互作用(F造模×运动=43.387,P=0.000)对DAI的影响均有统计学意义;多重比较显示,造模过程中SED-DSS组DAI高于SED-CON组(P=0.000),而EXE-DSS组则低于SEDDSS组(P=0.003,图1b)。
结肠长度:各组结肠长度分别为SED-CON组(7.81±1.12 cm)、EXE-CON组(7.93±1.50 cm)、SED-DSS组(6.11±0.79 cm)和EXE-DSS组(7.69±0.98 cm);统计结果显示,造模主效应(F造模=11.394,P=0.002)对体重的影响具有统计学意义,运动主效应F运动=0.642,P=0.428)以及交互作用(F造模×运动=0.317,P=0.577)则无统计学差异;多重比较显示,SED-DSS组结肠长度低于SED-CON组(P=0.009),而SED-DSS和EXE-DSS组则无显著性差异(P=0.354,图1c)。
2.2 组织病理学改变与结肠组织损伤评分
结肠病理学改变见图2。SED-CON和EXE-CON组结肠黏膜结构完整,上皮细胞排列规则,腺体完整,隐窝正常,无充血水肿、糜烂溃疡及炎症细胞浸润等炎症性病变。SED-DSS组黏膜缺失,腺体多数不完整,隐窝破坏,炎症细胞广泛浸润,呈典型炎症改变。与SED-DSS组比较,EXEDSS组表现为炎症浸润减轻、上皮损伤以及黏膜隐窝破坏减少。
结肠组织损伤评分见图3。各组结肠组织损伤评分分别为SED-CON组0.11±0.03、EXE-CON组0.15±0.05、SEDDSS组2.81±0.79和EXE-DSS组1.90±0.88;统计结果显示,主效应(F造模=177.745,P=0.000;F运动=5.298,P=0.028)以及交互作用(F造模×运动=7.200,P=0.011)对结肠组织损伤评分的影响均有统计学意义;多重比较显示,SED-DSS组结肠组织损伤评分高于SED-CON组(P=0.000),而EXEDSS组则低于SED-DSS组(P=0.002)。
2.3 结肠炎症因子基因表达的变化
各组结肠IL-1β mRNA表达量分别为SED-CON组1.00±0.38、EXE-CON组1.04±0.25、SED-DSS组2.89±0.59和EXE-DSS组2.15±0.43;统计结果显示,主效应(F造模=118.413,P=0.000;F运动=6.503,P=0.015)以及交互作用(F造模×运动=7.975,P=0.008)对结肠IL-1β mRNA表达量的影响均有统计学意义;多重比较显示,SED-DSS组结肠IL-1β mRNA表达量高于SED-CON组(P=0.000),而EXE-DSS组则低于SED-DSS组(P=0.001,图4a)。
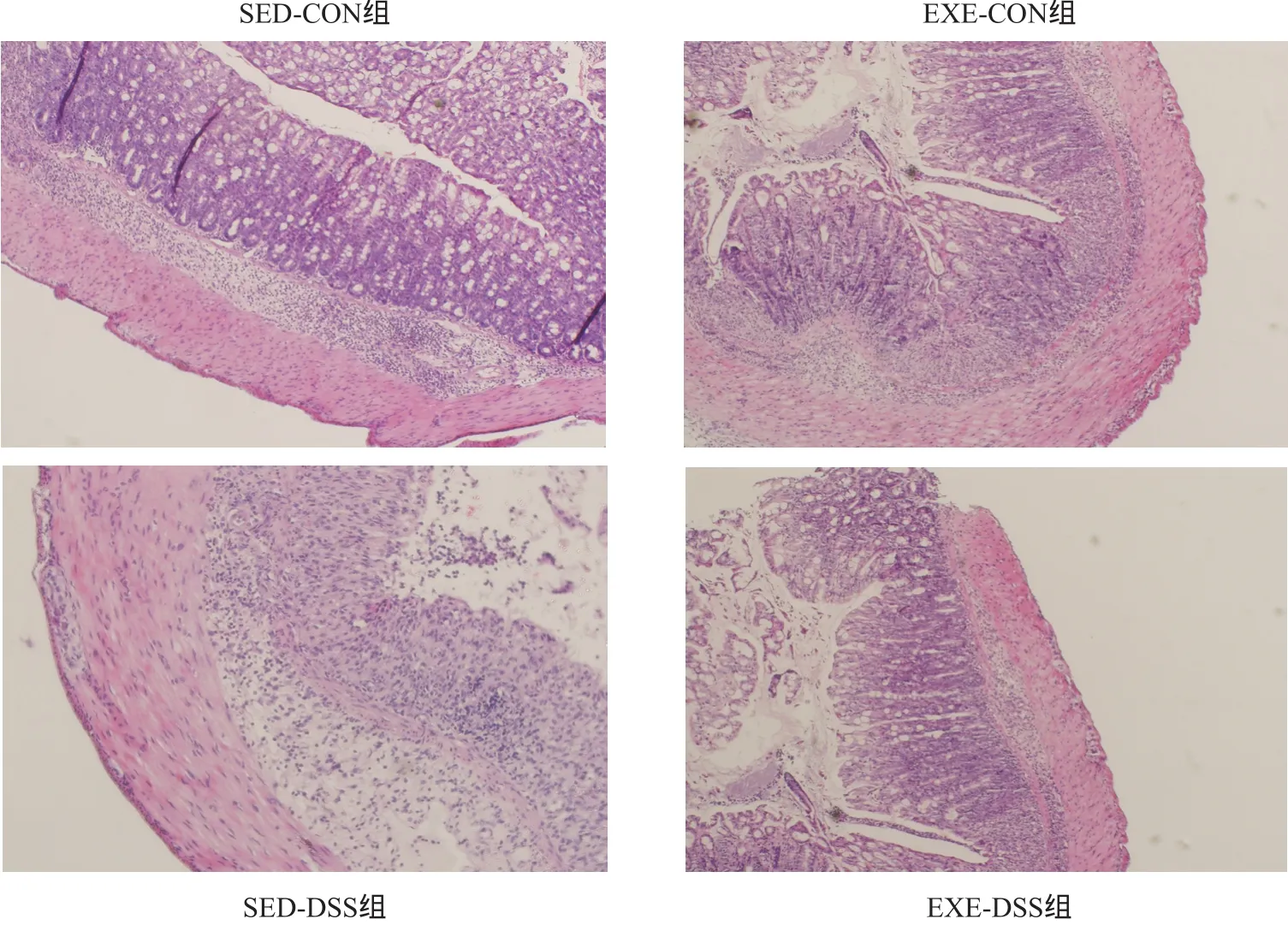
图2 结肠组织病理学观察 (HE染色,×200)Figure 2. Histopathology of Colon (HE staining,×200)

图3 结肠组织损伤评分Figure 3. Tissue Damage Score of Colon
各组结肠IL-6 mRNA表达量分别为SED-CON组1.00±0.26、EXE-CON组1.07±0.19、SED-DSS组7.95±2.18和EXE-DSS组6.15±1.82;统计结果显示,模型主效应(F造模=177.889,P=0.000)以及交互作用(F造模×运动=4.277,P=0.046)对结肠IL-6 mRNA表达量的影响均有统计学意义,而运动主效应(F运动=3.660,P=0.064)则无统计学差异;多重比较显示,SED-DSS组结肠IL-6 mRNA表达量高于SED-CON组(P=0.000),而EXE-DSS组则低于SED-DSS组(P=0.010,图4b)。
各组结肠TNF-α mRNA表达量分别为SED-CON组 1.01±0.22、EXE-CON 组 1.05±0.29、SED-DSS 组5.77±1.65和EXE-DSS组5.32±2.30;统计结果显示,模型主效应(F造模=101.804,P=0.000)对结肠TNF-α mRNA表达量的影响有统计学意义,而运动主效应(F运动=0.208,P=0.651)以及交互作用(F造模×运动=0.322,P=0.574)则无统计学差异;多重比较显示,SEDDSS组结肠TNF-α mRNA表达量高于SED-CON组(P=0.000),而EXE-DSS组与SED-DSS组则无显著性差异(P=0.485,图4c)。
各组结肠IL-1β蛋白表达量分别为SED-CON组1.00±0.23、EXE-CON组0.94±0.27、SED-DSS组3.27±0.82和EXE-DSS组2.94±0.77;统计结果显示,模型主效应F造模=129.687,P=0.000对结肠IL-1β蛋白表达量的影响有统计学意义,但运动主效应(F运动=1.139,P=0.293)以及交互作用(F造模×运动=0.537,P=0.469)则无统计学差异;多重比较显示,SED-DSS组结肠IL-1β蛋白表达量高于SED-CON组(P=0.000),而EXE-DSS组与SED-DSS组则无显著性差异(P=0.223,图5a)。
各组结肠IL-6蛋白表达量分别为SED-CON组1.01±0.38、EXE-CON组0.98±0.33、SED-DSS组6.83±1.83和EXE-DSS组4.37±1.76;统计结果显示,主效应(F造模= 126.821,P=0.000;F运动=9.198,P=0.005)以及交互作用(F造模×运动=8.823,P=0.005)对结肠IL-6蛋白表达量的影响均有统计学意义;多重比较显示,SED-DSS组结肠IL-6蛋白表达量高于SED-CON组(P=0.000),而EXEDSS组则低于SED-DSS组(P=0.000,图5b)。
各组结肠TNF-α蛋白表达量分别为SED-CON组1.00±0.37、EXE-CON组0.96±0.29、SED-DSS组3.22±1.06和EXE-DSS组2.99±0.77;统计结果显示,模型主效应(F造模=91.073,P=0.000)对结肠TNF-α蛋白表达量的影响有统计学意义,而运动主效应(F运动=0.358,P=0.554)以及交互作用(F造模×运动=0.176,P=0.677)则无统计学差异;多重比较显示,SED-DSS组结肠TNF-α蛋白表达量高于SED-CON组(P=0.000),而EXE-DSS组与SED-DSS组则无显著性差异(P=0.484,图5c)。

图4 IL-1β(a)、IL-6(b)和TNF-α(c)mRNA表达量Figure 4. IL-1β (a),IL-6 (b) and TNF-α (c) mRNA Expression

图5 IL-1β(a)、IL-6(b)和TNF-α(c)蛋白表达量Figure 5. IL-1β (a),IL-6 (b) and TNF-α (c) Protein Expression
2.4 miR-214/PTEN信号环路中各信号分子基因表达变化

图6 miR-214/PTEN信号环路中miR-214(a)、PTEN(b、c)、Akt(d)、NF-κB(e)和STAT3(f)表达量的变化Figure 6. Expression of miR-214 (a),PTEN (b,c),Akt (d),NF-κB (e) and STAT3 (f) in miR-214/PTEN Signal Circuit Pathway
各组结肠miR-214表达量分别为SED-CON组 1.01±0.20、EXE-CON 组 0.75±0.13、SED-DSS 组5.33±1.41和EXE-DSS组3.95±1.21;统计结果显示,主效应(F造模=161.720,P=0.000;F运动=7.725,P=0.009)以及交互作用(F造模×运动=3.591,P=0.047)对结肠miR-214表达量的影响均有统计学意义;多重比较显示,SED-DSS组结肠miR-214表达量高于SED-CON组(P=0.000),而EXEDSS组则低于SED-DSS组(P=0.003,图6a)。
各组结肠PTEN mRNA表达量分别为SED-CON组1.01±0.13、EXE-CON组0.99±0.22、SED-DSS组0.49±0.11和EXE-DSS组(0.72±0.10);统计结果显示,主效应(F造模=67.425,P=0.000;F运动=4.563,P=0.040)以及交互作用(F造模×运动=6.650,P=0.014)对结肠PTEN mRNA表达量的影响均有统计学意义;多重比较显示,SED-DSS组结肠PTEN mRNA表达量低于SED-CON组(P=0.000),而EXEDSS组则高于SED-DSS组(P=0.013,图6b)。
各组结肠PTEN蛋白(p-PTEN/PTEN)表达量分别为SED-CON组1.00±0.50、EXE-CON组1.05±0.29、SED-DSS组0.51±0.14和EXE-DSS组0.86±0.11;统计结果显示,主效应(F造模=12.856,P=0.001;F运动=4.234,P=0.047)对结肠PTEN蛋白表达量的影响均有统计学意义,但交互作用(F造模×运动=2.501,P=0.123)无显著性差异;多重比较显示,SED-DSS组结肠PTEN蛋白表达量低于SED-CON组(P=0.001),而EXE-DSS组则高于SED-DSS组(P=0.017,图6c)。
各组结肠Akt蛋白表达量(p-Akt/Akt)分别为SEDCON组 1.00±0.35、EXE-CON组 1.04±0.23、SED-DSS组5.70±1.65和EXE-DSS组3.78±1.31;统计结果显示,主效应(F造模=119.947,P=0.000;F运动=7.774,P=0.009)以及交互作用(F造模×运动=8.356,P=0.007)对结肠Akt蛋白表达量的影响均有统计学意义;多重比较显示,SED-DSS组结肠Akt蛋白表达量高于SED-CON组(P=0.000),而EXEDSS组则低于SED-DSS组(P=0.000),图6d)。
各组结肠NF-κB活性分别为SED-CON组0.30±0.09、EXE-CON组0.24±0.11、SED-DSS组0.88±0.11和EXE-DSS组0.68±0.18;统计结果显示,主效应(F造模=154.389,P=0.000;F运动=9.975,P=0.003)对结肠NF-κB活性表达量的影响有统计学意义,但交互作用(F造模×运动=2.703,P=0.109)并无显著性差异;多重比较显示,SED-DSS组结肠NF-κB活性高于SED-CON组(P=0.000),而EXE-DSS组则低于SED-DSS组(P=0.002),图6e)。
各组结肠STAT3蛋白表达量(p-STAT3/ STAT3)分别为SED-CON组1.00±0.31、EXE-CON组1.03±0.20、SED-DSS组7.70±0.93和EXE-DSS组6.41±1.41;统计结果显示,主效应(F造模=488.365,P=0.000;F运动=5.275,P=0.028)以及交互作用(F造模×运动=5.795,P=0.022)对结肠STAT3蛋白表达量的影响均有统计学意义;多重比较显示,SED-DSS组结肠STAT3蛋白表达量高于SEDCON组(P=0.000),而EXE-DSS组则低于SED-DSS组(P=0.003,图6f)。
3 讨论
本研究成功建立DSS诱导实验性UC模型并发现,8周随意跑轮运动预适应能够减轻UC小鼠促炎症因子过表达并改善临床症状,其机制可能与下调miR-214、上调PTEN表达并部分恢复miR-214/PTEN信号转导环路功能有关。
3.1 随意跑轮运动对UC的保护效应
有关运动与UC关系中,病例对照研究显示,体力活动减少是UC的重要危险因素[14,25,43],但前瞻性研究结论并不一致。人体研究认为,运动可缓解UC病情[4-7,19,20,29]或无明显作用[15,27,40];动物实验发现,中等强度跑台运动(强制运动)[13]和随意跑轮运动[17,33,44]均可减轻三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)诱导的大鼠结肠炎症状并降低炎症因子表达,而Cook等[17]和Allen等[9]以DSS诱导UC小鼠为模型,发现强制运动加重结肠炎病情、上调炎症因子表达并增加死亡率,而随意跑轮运动则减轻患鼠症状并下调炎性介质,其机制可能与不同运动方式对肠道菌群的调控存在差异有关。研究结论不一致甚至相互矛盾可能与受试对象、动物造模、运动方式、运动强度、遗传因素以及运动时疾病是否处于活动期有关。Nathan等[39]提出,有氧运动可作为UC患者缓解期非药物治疗的重要手段,然而,针对UC患者的最佳的运动处方至今仍未确定[12]。由于随意运动对于实验性UC小鼠的疗效较为肯定,因此本研究采用该运动方式,结果发现,与SED-CON组比较,SED-DSS组动物表现出腹泻、血便、体重下降等症状,结肠组织病理学观察可见黏膜糜烂、溃疡形成、隐窝结构受损、炎症浸润等,DAI评分与组织病理学评分升高、炎症因子(IL-1β、IL-6、TNF-α)表达上调,提示DSS造模成功;经过8周运动预适应再进行UC造模发现,与SED-DSS组比较,EXE-DSS组小鼠症状和组织病理学变化减轻,DAI评分与组织病理学评分下降,炎症因子表达下调,说明8周随意跑轮运动预适应对DSS诱导的UC模型具有保护效应,这与课题组前期的研究[1,4-7]以及前人的研究[4-7,13,17,19,20,29,33,44]结果基本一致,同时也提示,随意运动可能是人类UC行之有效的预防策略,因此,应长期坚持规律的体力活动。
3.2 miR-214/PTEN信号环路在UC中的作用
miRNAs可调控炎症信号转导通路,在诸多炎症相关疾病(包括UC)的发病机制中起关键调节作用[28,47]。研究证实,miRNAs通过参与免疫系统的发育和分化过程或影响下游炎症因子的分泌对炎症反应起调控作用[28]。miR-214是miRNAs中的一员,可通过调控多种靶基因在诸多疾病中发挥关键作用,其在多个系统特别是心血管疾病中的作用受到广泛研究[26,49,50]。PTEN是具有磷酸酶活性的抑癌基因,可使磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)产生的第二信使去磷酸化而阻断其下游的Akt发挥生物学功能,因此,是PI3K/Akt信号通路的负性调节因子,与多种恶性肿瘤的发生密切相关[38,48]。
miR-214、PTEN与UC的关系最近才被确定。Farraye等[22]发现,UC患者miR-214高表达,且与患者疾病活动度以及病程显著正相关。miR-214通过与转录因子,如NF-κB等相互作用而调节炎症信号通路,同时还能够上调多种促炎症因子,如IL-1β、IL-6、TNF-α等表达,因此,在炎症反应调控中起重要作用。Polytarchou等[42]最近的一项研究显示,UC以及UC相关癌变(UC-associated cancer,UCAC)患者miR-214表达水平显著上调;利用生物信息学和全基因组分析发现,miR-214可调节NF-κB活性并激活炎症反应,其机制在于miR-214下调抑癌基因PTEN,由于PTEN对Akt起抑制作用,而Akt则可激活NF-κB,故miR-214过表达最终激活NF-κB信号途径。此外,STAT3是miR-214上游的转录因子,可上调miR-214表达;IL-6可同时活化STAT3和NF-κB,而IL-6又是NF-κB下游的靶基因,因此形成miR-214/PTEN/Akt/NF-κB/IL-6/STAT3/miR-214反馈环路,这一信号环路与UC的发生、发展及癌变密切相关。上述结论在本研究得到进一步证实,即与SED-CON组比较,SED-DSS组miR-214表达上调,PTEN表达下调,Akt蛋白含量以及NF-κB与DNA结合活性增加,IL-6和STAT3蛋白水平升高,提示,UC时miR-214/PTEN信号转导环路调节发生紊乱,炎症“调节器”NF-κB被持续激活并导致下游促炎症因子大量表达。体外实验证实[42],过表达miR-214可诱导肠道炎症反应甚至UCAC,而miR-214抑制剂则可通过上调PTEN表达减轻DSS诱导的小鼠UC病情以及减少氧化偶氮甲烷(azoxymethane,AOM)和DSS诱导的小鼠UCAC肿瘤的数量和大小。上述研究提示,miR-214对UC肠道炎症起重要调控作用,抑制miR-214有助于维持肠道稳态并预防UC发生,调控miR-214/PTEN信号通路可能是防治UC的重要干预靶点[42]。
3.3 随意跑轮运动通过调控miR-214/PTEN信号环路发挥对UC的保护效应
运动是否通过调控miR-214/PTEN信号环路介导对UC的保护效应是本研究的主要目的。针对运动与miR-214、PTEN的关系主要集中在心肌组织,且不同组织结论不一,而肠道中该信号环路在运动改善UC中的作用如何目前尚无关注。本研究旨在探讨运动预适应对UC小鼠miR-214/PTEN信号环路的调控作用。
NF-κB介导的免疫炎症信号通路持续激活及下游炎症因子过表达是UC发生发展的重要分子机制,抑制肠道NF-κB信号途径是治疗UC的重要靶点。我们近期的两项的研究证实,8周运动预适应能够抑制C57BL/6小鼠实验性UC结肠NF-κB过表达[1],而长期有氧运动可下调缓解期UC患者外周血白细胞NF-κB表达量[6],提示,运动可能通过抑制NF-κB信号通路改善UC患者的炎症反应和临床症状。前面提到,miR-214上调间接激活NF-κB是UC的重要机制[42],但运动是否能够抑制miR-214介导的信号途径尚不得而知。有关运动与miR-214的关系研究较少且主要集中在心肌组织。Melo等[37]的研究证实,心肌梗塞大鼠miR-214表达上调,而运动训练则通过下调miR-214表达而改善心功能。Melo等[36]另一项针对正常心肌组织的研究发现,抗阻训练通过下调miR-214并上调其下游靶基因心肌肌质网Ca2+-ATP酶表达介导心肌肥大,但并未改变促炎症因子的含量,提示,正常状态下抑制miR-214表达对炎症反应并无显著影响。本研究发现,与SED-DSS组比较,EXE-DSS组miR-214表达下降,Akt、NF-κB、IL-6、STAT3等炎症信号分子均表达下调,提示,运动下调miR-214表达可有效抑制NF-κB活性从而使DSS诱导的结肠炎症得到改善。上述结果说明,运动预适应可能通过下调结肠miR-214表达、抑制促炎症因子释放,从而对UC起预防和保护作用。
最近的研究显示[42],miR-214与PTEN mRNA 3’-UTR结合并抑制其表达是miR-214激活NF-κB的主要机制,因而构成miR-214/PTEN信号环路,在UC发生发展中起重要作用。运动与PTEN的关系鲜有关注,Liu等[32]证实,大鼠脊髓损伤后进行后肢运动,可通过下调PTEN并激活mTOR信号途径改善脊髓可塑性;Ma等[34]发现,游泳运动可诱导心肌肥大,其机制同样与心肌PTEN表达下调以及PI3K/Akt/mTOR信号途径激活有关,同时也提示,正常状态下抑制PTEN并未造成机体的不良反应(包括炎症反应)。在本研究中,与SED-DSS组比较,EXE-DSS组PTEN表达上调,Akt、NF-κB和炎症因子含量下降,提示,运动上调PTEN表达可有效抑制Akt激活NF-κB的效应。
将结肠健康状态、UC发病机制以及运动改善UC的可能机制进行归纳总结。结肠处于健康状态时,miR-214微量表达并对PTEN轻度抑制,PTEN高表达并强烈抑制Akt使其少量表达,继而使NF-κB/IL-6/STAT3信号途径轻度激活并维持结肠组织的健康状态。当UC发生时,miR-214大量表达并强烈抑制PTEN使其含量减少,PTEN对于Akt的抑制作用减弱,Akt表达上调并持续高度激活NF-κB/IL-6/STAT3信号途径,STAT3升高又进一步促进miR-214表达上调,形成对miR-214的正反馈调节,最终造成结肠的炎症反应状态,因此,miR-214介导的信号反馈环路在UC发生发展甚至癌变过程中起重要作用[42]。长期运动则抑制miR-214过表达,部分解除了对PTEN的抑制,PTEN表达上调,同时Akt/NF-κB/IL-6/STAT3信号途径高度激活状态亦得到部分抑制,STAT3含量降低,其对于miR-214的持续正反馈性激活作用减弱,最终改善结肠炎症反应状态并缓解临床症状,因此,运动改善UC可能是通过调控miR-214/PTEN信号环路实现的。
4 结论与展望
利用DSS建立C57BL/6小鼠实验性UC模型并探讨运动预适应对UC的作用及机制,结果证实,随意跑轮运动预适应可能通过调控miR-214/PTEN信号环路,即下调miR-214并上调PTEN表达,抑制Akt/NF-κB/IL-6/STAT3信号转导通路,改善促炎症因子过度表达状态,进而对DSS诱导的C57BL/6小鼠实验性UC起保护效应。由于miR-214/PTEN信号环路参与了UC特别是包括UCAC在内的多种肿瘤发生的病理过程,因此,本研究也为运动预防UC和结直肠癌提供了间接证据。
miRNAs主要在转录后水平调控基因的表达,近年的研究发现,UC患者的血浆、肠黏膜组织、粪便中均存在多种miRNAs差异表达[28]。除本研究所提及的miR-214外,研究还发现[28],与健康人群相比较,活动期UC结肠上皮细胞中miR-192低表达,而miR-21高表达;缓解期UC中miR-192表达不变,而miR-375、miR-422表达增高,提示,不同miRNAs在活动性和非活动性UC组织中的表达有所差异。此后,多种miRNAs被鉴别并发现与UC发生、发展与癌变有关,因此,miRNAs表达谱有望成为UC的有效诊断工具和治疗靶点,人为操纵miRNAs的表达水平有可能抑制炎症反应并有望成为新的治疗策略。运动作为防治UC的重要非药物手段,具有安全、经济、无副作用的特点,然而运动改善UC的具体机制仍不清楚,针对UC患者最佳运动处方仍未确定。
本研究中,运动对肠道miR-214/PTEN信号环路的调控作用与前人针对心肌组织的研究结果存在差异,即运动下调结肠miR-214并上调PTEN表达,而在心肌组织中miR-214和PTEN在运动后同时下调[34,36,37],提示,该信号通路具有组织特异性,此外,还可能与运动方式、运动强度、动物是否处于病理状态等因素有关。由于miRNAs的主要作用在于负调控靶基因表达,其表达模式具有高度保守性、组织特异性和时序性,在不同发育阶段、不同组织中表达水平有显著差异[46],因此,今后的研究应针对不同疾病模型、不同组织,揭示不同运动处方(运动方式、运动强度、运动时间等)以及运动联合临床治疗手段(药物、手术等)对miRNAs及其介导信号转导通路的调控作用,深入探讨运动有益健康的具体机制,继而进一步优化运动方案。
需要强调的是,本研究主要关注miR-214/PTEN信号通路在运动预适应预防和保护实验性UC中的作用,但仍存在其他诸多可能机制。例如,肠道微生物在UC发生和进展中起重要作用,微生物的多样性和组成成分与炎症因子水平密切相关[30]。肠道微生物多样性受损与疾病易感性和严重程度增加有关,增加多样性能够改善健康状况[41]。Clarke等[16]的研究证实,运动可增加肠道微生物多样性并降低炎症反应水平。因此,本研究中运动保护UC的机制还可能与肠道微生物多样性增加有关。此外,骨骼肌作为内分泌器官在运动时可分泌肌肉因子(myokines)(包括肌源性IL-6、IL-15、BDNF、IGF-1和Irisin等),进而调节远隔器官(包括结肠)的功能。研究证实,肌肉因子与诸多运动健康效应相关,例如,改善代谢和抗炎作用[31]。本研究并未检测肌肉因子水平,今后的研究应进一步确定运动保护UC的效应是否与肌肉因子的变化有关。
[1] 代志军,马延超. 运动预适应对C57BL/6小鼠溃疡性结肠炎的预防作用及其机制分析[J]. 体育学刊,2014,(3):140-144.
[2] 高亚贤,郭亚春,肖丽君,等. 穿山龙总皂苷含药血清对IL-17和TNF-α诱导的大鼠滑膜细胞株RSC-364NF-κB p65活性、STAT3及VEGF mRNA表达的影响[J]. 免疫学杂志,2012,28(10):848-852.
[3] 郭亚春,高亚贤,宋鸿儒. 薯蓣皂苷片含药血清对IL-17和TNF-α诱导大鼠滑膜细胞株RSC-364 NF-кB p65、STAT3及VEGF影响的实验研究[J]. 中国中西医结合杂志,2013,33(6):814-818.
[4] 施曼莉,王晨宇. 12周有氧运动对缓解期溃疡性结肠炎患者氧化应激、炎症因子和运动能力的影响[J]. 中国体育科技,2014,50(2):92-97.
[5] 王晨宇. 16周有氧运动对缓解期溃疡性结肠炎患者临床疗效及运动能力的影响[J]. 河南大学学报(自然科学版),2014,44(4):449-455.
[6] 王晨宇. 8周低强度有氧运动可能通过Toll-4/NF-κB途径提高缓解期炎症性肠病疗效[J]. 天津体育学院学报,2014,29(3):259-263.
[7] 张艳,李荣源,黄华生,等. 不同运动方式在缓解期溃疡性结肠炎患者康复治疗中的作用[J]. 中国体育科技,2016,52(5):59-67.
[8] 周凤华,温子云,何泽淮,等. 虎杖苷对ApoE-/-小鼠肝脏miR-214表达水平及肝功能的影响[J]. 南方医科大学学报,2016,36(6):763-767.
[9] ALLEN J M,BERG MME,PENCE B D,et al. Voluntary and forced exercise differentially alters the gut microbiome in C57BL/6J mice[J]. J Appl Physiol (1985),2015,118(8):1059-1066.
[10] BARRAL M,DOHAN A,ALLEZ M,et al. Gastrointestinal cancers in inf l ammatory bowel disease:An update with emphasis on imaging fi ndings[J]. Crit Rev Oncol Hematol,2016,97:30-46.
[11] BASCHUNG P P,DE BRUIN E D,TOBLER-AMMANN B C,et al. The relevance of applying exercise training principles when designing therapeutic interventions for patients with inf l ammatory myopathies:a systematic review[J]. Rheumatol Int,2015,35(10):1641-1654.
[12] BILSKI J,BRZOZOWSKI B,MAZUR-BIALY A,et al. The role of physical exercise in inf l ammatory bowel disease[J/OL].Biomed Res Int,2014.http://dx.doi.org/10.1155/2014/429031.
[13] BILSKI J,MAZUR-BIALY A I,BRZOZOWSKI B,et al. Moderate exercise training attenuates the severity of experimental rodent colitis:the importance of crosstalk between adipose tissue and skeletal muscles. Mediators Inf l amm[J]. 2015.http://dx.doi.org/10.1155/2015/605071.
[14] BOGGILD H,TUCHSEN F,ORHEDE E. Occupation,employment status and chronic inflammatory bowel disease in Denmark[J].Int J Epidemiol,1996,25(3):630-7.
[15] CHAN D,ROBBINS H,ROGERS S,et al. Inf l ammatory bowel disease and exercise:results of a Crohn’s and Colitis UK survey[J].Frontline Gastroenterol,2014,5(1):44-48.
[16] CLARKE S F,MURPHY E F,O’SULLIVAN O,et al. Exercise and associated dietary extremes impact on gut microbial diversity[J].Gut,2014,63(12):1913-1920.
[17] COOK M D,MARTIN S A,WILLIAMS C,et al. Forced treadmill exercise training exacerbates inflammation and causes mortality while voluntary wheel training is protective in a mouse model of colitis[J]. Brain Behav Immun,2013,33:46-56.
[18] COOPER H S,MURTHY S N,SHAH R S,et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J].Lab Invest,1993,69(2):238-49.
[19] DE SOUZA TAJIRI G J,DE CASTRO C L,ZALTMAN C. Progressive resistance training improves muscle strength in women with inf l ammatory bowel disease and quadriceps weakness[J]. J Crohns Colitis,2014,8(12):1749-1750.
[20] DEFILIPPIS E M,TABANI S,WARREN R U,et al. Exercise and self-reported limitations in patients with inf l ammatory bowel disease[J]. Dig Dis Sci,2016,61(1):215-220.
[21] DERIKX LA,DIELEMAN LA,HOENTJEN F. Probiotics and prebiotics in ulcerative colitis[J]. Best Pract Res Clin Gastroenterol,2016,30(1):55-71.
[22] FARRAYE F A,ODZE R D,EADEN J,et al. AGA technical review on the diagnosis and management of colorectal neoplasia in inf l ammatory bowel disease[J]. Gastroenterology,2010,138(2):746-774.
[23] GÓMEZ-BANOY N,MOCKUS I,ARANZÁLEZ L H,et al.Changes to circulating inflammatory cytokines in response to moderate exercise[J]. J Sports Med Phys Fitness,2016,56(1-2):100-104.
[24] HAYASHINO Y,JACKSON J L,HIRATA T,et al. Effects of exercise on C-reactive protein,inf l ammatory cytokine and adipokine in patients with type 2 diabetes:a meta-analysis of randomized controlled trials[J]. Metab,2014,63(3):431-440.
[25] HLAVATY T,TOTH J,KOLLER T. Smoking,breastfeeding,physical inactivity,contact with animals,and size of the family inf l uence the risk of inf l ammatory bowel disease:A Slovak casecontrol study[J]. United Euran Gastroenterol J,2013,1(2):109-119.
[26] JIN Y,YANG C J,XU X,et al. MiR-214 regulates the pathogenesis of patients with coronary artery disease by targeting VEGF[J].Mol Cell Biochem,2015,402(1-2):111-122.
[27] JONES P D,KAPPELMAN M D,MARTIN C F,et al. Exercise decreases risk of future active disease in patients with inf l ammatory bowel disease in remission[J]. Inf l amm Bowel Dis,2015,21(5):1063-1071.
[28] KALLA R,VENTHAM N T,KENNEDY N A,et al. MicroRNAs:new players in IBD[J]. Gut,2015,64(3):504-517.
[29] KLARE P,NIGG J,NOLD J,et al. The impact of a ten-week physical exercise program on health-related quality of life in patients with inf l ammatory bowel disease:a prospective randomized controlled trial[J]. Digestion,2015,91(3):239-247.
[30] KNIGHTS D,LASSEN K G,XAVIER R J. Advances in inf l ammatory bowel disease pathogenesis:linking host genetics and the microbiome[J]. Gut,2013,62(10):1505-1510.
[31] KOSTROMINOVA T Y. Role of myokines in the maintenance of whole-body metabolic homeostasis[J]. Minerva Endocrinol,2016,41(4):403-420.
[32] LIU G,DETLOFF M R,MILLER K N,et al. Exercise modulates microRNAs that affect the PTEN/mTOR pathway in rats after spinal cord injury[J]. Exp Neurol,2012,233(1):447-456.
[33] LIU W X,ZHOU F,WANG Y,et al. Voluntary exercise protects against ulcerative colitis by up-regulating glucocorticoid-mediated PPAR-γ activity in the colon in mice[J]. Acta Physiol (Oxf),2015,215(1):24-36.
[34] MA Z,QI J,MENG S,et al. Swimming exercise training-induced left ventricular hypertrophy involves microRNAs and synergistic regulation of the PI3K/AKT/mTOR signaling pathway[J]. Eur J Appl Physiol,2013,113(10):2473-2486.
[35] MALMBORG P,HILDEBRAND H. The emerging global epidemic of paediatric inf l ammatory bowel disease--causes and consequences[J]. J Intern Med,2016,279(3):241-258.
[36] MELO S F,BARAUNA V G,JÚNIOR M A,et al. Resistance training regulates cardiac function through modulation of miRNA-214[J]. Int J Mol Sci,2015,16(4):6855-6867.
[37] MELO S F,BARAUNA V G,NEVES V J,et al. Exercise training restores the cardiac microRNA-1 and -214 levels regulating Ca2+handling after myocardial infarction[J]. BMC Cardiovasc Disord,2015,15:166-171.
[38] MURPHY S J,KARNES R J,KOSARI F,et al. Integrated analysis of the genomic instability of PTEN in clinically insignif i cant and signif i cant prostate cancer[J]. Mod Pathol,2016,29(2):143-156.
[39] NATHAN I,NORTON C,CZUBER-DOCHAN W,et al. Exercise in individuals with inf l ammatory bowel disease[J]. Gastroenterol Nurs,2013,36(6):437-442.
[40] NOWAK A,KUCIO C. Quality of life and physical activity of patients with inf l ammatory bowel diseases[J]. Wiad Lek,2015,68(1):26-31.
[41] PALM NW,D E ZOETE M R,CULLEN T W,et al. Immunoglobulin A coating identif i es colitogenic bacteria in inf l ammatory bowel disease[J]. Cell,2014,158(5):1000-1010.
[42] POLYTARCHOU C,HOMMES D W,PALUMBO T,et al. MicroRNA214 is associated with progression of ulcerative colitis,and inhibition reduces development of colitis and colitis-associated cancer in mice[J]. Gastroenterology,2015,149(4):981-992.
[43] SONNENBERG A. Occupational distribution of inflammatory bowel disease among German employees[J]. Gut,1990,31(9):1037-1040.
[44] SZALAI Z,SZASZ A,NAGY I,et al. Anti-inf l ammatory effect of recreational exercise in TNBS-induced colitis in rats:role of NOS/HO/MPO system[J/OL]. Oxid Med Cell Longev,2014.http://dx.doi.org/10.1155/2014/925981.
[45] THORNE K,ALRUBAIY L,AKBARI A,et al. Colectomy rates in patients with ulcerative colitis following treatment with inf l iximab or ciclosporin:a systematic literature review[J]. Eur J Gastroenterol Hepatol,2016,28(4):369-382.
[46] WITWER K W,HALUSHKA M K. Toward the promise of microRNAs - Enhancing reproducibility and rigor in microRNA research[J]. RNA Biol,2016,13(11):1103-1116.
[47] WU F,ZIKUSOKA M,TRINDADE A,et al. MicroRNAs are differentially expressed in ulcerative colitis and alter expression of macrophage inf l ammatory peptide-2 alpha[J]. Gastroenterology,2008,135(5):1624-1635.
[48] YANG H P,MEEKER A,GUIDO R,et al. PTEN expression in benign human endometrial tissue and cancer in relation to endometrial cancer risk factors[J]. Cancer Causes Control,2015,26(12):1729-1736.
[49] YANG T,GU H,CHEN X,et al. Cardiac hypertrophy and dysfunction induced by overexpression of miR-214 in vivo[J]. J Surg Res,2014,192(2):317-325.
[50] YANG X,QIN Y,SHAO S,et al. MicroRNA-214 inhibits left ventricular remodeling in an acute myocardial infarction rat model by suppressing cellular apoptosis via the Phosphatase and Tensin Homolog (PTEN)[J]. Int Heart J,2016,57(2):247-250.
Effects of Voluntary Wheel Running Exercise Preconditioning on miR-214/PTEN Signal Circuit Pathway of Colon in Experimental Ulcerative Colitis Mice
Objective:To observe the effects of 8-weeks voluntary wheel running exercise preconditioning on dextran sulfate sodium (DSS)-induced experimental ulcerative colitis (UC) of C57BL/6 mouse and investigate the possible mechanism of miR-214/PTEN signal circuit pathway in the pathological process. Methods:Forty male C57BL/6 mice were divided into four groups:sedentary control group (SED-CON),sedentary DSS group (SED-DSS),exercise control group (EXE-CON)and exercise DSS group (EXE-DSS). Animals of SED-CON and SED-DSS groups maintained resting state while those of EXE-CON and EXE-DSS groups conducted voluntary wheel running exercise preconditioning lasting for 8 weeks. UC model was induced by 3.5% DSS solution in modeling groups and equivalent distilled water was given to control groups. Body weight and disease activity index (DAI) were recorded daily. Seven days later the animals were sacrif i ced for histopathological examination of the colon and tissue damage score,and gene expression of IL-1β,IL-6,TNF-α,miR-214,PTEN,STAT3,Akt as well as NF-κB activity were determined. Results:Compared with SED-DSS group,mice of EXE-DSS group exhibited improved clinical symptoms (body weight increased,DAI decreased,pro-inf l ammatory factors expression downregulated and tissue damage of colon reduced). Molecular biology study revealed that,compared with SED-DSS group,miR-214,as well as Akt,STAT3,IL-6 expression and NF-κB activity reduced while PTEN mRNA and protein expression level raised in EXE-DSS group (P<0.05). Conclusion:Long-term voluntary wheel running exercise preconditioning protected against DSS-induced experimental UC of C57BL/6 mouse,and the possible mechanism may be related with partial restoration of miR-214/PTEN signal circuit pathwayc function.
exercise preconditioning;ulcerative colitis;miR-214;PTEN;inf l ammatory reaction;signal pathway
G804.7
A
2016-12-18;
2017-12-07
河南省自然科学基金项目(142102310359)。
;孟宪欣,男,讲师,硕士,主要研究方向为运动训练与健康促进,E-mail:mengxianxin1999@126.com,;葛吉生,男,教授,学士,主要研究方向为运动训练与健康促进,E-mail:sdqdgjs2008@163.com;王希柳,男,讲师,学士,主要研究方向为运动训练与健康促进,E-mail:695381505@qq.com。
1. 青岛大学 体育学院,山东 青岛,266071;2. 郑州航空工业管理学院 体育部,河南 郑州 450015;3. 洛阳师范学院 体育学院,河南 洛阳,471022 1. Qingdao University,Shandong Qingdao,266071,China;2. Zhengzhou Unwersity of Aeronautics,Zhengzhou 450015,China;3. College of Physical Education,Luoyang Normal University,Luoyang 471022,China.
