第四代大环内酯类抗生素-索利霉素
2018-01-03杨清
杨 清
第四代大环内酯类抗生素-索利霉素
杨 清
大环内酯类抗生素在社区获得性细菌性肺炎的治疗中起着十分重要的作用。索利霉素是新一代大环内酯-酮内酯类抗菌药物,其保留了酮基大环内酯类对抗多种呼吸道病原体和多药耐药菌的强大能力,且不良反应较泰利霉素明显减轻。本文对索利霉素的作用机制、抗菌活性、药效学、临床研究及监管状况等进行综述。
抗生素;大环内酯;氟酮内酯;索利霉素;社区获得性肺炎
0 引言
社区获得性肺炎(Community-acquired pneumonia,CAP)是一种常见的且发病率与死亡率均较高的感染性疾病,其发病率随着年龄的增长而升高,且复发率和需要入院治疗的比例很高。全球每年治疗CAP的总费用约为130亿美元,给各国患者和医保系统带来沉重的经济负担。此外,流行病学研究发现,CAP年发病率在过去20年呈持续上升趋势[1]。
合理选择抗生素治疗方案,可以显著降低CAP患者的死亡率。与单独使用第3代头孢菌素治疗方案相比,由第3代头孢菌素联合大环内酯的CAP治疗方案不仅可以显著降低患者的住院时间和总住院费用,同时可将30 d死亡率降低34%[2]。因此,美国传染病学会(IDSA)发布的CAP成人经验疗法也推荐联合应用大环内酯类药物[3]。然而,随着该类药物的广泛应用,多种大环内酯类耐药菌迅速出现。因此,第3代大环内酯类药物泰利霉素(Telithromycin)应运而生。泰利霉素是首个上市的酮基大环内酯类抗生素,其对某些细菌核糖体的结合能力远高于其他大环内酯类,且不易成为与细菌耐药相关的主动外排泵的底物,因而增强了抗大环内酯耐药菌、潜在的诱导耐药菌株以及β-内酰胺酶等的活性[4-5]。然而,泰利霉素可能导致严重肝损伤等不良反应,因此,美国食品药品管理局(FDA)将其适应证严格限定为轻、中度CAP[6]。
索利霉素(Solithromycin)是正在研发的第4代大环内酯类抗菌药物-氟酮内酯类。其不仅保留了酮基大环内酯类的抗菌活性,且不良反应较泰利霉素明显减轻[7-8]。本文将对索利霉素的作用机制、抗菌活性、药效学、临床应用等情况进行介绍。
1 作用机制
大环内酯类药物是通过结合核糖体50S亚基从而抑制蛋白质合成来发挥其抗菌作用。随着该类药物临床应用的增多,细菌对其耐药性日益增加,其耐药机制包括[9]:①通过甲基或基因突变实现组成型或大环内酯诱导型核糖体靶位点修饰。由Erm蛋白质介导进行的50S核糖体亚基23S rRNA的A2058残基甲基化,导致大环内酯类药物不能与50S核糖体亚基23S rRNA的特殊靶点结合,从而产生耐药性。因为大环内酯类、林可酰胺类与链阳霉素-B(MLSB)的作用部位相仿,故由核糖体结合点改变所致的MLSB表型的抗性谱已成为局限第二代大环内酯类药物临床应用的主要问题。②膜通透性降低或主动外排系统参与。由于耐药基因编码了具有能量依赖性主动外排功能的蛋白质,将大环内酯类抗生素外排,或者降低了细菌细胞膜对大环内酯类抗生素的通透性,使耐药菌细胞内的药物浓度明显低于敏感菌。③灭活酶的产生。质粒介导的红霉素酯酶和大环内酯2-磷酸转移酶产生,通过水解内酯键打开内酯环。
索利霉素是新一代大环内酯-氟酮内酯类抗生素,其结构式如图1A所示。与泰利霉素(图1B)相同,索利霉素在C-11和C-12碳上也含有烷基芳基侧链。但与泰利霉素相比,索利霉素扩展的烷基-芳基侧链及C-2氟的独特添加赋予其与核糖体结合位点更好的锚定[10]。结合到23S核糖体组分的索利霉素结晶和生物化学表征表明,其烷基-芳基侧链可能与23S rRNA的结构域Ⅱ中的螺旋35环中的残基形成氢键,从而与结合位产生更紧密的相互作用。此外,酮内酯可与Erm介导的甲基化A2058残基进行结合。但与泰利霉素相比,索利霉素的结合效率更高[11]。
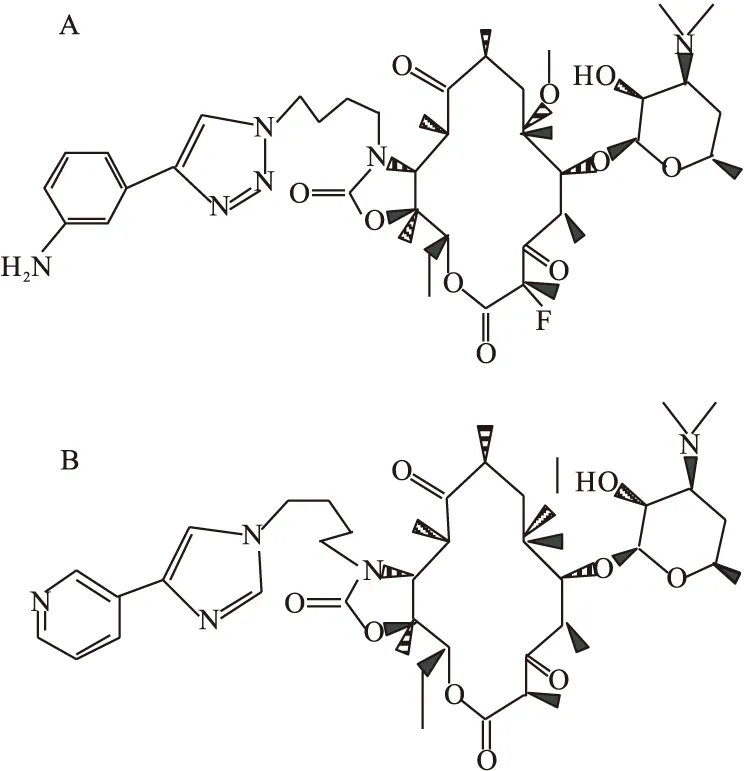
图1 酮内酯类的结构式
泰利霉素对各种烟碱乙酰胆碱受体均具有抑制作用,其中包括终止于肝脏迷走神经分支表达的α7受体。这些受体的刺激对促炎性细胞因子(如肿瘤坏死因子α)具有保护作用,因此其抑制可能是泰利霉素引起肝损伤的主要原因[11]。而与泰利霉素比较,可能是由于在索利霉素的烷基-芳基侧链中缺少吡啶部分,其对α7受体无显著的抑制作用,因此索利霉素的肝毒性较低[12]。
2 药效学
2.1 体外活性 索利霉素对肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、支原体、肺炎衣原体和嗜肺军团菌等关键CAP病原体均具有极好的体外活性[13]。该活性还保留在许多耐药菌株中,包括耐红霉素B组链球菌[14]、耐大环内酯类肺炎链球菌分离物(如:多药耐药血清型19A和基于表达甲基化和突变介导的抗性分离株)[15],以及一些耐阿奇霉素的抗性生殖体支原体分离株[16]。索利霉素还具有抗耐大环内酯淋病奈瑟氏球菌分离物的体外活性[17],以及体外抗疟活性,包括多药耐药恶性疟原虫系[18]。索利霉素对上述任何一种生物体均没有敏感性突变点。
2.2 体内活性 采用小鼠全身感染模型对索利霉素进行测试。其中,小鼠在鼠肺炎链球菌或化脓性链球菌感染1 h后采用管饲口服法进行治疗。对于肺炎链球菌和化脓性脓毒症,索利霉素和克拉霉素的ED50分别为14.4、26.9 mg/kg,8.9、24.3 mg/kg[19]。
另外一项小鼠全身感染(分别感染肺炎链球菌、化脓性链球菌或金黄色葡萄球菌)研究显示,与前几代大环内酯类药物相比,索利霉素具有相似的甚至更高的体内活性;但与大环内酯敏感菌株相比,需要大约3倍的索利霉素剂量,才能使耐大环内酯类肺炎链球菌感染的小鼠的存活率达到50%[20]。在中性粒细胞减少小鼠模型中,与阿奇霉素、克拉霉素和泰利霉素相比,具有肺部肺炎链球菌感染的小鼠仅需要较低剂量的索利霉素,就可将对大环内酯敏感和大环内酯类抗性菌株的肺细菌计数降低2 log10以上。文献还指出,流感嗜血杆菌肺部感染的中性粒细胞减少大鼠模型在使用索利霉素治疗后24、48 h,可观察到肺组织中的细菌计数明显减少[20]。在具有肺炎链球菌和不可流行的流感嗜血杆菌的中耳炎的栗鼠模型中,索利霉素的中耳液浓度均超过血浆浓度,且在MICs≤0.5 mg/mL的2种病原体的菌株中均观察到中耳液的快速灭菌[21]。
2.3 药效分析 大环内酯类的抗菌药效与其在细胞内积聚浓度密切相关。积聚浓度、缓慢的杀菌活性以及抗生素白细胞增强效应共同作用产生时变的药效特征,且该特征还和药时曲线下面积与最小抑菌浓度的比值(AUC/MIC)有关[22]。对临床试验数据进行分析发现,索利霉素具有基于AUC/MIC的抗微生物特征。
Lemaire等[23]研究了索利霉素在被金黄色葡萄球菌、单核细胞增生利斯特氏菌和肺炎杆菌感染的THP-1细胞内的药效学。索利霉素在THP-1细胞中24 h内的积聚浓度比细胞外浓度高约350倍,明显高于阿奇霉素。索利霉素细胞内50%有效浓度为0.006 8 mg/L,阿奇霉素为0.11 mg/L;此外,索利霉素的表观抑菌浓度为0.022 mg/L,而阿奇霉素>50 mg/L。可见,索利霉素比阿奇霉素具有更高的效力。将培养基pH值从为7.4调节至5.5时,所研究的所有药物的效力均显著降低。但是,索利霉素保留了最多的活性。例如,当金黄色葡萄球菌的pH值为7.4~5.5时,阿奇霉素的MIC范围约为0.5~256 mg/L,而索利霉素约为0.062 5~1 mg/L。与其他大环内酯类相比,索利霉素具有更好的抗非典型病原体的抗菌谱。这可能是因为索利霉素具有增强的靶位点结合特性[24]。
3 临床研究
索利霉素生产商Cempra公司已经完成了该药治疗成人CAP的Ⅱ期和Ⅲ临床试验,如表1所示。Ⅱ期临床试验对比口服索利霉素和口服左氧氟沙星5 d的疗效和安全性。结果显示,索利霉素与左氧氟沙星疗效相近,且安全性较高[25]。随后的2项Ⅲ期非劣效性试验均使用莫西沙星作为比较剂,主要观察患者的早期临床反应,即治疗72 h后至少2种症状(包括咳嗽、呼吸困难、胸膜炎胸痛和痰液产生)得以改善,并且没有任何其他症状恶化。非劣效界限为-10%[26-27]。Ⅲ期临床试验结果表明,索利霉素口服或者静脉输液转口服治疗CAP,口服索利霉素疗效不及莫西沙星,静脉输液转口服的疗效不及莫西沙星静脉输液。若采用口服方案,则治疗第1天使用800 mg的口服负荷剂量,随后几天维持400 mg的低剂量。随意增加剂量并不能提高疗效,反而可能增加毒性。喂饲或禁食状态下施用索利霉素,对口服药物的生物利用度没有明显影响,但与食物同服可提高耐受性。静脉输液方案采用400 mg,1次/d,且无负荷剂量。用0.45%或0.9%氯化钠注射液或乳酸林格注射液稀释注射用索利霉素,60 min后输液。根据患者病情严重程度,治疗时间为5~7 d。目前,该公司正在进行Ⅱ/Ⅲ期随机、开放标签、主动控制的多中心研究,以评估索利霉素应用于CAP儿童和青少年患者的安全性和有效性,预计完成日期为2018年1月。
上述研究已经证明了索利霉素针对淋病奈瑟氏球菌(包括大环内酯抗性菌株)的体外活性。在非并发症泌尿生殖淋巴瘤成人患者的Ⅱ期非对照试验中,59例患者接受单剂量的口服索利霉素1 000或1 200 mg后,对于培养证实感染的所有部位,淋病奈瑟氏球菌的培养物均为阴性[28]。
还有其他与淋病相关的索利霉素临床试验,包括最近完成的索利霉素泌尿生殖和咽部药代动力学Ⅰ期研究,以及正在进行的Ⅲ期研究-比较口服索利霉素与肌注头孢曲松加口服阿奇霉素对泌尿生殖淋巴瘤(SOLITAIRE-U)的疗效。

表1 CAP成人临床试验
使用索利霉素可以明显降低非酒精性脂肪性肝炎(NASH)糖尿病鼠模型的平均肝脏重量及肝脏体重比,还能降低其全血糖水平,有效改善组织学评分。目前正在开展的Ⅱ期原理验证研究,评估索利霉素对NASH患者的肝组织学和生物标志物的影响,预计在2017年底完成。
4 安全性及耐受性
上述索利霉素临床试验均包括安全性和耐受性分析。所有研究中均没有发生与治疗相关的死亡事件。
在CAP治疗中,最常见的非输注部位不良事件是轻度腹泻、头痛和恶心。静脉输液和口服治疗的不良事件发生率没有明显区别。若排除输注部位事件,则索利霉素组和莫西沙星组的不良事件发生率相似。在试验中还观察到部分患者的丙氨酸转移酶(ALT)水平高于正常上限(ULN),且索利霉素组出现肝功能异常的比例高于莫西沙星组,这一现象在SOLITAIRE-Ⅳ试验中更为明显。索利霉素的排泄途径主要为肝脏转化和粪便排泄。在没有剂量调整的情况下,对轻、中和重度肝功能不全患者用药,对索利霉素暴露水平或不良事件的发生率可能没有显著影响。此外,任何索利霉素治疗组均未报道艰难梭菌结肠炎,而莫西沙星治疗组报告有2例(<1%)患者存在该不良事件。
在非并发症泌尿生殖淋巴瘤的Ⅱ期非对照试验中,采用1 000 mg剂量和1 200 mg剂量,胃肠道不良反应的发生率不同,如:自限性腹泻(61% vs.42%),轻度恶心(32% vs.14%)和轻度呕吐(26% vs.3%)[28]。
NASHⅡ期原理验证研究显示,17%(1/6)的患者出现肝毒性(ALT>4.5 ULN)[20]。这一比例远远高于CAP临床试验,其原因可能在于NASH临床研究中索利霉素用药时间为13周,其药物暴露量明显高于CAP试验。
5 现行监管状况
FDA抗菌药物咨询委员会于2016年11月审查了索利霉素的新药申请。该委员会一致认为,索利霉素是治疗CAP的有效方法,但潜在的肝毒性风险尚未得到充分表征。委员会建议:①增加使用期限超过7 d的警告;②去除从输液转为口服治疗的患者的口服负荷剂量;③仔细选择接受索利霉素的患者,以避免通过肾功能障碍或药物-药物相互作用增加暴露的可能性。此外,鉴于第1个酮基大环内酯类药物泰利霉素上市后报告了3起严重肝毒性事件(其中1例导致死亡,1例导致肝移植),委员会还建议将临床试验规模由920例扩大至 9 000例,以全面评估该药的安全性[20]。尽管索利霉素以较低的剂量和较短的治疗持续时间就取得了显著的CAP疗效,且在耐大环内酯类非典型细菌中具有广泛活性,然而在缺乏大量的肝脏安全性数据的情况下,其不太可能被批准用于CAP治疗。此外,索利霉素的其他用途(如治疗淋球菌疾病、NASH和儿科CAP)需要认真考虑,因为这些人群的毒性特征可能会有很大差异。
[1] 曾军.优化社区获得性肺炎抗菌药物应用策略:避免过度治疗[J].中国实用内科杂志,2017,37(2):180-184.
[2] Brown RB,Iannini P,Gross P,et al.Impact of initial antibiotic choice on clinical outcomes in community-acquired pneumonia:analysis of a hospital claims-made database[J].Chest,2003,123(5):1503-1511.
[3] Sligl WI,Asadi L,Eurich DT,et al.Macrolides and mortality in critically ill patients with community-acquired pneumonia:a systematic review and meta-analysis[J].Crit Care Med,2014,42(2):420-432.
[4] 孙忠实,朱珠.新型抗生素泰利霉素[J].中国新药杂志,2002,11(7):528-530.
[5] 王登旭,王二兵,彭向前.泰利霉素的药理作用及临床应用[J].中国药物与临床,2005,5(7):524-525.
[6] 雷招宝.泰利霉素的肝毒性反应[J].抗感染药学,2010,7(1):60-62.
[7] 张婷婷,魏增泉.临床研究中的抗生素新药[J].国外医药:抗生素分册,2013,34(6):241-244,249.
[8] 杨臻峥.大环内酯类抗生素Solithromycin[J].药学进展,2012,36(2):94-95.
[9] 杨世杰,杨宝峰,王怀良.药理学[M].北京:人民卫生出版社,2005.
[10] Douthwaite S,Hansen LH,Mauvais P.Macrolide-ketolide inhibition of MLS-resistant ribosomes is improved by alternative drug interaction with domain II of 23S rRNA[J].Mol Microbiol,2000,36(1):183-193.
[11] 李喆宇,崔玉彬,张静霞,等.大环内酯类抗生素的研究新进展[J].国外医药:抗生素分册,2013,34(1):6-15.
[12] Fernandes P,Martens E,Bertrand D,et al.The solithromycin journey-it is all in the chemistry[J].Bioorg Med Chem,2016,24(24):6420-6428.
[13] Weintraub A,Rashid MU,Nord CE.In-vitro activity of solithromycin against anaerobic bacteria from the normal intestinal microbiota[J].Anaerobe,2016,42:119-122.
[14] Piccinelli G,Fernandes P,Bonfanti C,et al.In vitro activity of solithromycin against erythromycin-resistant Streptococcus agalactiae[J].Antimicrob Agents Chemother,2014,58(3):1693-1698.
[15] Farrell DJ,Mendes RE,Jones RN.Antimicrobial activity of solithromycin against serotyped macrolide-resistant Streptococcus pneumoniae isolates collected from U.S.medical centers in 2012[J].Antimicrob Agents Chemother,2015,59(4):2432-2434.
[16] Farrell DJ,Sader HS,Castanheira M,et al.Antimicrobial characterisation of CEM-101 activity against respiratory tract pathogens,including multidrug-resistant pneumococcal serogroup 19A isolates[J].Int J Antimicrob Agents,2010,35(6):537-543.
[17] Jensen JS,Fernandes P,Unemo M.In vitro activity of the new fluoroketolide solithromycin (CEM-101) against macrolide-resistant and -susceptible Mycoplasma genitalium strains[J].Antimicrob Agents Chemother,2014,58(6):3151-3156.
[18] Wittlin S,Ekland E,Craft JC,et al.In vitro and in vivo activity of solithromycin (CEM-101) against plasmodium species[J].Antimicrob Agents Chemother,2012,56(2):703-707.
[19] Pereira D,Fernandes P.Synthesis and antibacterial activity of novel 4-aryl-[1,2,3]-triazole containing macrolides[J].Bioorg Med Chem Lett,2011,21(1):510-513.
[20] Food and Drug Administration.Briefing document.Solithromycin oral capsule and injection.Meeting of the Antimicrobial Drugs Advisory Committee[EB/OL].http://www.fda.gov/downloads/Advisory Committees/Committees Meeting Materials/Drugs/Anti-Infective Drugs Advisory Committee/UCM527690.pdf.[2016-11-4]
[21] Figueira M,Fernandes P,Pelton SI.Efficacy of Solithromycin (CEM-101) for experimental otitis media caused by nontypeable haemophilus influenzae and streptococcus pneumoniae[J].Antimicrob Agents Chemother,2016,60(9):5533-5538.
[22] 谢婷婷,朱曼,任浩洋.依据抗菌药物PK/PD理论对我院门诊药房抗菌药物不合理处方的点评及案例解析[J].中国药物应用与监测,2013,10(6):323-325.
[23] Lemaire S,Van Bambeke F,Tulkens PM.Cellular accumulation and pharmacodynamic evaluation of the intracellular activity of CEM-101,a novel fluoroketolide,against Staphylococcus aureus,Listeria monocytogenes,and Legionella pneumophila in human THP-1 macrophages[J].Antimicrob Agents Chemother,2009,53:3734-3743.
[24] 靳龙龙.新结构酮内酯抗生素衍生物的合成及生物活性研究[D].北京:北京协和医学院,2014.
[25] Oldach D,Clark K,Schranz J,et al.Randomized,double-blind,multicenter phase 2 study comparing the efficacy and safety of oral solithromycin (CEM-101) to those of oral levofloxacin in the treatment of patients with community-acquired bacterial pneumonia[J].Antimicrob Agents Chemother,2013,57(6):2526-2534.
[26] Barrera CM,Mykietiuk A,Metev H,et al.Efficacy and safety of oral solithromycin versus oral moxifloxacin for treatment of community-acquired bacterial pneumonia:a global,double-blind,multicentre,randomised,active-controlled,non-inferiority trial (SOLITAIRE-ORAL)[J].Lancet Infect Dis,2016,16(4):421-430.
[27] File TM,Rewerska B,Vucinic-Mihailovic V,et al.SOLITAIRE-IV:a randomized,double-blind,multicenter study comparing the efficacy and safety of intravenous-to-oral solithromycin to intravenous-to-oral moxifloxacin for treatment of community-acquired bacterial pneumonia[J].Clin Infect Dis,2016,63(8):1007-1016.
[28] Hook EW,Golden M,Jamieson BD,et al.A phase 2 trial of oral solithromycin 1200 mg or 1000 mg as single-dose oral therapy for uncomplicated gonorrhea[J].Clin Infect Dis,2015,61:1043-1048.
Fourth-generationmacrolideantibiotics-solithromycin
YANG Qing
(Procurement Approval Center,Nantong Second People′s Hospital,Nantong 226002,China)
Macrolide antibiotics play an important role in the treatment of community-acquired pneumonia.Solithromycin is a novel-developed fluorone lactone antibiotics,which retains the strong activity against a broad range of respiratory pathogens and multidrug-resistant bacteria.Furthermore,its adverse reactions are significantly reduced in comparison with telithromycin.In this paper,the activity mechanism,antimicrobial activity,pharmacodynamics,clinical research and regulatory status of solithromycin are briefly introduced.
Antibiotics;Macrolide;Fluconone;Solithromycin;Community-acquired pneumonia
2017-08-06
南通市第二人民医院采购审批中心,江苏 南通 226002
10.14053/j.cnki.ppcr.201712028
