褪黑素诱导NB4细胞凋亡及机制的研究
2018-01-03杨松柳刘媛媛金松根赵鸣雁
杨松柳,刘媛媛,金松根,赵鸣雁
褪黑素诱导NB4细胞凋亡及机制的研究
杨松柳,刘媛媛,金松根,赵鸣雁*
目的探讨褪黑素对NB4细胞凋亡的增殖抑制和凋亡诱导作用。方法将0、10-8、10-6、10-4mol/L褪黑素在体外与NB4细胞共同培养,应用噻唑蓝(MTT)比色法测定细胞活性,Hoechst荧光染色检测细胞凋亡,流式细胞技术检测凋亡细胞比例,分光光度计检测上清液中Caspase-3及Caspase-9含量。结果褪黑素能显著抑制NB4细胞增殖,促进细胞凋亡,增加凋亡因子的表达。结论褪黑素促进NB4细胞凋亡的机制可能与增加Caspase-3及Caspase-9表达有关。
褪黑素;NB4细胞;凋亡;Caspase-3;Caspase-9
0 引言
传统化疗药物通过抑制白血病肿瘤细胞增殖,促进其凋亡发挥治疗作用,但由此带来的对正常细胞的毒副作用不容忽视[1-3]。因此,应寻找一种低毒、安全、不良反应小的药物替代或辅助现有治疗药物,达到减少耐药性、降低不良反应的目的。褪黑素是一种由松果体分泌的具有强抗氧化能力的自由基清除剂,作为一种生物类激素,褪黑素由人体自身合成并分泌,其安全性得到保证。刘沁华等[4]研究显示,褪黑素联合全反式维甲酸可以抑制人早幼粒细胞白血病细胞株HL-60细胞的增殖,促进其凋亡,诱导其分化,从而延缓病情发展;曾庆曙等[5]研究显示,褪黑素能维持胰岛细胞的正常生理功能和生化指标,促进NB4细胞的凋亡,但作用的具体机制尚不清楚。本研究通过观察褪黑素对人急性早幼粒白血病细胞株NB4细胞的增殖抑制作用并探讨相关机制,希望为白血病的治疗提供新的药物选择。
1 材料与方法
1.1 主要材料 褪黑素(美国Sigma公司,纯度97%),青霉素、链霉素(华北制药公司),RPMI 1640培养基(美国Hyclone公司),四甲基偶氮唑盐(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT,Sigma公司),AnnexinV FITC/PI凋亡试剂盒(美国BD公司),Caspase-3、Caspase-9酶检测试剂盒(江苏碧云天生物技术研究所),酶标仪(上海精密科学仪器有限公司),流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养 NB4细胞培养在含有10%胎牛血清的RPMI 1640培养基内,培养箱内温度37 ℃,CO2体积分数5%,细胞贴壁生长,取对数生长期的细胞进行实验。
1.2.2 细胞增殖检测 采用MTT法,NB4细胞接种于96孔板中(3×104个,200 μL/孔),设4个复孔,分别加入0、10-8、10-6、10-4mol/L褪黑素,细胞培养24 h后,换掉培养液,PBS冲洗3次后加入体积分数为0.5%的MTT溶液20 μL,温育4 h,弃上清液加入100 μL DMSO溶液,室温下摇床低速震荡20 min后全自动酶标光度仪测定各孔490 nm的光密度值(OD值),实验重复3次。
1.2.3 细胞凋亡率的流式细胞术检测 按“1.2.2”项分组方法将细胞培养在6孔板中,收集各处理组NB4细胞,PBS洗涤2次后,1 200 r/min离心弃上清液,用试剂盒中的缓冲液悬浮细胞,分别加入FITC-Annexin Ⅴ和PI染液各5 μL,温箱孵育20 min后离心弃上清。于避光环境内PBS洗涤2次后上流式细胞仪进行细胞凋亡检测。
1.2.4 细胞凋亡的Hoechst 33285荧光染色测定 取对数生长期细胞,用PBS洗涤2次,在150 μL的Binding Buffer中加入2 μL Hoechst染液,避光、室温反应5 min后置于荧光显微镜下观察,放大倍数为400倍。
1.2.5 Caspase-3、Caspase-9活性检测 采用分光光度法,按“1.2.2”项方法处理细胞,收集细胞并用0.1%胰酶消化,1 200 r/min离心10 min,收集细胞并用PBS冲洗2次,加入30 μL细胞裂解液后冰上孵育20 min,10 000 r/min离心10 min,进行Caspase活性检测。检测方法按试剂盒进行。Caspase活性=OD405 nm/OD595 nm。

2 结果
2.1 不同浓度褪黑素对NB4细胞增殖的抑制作用 阴性对照组NB4细胞活性为(101.00%±3.02%),用不同浓度褪黑素处理后,细胞活性分别下降到76.33%±2.04%、59.67%±3.52%和46.67%±3.21%,与阴性对照组比较差异有统计学意义(P<0.05)。见图1。
2.2 流式细胞计数检测褪黑素对NB4细胞凋亡的影响 流式细胞计数检测结果显示,NB4细胞经过0、10-8、10-6、10-4mol/L褪黑素处理后,细胞凋亡率分别为2.11%±0.54%、25.76%±2.97%、33.72%±2.86%和47.53%±3.05%,随着褪黑素浓度的增加,NB4细胞凋亡比例逐渐增加。见图2。

图1 褪黑素对NB4细胞活性的影响
2.3 Hoechst 33285核染色法检测各组NB4细胞凋亡 在荧光显微镜下,凋亡细胞核或细胞质内可见浓染致密的颗粒状高荧光,未发生凋亡的细胞核呈均匀淡黑色低荧光。本实验显示,阴性对照组(2.00%±1.11%)未见明显凋亡染色的细胞核,不同浓度的褪黑素处理后,凋亡细胞比例逐渐增加(29.08%±3.34%、36.00%±2.07%、56.73%±4.52%),与阴性对照组凋亡细胞比例比较差异有统计学意义(P<0.05)。见图3、图4。
2.4 褪黑素对NB4细胞内Caspase-3、Caspase-9含量的影响 加入褪黑素作用后,NB4细胞内Caspase-3、Caspase-9表达较阴性对照组显著增加,差异有统计学意义(P<0.05)。见表1。

表1 各组NB4细胞内Caspase-3、Caspase-9含量(n=3)
注:与阴性对照组比较,*P<0.05,**P<0.01
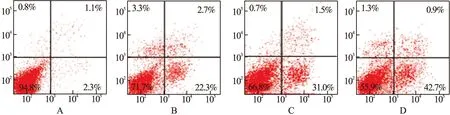
图2 褪黑素对NB4细胞凋亡的影响

图3 褪黑素对NB4细胞凋亡的影响
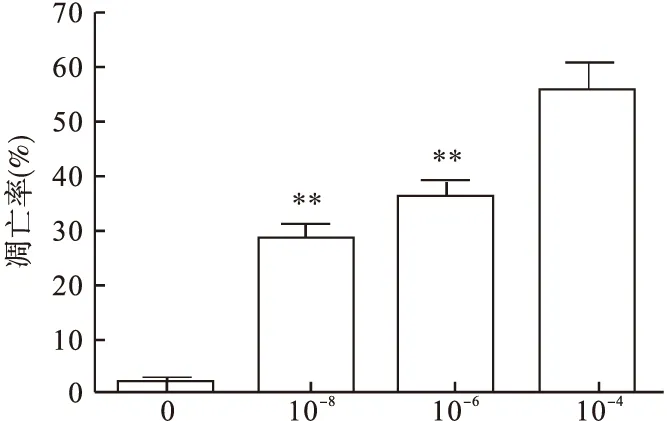
图4 各组细胞凋亡率比较
3 讨论
白血病的治疗机制为通过药物诱导肿瘤细胞凋亡[6]。白血病有很多分类,不同类型的白血病对化疗敏感性不同,化疗可以使部分白血病患者病情得到缓解,但是由于化疗过程中肿瘤细胞长期与药物接触,逐渐产生耐药性,影响化疗效果及患者生存率[7]。因此,研发出一种自然低毒、不良反应少的抗肿瘤药物已经成为治疗的新方向。
通过研究药物诱导肿瘤细胞凋亡的影响,不但可以为肿瘤的防治提供新的理论依据,还可以进一步探索肿瘤细胞的生长规律,进一步指导临床治疗。褪黑素化学名称为5-甲氧基-N-乙酰色胺,具有广泛的生物学效应,其基本功能包括调节昼夜节律、情绪及睡眠[7-8]。褪黑素具有双向作用机制:对于正常细胞,褪黑素能抑制其凋亡,对于肿瘤细胞,褪黑素能诱导其凋亡。临床上褪黑素也被广泛应用于神经系统、内分泌系统、消化系统疾病的治疗[9-11]。近年来有人将其用于白血病的治疗上,也取得一定效果。本实验通过MTT分析细胞活性发现褪黑素能够剂量依赖性地抑制NB4细胞活性。Hoechst 33285核染色法是一种定量检测细胞凋亡的实验方法,可以直观发现凋亡细胞的形态,并初步评估凋亡细胞数量。本研究结果显示,NB4细胞经过褪黑素干预后,细胞核内染色质固缩呈致密浓染的亮蓝色高荧光,表明褪黑素诱导了NB4细胞凋亡。流式细胞计数结果进一步验证了褪黑素能够诱导NB4细胞凋亡。
肿瘤的形成是肿瘤细胞增殖与凋亡比例失衡的结果。凋亡过程中有许多蛋白酶的参与,其中Caspase家族蛋白酶在其中发挥重要作用[12]。有研究显示,褪黑素可以使人B淋巴母细胞瘤细胞胞内Caspase-3表达增加,进而诱导B淋巴母细胞瘤凋亡[13]。本研究结果与其相似,褪黑素处理后的NB4细胞内Caspase-3及Caspase-9的表达均升高,证实了褪黑素对NB4细胞凋亡的促进作用。
综上所述,褪黑素可以诱导NB4细胞凋亡,其抑制作用呈量-效相关性,为该药物应用于临床白血病的治疗提供了理论依据。
[1] Bose P,Gandhi VV,Keating MJ.Pharmacokinetic and pharmacodynamic evaluation of ibrutinib for the treatment of chronic lymphocytic leukemia:rationale for lower doses[J].Expert Opin Drug Metab Toxicol,2016:1-12.
[2] Kost SE,Bouchard ED,LaBossière É,et al.Cross-resistance and synergy with bendamustine in chronic lymphocytic leukemia[J].Leuk Res,2016,50:63-71.
[3] Tokeji K,Sakaguchi S,Kurimoto T,et al.Immune thrombocytopenia in a child with T cell lymphoblastic lymphoma[J].Case Rep Hematol,2016,2016:2897325.
[4] 刘沁华,夏瑞祥,李嘉嘉.褪黑素联合全反式维甲酸对HL-60细胞作用的研究[J].安徽医学,2010,31(7):726-729.
[5] 曾庆曙,刘沁华,夏瑞祥,等.褪黑素对NB4细胞作用的研究[J].安徽医科大学学报,2008,43(3):305-308.
[6] Li B,Zhao W,Zhang X,et al.Design,synthesis and evaluation of anti-CD123 antibody drug conjugates[J].Bioorg Med Chem,2016,24(22):5855-5860.
[7] 李明正.褪黑素的抗自由基氧化损伤和防护作用[J].国外医学:卫生学分册,2000,27(1):26-29,50.
[8] 李晓艳,张卯年.褪黑素的抗氧化作用及其在眼部疾病应用的研究进展[J].国际眼科杂志,2008,8(8):1657-1660.
[9] 林梅芳,冯星.褪黑素抗氧化应激作用与器官保护[J].实用儿科临床杂志,2007,22(20):1583-1585.
[10] Khan N,Hills RK,Knapper S,et al.Normal hematopoietic progenitor subsets have distinct reactive oxygen species,BCL2 and cell-cycle profiles that are decoupled from maturation in acute myeloid leukemia[J].PLoS One,2016,11(9):e0163291.
[11] Perdomo J,Cabrera J,Estévez F,et al.Melatonin induces apoptosis through a caspase-dependent but reactive oxygen species-independent mechanism in human leukemia Molt-3 cells[J].J Pineal Res,2013,55(2):195-206.
[12] Sun K,Fan J,Han J.Ameliorating effects of traditional Chinese medicine preparation,Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage[J].Acta Pharm Sin B,2015,5(1):8-24.
[13] Büyükavci M,Ozdemir O,Buck S,et al.Effect of melatonin on the cytotoxicity of chemotherapeutic drugs in human leukemia cells[J].In Vivo,2011,25(3):405-409.
MelatonininducedtheapoptosisofNB4cellsanditsmechanism
YANG Song-liu,LIU Yuan-yuan,JIN Song-gen,ZHAO Ming-yan*
(the Critical Care Medicine,First Affiliated Hospital of Harbin Medical University,Harbin 150001,China)
ObjectiveTo investigate the effect of melatonin on the proliferation inhibition and apoptosis induction of NB4 cells.MethodsNB4 cells and 0,10-8,10-6and 10-4mol/L melatonin were cultured togetherinvitro.The cell viability was measured by MTT colorimetric assay;the apoptosis was detected by Hoechst fluorescent staining,and the rate of apoptosis cells were measured by flow cytometry;the contents of Caspase-3 and Caspase-9 in supernatant were checked by spectrophotometer.ResultsMelatonin significantly inhibited NB4 cell proliferation,promoted cell apoptosis,and increased the expression of apoptosis factors.ConclusionThe mechanism of melatonin promoting the apoptosis rate of NB4 cells may be related to increasing the expression of Caspase-3 and Caspase-9.
Melatonin;NB4 cell;Apoptosis;Caspase-3;Caspase-9
2017-05-30
哈尔滨医科大学附属第一医院重症医学科,哈尔滨 150001
国家自然科学基金(81171785)
*
10.14053/j.cnki.ppcr.201712006
